Лекция_1. Термодинамика биологических систем..ppt
- Количество слайдов: 42

Балтийский федеральный университет им. И. Канта БИОФИЗИКА Лекция 1. Термодинамика биологических систем Жуков Валерий Валентинович, к. биол. н. доцент кафедры молекулярной физиологии и биофизики Калининград 2013 1

Основные положения и базовые понятия классической термодинамики. Первый закон термодинамики, закон Гесса. Второй закон термодинамики, энтропия. Характеристические функции и максимально полезная работа. Второй закон термодинамики в открытых системах. Возрастание энтропии при теплообмене, функция диссипации. Соотношение Онзагера. Теорема Пригожина. 2

• Термодинамика рассматривает закономерности превращения энергии при ее передаче виде тепла и работы между телам или совокупностями тел (системами). Параметры — это свойства систем, которые идентифицируют их термодинамическое состояние в определенное время. Термодинамическое состояние — это состояние вещества с точки зрения его давления, температуры, внутренней энергии, плотности, удельного объема, энтальпии и энтропии. Любые два параметра вещества определяют его термодинамическое состояние. Существует две категории термодинамических параметров: интенсивные и экстенсивные. Интенсивный параметр — это свойство, которое не зависит от количества или размера системы. Температура, давлении, плотность — интенсивные параметры веществ и систем. Экстенсивные параметры зависят от количества или размера вещества или системы. Масса, объем, энтропия — экстенсивные параметры. 3
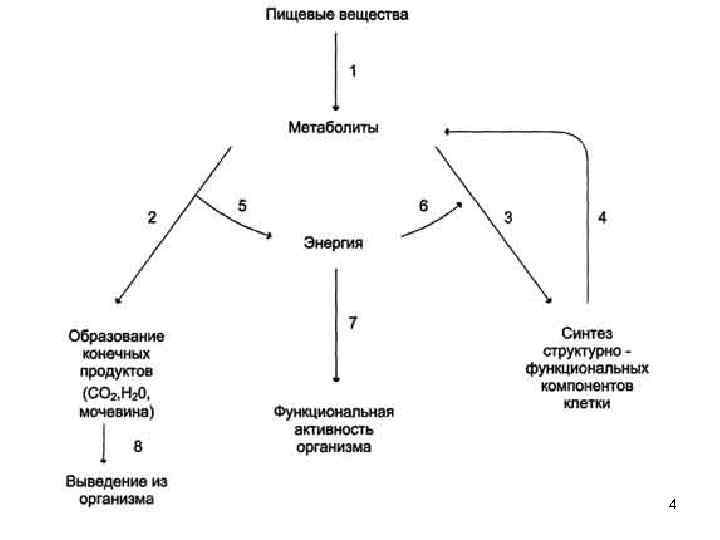
4
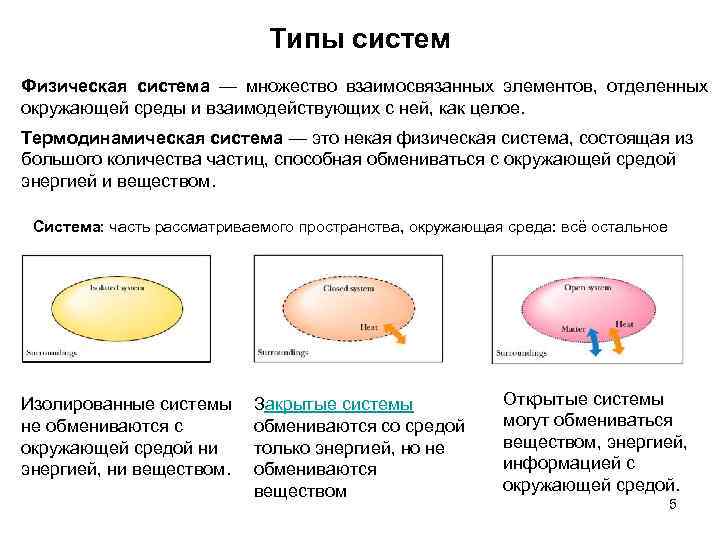
Типы систем Физическая система — множество взаимосвязанных элементов, отделенных окружающей среды и взаимодействующих с ней, как целое. Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Система: часть рассматриваемого пространства, окружающая среда: всё остальное Изолированные системы не обмениваются с окружающей средой ни энергией, ни веществом. Закрытые системы обмениваются со средой только энергией, но не обмениваются веществом Открытые системы могут обмениваться веществом, энергией, информацией с окружающей средой. 5

Равновесные (обратимые) процессы Равновесный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний. Равновесный тепловой процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений. Реальный процесс изменения состояния системы будет тем ближе к равновесному, чем медленнее он совершается, поэтому равновесные процессы называют квазистатическими. Изотермический процесс, при котором температура системы не изменяется (T=const) Изохорный процесс, происходящий при постоянном объёме системы (V=const) Изобарный процесс, происходящий при постоянном давлении в системе (P=const) Адиабатический процесс, проходящий без теплообменена, поэтому при неизменной энтропии в системе (S=const) Классическая термодинамика рассматривает главным образом равновесные состояния систем, в которых параметры не изменяются во времени, оценивая лишь общие энергетические эффекты процессов путем сравнения параметров конечного и начального состояний системы. 6

Неравновесные (необратимые) процессы • Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Реальные процессы изменения состояния системы всегда происходят с конечной скоростью, поэтому не могут быть равновесными. В открытых системах реакции и соответствующие энергетические превращения происходят постоянно и необходимо знать скорость превращения энергии в каждый момент времени, т. е. учитывать фактор времени, сочетая применение термодинамического и кинетического подходов. 7
8

1 -ый закон термодинамики Hermann Ludwig Ferdinand von Helmholtz Герман Людвиг Фердинанд фон Гельмгольц 1821 — 1894 Julius Robert von Mayer Юлиус Роберт фон Майер 1814— 1878 James Prescott Joule Джеймс Прескотт Джоуль 1818 - 1889 4, 159 Дж/кал, 1850. 9

Внутренняя энергия – функция состояния 10

Экспериментальное подтверждение закона сохранения энергии в биологических системах Работы Рубнера в области физиологии обмена веществ живых организмов представляют собой завершение исторических работ Лавуазье и Лапласа по химической трактовке процессов дыхания животных и природе животной теплоты и работ Майера и Гельмгольца по закону сохранения энергии. Эти работы дали в точных экспериментах цифровое выражение процессов обмена веществ и энергии в живых организмах. Wilbur Olin Atwater (1844 — 1907) Уилбур Этуотер Max Rubner Макс Рубнер (1854 — 1932) Этуотер создал установку для изучения обменных процессов человека (калориметр Этуотера - Розы), с помощью которой доказал применимость закона сохранения энергии к человеку: количество тепла, продуцируемое индивидуумом равняется количеству тепла, которое выделяется при окислении принятой им пищи. Разработал таблицы калориметрической ценности пищевых веществ (1894). 11

2 -й закон термодинамики • Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса). Rudolf Julius Emanuel Clausius Рудольф Юлиус Эммануэль Клаузиус 1822 - 1888 • Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона). William Thomson, 1 st Baron Kelvin Уильям Томсон, лорд Кельвин 1824 - 1907 12

Теорема Клаузиуса • Для любой квазиравновесной термодинамической системы существует такая однозначная функция термодинамического состояния (энтропия, S), что ее полный дифференциал Для изолированных систем 13
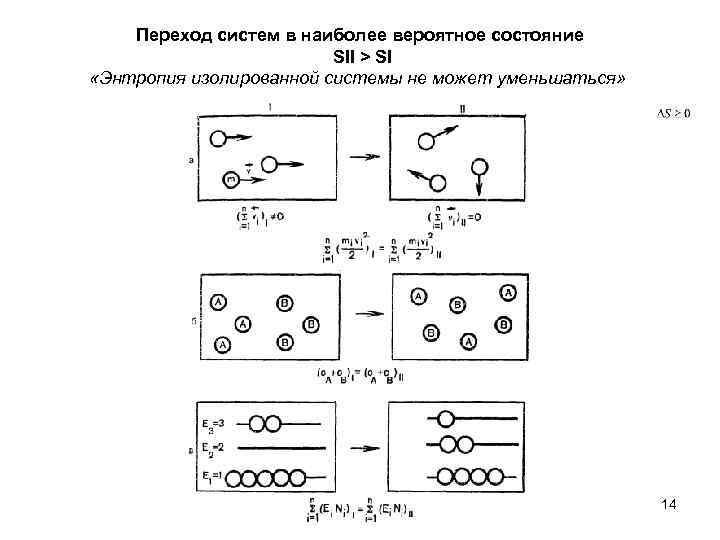
Переход систем в наиболее вероятное состояние SII > SI «Энтропия изолированной системы не может уменьшаться» 14

Статистическая интерпретация энтропии Информация и энтропия Ludwig Eduard Boltzmann Людвиг Больцман 1844 - 1906 «энтропия дискретного источника информации» информация = убыванию энтропии S = увеличению негэнтропии N Léon Nicolas Brillouin Лео н Николя Бриллюэ н 1889 - 1969 Claude Elwood Shannon Клод Э лвуд Ше ннон 1916 - 2001 15
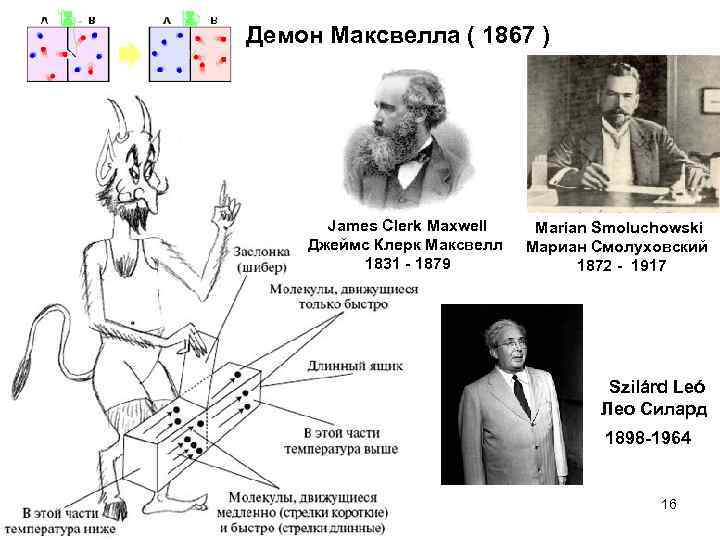
Демон Максвелла ( 1867 ) James Clerk Maxwell Джеймс Клерк Максвелл 1831 - 1879 Marian Smoluchowski Мариан Смолуховский 1872 - 1917 Szilárd Leó Лео Силард 1898 -1964 16
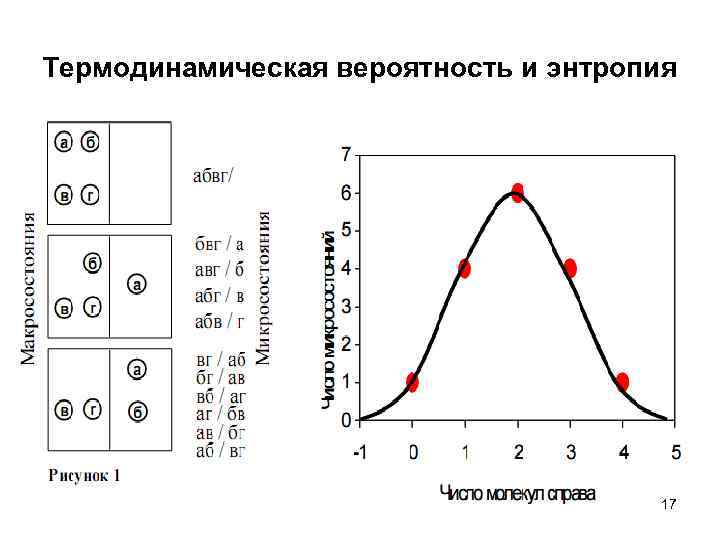
Термодинамическая вероятность и энтропия 17

Термодинамические функции состояния: энтальпия стандартное состояние термодинамической функции (р=101, 325 к. Па, Т=298 К) Физический смысл введения понятия энтальпии: ее изменение — это тепло, подведенное к системе в изобарическом процессе(при постоянном давлении). Практическое применение этой функции основано на том, что множество химических процессов в реальных или лабораторных условиях реализуются именно при постоянном (атмосферном) давлении, когда резервуар открыт. Так, энтальпия образования — количество энергии, которое выделяется или поглощается при образовании сложного вещества из простых веществ. Все химические реакции сопровождаются выделением (экзотермические) или поглощением (эндотермические) тепла. Мерой теплоты реакции служит изменение энтальпии ΔН, которая соответствует теплообмену при постоянном давлении. В случае экзотермических реакций система теряет тепло и ΔН — величина отрицательная. В случае эндотермических реакций система поглощает 18 тепло и ΔН — величина положительная.

Закон Гесса (1840) • Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. • Количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление Germain Henri Hess глюкозы в организме осуществляется по очень Герман Иванович сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного Гесс процесса равен теплоте сгорания глюкозы. (1802 — 1850) 19

Термодинамические функции состояния: свободная энергия Гиббса, или потенциал Гиббса Josiah Willard Gibbs Джоза йя Уи ллард Гиббс 1839— 1903 Изменение энергии Гиббса в процессах, протекающих при постоянном давлении и температуре, определяется суммарным эффектом энтропийного и энтальпийного факторов: процесс принципиально не может протекать самопроизвольно процесс принципиально может протекать самопроизвольно система находиться в состоянии равновесия 20
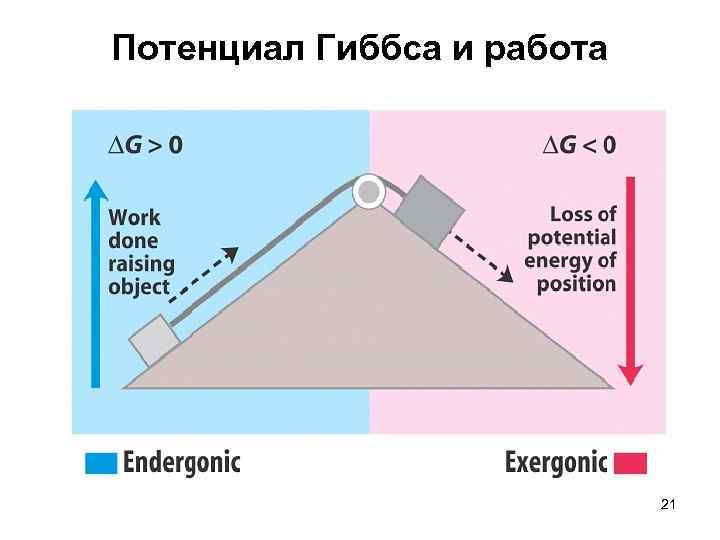
Потенциал Гиббса и работа 21

Энергия Гиббса и константа равновесия Аденозин-Ф~Ф~Ф + Н 2 О Аденозин-Ф~Ф + Н 2 РО 4 - В физиологических условиях 22

Термодинамические потенциалы: свободная энергия Гельмгольца Является мерой работы, которую может совершить термодинамическая система над внешними телами. Максимальная полезная работа, которую может совершить система равна убыли свободной энергии Гельмгольца : 23

Химический потенциал закон Гесса 24

Химическое сродство химическое сродство реакции стехиометрические коэффициенты 25

Энтропия в открытых системах Ludwig von Bertalanffy Карл Людвиг фон Берталанфи 1901 — 1972 Ludwig von Bertalanffy Theory of Open Systems in Physics and Biology// Science 13 January 1950 111: 23 -29 Илья Романович Пригожин (1917 — 2003) бельгийский и американский физик и химик российского происхождения, лауреат Нобелевской премии по химии 1977 года, виконт 26 Бельгии.

Энтропия в открытой системе Постулат И. Р. Пригожина: Общая энтропия открытой системы может изменяться либо за счет процесса обмена энтропией системы с внешней средой, либо за счет возникновения энтропии в самой системе. 27

Баланс энтропии в открытой системе 28

Основные формы энергии в биосистемах 29

Функция диссипации • Диссипативная система, или диссипативная структура (лат. dissipatio — «рассеиваю, разрушаю» ) — это открытая система, которая оперирует вдали от термодинамического равновесия. Это устойчивое состояние, возникающее в неравновесной среде при условии диссипации (рассеивания) энергии, которая поступает извне. Диссипативная система иногда называется ещё стационарной открытой системой или неравновесной открытой системой. Диссипативная система характеризуется спонтанным появлением сложной, зачастую хаотичной структуры. 30
31

Химическое сродство и скорость возрастания энтропии 32

Сопряжение процессов 1) 2) 33

Принцип Кюри - Пригожина • Принцип симметрии Кюри - Пригожина: связь между тензорами различного ранга невозможна. • В изотропной системе невозможно сопряжение скалярных и векторных процессов Pierre Curie Пьер Кюри (1859— 1906)— французский учёныйфизик, один из первых исследователей радиоактивности, член Французской Академии наук, лауреат Нобелевской премии по физике за 1903 год. 1. Cкалярные - химические реакции, теплообмен и обмен масс между фазами; 2. Векторные - диффузия и теплопроводность в сплошной фазе, вязкое взаимодействие между фазами; 3. Тензорные - вязкое взаимодействие в сплошной фазе. 34
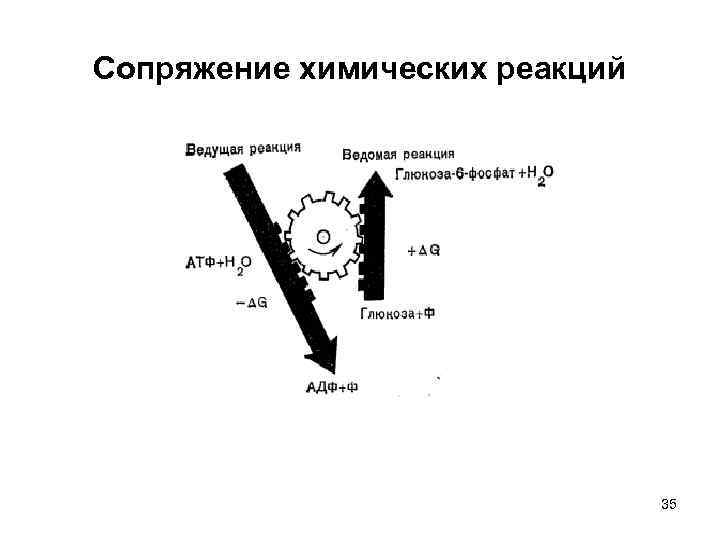
Сопряжение химических реакций 35

Хемиосмотическое сопряжение в митохондриях Владимир Петрович Скулачёв (род. 1935) — советский и российский биохимик, академик РАН СССР. Peter Dennis Mitchell Питер Митчелл (1920 – 1992) – британский биохимик, лауреат Нобелевской премии (1978) по химии за открытие хемиосмотического механизма синтеза АТФ 36

Принцип Онзагера • Для закрытой системы (то есть, не обменивающейся энергией с внешней средой), при возможности развития процесса по нескольким направлениям, реализуется тот из них, который обеспечивает минимум рассеяния энергии, то есть минимальный прирост энтропии. Onsager L. , Reciprocal relations in irreversible processes, «Physical Review» , 1931, vol. 37, p. 405; vol. 38, p. 2265. Lars Onsager Ларс Онзагер (1903 - 1976) норвежско-американский физхимик и физик, лауреат Нобелевской премии 37 по химии (1968).

Соотношения взаимности Онзагера >> Принцип симметрии феноменологических коэффициентов 38

Теорема Пригожина (1946) • При неизменных внешних условиях в частично равновесной открытой системе в стационарном состоянии, близком к термодинамическому равновесию, значение скорости прироста энтропии за счет внутренних необратимых процессов достигает отличного от нуля постоянного минимального положительного значения. 39

Доказательство теоремы Пригожина 40
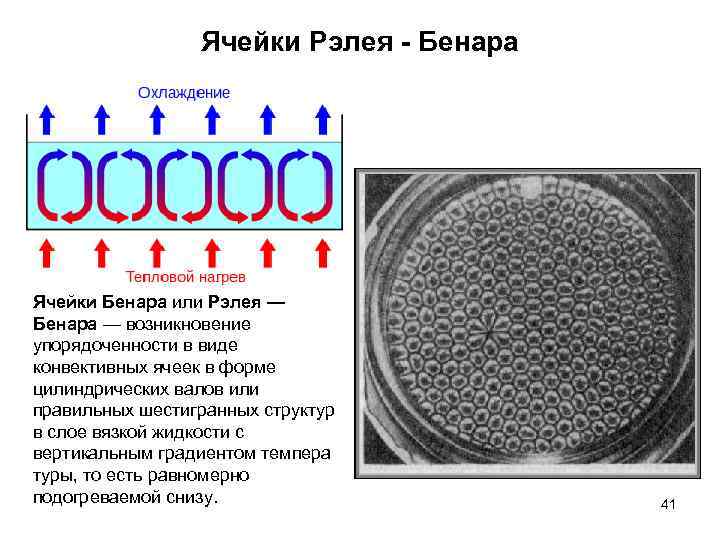
Ячейки Рэлея - Бенара Ячейки Бенара или Рэлея — Бенара — возникновение упорядоченности в виде конвективных ячеек в форме цилиндрических валов или правильных шестигранных структур в слое вязкой жидкости с вертикальным градиентом темпера туры, то есть равномерно подогреваемой снизу. 41
42
Лекция_1. Термодинамика биологических систем..ppt