B, Al, Ga, In, Tl
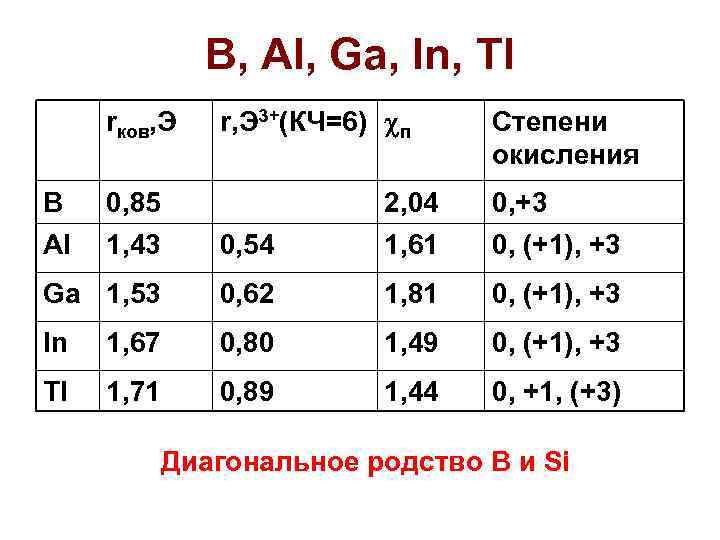
B, Al, Ga, In, Tl rков, Э B 0, 85 Al 1, 43 r, Э 3+(КЧ=6) п Степени окисления 2, 04 0, +3 0, 54 1, 61 0, (+1), +3 Ga 1, 53 0, 62 1, 81 0, (+1), +3 In 1, 67 0, 80 1, 49 0, (+1), +3 Tl 1, 71 0, 89 1, 44 0, +1, (+3) Диагональное родство B и Si

Распространенность в земной коре и минералы В – 28 место, H 3 BO 3 (сассолит), Na 2 B 4 O 7. 10 H 2 O (бура) Al – 3 место; x. Al(OH)3. y. Al. O(OH) (боксит), Al 2 O 3. 2 Si. O 2. 2 H 2 O (каолинит), алюмосиликаты Ga – редкий и рассеянный, примерно 60 -70 место, Cu. Ga. S 2 (галлит) In – редкий и рассеянный, примерно 70 -75 место, примесь к сульфидным рудам Tl – редкий и рассеянный, примерно 75 -80 место, примесь к сульфидным рудам

Открытие элементов • B – 1808 г. , фр. Гей =-Люссак и Тенар. • Al – 1825 г. , дат. Эрстед; от лат. «алюмен» • Ga - предсказан Менделеевым в 1871 г. , открыт фр. Лекок де Буабодран в 1875 г. , в честь Франции, лат. Gallia • In – 1863 г. , нем. Рейх и Рихтез, от синей краски индиго (две синие линии в спектре) • Tl – 1861 г. , анг. Крукс, от гр. «таллос» молодая зеленая ветвь (зеленая линия в спектре)

Бор Коричневый, полупроводник, анамально высокая Т пл = 2075 о. С Получение: 2 H 3 BO 3 = B 2 O 3 + 3 H 2 O (при Т) B 2 O 3 + 3 Mg = 3 Mg. O + 2 B (далее обр. НСl) БОР ХИМИЧЕСКИ ИНЕРТЕН Икосаэдр
![Бор [H+]: H 3 BO 3 + 3 H+ + 3 e = B Бор [H+]: H 3 BO 3 + 3 H+ + 3 e = B](https://present5.com/presentation/35372537_156360515/image-6.jpg)
Бор [H+]: H 3 BO 3 + 3 H+ + 3 e = B + 3 H 2 O E 0 = -0, 87 B [OH-]: [B(OH)4]- + 3 e = B + 4 OH- E 0 = -1, 79 B Кинетические затруднения, нет реакции с водой 2 B + 3 H 2 O = B 2 O 3 + 3 H 2 (800 o. C) 2 B + 3 X 2 = 2 BX 3 (X = F, Cl, Br, I) 4 B + 3 O 2 = 2 B 2 O 3 (горение) 2 B + N 2 = BN (1200 о. С) В не реагирует с Н 2
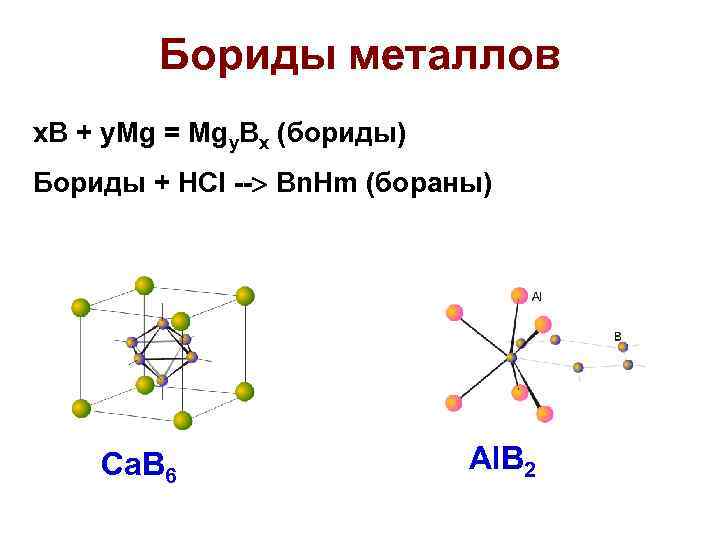
Бориды металлов x. B + y. Mg = Mgy. Bx (бориды) Бориды + НCl -- Bn. Hm (бораны) Ca. B 6 Al. B 2
![Бораны 1) Бориды магния + НCl -- Bn. Hm (бораны) 2) 3 Li[ЭH 4] Бораны 1) Бориды магния + НCl -- Bn. Hm (бораны) 2) 3 Li[ЭH 4]](https://present5.com/presentation/35372537_156360515/image-8.jpg)
Бораны 1) Бориды магния + НCl -- Bn. Hm (бораны) 2) 3 Li[ЭH 4] + 4 BF 3 = 2 B 2 H 6 + 3 Li[ЭF 4] Э = B, Al Реакция обмена в эфире! 3) Контролируемый пиролиз B 2 H 6 дает высшие бораны Bn. Hn+4 и Bn. Hn+6 Пример B 4 H 10 – тетраборан(10)
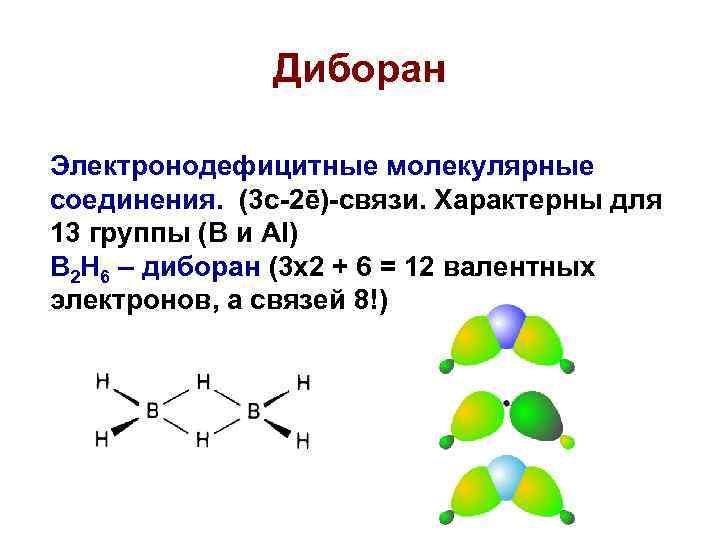
Диборан Электронодефицитные молекулярные соединения. (3 с-2ē)-связи. Характерны для 13 группы (B и Al) B 2 H 6 – диборан (3 х2 + 6 = 12 валентных электронов, а связей 8!)

Хим. свойства диборана 1) B 2 H 6 + 3 O 2 = B 2 O 3 + 3 H 2 O (Δr. H = 2000 к. Дж/моль) 2) B 2 H 6 + 6 H 2 O = 2 H 3 BO 3 + 6 H 2 (полный гидролиз) 3) B 2 H 6 + 2 Na. H = 2 Na[BH 4] – борогидрид (удобный восстановитель) Na[BH 4] + 4 H 2 O = 4 H 2 + H 3 BO 3 + Na. OH 4) B 2 H 6 + Me 3 N = H 3 B-NMe 3

Галогениды бора BF 3 ( f. G 0 = -1112 к. Дж/моль), BCl 3 – газы, BBr 3 – жидкий, BI 3 – твердый ( f. G 0 =+21 к. Дж/моль) 2 B + 3 X 2 = 2 BX 3 (X = F, Cl, Br) B 2 O 3 + 3 Ca. F 2 + 3 H 2 SO 4 = 2 BF 3↑+3 Ca. SO 4 +H 2 O Кислотность по Льюису: BF 3< BCl 3< BBr 3
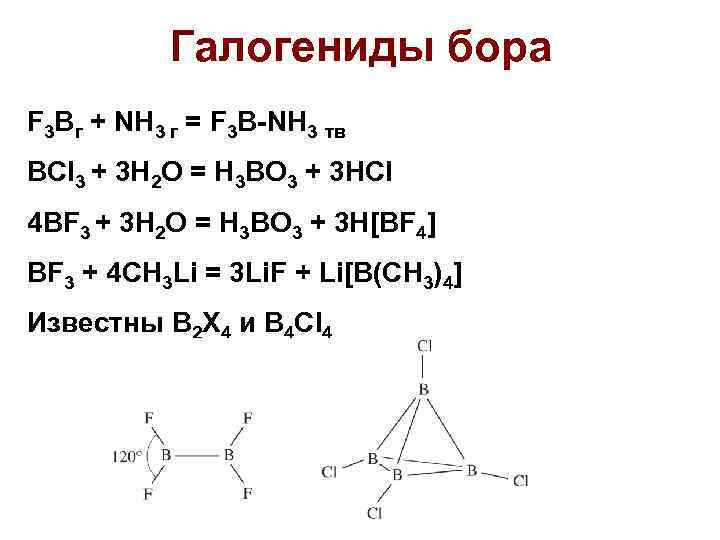
Галогениды бора F 3 Bг + NH 3 г = F 3 B-NH 3 тв BCl 3 + 3 H 2 O = H 3 BO 3 + 3 HCl 4 BF 3 + 3 H 2 O = H 3 BO 3 + 3 H[BF 4] BF 3 + 4 CH 3 Li = 3 Li. F + Li[B(CH 3)4] Известны B 2 X 4 и B 4 Cl 4

Соединения В с кислородом B 2 O 3 – f. G 0 = -1194 к. Дж/моль, б/цв, Т пл = 577 о. С, растворим в воде B 2 O 3 + H 2 O = H 3 BO 3 ортоборная кислота ОДНООСНОВНАЯ И СЛАБАЯ p. Ka = 9, 2 B(OH)3 + 2 H 2 O = H 3 O+ + [B(OH)4]Нагревание ортоборной к-ты при 100 o. C дает H 3 B 3 O 6 (триметаборная к-та), при 140 о. С образуется H 2 B 4 O 7 (тетраборная к-та) H 2 B 4 O 7 по силе как уксусная: Ka 1 = 2. 10 -4; Ka 2 = 2. 10 -5
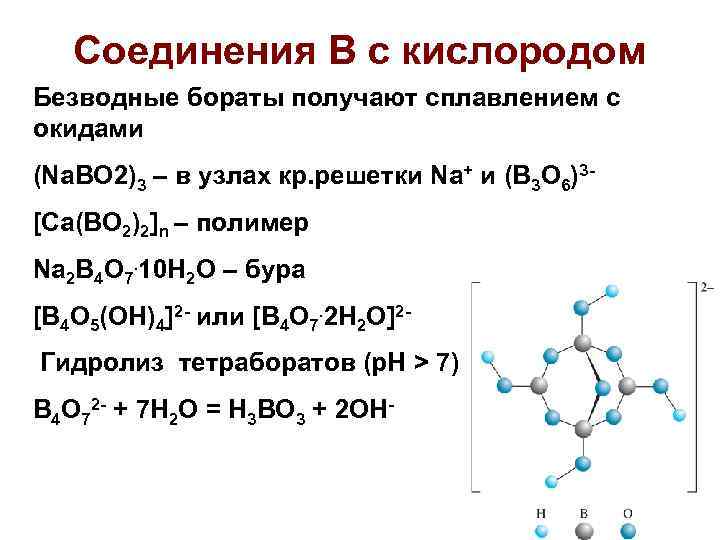
Соединения В с кислородом Безводные бораты получают сплавлением с окидами (Na. BO 2)3 – в узлах кр. решетки Na+ и (B 3 O 6)3[Ca(BO 2)2]n – полимер Na 2 B 4 O 7. 10 H 2 O – бура [B 4 O 5(OH)4]2 - или [B 4 O 7. 2 H 2 O]2 Гидролиз тетраборатов (р. Н > 7) B 4 O 72 - + 7 H 2 O = H 3 BO 3 + 2 OH-
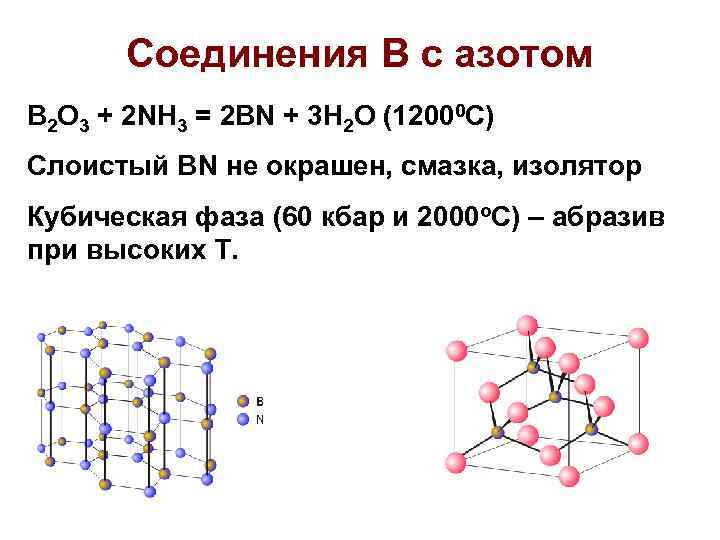
Соединения В с азотом B 2 O 3 + 2 NH 3 = 2 BN + 3 H 2 O (12000 C) Слоистый BN не окрашен, смазка, изолятор Кубическая фаза (60 кбар и 2000 о. С) – абразив при высоких Т.
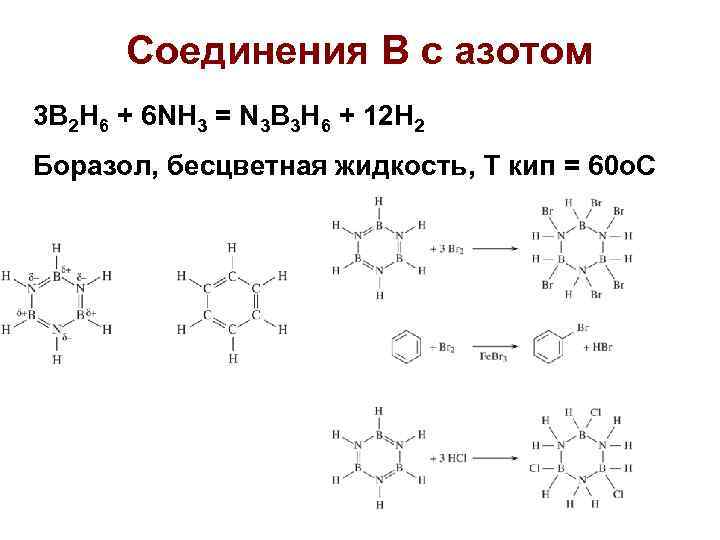
Соединения В с азотом 3 B 2 H 6 + 6 NH 3 = N 3 B 3 H 6 + 12 H 2 Боразол, бесцветная жидкость, Т кип = 60 о. С

Получение алюминия Электролиз раствора Al 2 O 3 в расплаве (962 o. C) криолита Na 3[Al. F 6]: катод – Al, анод – O 2 Бокситы – основной источник Al Криолит – минерал в Гренландии 3 Na 2 CO 3 + 2 Al(OH)3 + 12 HF = 2 Na 3 Al. F 6 +3 CO 2 + 9 H 2 O
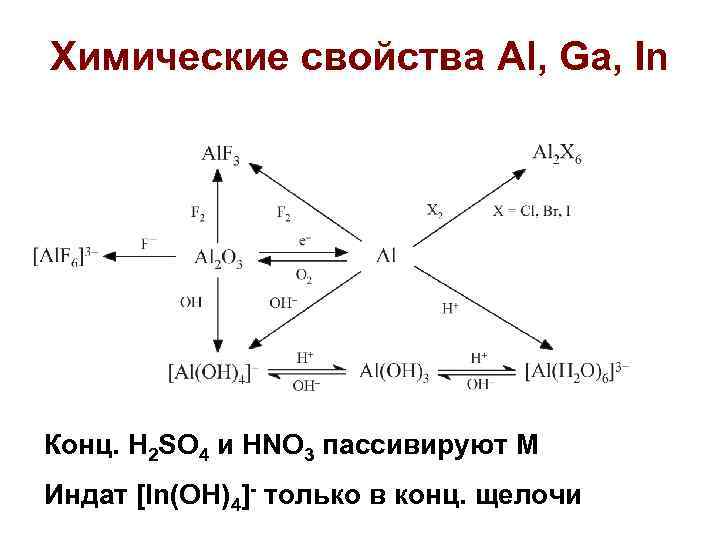
Химические свойства Al, Ga, In Конц. H 2 SO 4 и HNO 3 пассивируют M Индат [In(OH)4]- только в конц. щелочи

Химические свойства Al, Ga, In, Tl Al, Ga, In – характерна ст. ок. +3, для Tl – ст. ок. +1 2 Э + 2 HX = H 2 + ЭX 1200 о. С (Э = Al, Ga; X = Cl, Br) Диспропорционирование T>0 o. C: 3 ЭX = 2 Э + ЭX 3 Al. Cl–Ga. Cl-In. Cl-Tl. Cl увеличение устойчивости 2 Ga. X 3 + Ga = 3 Ga. X 2 (Ga. I[Ga. IIIX 4]) Известны для Ga, In, Tl

Химические свойства Al, Ga, In, Tl Al(OH)3 – Ga(OH)3 -In(OH)3 -Tl. OH увеличение основных свойств, Tl. OH только основные Al 13
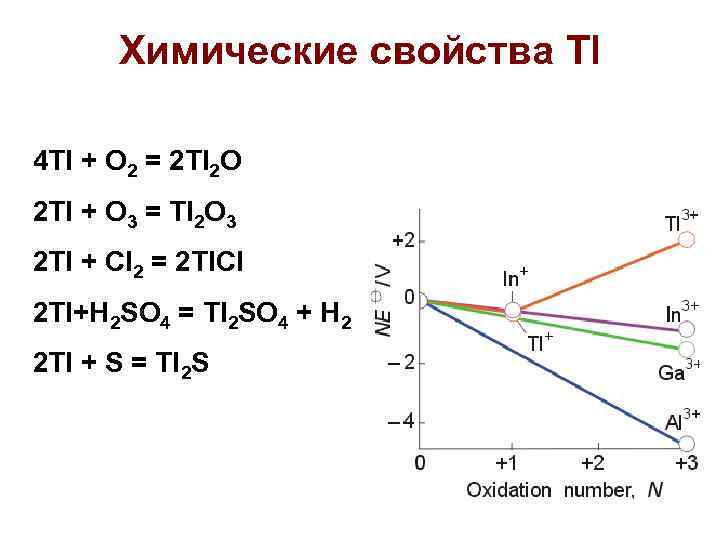
Химические свойства Tl 4 Tl + O 2 = 2 Tl 2 O 2 Tl + O 3 = Tl 2 O 3 2 Tl + Cl 2 = 2 Tl. Cl 2 Tl+H 2 SO 4 = Tl 2 SO 4 + H 2 2 Tl + S = Tl 2 S

Химические свойства Tl+ Сходство с Na+: МOH – хорошо растворимы, сильные основания M 2 SO 4, MNO 3, M 2 CO 3 – хорошо растворимы KM(SO 4)2. 12 H 2 O – образуют квасцы Сходство с Ag+: MX, M 2 S – нерастворимы MX – разлагаются на свету