Амины (2).ppt
- Количество слайдов: 31
 Азотсодержащие соединения
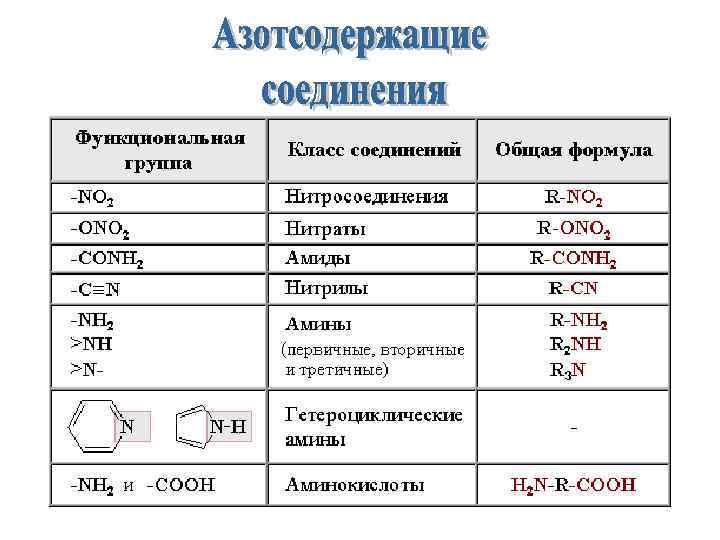
Азотсодержащие соединения
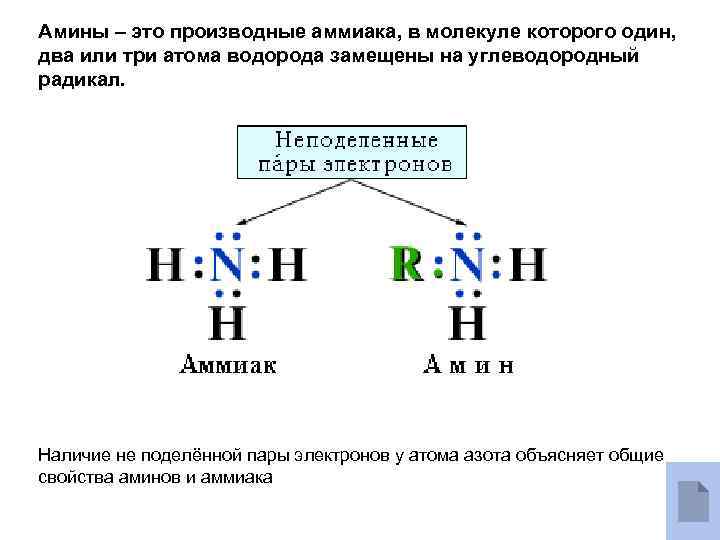 Амины – это производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородный радикал. Наличие не поделённой пары электронов у атома азота объясняет общие свойства аминов и аммиака
Амины – это производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородный радикал. Наличие не поделённой пары электронов у атома азота объясняет общие свойства аминов и аммиака



 Номенклатура аминов
Номенклатура аминов
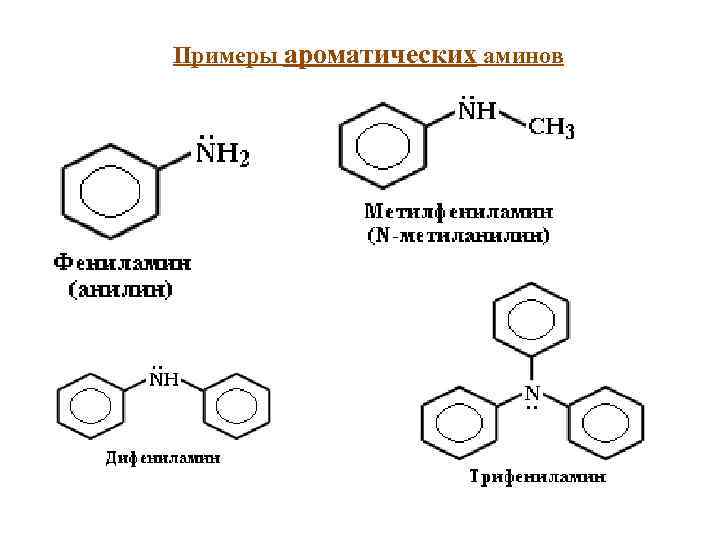 Примеры ароматических аминов
Примеры ароматических аминов
 Модели молекул фениламина (анилина)
Модели молекул фениламина (анилина)

 Физические свойства При обычной температуре только низшие жирные амины CH 3 NH 2, (CH 3)2 NH, (CH 3)3 N – газы (с запахом аммиака), средние амины – жидкости с резким запахом гниющей рыбы, высшие – твердые вещества без запаха. Амины способны к образованию водородных связей с водой. Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т. к. увеличиваются пространственные препятствия к образованию водородных связей. Ароматические амины – бесцветные жидкости и твердые вещества с неприятным запахом, в воде практически не растворяются.
Физические свойства При обычной температуре только низшие жирные амины CH 3 NH 2, (CH 3)2 NH, (CH 3)3 N – газы (с запахом аммиака), средние амины – жидкости с резким запахом гниющей рыбы, высшие – твердые вещества без запаха. Амины способны к образованию водородных связей с водой. Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т. к. увеличиваются пространственные препятствия к образованию водородных связей. Ароматические амины – бесцветные жидкости и твердые вещества с неприятным запахом, в воде практически не растворяются.


 Алкилирование аминов Этим способом получают из первичных аминов вторичные и третичные, а из вторичных – третичные. Процесс идет через образование солей алкиламмония, которые при нагревании превращаются в амины. t C CH 3 NH 2 + C 2 H 5 Cl [(CH 3)2 NH 2]+Cl– (CH 3)2 NH + HCl метиламин хлорид диметиламмония диметиламин В избытке алкилгалогенида образуется третичные амины: t C CH 3 NH 2 + 2 C 2 H 5 Br CH 3 N(C 2 H 5)2 + 2 HBr метиламин метилдиэтиламин
Алкилирование аминов Этим способом получают из первичных аминов вторичные и третичные, а из вторичных – третичные. Процесс идет через образование солей алкиламмония, которые при нагревании превращаются в амины. t C CH 3 NH 2 + C 2 H 5 Cl [(CH 3)2 NH 2]+Cl– (CH 3)2 NH + HCl метиламин хлорид диметиламмония диметиламин В избытке алкилгалогенида образуется третичные амины: t C CH 3 NH 2 + 2 C 2 H 5 Br CH 3 N(C 2 H 5)2 + 2 HBr метиламин метилдиэтиламин
 Взаимодействие с кислотами Взаимодействие с водой Реакции окисления
Взаимодействие с кислотами Взаимодействие с водой Реакции окисления
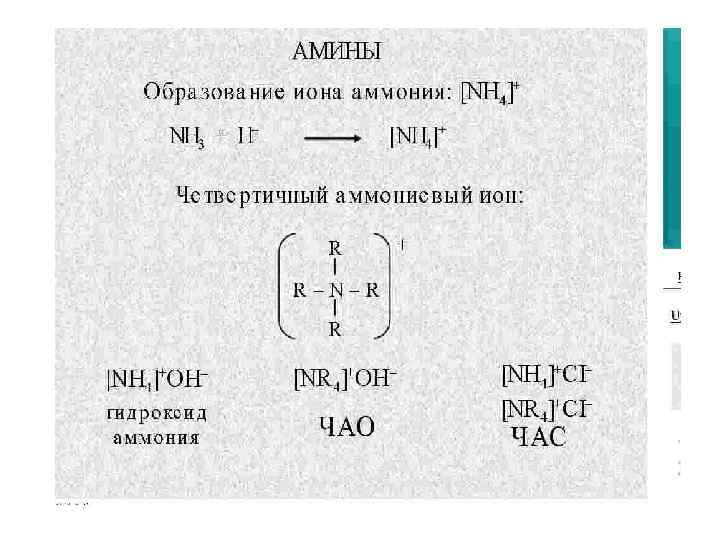
 Основные свойства аминов Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов. Поэтому амины подобно аммиаку проявляют свойства оснований (акцепторов протонов). Основность аминов выше, чем у большинства органических веществ других классов. CH 3 -NH 2 + HCl (CH 3 -NH 3)Cl метиламин хлорид метиламмония Водные растворы алифатических аминов проявляют щелочную реакцию, т. к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония. CH 3 -NH 2 + H 2 O (CH 3 -NH 3)OH метиламин гидроксид метиламмония
Основные свойства аминов Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов. Поэтому амины подобно аммиаку проявляют свойства оснований (акцепторов протонов). Основность аминов выше, чем у большинства органических веществ других классов. CH 3 -NH 2 + HCl (CH 3 -NH 3)Cl метиламин хлорид метиламмония Водные растворы алифатических аминов проявляют щелочную реакцию, т. к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония. CH 3 -NH 2 + H 2 O (CH 3 -NH 3)OH метиламин гидроксид метиламмония
 Соли аминов – твердые вещества, хорошо растворимые в воде. Щелочи при нагревании вытесняют из них амины: t C [CH 3 NH 3]Cl + Na. OH CH 3 NH 2 + Na. Cl + H 2 O Ароматические амины – более слабые основания, чем аммиак, поскольку неподеленная электронная пара атома азота прочнее удерживается за счет сопряжения с -электронной системой бензольного кольца. Это приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H 2 SO 4), а его водный раствор не окрашивает лакмус в синий цвет. Таким образом, основные свойства изменяются в ряду: C 6 H 5 NH 2 < NH 3 < RNH 2 < R 2 NH < R 3 N (в газовой фазе).
Соли аминов – твердые вещества, хорошо растворимые в воде. Щелочи при нагревании вытесняют из них амины: t C [CH 3 NH 3]Cl + Na. OH CH 3 NH 2 + Na. Cl + H 2 O Ароматические амины – более слабые основания, чем аммиак, поскольку неподеленная электронная пара атома азота прочнее удерживается за счет сопряжения с -электронной системой бензольного кольца. Это приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H 2 SO 4), а его водный раствор не окрашивает лакмус в синий цвет. Таким образом, основные свойства изменяются в ряду: C 6 H 5 NH 2 < NH 3 < RNH 2 < R 2 NH < R 3 N (в газовой фазе).
 Амины способны окисляться с образованием различных продуктов, строение которых зависит от типа амина и условий реакции. Например, при действии перманганата калия на первичные ароматические амины образуются нитропроизводные аренов: KMn. O 4 С 6 H 5 NH 2 + 3[O] С 6 H 5 NO 2 + H 2 O анилин нитробензол Ароматические амины легко окисляются на воздухе, приобретая при этом темную окраску. Полное окисление аминов происходит при их горении: 4 СH 3 NH 2 + 9 O 2 4 CO 2 + 10 H 2 O + 2 N 2 В отличие от аммиака, амины способны воспламеняться от открытого пламени.
Амины способны окисляться с образованием различных продуктов, строение которых зависит от типа амина и условий реакции. Например, при действии перманганата калия на первичные ароматические амины образуются нитропроизводные аренов: KMn. O 4 С 6 H 5 NH 2 + 3[O] С 6 H 5 NO 2 + H 2 O анилин нитробензол Ароматические амины легко окисляются на воздухе, приобретая при этом темную окраску. Полное окисление аминов происходит при их горении: 4 СH 3 NH 2 + 9 O 2 4 CO 2 + 10 H 2 O + 2 N 2 В отличие от аммиака, амины способны воспламеняться от открытого пламени.
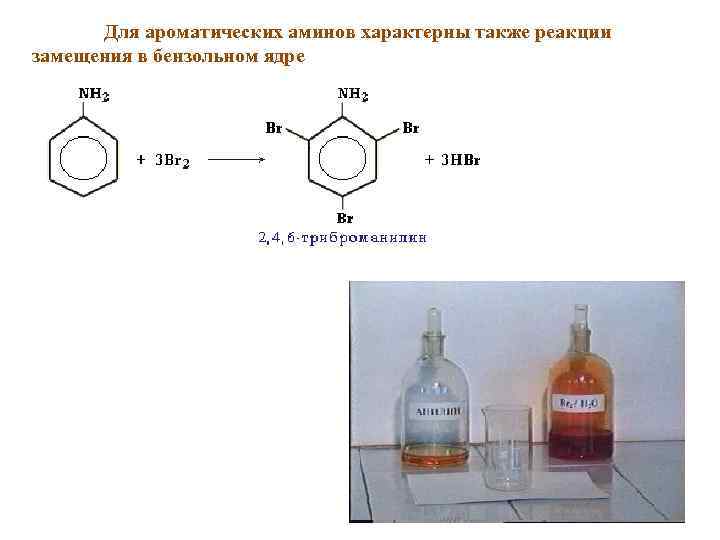 Для ароматических аминов характерны также реакции замещения в бензольном ядре
Для ароматических аминов характерны также реакции замещения в бензольном ядре
 Анилин (C 6 H 5 NH 2 ) Это бесцветная жидкость, которая плохо растворяется в воде; имеет светло-коричневую окраску при частичном окислении на воздухе; сильно ядовит. Основные свойства у анилина проявляются слабее, чем у аммиака и аминов предельного ряда. 1. Анилин не изменяет окраски лакмуса, но при взаимодействии с кислотами образует соли. 2. Если к анилину прилить концентрированную соляную кислоту, то происходит экзотермическая реакция и после охлаждения смеси можно наблюдать образование кристаллов соли: [C 6 H 5 NH 3]+Cl- – хлорид фениламмония. 3. Если на раствор хлорида фениламмония подействовать раствором щелочи, то снова выделится анилин: [С 6 Н 5 NН 3]+ + Сl- + Nа+ + ОН- → Н 2 О + С 6 Н 5 NН 2 + Nа+ + СI-. Здесь выражено влияние ароматического радикала фенила – С 6 Н 5.
Анилин (C 6 H 5 NH 2 ) Это бесцветная жидкость, которая плохо растворяется в воде; имеет светло-коричневую окраску при частичном окислении на воздухе; сильно ядовит. Основные свойства у анилина проявляются слабее, чем у аммиака и аминов предельного ряда. 1. Анилин не изменяет окраски лакмуса, но при взаимодействии с кислотами образует соли. 2. Если к анилину прилить концентрированную соляную кислоту, то происходит экзотермическая реакция и после охлаждения смеси можно наблюдать образование кристаллов соли: [C 6 H 5 NH 3]+Cl- – хлорид фениламмония. 3. Если на раствор хлорида фениламмония подействовать раствором щелочи, то снова выделится анилин: [С 6 Н 5 NН 3]+ + Сl- + Nа+ + ОН- → Н 2 О + С 6 Н 5 NН 2 + Nа+ + СI-. Здесь выражено влияние ароматического радикала фенила – С 6 Н 5.
 Области применения анилина: 1) один из важнейших продуктов химической промышленности; 2) является исходным веществом для получения многочисленных анилиновых красителей; 3) используется при получении лекарственных веществ, например сульфаниламидных препаратов, взрывчатых веществ, высокомолекулярных соединений и т. д.
Области применения анилина: 1) один из важнейших продуктов химической промышленности; 2) является исходным веществом для получения многочисленных анилиновых красителей; 3) используется при получении лекарственных веществ, например сульфаниламидных препаратов, взрывчатых веществ, высокомолекулярных соединений и т. д.
 АМИДЫ КИСЛОТ - RCONН 2 Это продукты замещения гидроксила в карбоксильной группе кислот на группу NH 2. Физические свойства Амид муравьиной кислоты – это жидкость; амиды всех других кислот – это белые кристаллические вещества; Низшие амиды хорошо растворимы в воде; Водные растворы амидов дают нейтральную реакцию на лакмус, т. к. амиды проявляют слабые кислые свойства и еще более слабые основные свойства.
АМИДЫ КИСЛОТ - RCONН 2 Это продукты замещения гидроксила в карбоксильной группе кислот на группу NH 2. Физические свойства Амид муравьиной кислоты – это жидкость; амиды всех других кислот – это белые кристаллические вещества; Низшие амиды хорошо растворимы в воде; Водные растворы амидов дают нейтральную реакцию на лакмус, т. к. амиды проявляют слабые кислые свойства и еще более слабые основные свойства.
 ПОЛУЧЕНИЕ 1) Сплавление аммонийных солей карбоновых кислот: СН 3 СООNH 4 → CH 3 CONH 2 + H 2 O 2) Действие аммиака на сложные эфиры: RCOOR′ + NH 3 → RCONH 2 + R′OH. ХИМИЧЕСКИЕ СВОЙСТВА 1) Важнейшее свойство амидов – это их способность к гидролизу в присутствии кислот и щелочей. При этом образуются кислота и аммиак: RCONH 2 + H 2 O → RCOOH + NH 3 2) Амиды, восстанавливаясь, превращаются в амины: RCONH 2 + 4 Н → RCН 2 NH 2 + Н 2 О
ПОЛУЧЕНИЕ 1) Сплавление аммонийных солей карбоновых кислот: СН 3 СООNH 4 → CH 3 CONH 2 + H 2 O 2) Действие аммиака на сложные эфиры: RCOOR′ + NH 3 → RCONH 2 + R′OH. ХИМИЧЕСКИЕ СВОЙСТВА 1) Важнейшее свойство амидов – это их способность к гидролизу в присутствии кислот и щелочей. При этом образуются кислота и аммиак: RCONH 2 + H 2 O → RCOOH + NH 3 2) Амиды, восстанавливаясь, превращаются в амины: RCONH 2 + 4 Н → RCН 2 NH 2 + Н 2 О
 Мочевина – это конечный продукт азотистого обмена в организме человека и животных; Образуется при распаде белков и выделяется вместе с мочой; Мочевину можно рассматривать как полный амид угольной кислоты: НО-С-О=ОH – угольная кислота, Н 2 N-СО-NН 2 – мочевина; Мочевина, или карбамид, – это белое кристаллическое вещество, которое хорошо растворяется в воде; Получение: 1) впервые она была получена немецким ученым Велером в 1828 г. из цианата аммония: NH 4 OC≡N → H 2 N-CO-NH 2. 2) в промышленности мочевина получается из оксида углерода (IV) и аммиака при нагревании (150°C) и высоком давлении: СO 2 + 2 NН 3 → Н 2 N-СО-NН 2 + Н 2 О
Мочевина – это конечный продукт азотистого обмена в организме человека и животных; Образуется при распаде белков и выделяется вместе с мочой; Мочевину можно рассматривать как полный амид угольной кислоты: НО-С-О=ОH – угольная кислота, Н 2 N-СО-NН 2 – мочевина; Мочевина, или карбамид, – это белое кристаллическое вещество, которое хорошо растворяется в воде; Получение: 1) впервые она была получена немецким ученым Велером в 1828 г. из цианата аммония: NH 4 OC≡N → H 2 N-CO-NH 2. 2) в промышленности мочевина получается из оксида углерода (IV) и аммиака при нагревании (150°C) и высоком давлении: СO 2 + 2 NН 3 → Н 2 N-СО-NН 2 + Н 2 О
 С сильными минеральными кислотами мочевина образует соли: H 2 N-CO-NH 2 + HNO 3 → H 2 N-CO-NH 2·HNO 3; Мочевина – это ценное высококонцентрированное азотное удобрение (46, 6% азота), она широко используется на всех почвах и под все культуры; Как источник азота мочевину добавляют в корм скоту в качестве заменителя протеина. Высшие амиды (С 9 -С 21) могут служить в качестве добавок при формовании водостойких гипсовых плит.
С сильными минеральными кислотами мочевина образует соли: H 2 N-CO-NH 2 + HNO 3 → H 2 N-CO-NH 2·HNO 3; Мочевина – это ценное высококонцентрированное азотное удобрение (46, 6% азота), она широко используется на всех почвах и под все культуры; Как источник азота мочевину добавляют в корм скоту в качестве заменителя протеина. Высшие амиды (С 9 -С 21) могут служить в качестве добавок при формовании водостойких гипсовых плит.
 АМИНОКИСЛОТЫ Аминокислоты – это вещества, в молекулах которых содержатся одновременно одна или несколько аминогрупп NН 2 и карбоксильная группа – СООН. NH 2 -COOH – аминоуксусная кислота (глицин) CH 3 -CH(NH 2)-COOH – аминопропионовая кислота (аланин) Аминокислоты – это бесцветные кристаллические вещества, растворимые в воде. Многие аминокислоты имеют сладкий вкус. Изомерия аминокислот зависит от изомерии углеродной цепи, положения аминогрупп по отношению к карбоксилу (α-, β-, γ- и т. д. ) и пространственного расположения замещающих групп в молекуле (оптическая изомерия).
АМИНОКИСЛОТЫ Аминокислоты – это вещества, в молекулах которых содержатся одновременно одна или несколько аминогрупп NН 2 и карбоксильная группа – СООН. NH 2 -COOH – аминоуксусная кислота (глицин) CH 3 -CH(NH 2)-COOH – аминопропионовая кислота (аланин) Аминокислоты – это бесцветные кристаллические вещества, растворимые в воде. Многие аминокислоты имеют сладкий вкус. Изомерия аминокислот зависит от изомерии углеродной цепи, положения аминогрупп по отношению к карбоксилу (α-, β-, γ- и т. д. ) и пространственного расположения замещающих групп в молекуле (оптическая изомерия).
 ПОЛУЧЕНИЕ 1) Гидролиз белковых тел. Образуется сложная смесь различных аминокислот (в основном α-аминокислот). 2) Присоединение аммиака к ненасыщенным кислотам: СН 2=СН-СООН + NH 3 → H 2 N-CH 2 -COOH β- аминопропионовая кислота ХИМИЧЕСКИЕ СВОЙСТВА Свойства аминокислот определяются свойствами двух функциональных групп: карбоксильной и аминогруппы. Специфические свойства зависят от взаимодействия двух этих групп.
ПОЛУЧЕНИЕ 1) Гидролиз белковых тел. Образуется сложная смесь различных аминокислот (в основном α-аминокислот). 2) Присоединение аммиака к ненасыщенным кислотам: СН 2=СН-СООН + NH 3 → H 2 N-CH 2 -COOH β- аминопропионовая кислота ХИМИЧЕСКИЕ СВОЙСТВА Свойства аминокислот определяются свойствами двух функциональных групп: карбоксильной и аминогруппы. Специфические свойства зависят от взаимодействия двух этих групп.
 1) Образование солей: NH 2 -COOH + Na. OH → NH 2 -COONa + H 2 O 2) Образование сложных эфиров: NH 2 -COOH+ С 2 Н 5 ОН → H 2 N-CH 2 -COOC 2 H 5 3) Реакции полимеризации. При поликонденсации ε– аминокапроновой кислоты образуется высокомолекулярное соединение – капрон, из которого изготавливают капроновое волокно: [-NH-(CH 2)5 -CO-]n Аминокислоты могут вступать в реакции поликонденсации с образованием природных высокомолекулярных продуктовполипептидов (белков): …+H 2 N-(CH 2)n-COOH+H 2 N-(CH 2)n-COOH … --→ ------→ …HN-(CH 2)n-CO-… -m. H 2 O Где ( -CO-NH-)- пептидные связи.
1) Образование солей: NH 2 -COOH + Na. OH → NH 2 -COONa + H 2 O 2) Образование сложных эфиров: NH 2 -COOH+ С 2 Н 5 ОН → H 2 N-CH 2 -COOC 2 H 5 3) Реакции полимеризации. При поликонденсации ε– аминокапроновой кислоты образуется высокомолекулярное соединение – капрон, из которого изготавливают капроновое волокно: [-NH-(CH 2)5 -CO-]n Аминокислоты могут вступать в реакции поликонденсации с образованием природных высокомолекулярных продуктовполипептидов (белков): …+H 2 N-(CH 2)n-COOH+H 2 N-(CH 2)n-COOH … --→ ------→ …HN-(CH 2)n-CO-… -m. H 2 O Где ( -CO-NH-)- пептидные связи.
 ПРИМЕНЕНИЕ Молекулы аминокислот – это те кирпичики, из которых построены все растительные и животные белки. Аминокислоты, необходимые для построения белков организма, человек и животные получают в составе белков пищи. Аминокапроновая и аминоэнантовая кислоты используются для получения синтетических волокон – капрона и энанта. В медицине (например, глутаминовая кислота используется при нервных заболеваниях, гистидин – при язве желудка, глицин – для улучшения памяти). В сельском хозяйстве для подкормки животных.
ПРИМЕНЕНИЕ Молекулы аминокислот – это те кирпичики, из которых построены все растительные и животные белки. Аминокислоты, необходимые для построения белков организма, человек и животные получают в составе белков пищи. Аминокапроновая и аминоэнантовая кислоты используются для получения синтетических волокон – капрона и энанта. В медицине (например, глутаминовая кислота используется при нервных заболеваниях, гистидин – при язве желудка, глицин – для улучшения памяти). В сельском хозяйстве для подкормки животных.


