 АЗОТНАЯ КИСЛОТА. СОЛИ АЗОТНОЙ КИСЛОТЫ. 9 класс.
АЗОТНАЯ КИСЛОТА. СОЛИ АЗОТНОЙ КИСЛОТЫ. 9 класс.
 Домашнее задание Параграф 19, 20 читать. Выписать схему из параграфа 20 (разложение нитратов), круговорот азота в природе пересказ № 1. Назвать соли: KNO 3, Al(NO 3)3, Fe(NO 3)3, Cu(NO 3)2, Cu. SO 4, Na 2 S, K 2 SO 3. № 2. Написать уравнения реакций в молекулярном и ионном виде между азотной кислотой и а) гидроксидом натрия, б) карбонатом натрия, в) оксидом меди (II). № 3. Написать уравнения реакций разложения: Na. NO 3, Fe(NO 3)3, Hg(NO 3)2
Домашнее задание Параграф 19, 20 читать. Выписать схему из параграфа 20 (разложение нитратов), круговорот азота в природе пересказ № 1. Назвать соли: KNO 3, Al(NO 3)3, Fe(NO 3)3, Cu(NO 3)2, Cu. SO 4, Na 2 S, K 2 SO 3. № 2. Написать уравнения реакций в молекулярном и ионном виде между азотной кислотой и а) гидроксидом натрия, б) карбонатом натрия, в) оксидом меди (II). № 3. Написать уравнения реакций разложения: Na. NO 3, Fe(NO 3)3, Hg(NO 3)2
 1. Строение молекулы азотной кислоты. HNO 3 1. Классифицируйте азотную кислоту по всем известным признакам: А)Сила как электролита; Б)Содержание кислорода в молекуле; В)Основность азотной кислоты. 2. Какой вид связи в молекуле азотной кислоты? Чему равна валентность и степень окисления азота в молекуле? 3. * Объясните схему образования молекулы азотной кислоты с использованием понятия о донорно-акцепторном механизме.
1. Строение молекулы азотной кислоты. HNO 3 1. Классифицируйте азотную кислоту по всем известным признакам: А)Сила как электролита; Б)Содержание кислорода в молекуле; В)Основность азотной кислоты. 2. Какой вид связи в молекуле азотной кислоты? Чему равна валентность и степень окисления азота в молекуле? 3. * Объясните схему образования молекулы азотной кислоты с использованием понятия о донорно-акцепторном механизме.
 2. Физические свойства азотной кислоты.
2. Физические свойства азотной кислоты.
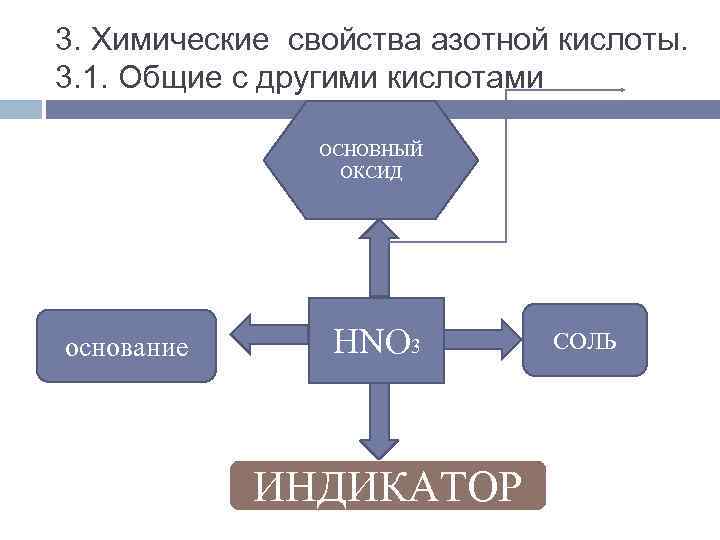 3. Химические свойства азотной кислоты. 3. 1. Общие с другими кислотами ОСНОВНЫЙ ОКСИД основание НNO 3 ИНДИКАТОР СОЛЬ
3. Химические свойства азотной кислоты. 3. 1. Общие с другими кислотами ОСНОВНЫЙ ОКСИД основание НNO 3 ИНДИКАТОР СОЛЬ
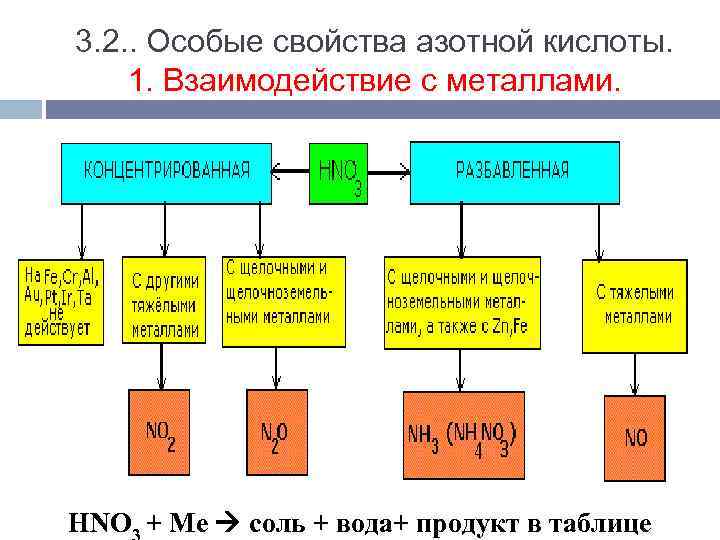 3. 2. . Особые свойства азотной кислоты. 1. Взаимодействие с металлами. HNO + Mе соль + вода+ продукт в таблице
3. 2. . Особые свойства азотной кислоты. 1. Взаимодействие с металлами. HNO + Mе соль + вода+ продукт в таблице
 2. Разложение при нагревании. HNO 3 NO 2 + H 2 O + O 2 Расставьте коэффициенты методом электронного баланса.
2. Разложение при нагревании. HNO 3 NO 2 + H 2 O + O 2 Расставьте коэффициенты методом электронного баланса.
 Проверка составления УХР. 4 HNO 3 4 NO 2 +2 Н 2 О + O 2
Проверка составления УХР. 4 HNO 3 4 NO 2 +2 Н 2 О + O 2
 3. Взаимодействие с неметаллами. Например: серой, фосфором, бором. Х+ HNO 3 (конц) NO 2 +(Н 2 О) + кислота
3. Взаимодействие с неметаллами. Например: серой, фосфором, бором. Х+ HNO 3 (конц) NO 2 +(Н 2 О) + кислота
 Азотная кислота входит в состав сильного окислителя «царской водки» 3 моль НСl(конц. ) + 1 моль НNO 3(конц. ) Царская водка: растворяет благородные металлы. HNO 3 + 4 HCl + Au = H[Au. Cl 4] + NO + 2 H 2 O 4 HNO 3 + 18 HCl + 3 Pt = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O
Азотная кислота входит в состав сильного окислителя «царской водки» 3 моль НСl(конц. ) + 1 моль НNO 3(конц. ) Царская водка: растворяет благородные металлы. HNO 3 + 4 HCl + Au = H[Au. Cl 4] + NO + 2 H 2 O 4 HNO 3 + 18 HCl + 3 Pt = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O
 О Радищеве А. Н.
О Радищеве А. Н.
 4. Получение в промышленности. NH 3 --- NO 2 --HNO 3
4. Получение в промышленности. NH 3 --- NO 2 --HNO 3
 5. Применение (рис. 15 с. 56) Выписать основные направления применения
5. Применение (рис. 15 с. 56) Выписать основные направления применения