Лекция_кисл_соед_N_P_и_др.pptx
- Количество слайдов: 29

Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы
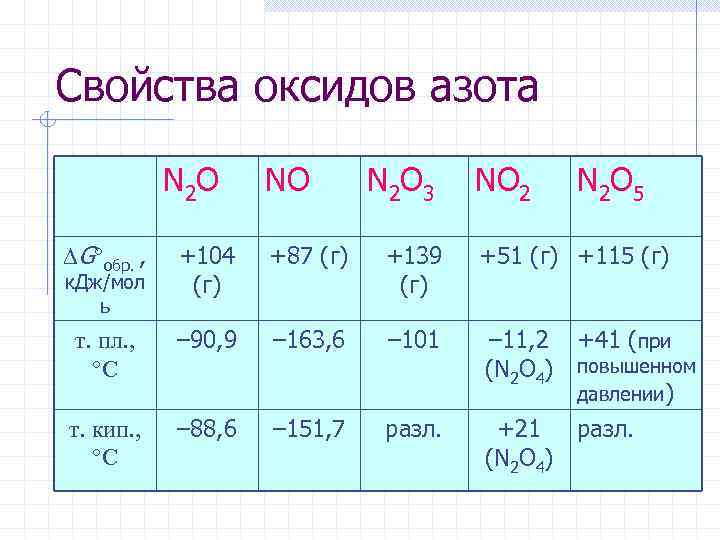
Свойства оксидов азота N 2 O NO N 2 O 3 NO 2 N 2 O 5 G обр. , +104 (г) +87 (г) +139 +51 (г) +115 (г) т. пл. , С – 90, 9 – 163, 6 – 101 т. кип. , С – 88, 6 – 151, 7 разл. к. Дж/мол ь – 11, 2 +41 (при (N 2 O 4) повышенном давлении) +21 разл. (N 2 O 4)

Оксид диазота N 2 O 0 +II –II N N O , , –I +III N –II N O , , N 2 O – бесцв. газ со слабым приятным запахом и слабонаркотическим действием, т. пл. – 91 °С, т. кип. – 89 °С. N 2 O – несолеобр. оксид, сильный окислитель. Разложение: 2 N 2 O = 2 N 2 O + O 2

Монооксид азота NO NO – бесцв. газ, несолеобр. оксид, т. пл. – 164 °С, т. кип. – 152 °С. Димеризация: 2 NO(г) N 2 O 2(ж) Окисление: 2 NO + O 2 = 2 NO 2 Получение: 3 Cu + 8 HNO 3 = = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O 3 SO 2 + 2 HNO 3 + 4 H 2 O = = 3 H 2 SO 4 + 2 NO +II • N N –II , , , O O + Нитрозил-катион NO+: соль (NO)HSO 4
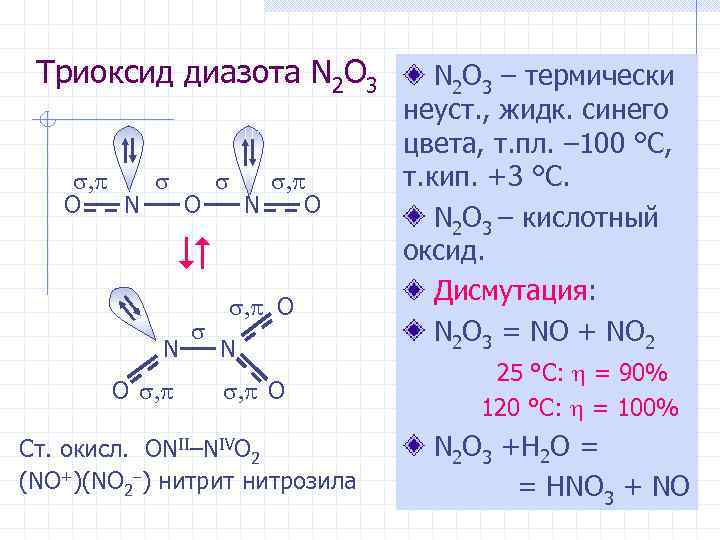
Триоксид диазота N 2 O 3 , , O N O , , O N , O Ст. окисл. ONII–NIVO 2 (NO+)(NO 2 ) нитрит нитрозила N 2 O 3 – термически неуст. , жидк. синего цвета, т. пл. – 100 °С, т. кип. +3 °С. N 2 O 3 – кислотный оксид. Дисмутация: N 2 O 3 = NO + NO 2 25 °С: = 90% 120 °С: = 100% N 2 O 3 +H 2 O = = HNO 3 + NO
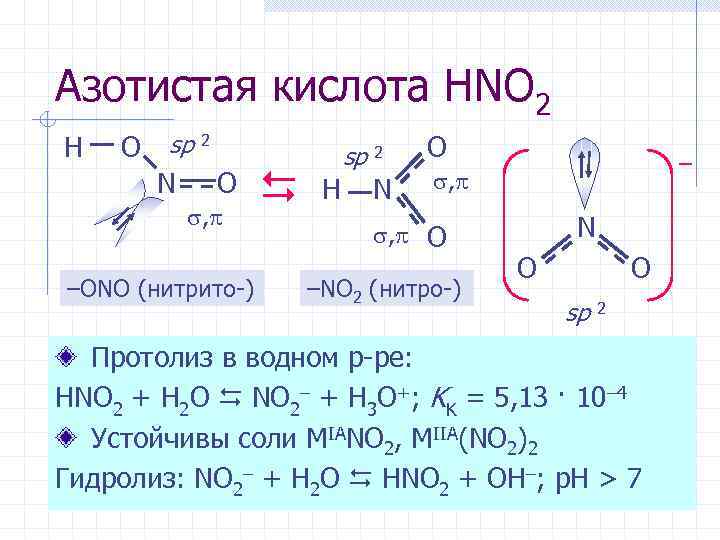
Азотистая кислота HNO 2 H O sp 2 N O , –ONO (нитрито-) sp 2 H N O – , , O –NO 2 (нитро-) N O O sp 2 Протолиз в водном р-ре: HNO 2 + H 2 O NO 2– + H 3 O+; KK = 5, 13 · 10– 4 Устойчивы соли MIANO 2, MIIA(NO 2)2 Гидролиз: NO 2– + H 2 O HNO 2 + OH–; р. Н > 7

Окислительно-восстановительные свойства Окислительные свойства р. Н > 7: NO 2–+ H 2 O + 2 e = NO + 2 OH ; = – 0, 45 В р. Н < 7: HNO 2 + H+ + 2 e = NO + H 2 O; = +1, 00 В Восстановительные свойства р. Н > 7: NO 2– + 2 OH – 2 e = NO 3– + H 2 O; = +0, 01 В р. Н < 7: HNO 2 + H 2 O – 2 e = NO 3– +3 H+; = +0, 93 В
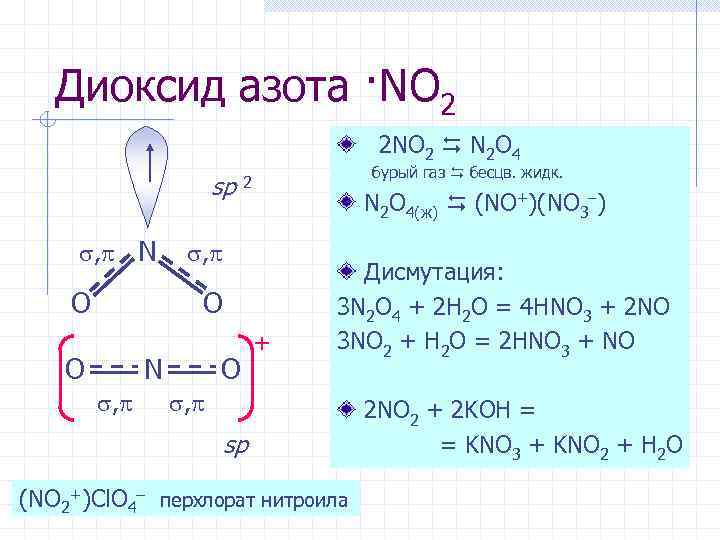
Диоксид азота ·NO 2 2 NO 2 N 2 O 4 sp , N O бурый газ бесцв. жидк. 2 N 2 O 4(ж) (NO+)(NO 3 ) , O O N , O + Дисмутация: 3 N 2 O 4 + 2 H 2 O = 4 HNO 3 + 2 NO 3 NO 2 + H 2 O = 2 HNO 3 + NO , sp (NO 2+)Cl. O 4– перхлорат нитроила 2 NO 2 + 2 KOH = = KNO 3 + KNO 2 + H 2 O

Получение В промышленности 2 NO + O 2 2 NO 2 + H 2 O = 2 HNO 3 В лаборатории Cu + 4 HNO 3(конц) = = Cu(NO 3)2 + H 2 O + 2 NO 2 (c примесями) 2 Pb(NO 3)2 = 2 Pb. O + 4 NO 2 + O 2 (+t) 2 NO 2 N 2 O 4 (–t) 2 N 2 O 4 + H 2 O = 2 HNO 3 + N 2 O 3 Термическое разложение Pb(NO 3)2 и взаимодействие N 2 O 4 с водой Видео: разложение Видео: + вода
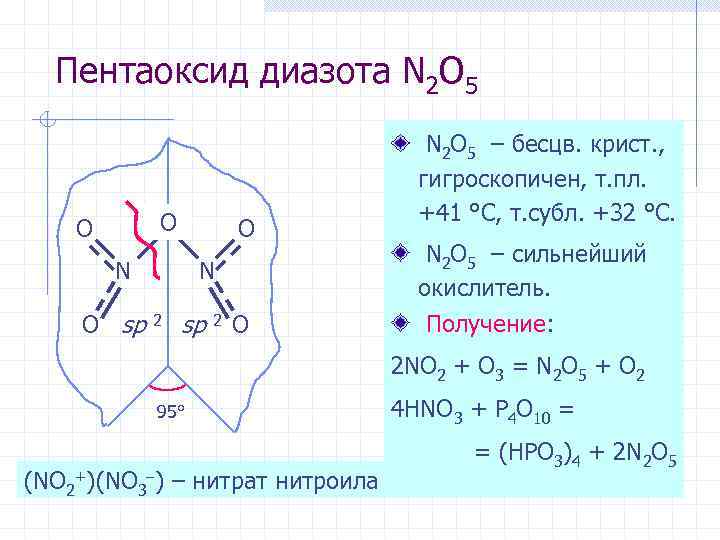
Пентаоксид диазота N 2 O 5 O O O N O sp N 2 sp 2 O N 2 O 5 – бесцв. крист. , гигроскопичен, т. пл. +41 °С, т. субл. +32 °С. N 2 O 5 – сильнейший окислитель. Получение: 2 NO 2 + O 3 = N 2 O 5 + O 2 95° (NO 2+)(NO 3 ) – нитрат нитроила 4 HNO 3 + P 4 O 10 = = (HPO 3)4 + 2 N 2 O 5
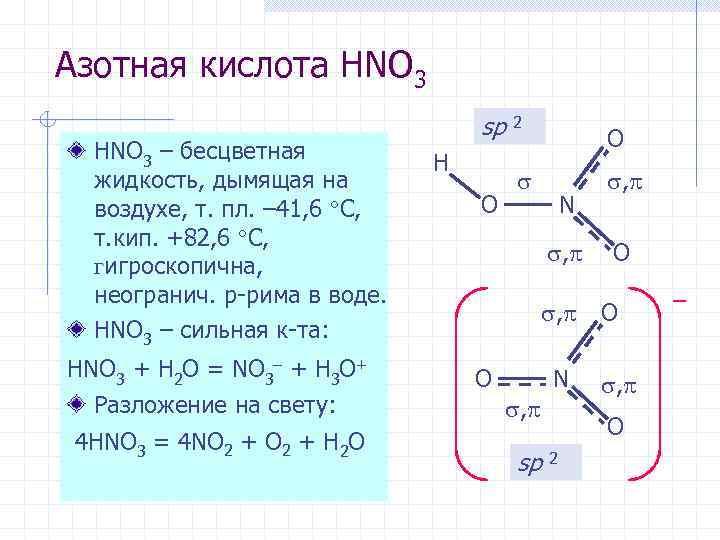
Азотная кислота HNO 3 – бесцветная жидкость, дымящая на воздухе, т. пл. – 41, 6 С, т. кип. +82, 6 С, гигроскопична, неогранич. р-рима в воде. HNO 3 – сильная к-та: HNO 3 + H 2 O = NO 3– + H 3 O+ Разложение на свету: 4 HNO 3 = 4 NO 2 + H 2 O sp 2 H O O N , , O N , sp 2 , O O , O –
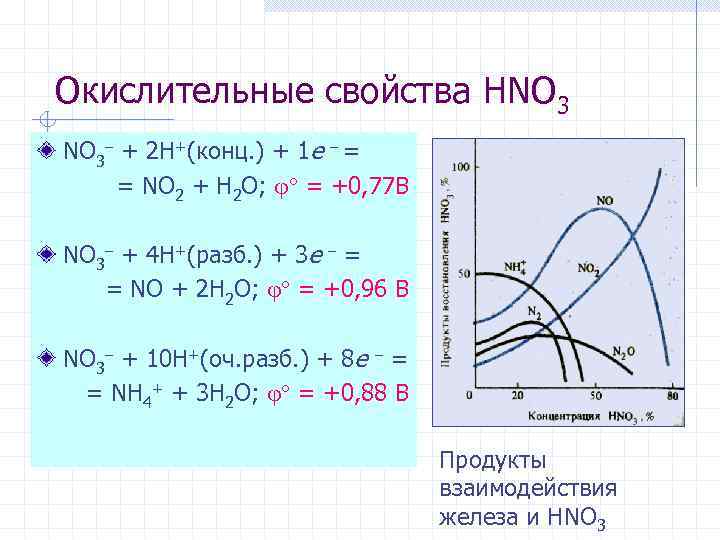
Окислительные свойства HNO 3 + 2 H+(конц. ) + 1 e = = NO 2 + H 2 O; = +0, 77 В NO 3 + 4 H+(разб. ) + 3 e = = NO + 2 H 2 O; = +0, 96 В NO 3 + 10 H+(оч. разб. ) + 8 e = = NH 4+ + 3 H 2 O; = +0, 88 В Продукты взаимодействия железа и HNO 3

«Царская водка» : HNO 3(к) + HCl(к) (1: 3 по объему) 3 HCl + HNO 3 NOCl + 2[Cl 0] + H 2 O Au + 4 HCl + HNO 3 = H[Au. Cl 4] + NO + 2 H 2 O 3 Pt + 18 HCl + 4 HNO 3 = 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O Термическое разложение нитратов MNO 3 t MNO 2 + O 2 (до Mg) MO + NO 2 + O 2 (Mg-Cu) M + NO 2 + O 2 (Ag, Au, Hg…)

Шкала степеней окисления фосфора +V +III +I 0 –III P 4 O 10, (HPO 3)x, H 4 P 2 O 7, H 3 PO 4, PГ 5, H[PF 6] P 4 O 6, H 3 PO 3, HPO 32–, PF 3 H(PH 2 O 2), PH 2 O 2– P (P 4, Px), P 2 PH 3, PH 4+, Na 3 P, Mg 3 P 2, Al. P

Еще раз о полиморфизме -P(т) гексагон. P 4 – 77 °С -P(т) кубич. +44 °С P 4 P(ж) P 4 +280 °С P(г) P 4 , P 2 Белый фосфор P 4 +250 °С, кат. I 2, Na, S Красный фосфор Pх p, t Черный фосфор (sp 2, тип графита) Т-ра вспышки: белый ф. +34 °С, p, t «Металлический» фосфор красный ф. +240 °С, черный ф. +400 °С

Дисмутация фосфора в щелочной среде на холоду: 4 P + 3 Na. OH(разб) + 3 H 2 O = 3 Na. H 2 P+IO 2 + P–IIIH 3 P + 3 H 2 O + 3 e = PH 3 + 3 OH– P + 2 OH– – 1 e = H 2 PO 2– (гипофосфит-ион) при нагревании: 2 P + 2 Na. OH(конц) + H 2 O = Na 2 HP+IIIO 3 + P–IIIH 3 P + 3 H 2 O + 3 e = PH 3 + 3 OH– P + 5 OH– – 3 e = HPO 33– + 3 H 2 O (фосфит-ион) Получение прокаливание фосфорита с углем и песком 2 Ca 3(PO 4)2 + 10 C + 6 Si. O 2 = 2 P 2 + 10 CO + 6 Ca. Si. O 3
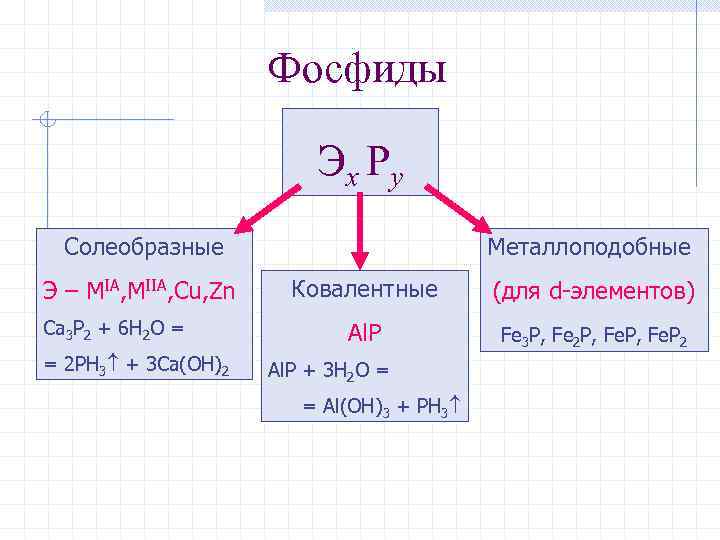
Фосфиды Эх Рy Солеобразные Э – MIA, MIIA, Cu, Zn Ca 3 P 2 + 6 H 2 O = = 2 PH 3 + 3 Ca(OH)2 Металлоподобные Ковалентные (для d-элементов) Al. P Fe 3 P, Fe 2 P, Fe. P 2 Al. P + 3 H 2 O = = Al(OH)3 + PH 3
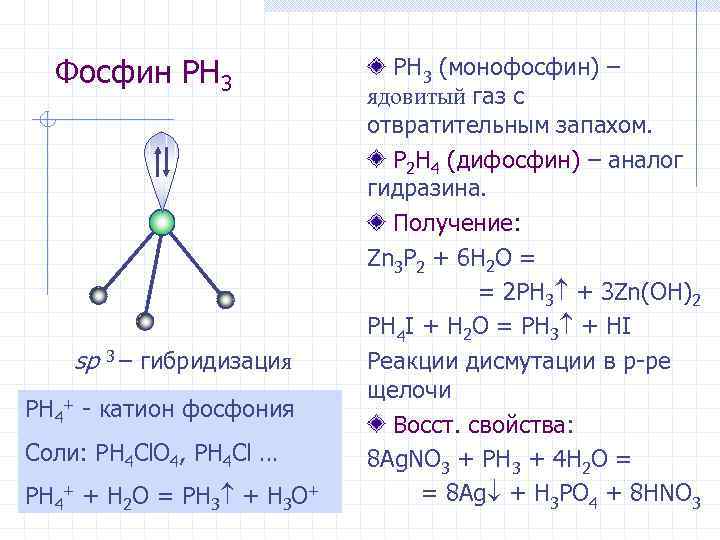
Фосфин PH 3 sp 3 – гибридизация PH 4+ - катион фосфония Соли: PH 4 Cl. O 4, PH 4 Cl … PH 4+ + H 2 O = PH 3 + H 3 O+ PH 3 (монофосфин) – ядовитый газ с отвратительным запахом. P 2 H 4 (дифосфин) – аналог гидразина. Получение: Zn 3 P 2 + 6 H 2 O = = 2 PH 3 + 3 Zn(OH)2 PH 4 I + H 2 O = PH 3 + HI Реакции дисмутации в р-ре щелочи Восст. свойства: 8 Ag. NO 3 + PH 3 + 4 H 2 O = = 8 Ag + H 3 PO 4 + 8 HNO 3

Кислородные кислоты Фосфорноватистая (фосфоновая) к-та, одноосновная H(PH 2 O 2) + H 2 O (PH 2 O 2) + H 3 O+; KK = 7, 94· 10– 2 Фосфористая (фосфиновая) к-та, двухосновная H 2(PHO 3) + H 2 O H(PHO 3) + H 3 O+; KK = 1, 00· 10– 2 H(PHO 3)– + H 2 O (PHO 3)2 + H 3 O+; KK = 2, 57· 10– 7 Ортофосфорная к-та, трехосновная H 3 PO 4 + H 2 O H 2 PO 4 + H 3 O+; KK = 7, 24· 10– 3 H 2 PO 4 + H 2 O HPO 42 + H 3 O+; KK = 6, 17· 10– 8 HPO 42 + H 2 O PO 43 + H 3 O+; KK = 4, 57· 10– 13 Дифосфорная к-та H 4 P 2 O 7 Полиметафосфорная к-та (HPO 3)x
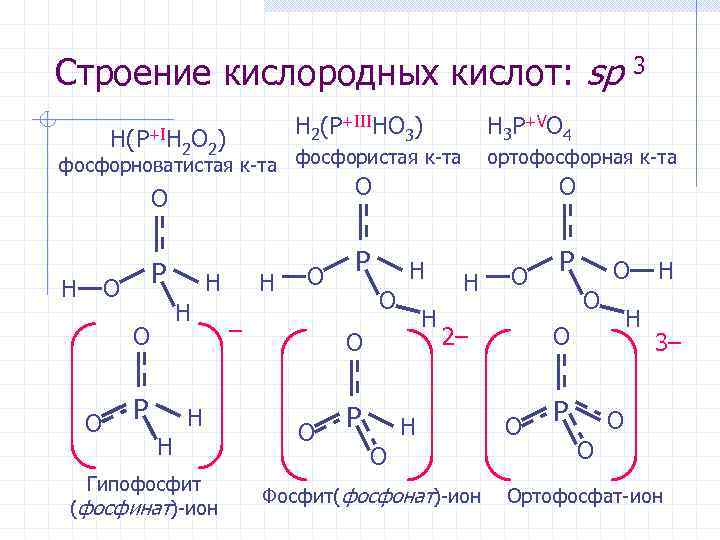
Строение кислородных кислот: sp H 2(P+IIIHO 3) H(P+IH 2 O 2) H 3 P+VO 4 фосфорноватистая к-та фосфористая к-та H P O O H H O P ортофосфорная к-та O O H H Гипофосфит (фосфинат)-ион H O – P H O O P 3 O H O 2– H O Фосфит(фосфонат)-ион P O O H O O P H 3– O O Ортофосфат-ион
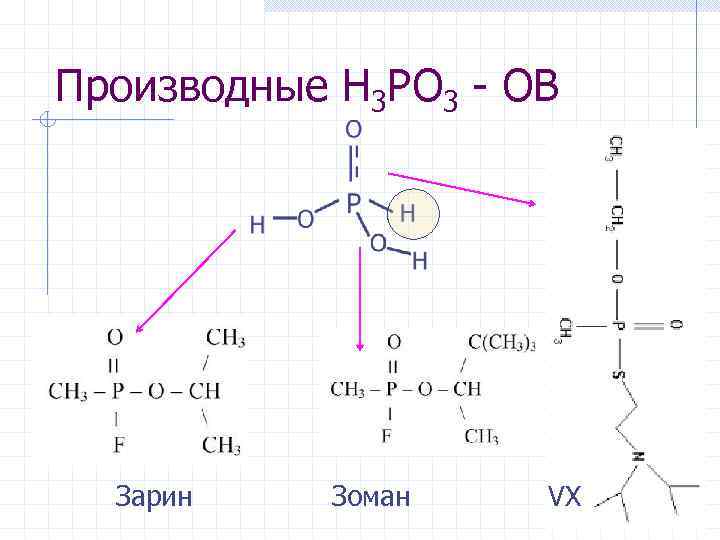
Производные H 3 PO 3 - ОВ Зарин Зоман VX
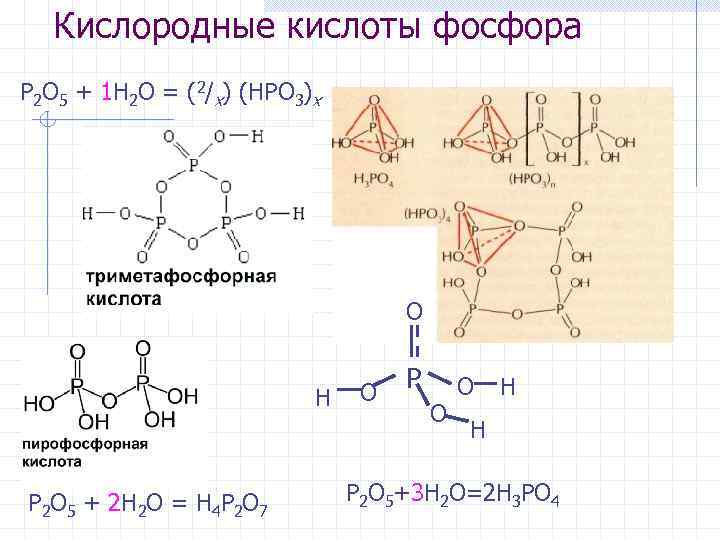
Кислородные кислоты фосфора P 2 O 5 + 1 H 2 O = (2/x) (HPO 3)x O H P 2 O 5 + 2 H 2 O = H 4 P 2 O 7 O P O O H H P 2 O 5+3 H 2 O=2 H 3 PO 4

Кислородные кислоты фосфора
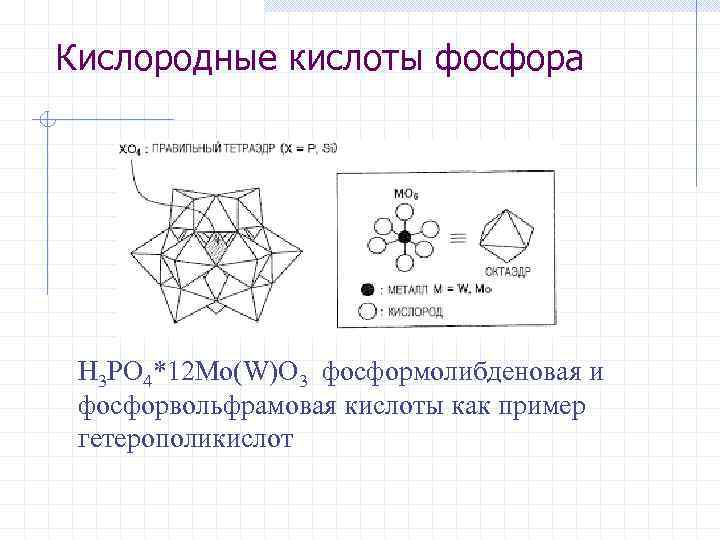
Кислородные кислоты фосфора H 3 PO 4*12 Mo(W)O 3 фосформолибденовая и фосфорвольфрамовая кислоты как пример гетерополикислот
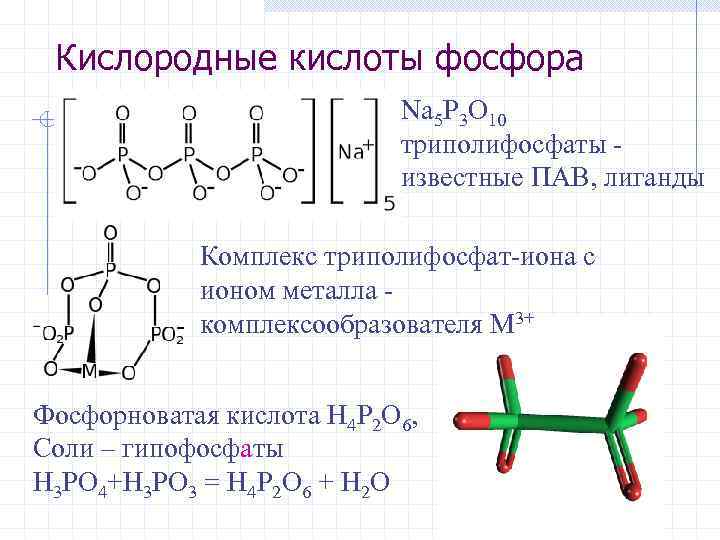
Кислородные кислоты фосфора Na 5 P 3 O 10 триполифосфаты известные ПАВ, лиганды Комплекс триполифосфат-иона с ионом металла комплексообразователя M 3+ Фосфорноватая кислота H 4 P 2 O 6, Соли – гипофосфаты H 3 PO 4+H 3 PO 3 = H 4 P 2 O 6 + H 2 O
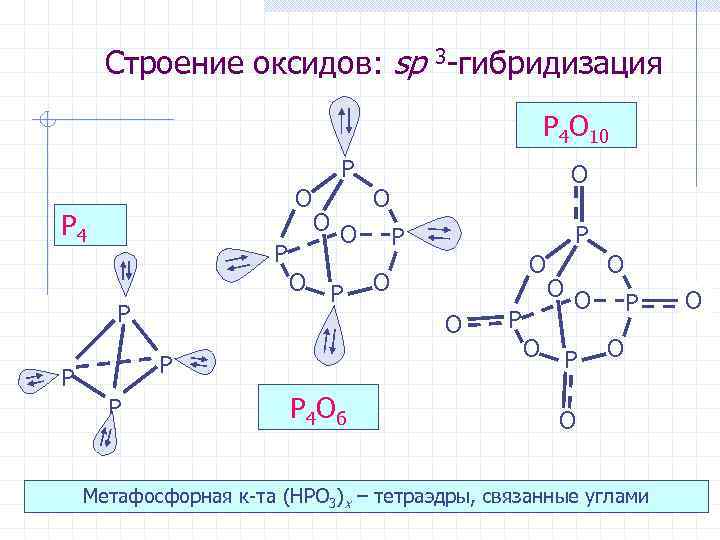
Строение оксидов: sp 3 -гибридизация P 4 O 10 P O P 4 P OO O P P P O O O P P O P 4 O 6 P O O P P O O Метафосфорная к-та (HPO 3)x – тетраэдры, связанные углами O

Окислительно-восстановительные свойства р. Н < 7: H 3 PO 2 + H 2 O – 2 e = H 3 PO 3 + 2 H+ = – 0, 49 В р. Н > 7: H 2 PO 2 + 3 OH – 2 e = HPO 32 + 2 H 2 O = – 1, 57 В р. Н < 7: H 3 PO 3 + H 2 O – 2 e = H 3 PO 4 + 2 H+ = – 0, 28 В р. Н > 7: HPO 32 + 3 OH – 2 e = PO 43 + 2 H 2 O = – 1, 12 В Пример: H 3 PO 3 + 2 Ag. NO 3 + H 2 O = H 3 PO 4 + 2 Ag + 2 HNO 3 разб
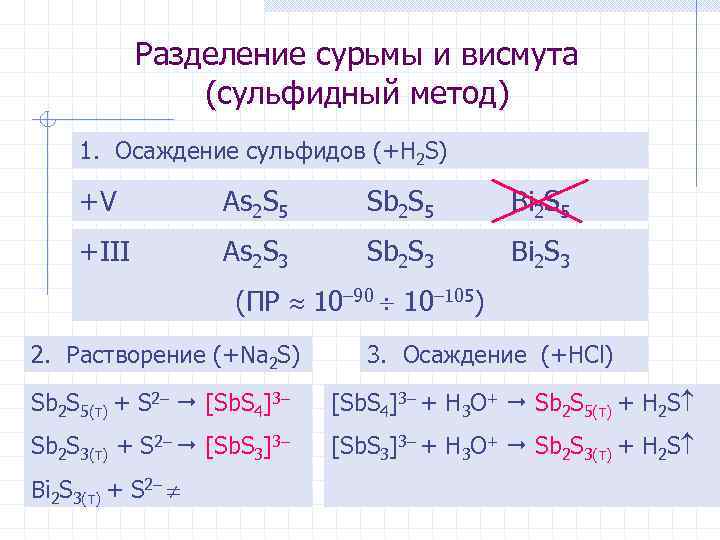
Разделение сурьмы и висмута (сульфидный метод) 1. Осаждение сульфидов (+H 2 S) +V As 2 S 5 Sb 2 S 5 Bi 2 S 5 +III As 2 S 3 Sb 2 S 3 Bi 2 S 3 (ПР 10– 90 10– 105) 2. Растворение (+Na 2 S) 3. Осаждение (+HCl) Sb 2 S 5(т) + S 2– [Sb. S 4]3– + H 3 O+ Sb 2 S 5(т) + H 2 S Sb 2 S 3(т) + S 2– [Sb. S 3]3– + H 3 O+ Sb 2 S 3(т) + H 2 S Bi 2 S 3(т) + S 2–

Особенности химии висмута Bi + 6 HNO 3 = Bi(NO 3)3 + 3 NO 2 + 3 H 2 O Bi(NO 3)3 + 6 H 2 O → [Bi(OH 2)6]3+ + 3 NO 3 -; p. H<<7 [Bi(OH 2)6]3+ + 2 H 2 O → [Bi(OH)2(OH 2)4]+ + 2 H 3 O+ OHBi(OH)3 + Na. OH → Bi. O+ + 5 H 2 O ( 2<p. H<6) [Bi(OH 2)6]3+ + 4 I- → [Bi. I 4]- +6 H 2 O Bi(OH)3 + O 3 + KOH → KBi. O 3 + H 2 O
Лекция_кисл_соед_N_P_и_др.pptx