Азот и его соединения мини.pptx
- Количество слайдов: 16
Азот и его соединения «Азот – безжизненный, или главный элемент жизни на Земле? »

Азот, как элемент 2 s 2 p ü Высшая валентность IV ü Степень окисления ü -3, 0, +1, +2, +3, +4, +5 ü Азо т — элемент 5 -й группы ü Природный азот состоит из двух стабильных изотопов 14 N и 15 N

Азот, как простое вещество (электронная формула) ü ü Молекула: N 2, Химическая связь - ковалентная неполярная Кристаллическая решётка - молекулярная Молекула очень устойчивая (молекулярная формула) (структурная формула)

Нахождение в природе • При нормальных условиях инертный газ , не вступающий в реакции с другими химическими соединениями. Физические свойства: бесцветный газ не имеет запаха нерастворим в воде температура кипения -195 0 С не поддерживает горение и дыхание не ядовит легче воздуха

• С металлами 1, 2 группы и алюминием 6 Li+N 2→ 2 Li 3 N нитрид (обычные условия) 3 Mg+N 2→Mg 3 N 2 (при температуре) • С неметаллами N 2+O 2→ 2 NO (при температуре) N 2+3 H 2→ 2 NH 3 аммиак Тройная связь между атомами азота является очень прочной, поэтому азот химически инертен.
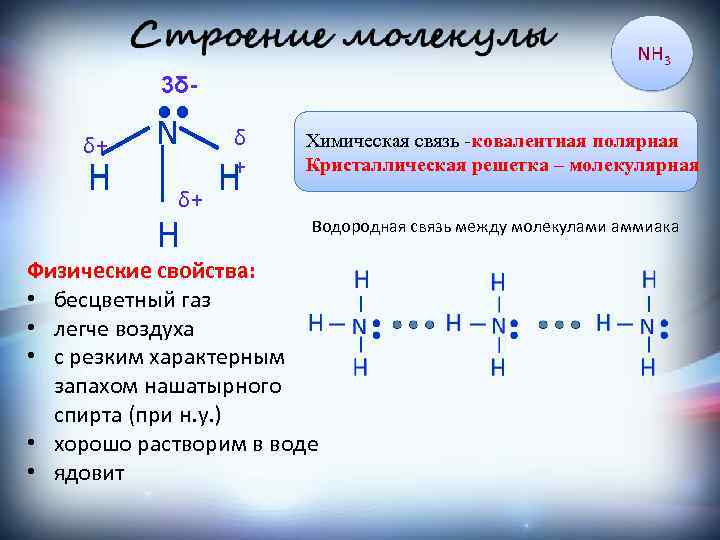
3δ- δ+ H • • N δ+ H δ + H Химическая связь -ковалентная полярная Кристаллическая решетка – молекулярная Водородная связь между молекулами аммиака Физические свойства: • бесцветный газ • легче воздуха • с резким характерным запахом нашатырного спирта (при н. у. ) • хорошо растворим в воде • ядовит
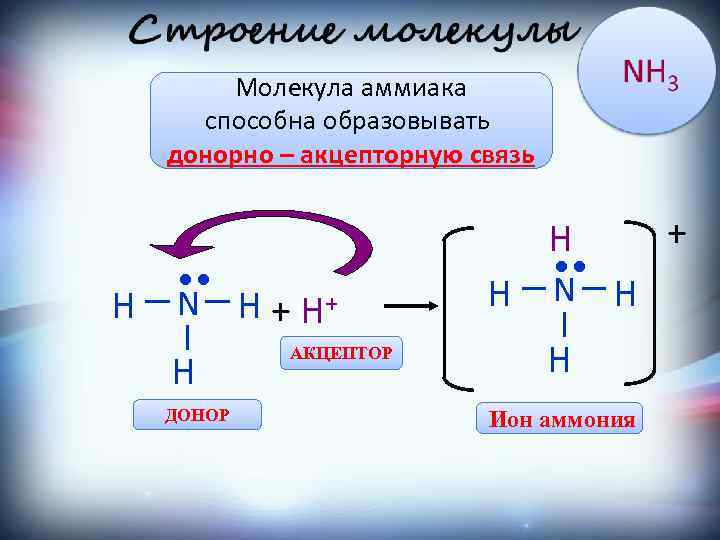
Молекула аммиака способна образовывать донорно – акцепторную связь H • • N H + H+ H ДОНОР АКЦЕПТОР H H • • N H H Ион аммония +
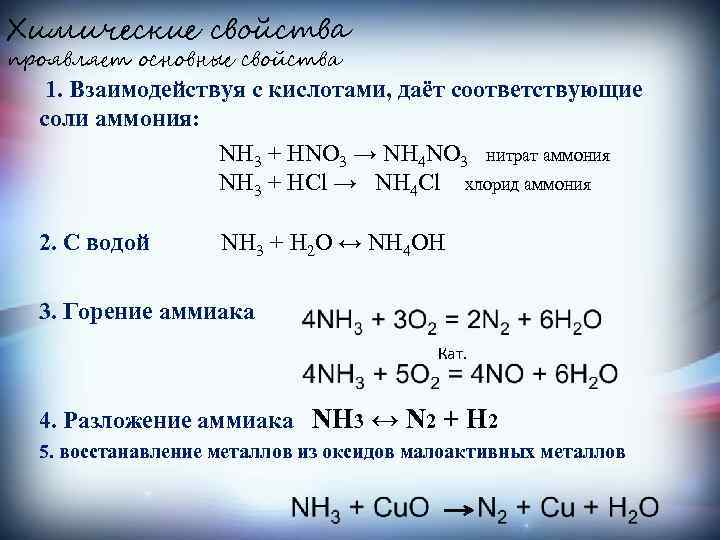
Химические свойства проявляет основные свойства 1. Взаимодействуя с кислотами, даёт соответствующие соли аммония: NH 3 + HNO 3 → NH 4 NO 3 нитрат аммония NH 3 + HCl → NH 4 Cl хлорид аммония 2. С водой NH 3 + H 2 O ↔ NH 4 OH 3. Горение аммиака Кат. 4. Разложение аммиака NH 3 ↔ N 2 + H 2 5. восстанавление металлов из оксидов малоактивных металлов
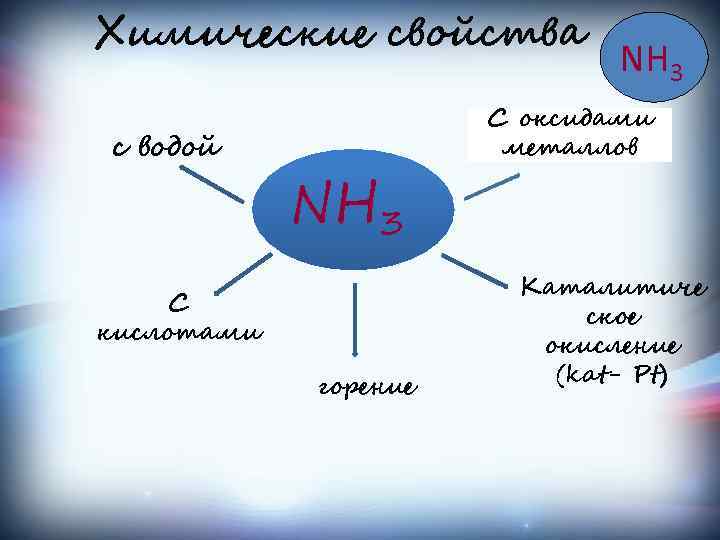
Химические свойства с водой NH 3 С кислотами горение NH 3 С оксидами металлов Каталитиче ское окисление (kat- Pt)

получение • 1. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота (при давлении, высокой температуре и катализаторе). Используют принцип циркуляции:
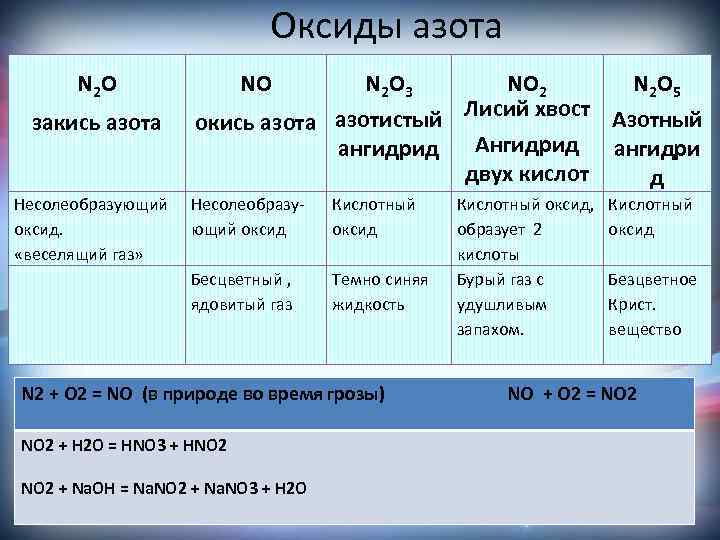
Оксиды азота N 2 O закись азота Несолеобразующий оксид. «веселящий газ» NO N 2 O 3 NO 2 N 2 O 5 азотистый Лисий хвост Азотный окись азота Ангидрид ангидрид двух кислот д Несолеобразующий оксид Кислотный оксид Бесцветный , ядовитый газ Темно синяя жидкость Кислотный оксид, образует 2 кислоты Бурый газ с удушливым запахом. Кислотный оксид Безцветное Крист. вещество N 2 + O 2 = NO (в природе во время грозы) NO + O 2 = NO 2 + H 2 O = HNO 3 + HNO 2 + Na. OH = Na. NO 2 + Na. NO 3 + H 2 O

Азотная кислота HNO 3 Азот в азотной кислоте четырёхвалентен, степень окисления +5. Физические свойства • Азотная кислота — бесцветная, дымящая на воздухе жидкость. • Растворимость азотной кислоты в воде не ограничена. • Водные растворы HNO 3 с массовой долей 95 -98 называют «дымящей азотной кислотой» , • с массовой долей 60 -70%— концентрированной азотной кислотой. • Резкий запах и при хранении желтеет, объясняется это тем, что концентрированная кислота малоустойчива и под действием света или при нагревании частично разлагается. • 4 HNO 3 = 2 H 2 O + 4 NO 2 + O 2

Химические свойства: •

Особые свойства концентрированная разбавленная Активные металлы Соль + N 2 O + H 2 O Соль + NH 4 NO 3 +H 2 O (NH 3; N 2 O) Соль + NO 2 + H 2 O Соль + NO + H 2 O Сред/cлаб ые металлы Неметаллы Высший оксид + NO 2 + H 2 O Высший оксид + NO + H 2 O Al, Fe, Cr Au, Pt Пассивируют в концентрированной кисл.

Разложение нитратов

Соли азотной кислоты При нагревании твердых нитратов они разлагаются с выделе нием кислорода можно выделить четыре груп пы. 1. Нитрат щелочных металлов 2 КNО 3→ 2 КNО 2+ О 2↑. 2. Большинство нитратов от Mg до Cu 2 Сu(NО 3)2 = 2 Сu. О + 4 NО 2 + O 2, 3. Нитраты наиболее тяжелых металлов (Аg. NО 3 и Нg(NО 3)2) Hg(NО 3)2 = Нg + 2 NО 2 + О 2, 4. Нитрат и нитрит аммония: NН 4 NО 3→N 2 О + 2 Н 2 O NH 4 NO 2→N 2+H 2 O
Азот и его соединения мини.pptx