Презентация2(Атомы и молекулы).ppt
- Количество слайдов: 16
 Атомы и молекулы Планетарная модель атома Атом состоит из тяжелого положительно заряженного ядра, вокруг которого по круговым либо эллиптическим орбитам движутся электроны. Э. Резерфорд Позже выяснилось, что электроны движутся вокруг ядра не по законам классической физики, а по законам квантовой механики
Атомы и молекулы Планетарная модель атома Атом состоит из тяжелого положительно заряженного ядра, вокруг которого по круговым либо эллиптическим орбитам движутся электроны. Э. Резерфорд Позже выяснилось, что электроны движутся вокруг ядра не по законам классической физики, а по законам квантовой механики
 Нельзя говорить о траектории электрона в атоме. На языке квантовой механики можно говорить только о стационарных состояниях электрона в атоме, в которых энергия имеет определенное значение. В таких состояниях, электрон как бы размазан вокруг ядра и как бы одновременно существует во всех этих точках. Форма электронных облаков для различных состояний атома водорода.
Нельзя говорить о траектории электрона в атоме. На языке квантовой механики можно говорить только о стационарных состояниях электрона в атоме, в которых энергия имеет определенное значение. В таких состояниях, электрон как бы размазан вокруг ядра и как бы одновременно существует во всех этих точках. Форма электронных облаков для различных состояний атома водорода.
 Начало ХХ века зачастую называют периодом кризиса в физике. Многие физики, воспитанные на классической физике не могли с помощью наглядных моделей объяснить квантовые явления. Фактически, время становления квантовой физики следует признать периодом наиболее бурного развития физической науки. Созданы: Теория относительности Квантовая механика открытие электрона, установление строения атома, открытие волновых свойств у частиц открытие корпускулярных свойств у волн Более правильно не кризис, а трудности слишком быстрого роста. Кризис несовместим с прогрессом, тем более бурным.
Начало ХХ века зачастую называют периодом кризиса в физике. Многие физики, воспитанные на классической физике не могли с помощью наглядных моделей объяснить квантовые явления. Фактически, время становления квантовой физики следует признать периодом наиболее бурного развития физической науки. Созданы: Теория относительности Квантовая механика открытие электрона, установление строения атома, открытие волновых свойств у частиц открытие корпускулярных свойств у волн Более правильно не кризис, а трудности слишком быстрого роста. Кризис несовместим с прогрессом, тем более бурным.
 Постулаты квантовой механики: • электрон в атоме может находиться только в определенных квантовых состояниях. • Квантовое состояние с наименьшей энергией атома называется основным. (n=1) • Все остальные квантовые состояния с большими значениями энергии называются возбужденными (n=2, 3, …). • Энергия связи электрона с ядром максимальна в основном состоянии. • С ростом n энергия связи электрона с ядром ослабевает • Когда энергия связи обращается в ноль, электрон отрывается от атома - ионизация атома. • В основном состоянии изолированный атом может существовать как угодно долго, в возбужденном же состоянии он живет недолго.
Постулаты квантовой механики: • электрон в атоме может находиться только в определенных квантовых состояниях. • Квантовое состояние с наименьшей энергией атома называется основным. (n=1) • Все остальные квантовые состояния с большими значениями энергии называются возбужденными (n=2, 3, …). • Энергия связи электрона с ядром максимальна в основном состоянии. • С ростом n энергия связи электрона с ядром ослабевает • Когда энергия связи обращается в ноль, электрон отрывается от атома - ионизация атома. • В основном состоянии изолированный атом может существовать как угодно долго, в возбужденном же состоянии он живет недолго.
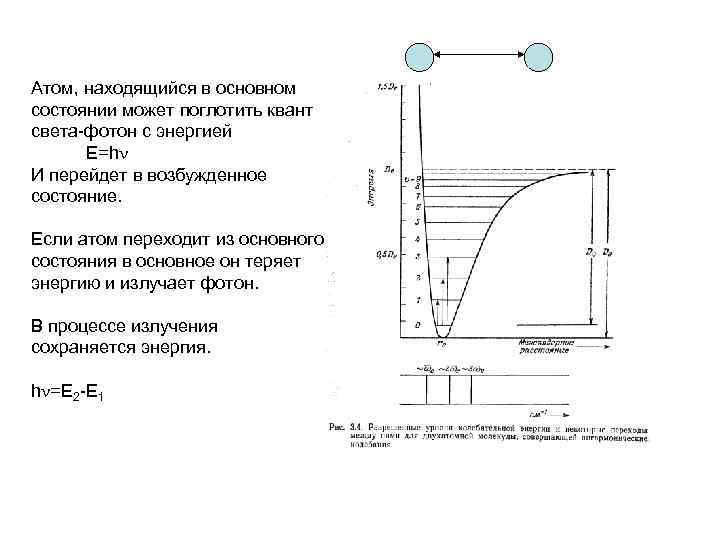 Атом, находящийся в основном состоянии может поглотить квант света-фотон с энергией Е=h И перейдет в возбужденное состояние. Если атом переходит из основного состояния в основное он теряет энергию и излучает фотон. В процессе излучения сохраняется энергия. h =E 2 -E 1
Атом, находящийся в основном состоянии может поглотить квант света-фотон с энергией Е=h И перейдет в возбужденное состояние. Если атом переходит из основного состояния в основное он теряет энергию и излучает фотон. В процессе излучения сохраняется энергия. h =E 2 -E 1
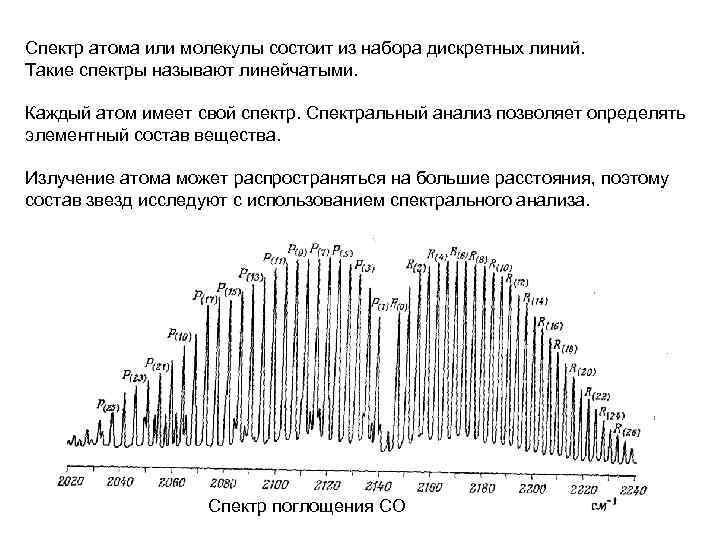 Спектр атома или молекулы состоит из набора дискретных линий. Такие спектры называют линейчатыми. Каждый атом имеет свой спектр. Спектральный анализ позволяет определять элементный состав вещества. Излучение атома может распространяться на большие расстояния, поэтому состав звезд исследуют с использованием спектрального анализа. Спектр поглощения СО
Спектр атома или молекулы состоит из набора дискретных линий. Такие спектры называют линейчатыми. Каждый атом имеет свой спектр. Спектральный анализ позволяет определять элементный состав вещества. Излучение атома может распространяться на большие расстояния, поэтому состав звезд исследуют с использованием спектрального анализа. Спектр поглощения СО
 Длина волны де Бройля Соотношения де Бройля устанавливают связь между волновыми и корпускулярными свойствами частиц. Измеряя длину волны излучения атома , мы можем вычислить соответствующую энергию фотона. =c - частота, Гц - длина волны, м с – скорость света, с=3× 106 м/с Пусть атом имеет энергию С другой стороны В – Длина волны де Бройля Чем больше масса, тем меньше длина волны
Длина волны де Бройля Соотношения де Бройля устанавливают связь между волновыми и корпускулярными свойствами частиц. Измеряя длину волны излучения атома , мы можем вычислить соответствующую энергию фотона. =c - частота, Гц - длина волны, м с – скорость света, с=3× 106 м/с Пусть атом имеет энергию С другой стороны В – Длина волны де Бройля Чем больше масса, тем меньше длина волны
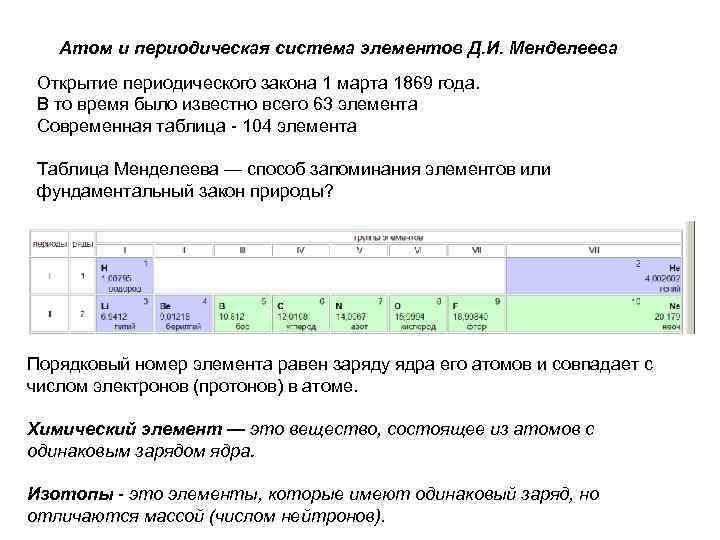 Атом и периодическая система элементов Д. И. Менделеева Открытие периодического закона 1 марта 1869 года. В то время было известно всего 63 элемента Современная таблица - 104 элемента Таблица Менделеева — способ запоминания элементов или фундаментальный закон природы? Порядковый номер элемента равен заряду ядра его атомов и совпадает с числом электронов (протонов) в атоме. Химический элемент — это вещество, состоящее из атомов с одинаковым зарядом ядра. Изотопы - это элементы, которые имеют одинаковый заряд, но отличаются массой (числом нейтронов).
Атом и периодическая система элементов Д. И. Менделеева Открытие периодического закона 1 марта 1869 года. В то время было известно всего 63 элемента Современная таблица - 104 элемента Таблица Менделеева — способ запоминания элементов или фундаментальный закон природы? Порядковый номер элемента равен заряду ядра его атомов и совпадает с числом электронов (протонов) в атоме. Химический элемент — это вещество, состоящее из атомов с одинаковым зарядом ядра. Изотопы - это элементы, которые имеют одинаковый заряд, но отличаются массой (числом нейтронов).
 Атом и периодическая система элементов Д. И. Менделеева Периодическое изменение химических свойств элементов с ростом заряда ядра атомов объяснила квантовая механика. 1) Электроны располагаются вокруг ядра слоями-оболочками. 2) Во-вторых, химические свойства элементов определяются структурой внешней электронной оболочки атома. 3) Начало заполнения новой оболочки совпадает с началом нового периода. В каждом столбце стоят элементы с одинаковыми свойствами
Атом и периодическая система элементов Д. И. Менделеева Периодическое изменение химических свойств элементов с ростом заряда ядра атомов объяснила квантовая механика. 1) Электроны располагаются вокруг ядра слоями-оболочками. 2) Во-вторых, химические свойства элементов определяются структурой внешней электронной оболочки атома. 3) Начало заполнения новой оболочки совпадает с началом нового периода. В каждом столбце стоят элементы с одинаковыми свойствами
 Объяснение периодической системы квантовой механикой Чтобы описать состояние электрона в атоме вводится четыре квантовых числа: n — главное квантовое число, n= 1, 2, 3. . . ; l— орбитальное квантовое число, l= 0, 1, 2, . . . , n— 1; т - магнитное квантовое число, т = -l, -(l— 1), . 0. . , l-1, l; s - спиновое квантовое число, принимающее два значения +1/2 и -1/2. n определяет энергию электрона и радиус оболочки. l определяет величину момента импульса. m — ориентацию момента импульса. s — ориентацию спина электрона. Принцип запрета Паули: в каждом квантовом состоянии не может находиться более одного электрона. Каждое состояние характеризуется набором квантовых чисел. n=1, l=0, m=0, s=1/2, -1/2 (2 состояния – 2 электрона на уровне n=1) n=2, l=0, 1, m=-1, 0, 1, s=1/2, -1/2 (8 состояний)
Объяснение периодической системы квантовой механикой Чтобы описать состояние электрона в атоме вводится четыре квантовых числа: n — главное квантовое число, n= 1, 2, 3. . . ; l— орбитальное квантовое число, l= 0, 1, 2, . . . , n— 1; т - магнитное квантовое число, т = -l, -(l— 1), . 0. . , l-1, l; s - спиновое квантовое число, принимающее два значения +1/2 и -1/2. n определяет энергию электрона и радиус оболочки. l определяет величину момента импульса. m — ориентацию момента импульса. s — ориентацию спина электрона. Принцип запрета Паули: в каждом квантовом состоянии не может находиться более одного электрона. Каждое состояние характеризуется набором квантовых чисел. n=1, l=0, m=0, s=1/2, -1/2 (2 состояния – 2 электрона на уровне n=1) n=2, l=0, 1, m=-1, 0, 1, s=1/2, -1/2 (8 состояний)
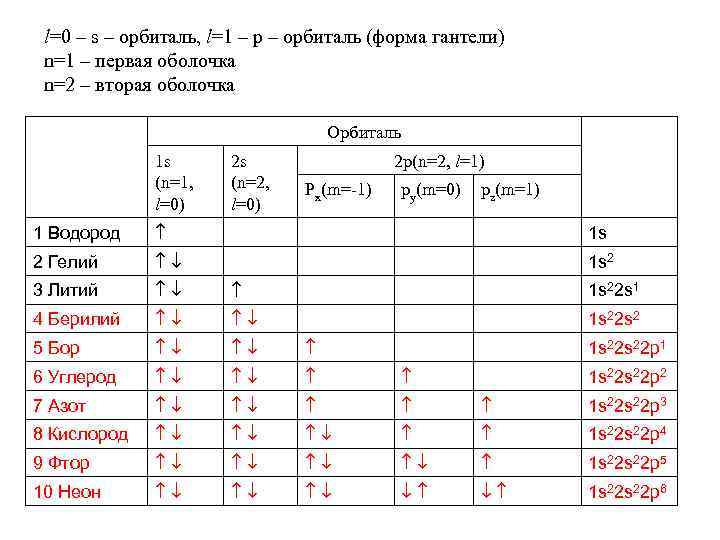 l=0 – s – орбиталь, l=1 – p – орбиталь (форма гантели) n=1 – первая оболочка n=2 – вторая оболочка Орбиталь 1 s (n=1, l=0) 2 s (n=2, l=0) 2 p(n=2, l=1) Px(m=-1) py(m=0) pz(m=1) 1 Водород 1 s 2 Гелий 1 s 2 3 Литий 1 s 22 s 1 4 Берилий 1 s 22 s 2 5 Бор 6 Углерод 7 Азот 1 s 22 p 3 8 Кислород 1 s 22 p 4 9 Фтор 1 s 22 p 5 10 Неон 1 s 22 p 6 1 s 22 p 1 1 s 22 p 2
l=0 – s – орбиталь, l=1 – p – орбиталь (форма гантели) n=1 – первая оболочка n=2 – вторая оболочка Орбиталь 1 s (n=1, l=0) 2 s (n=2, l=0) 2 p(n=2, l=1) Px(m=-1) py(m=0) pz(m=1) 1 Водород 1 s 2 Гелий 1 s 2 3 Литий 1 s 22 s 1 4 Берилий 1 s 22 s 2 5 Бор 6 Углерод 7 Азот 1 s 22 p 3 8 Кислород 1 s 22 p 4 9 Фтор 1 s 22 p 5 10 Неон 1 s 22 p 6 1 s 22 p 1 1 s 22 p 2
 1 период H 1 s 1 n=1, l=0, m=0, s=1/2 He 1 s 2 n=1, l=0, m=0, s=1/2, s= -1/2 Каждый период в таблице элементов Менделеева начинается щелочным металлом и заканчивается инертным газом
1 период H 1 s 1 n=1, l=0, m=0, s=1/2 He 1 s 2 n=1, l=0, m=0, s=1/2, s= -1/2 Каждый период в таблице элементов Менделеева начинается щелочным металлом и заканчивается инертным газом
 Молекулы и химические превращения валентность элемента определяется числом электронов во внешней оболочке, которые могут отдать или присоединить. Литий - 1 электрон на внешней оболочке (1 s 22 s 1) Фтор – может присоединить только 1 электрон (1 s 22 p 5) Валентность =1 Атомы щелочных металлов сравнительно легко отдают внешний электрон другим атомам, превращаясь в положительный ион. Во внешней оболочке атомов галогенов не хватает одного электрона, чтобы оболочка была полностью заполненной. Такие атомы легко принимают лишний электрон, образуя отрицательный ион. Образуется ковалентная связь Li+F=Li. F
Молекулы и химические превращения валентность элемента определяется числом электронов во внешней оболочке, которые могут отдать или присоединить. Литий - 1 электрон на внешней оболочке (1 s 22 s 1) Фтор – может присоединить только 1 электрон (1 s 22 p 5) Валентность =1 Атомы щелочных металлов сравнительно легко отдают внешний электрон другим атомам, превращаясь в положительный ион. Во внешней оболочке атомов галогенов не хватает одного электрона, чтобы оболочка была полностью заполненной. Такие атомы легко принимают лишний электрон, образуя отрицательный ион. Образуется ковалентная связь Li+F=Li. F
 Ковалентная связь в молекуле водорода: а — схематическое изображение атомов водорода; б — распределение электронной плотности в системе из двух атомов водорода: 1 — распределение электронной плотности в изолированных атомах водорода; 2—электронная плотность, которая получалась бы при простом наложении электронных облаков изолированных атомов 3 — действительное распределение электронной плотности в молекуле водорода
Ковалентная связь в молекуле водорода: а — схематическое изображение атомов водорода; б — распределение электронной плотности в системе из двух атомов водорода: 1 — распределение электронной плотности в изолированных атомах водорода; 2—электронная плотность, которая получалась бы при простом наложении электронных облаков изолированных атомов 3 — действительное распределение электронной плотности в молекуле водорода
 Ковалентная связь: 1) Электроны объединены и неразличимы 2) направленность 3) насыщенность H 2. Два атома водорода приближаются друг к другу. Электроны получают начинают двигаться по орбите, охватывающей оба атома. Эта новая орбита представляет собой объединение атомных орбит. В соответствие с принципом Паули, на этой орбите могут находиться два электрона с противоположно направленными спинами, то есть суммарный спин двух электронов равен нулю. Т. О. валентная связь создается перекрыванием атомных электронных облаков и два электрона обобществляются в валентной связи.
Ковалентная связь: 1) Электроны объединены и неразличимы 2) направленность 3) насыщенность H 2. Два атома водорода приближаются друг к другу. Электроны получают начинают двигаться по орбите, охватывающей оба атома. Эта новая орбита представляет собой объединение атомных орбит. В соответствие с принципом Паули, на этой орбите могут находиться два электрона с противоположно направленными спинами, то есть суммарный спин двух электронов равен нулю. Т. О. валентная связь создается перекрыванием атомных электронных облаков и два электрона обобществляются в валентной связи.
 He. Два атома гелия не образуют устойчивой молекулы, потому что у них во внешней оболочке находится по два электрона, а на низшую молекулярную орбиталь можно поместить только два электрона. C. Углерод — основа жизни на Земле. Углерод является четырехвалентным элементом (1 s 22 p 2). Благодаря этому, на его основе можно создать практически безграничное число молекул. Сегодня химикам известно порядка миллиона соединений углерода.
He. Два атома гелия не образуют устойчивой молекулы, потому что у них во внешней оболочке находится по два электрона, а на низшую молекулярную орбиталь можно поместить только два электрона. C. Углерод — основа жизни на Земле. Углерод является четырехвалентным элементом (1 s 22 p 2). Благодаря этому, на его основе можно создать практически безграничное число молекул. Сегодня химикам известно порядка миллиона соединений углерода.


