11 Атомные термы.pptx
- Количество слайдов: 25
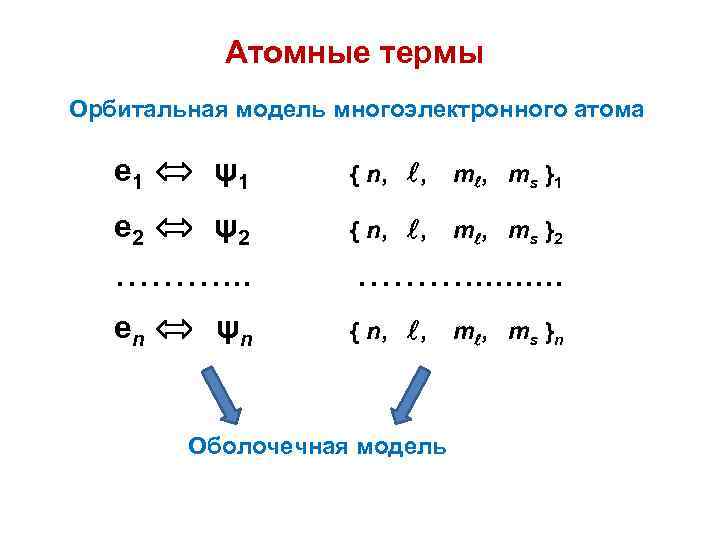
Атомные термы Орбитальная модель многоэлектронного атома е 1 ψ1 { n, , m , m s } 1 е 2 ψ2 { n, , m , m s } 2 ………. . . еn { n, , ψn Оболочечная модель m , m s } n

Оболочечная модель Спин-орбитали группируются в подоболочки по значениям квантовых чисел n, – оболочки ( n, ) , где — заселенность (число электронов) 1 s-оболочка ( макс. = 2 ) 2 p-оболочка ( макс. = 6 ) 3 s-оболочка ( макс. = 2 ) 3 p-оболочка ( макс. = 6 ) 3 d-оболочка ( макс. = 10 ) Емкость оболочки макс. = 2 (2 + 1)
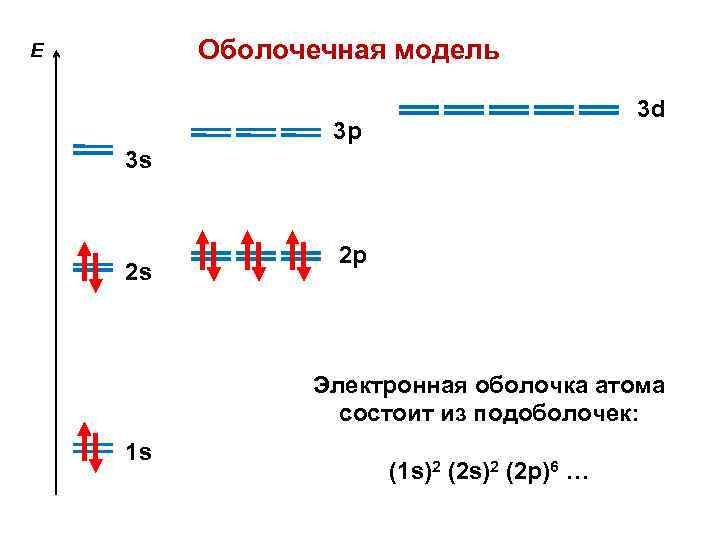
Оболочечная модель E 3 d 3 p 3 s 2 s 2 p Электронная оболочка атома состоит из подоболочек: 1 s (1 s)2 (2 p)6 …

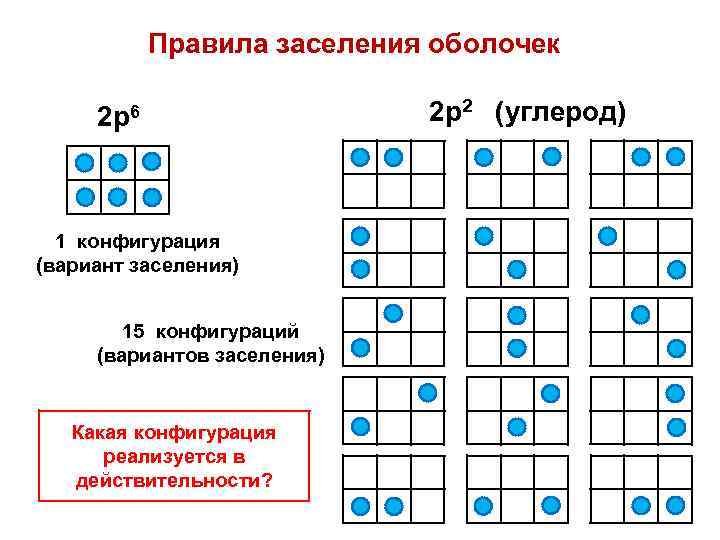
Правила заселения оболочек 2 р6 1 конфигурация (вариант заселения) 15 конфигураций (вариантов заселения) Какая конфигурация реализуется в действительности? 2 р2 (углерод)

Правило: реализуется состояние с минимальной полной энергией Полная энергия атома зависит от ряда параметров: 1) от орбитальных энергий и распределения электронов по атомным орбиталям (электронной конфигурации); 2) от кулоновских межэлектронных взаимодействий (межэлектронного отталкивания); 3) от магнитного спин-орбитального взаимодействия, обусловленного взаимным влиянием магнитных моментов атома — орбитального и спинового. Е = f ( |L|, |S|, |J| ) или E = f ( L, S, J )

Е = f ( |L|, |S|, |J| ) или E = f ( L, S, J ) Если значения квантовых чисел ( L, S, J ) заданы, то Е = const Атомный терм — совокупность состояний с заданными значениями квантовых чисел ( L, S, J ) и постоянной энергией Е = const

Атом углерода Электронная формула: (1 s)2 (2 p)2 1 вариант 15 вариантов Задача: для оболочки (2 р)2 найти значения квантовых чисел L, S и J L, S – приближение j, j – приближение L = L 1 + L 2 + … J 1 = L 1 + S 2 S = S 1 + S 2 + … J 2 = L 1 + S 2 J = L + S J = J 1 + J 2
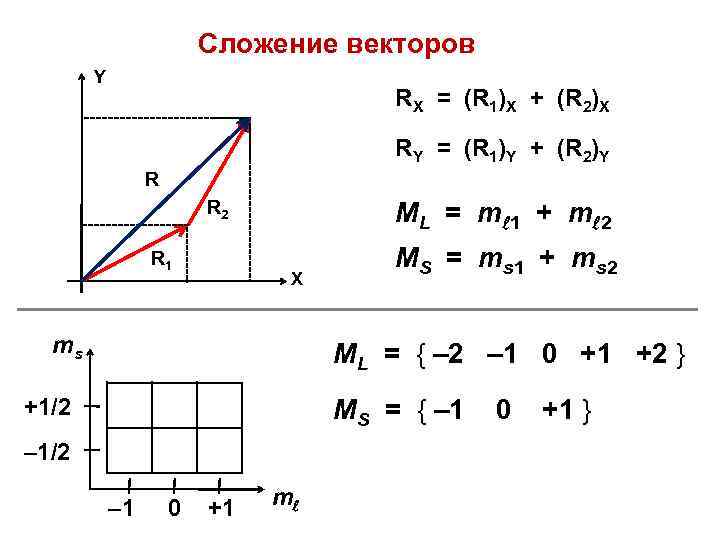
Сложение векторов Y RX = (R 1)X + (R 2)X RY = (R 1)Y + (R 2)Y R R 2 R 1 ML = m 1 + m 2 X ms MS = ms 1 + ms 2 ML = { – 2 – 1 0 +1 +2 } +1/2 MS = { – 1/2 – 1 0 +1 m 0 +1 }
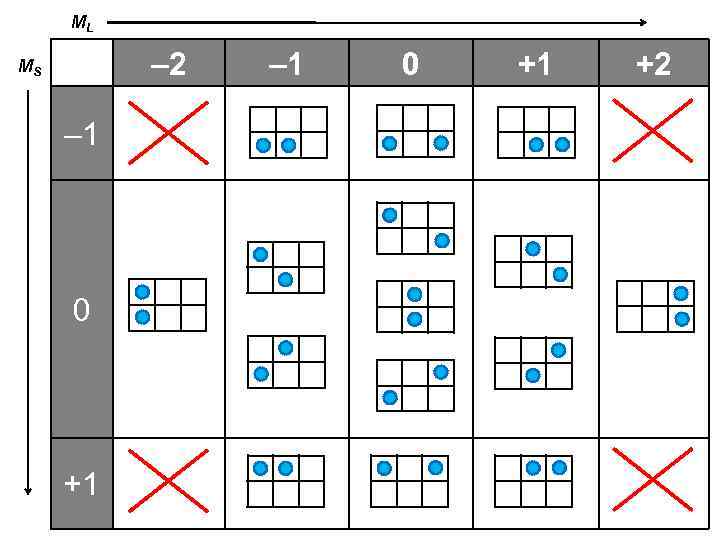
ML – 2 MS – 1 0 +1 +2
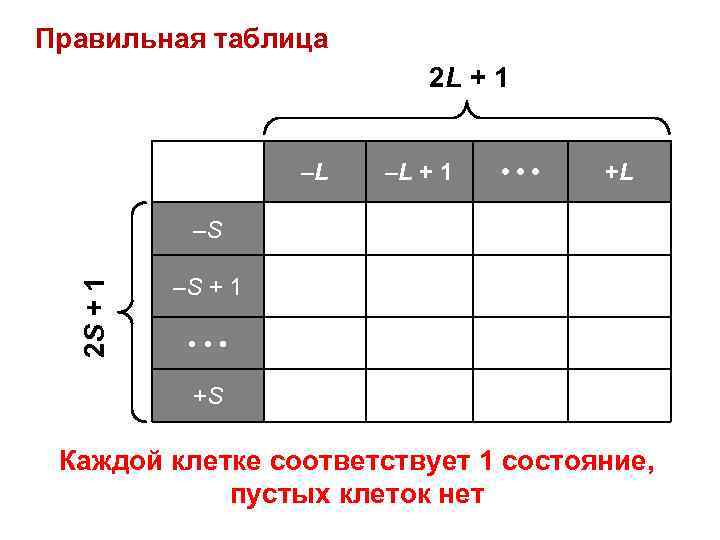
Правильная таблица 2 L + 1 –L –L + 1 • • • +L 2 S + 1 –S –S + 1 • • • +S Каждой клетке соответствует 1 состояние, пустых клеток нет
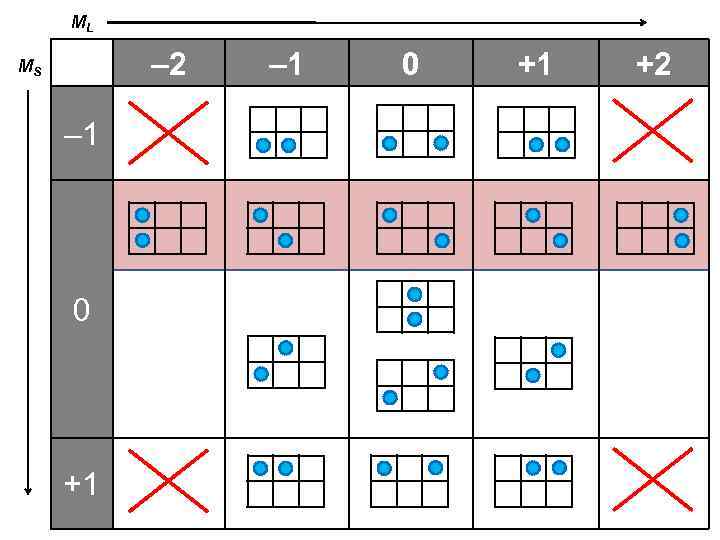
ML – 2 MS – 1 0 +1 +2
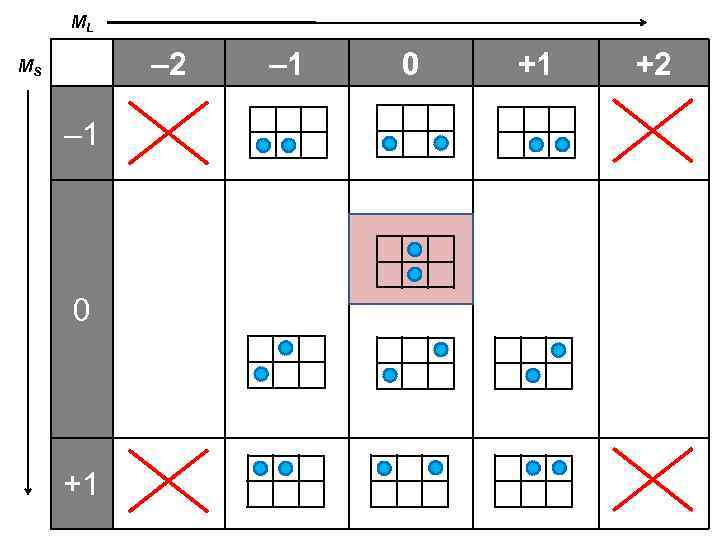
ML – 2 MS – 1 0 +1 +2
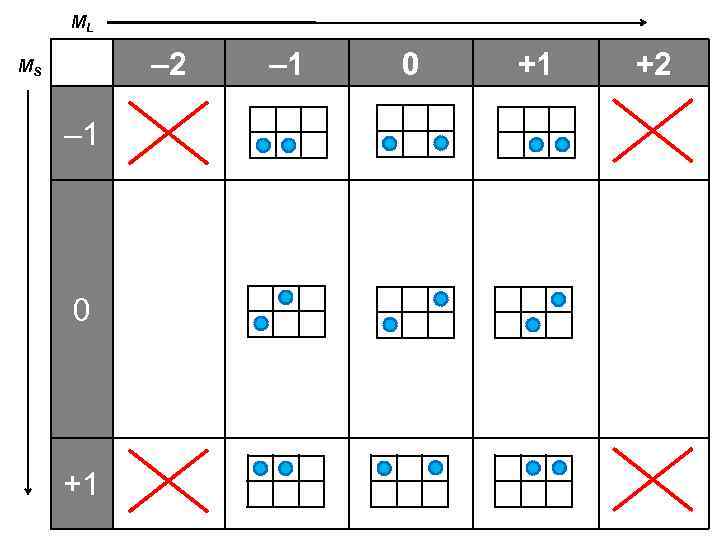
ML – 2 MS – 1 0 +1 +2
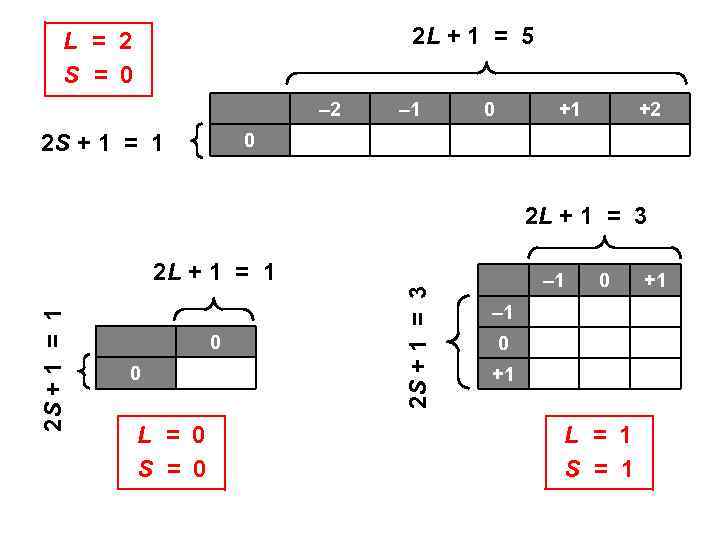
2 L + 1 = 5 L = 2 S = 0 – 2 2 S + 1 = 1 – 1 0 +1 +2 0 2 L + 1 = 3 0 0 L = 0 S = 0 2 S + 1 = 3 2 S + 1 = 1 2 L + 1 = 1 – 1 0 +1 L = 1 S = 1 +1
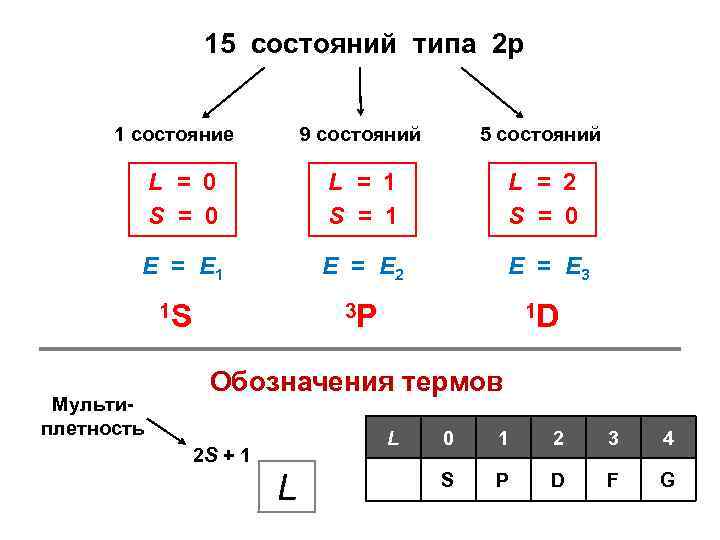
15 состояний типа 2 р 1 состояние 9 состояний 5 состояний L = 0 S = 0 L = 1 S = 1 L = 2 S = 0 Е = Е 1 Е = Е 2 Е = Е 3 1 S Мультиплетность 3 P 1 D Обозначения термов L 2 S + 1 L 0 1 2 3 4 S P D F G

Как располагаются термы на шкале энергии? 1 -е правило Хунда: минимальную энергию имеет терм с максимальной мультиплетностью (максимальным числом S) 2 -е правило Хунда: если мультиплетность нескольких термов одинакова, то минимальную энергию из них имеет терм с максимальным числом L 3 P 1 D 1 S E
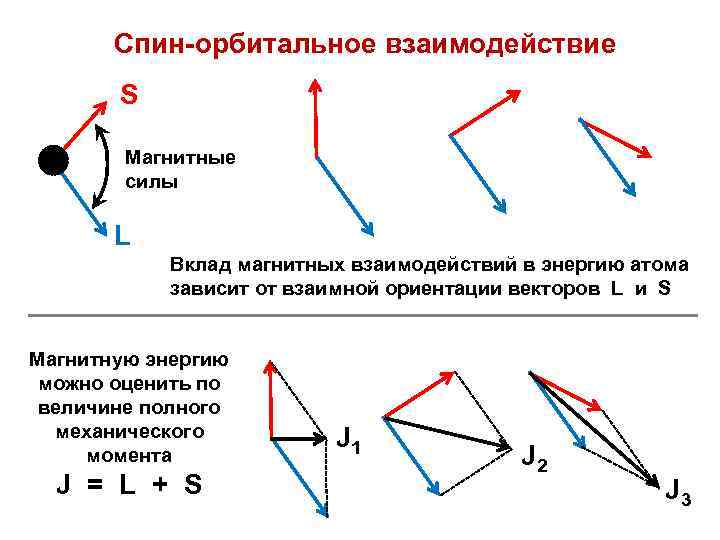
Спин-орбитальное взаимодействие S Магнитные силы L Вклад магнитных взаимодействий в энергию атома зависит от взаимной ориентации векторов L и S Магнитную энергию можно оценить по величине полного механического момента J = L + S J 1 J 2 J 3
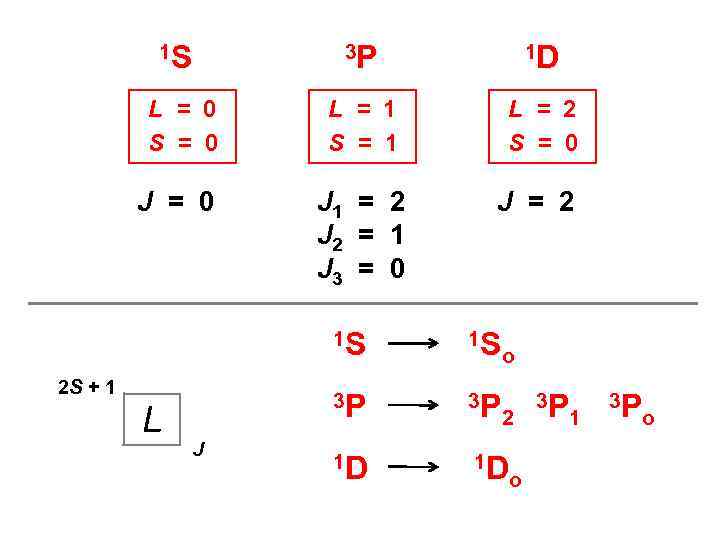
1 S 3 P 1 D L = 0 S = 0 L = 1 S = 1 L = 2 S = 0 J 1 = 2 J 2 = 1 J 3 = 0 J = 2 1 S 3 P 2 S + 1 L J 1 S 3 P 1 D 1 D o 2 o 3 P 1 3 P o

Как располагаются подтермы на шкале энергии? 3 -е правило Хунда: Вариант А: если подоболочка заполнена наполовину и менее ( 2 + 1 ), то минимальная энергия соответствует подтерму с минимальным квантовым числом J Вариант Б: если подоболочка заполнена более, чем наполовину ( 2 + 1 ), то минимальная энергия соответствует подтерму с максимальным квантовым числом J Для атома углерода реализуется вариант А ( = 2 3 = 2 + 1 )
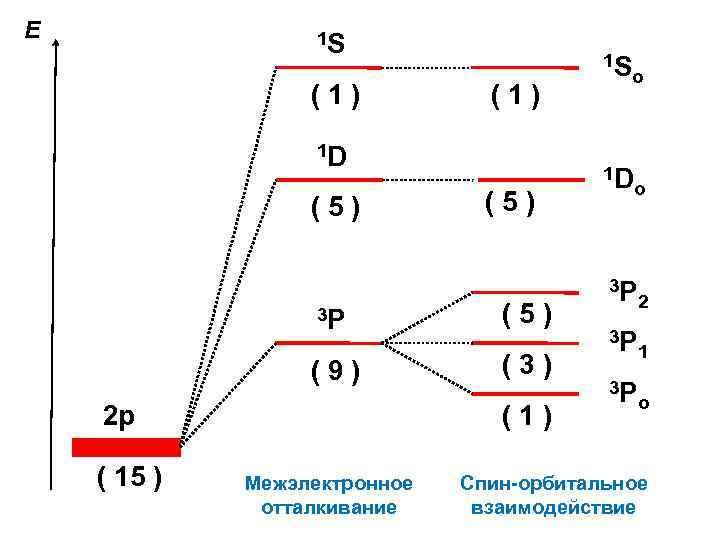
Е 1 S (1) 1 D (5) 3 Р (9) 2 р ( 15 ) (5) (3) (1) Межэлектронное отталкивание 1 S o 1 D o 3 Р 2 3 Р 1 3 Р o Спин-орбитальное взаимодействие
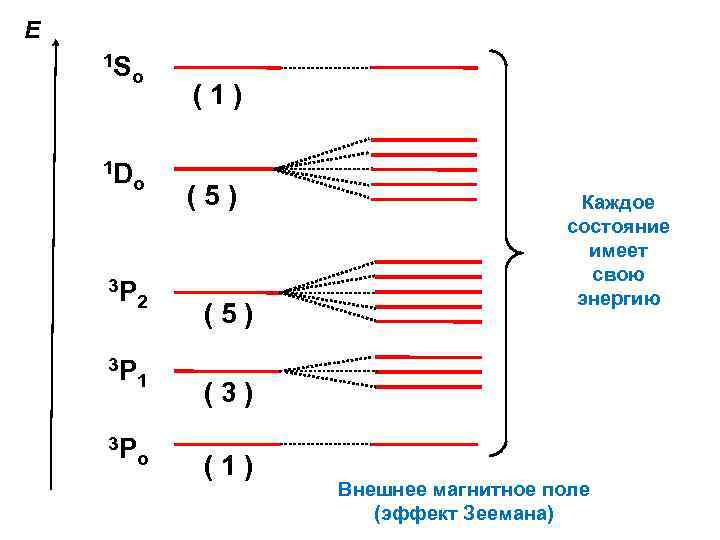
Е 1 S o 1 D o (1) (5) 3 Р 2 (5) 3 Р 1 (3) 3 Р o (1) Каждое состояние имеет свою энергию Внешнее магнитное поле (эффект Зеемана)
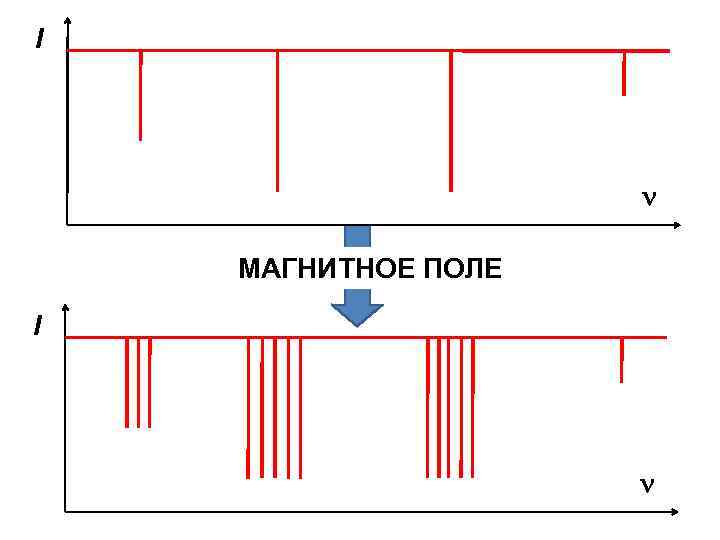
I МАГНИТНОЕ ПОЛЕ I

Домашнее задание Задача 7. 1. Для указанного атомного терма определить характер расщепления за счет спин-орбитального взаимодействия. Изобразить энергетическую диаграмму с учетом правил Хунда. Для каждого уровня указать степень вырождения и число стационарных состояний атома.
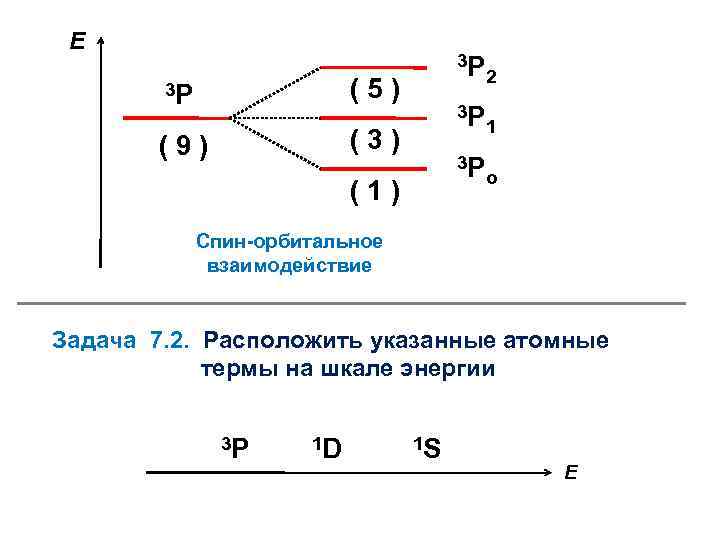
Е 3 Р (1) 1 3 Р (3) (9) 2 3 Р (5) 3 Р o Спин-орбитальное взаимодействие Задача 7. 2. Расположить указанные атомные термы на шкале энергии 3 P 1 D 1 S E
11 Атомные термы.pptx