Лекция 3 АМУ.ppt
- Количество слайдов: 36
 Атомно-молекулярное учение Лекция 3
Атомно-молекулярное учение Лекция 3
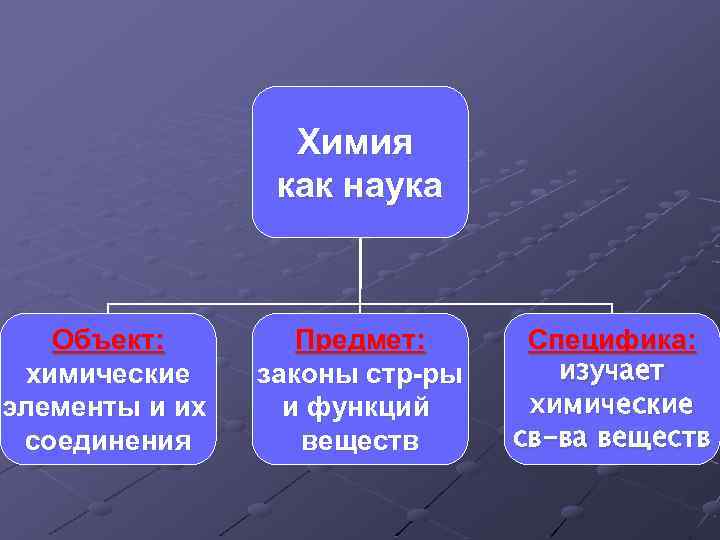 Химия как наука Объект: химические элементы и их соединения Предмет: законы стр-ры и функций веществ Специфика: изучает химические св-ва веществ
Химия как наука Объект: химические элементы и их соединения Предмет: законы стр-ры и функций веществ Специфика: изучает химические св-ва веществ
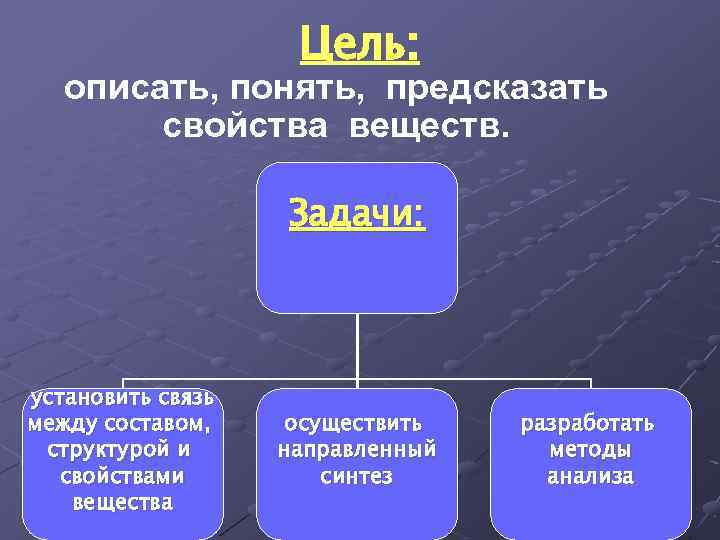 Цель: описать, понять, предсказать свойства веществ. Задачи: установить связь между составом, структурой и свойствами вещества осуществить направленный синтез разработать методы анализа
Цель: описать, понять, предсказать свойства веществ. Задачи: установить связь между составом, структурой и свойствами вещества осуществить направленный синтез разработать методы анализа
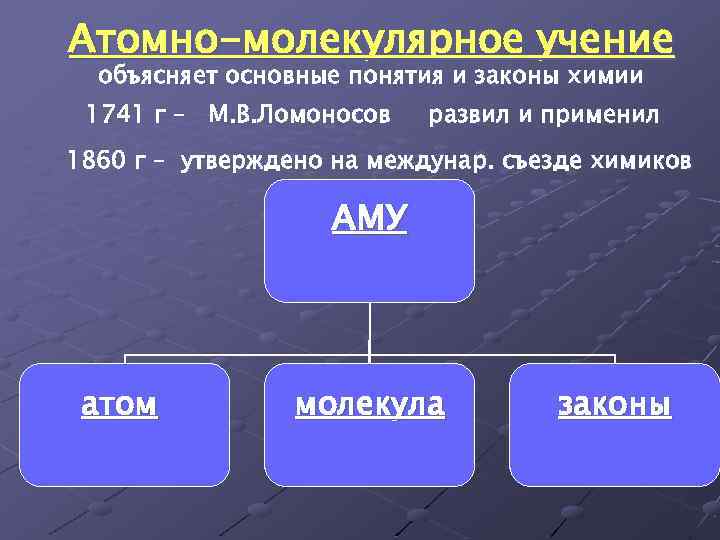 Атомно-молекулярное учение объясняет основные понятия и законы химии 1741 г – М. В. Ломоносов развил и применил 1860 г – утверждено на междунар. съезде химиков АМУ атом молекула законы
Атомно-молекулярное учение объясняет основные понятия и законы химии 1741 г – М. В. Ломоносов развил и применил 1860 г – утверждено на междунар. съезде химиков АМУ атом молекула законы
 Атом – химически неделимая электронейтральная микросистема элементарных взаимодействующих частиц, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в около ядерном пространстве. Система может быть устойчивой и неустойчивой (радиоактивной).
Атом – химически неделимая электронейтральная микросистема элементарных взаимодействующих частиц, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в около ядерном пространстве. Система может быть устойчивой и неустойчивой (радиоактивной).
 Характеристики элементарных частица 1897 г. Томсон ПРОТОН 1920 г. знак _ е + р масса, заряд, а. е. м. , ЭЛЕКТРОН открытие отн. ед. , показатели В ПС 0 -1 Z – порядковый номер 1 +1 номер Резерфорд НЕЙТРОН 1932 г. Чедвик Z – порядковый 0 n 1 0 n 0 = А – Z А – атомная масса
Характеристики элементарных частица 1897 г. Томсон ПРОТОН 1920 г. знак _ е + р масса, заряд, а. е. м. , ЭЛЕКТРОН открытие отн. ед. , показатели В ПС 0 -1 Z – порядковый номер 1 +1 номер Резерфорд НЕЙТРОН 1932 г. Чедвик Z – порядковый 0 n 1 0 n 0 = А – Z А – атомная масса
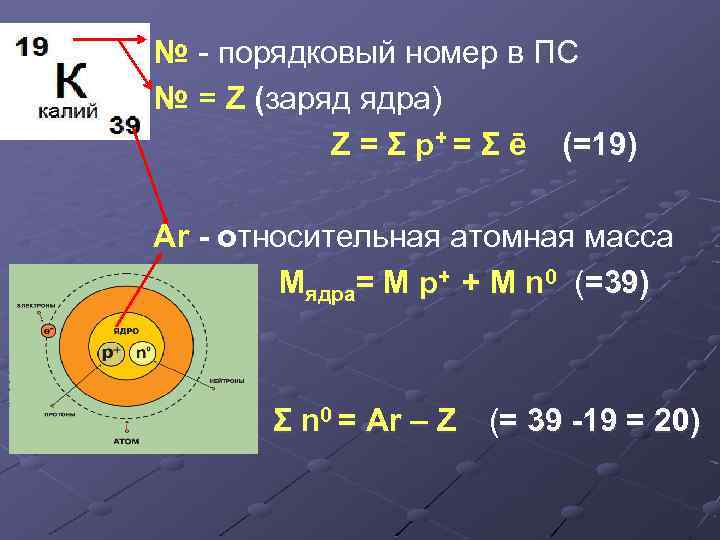 № - порядковый номер в ПС № = Z (заряд ядра) Z = Σ р+ = Σ ē (=19) Ar - относительная атомная масса Mядра= M р+ + M n 0 (=39) Σ n 0 = Ar – Z (= 39 -19 = 20)
№ - порядковый номер в ПС № = Z (заряд ядра) Z = Σ р+ = Σ ē (=19) Ar - относительная атомная масса Mядра= M р+ + M n 0 (=39) Σ n 0 = Ar – Z (= 39 -19 = 20)
 Химический элемент – вид атомов с одинаковым зарядом ядра. Изотопы – атомы одного химического элемента, ядра которых содержат разное число нейтронов.
Химический элемент – вид атомов с одинаковым зарядом ядра. Изотопы – атомы одного химического элемента, ядра которых содержат разное число нейтронов.
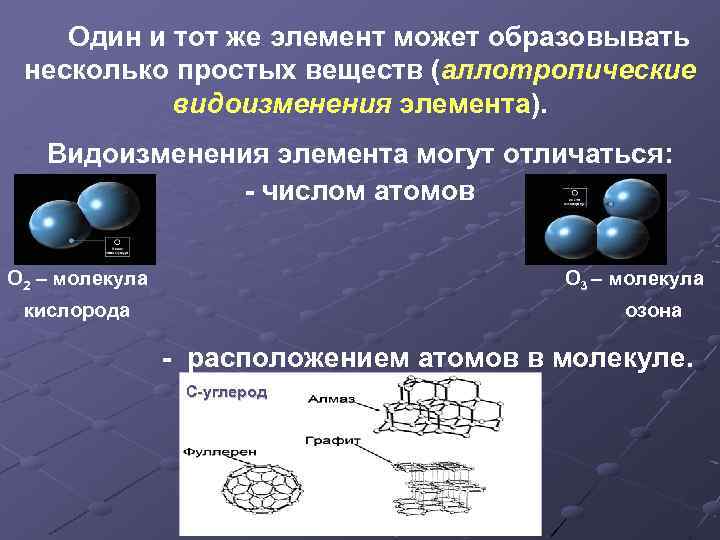 Один и тот же элемент может образовывать несколько простых веществ (аллотропические видоизменения элемента). Видоизменения элемента могут отличаться: - числом атомов O 2 – молекула О 3 – молекула кислорода озона - расположением атомов в молекуле. С-углерод
Один и тот же элемент может образовывать несколько простых веществ (аллотропические видоизменения элемента). Видоизменения элемента могут отличаться: - числом атомов O 2 – молекула О 3 – молекула кислорода озона - расположением атомов в молекуле. С-углерод
 Количественные характеристики атомов и молекул 1. Относительные атомные и молекулярные массы (Ar , Mr ). а)- абсолютные массы атомов очень малы mа (Н)=1, 67 ∙ 10 -27 кг, mа (С)=19, 93∙ 10 -27 кг б)- введена условная атомная единица массы 1 а. е. м. = в) А (элемента)= mа/ r 1 а. е. м - относитель. атомная масса Аr(Н) = 1, 67∙ 10 -27 1, 667∙ 10 -27 = 1, 008
Количественные характеристики атомов и молекул 1. Относительные атомные и молекулярные массы (Ar , Mr ). а)- абсолютные массы атомов очень малы mа (Н)=1, 67 ∙ 10 -27 кг, mа (С)=19, 93∙ 10 -27 кг б)- введена условная атомная единица массы 1 а. е. м. = в) А (элемента)= mа/ r 1 а. е. м - относитель. атомная масса Аr(Н) = 1, 67∙ 10 -27 1, 667∙ 10 -27 = 1, 008
 Мr = Σ А r
Мr = Σ А r
![2. Количество вещества моль [n] - это число структурных единиц (атомов, ионов, радикалов, молекул) 2. Количество вещества моль [n] - это число структурных единиц (атомов, ионов, радикалов, молекул)](https://present5.com/presentation/-29952931_12084594/image-12.jpg) 2. Количество вещества моль [n] - это число структурных единиц (атомов, ионов, радикалов, молекул) в системе. 1. Авогадро рассчитал, что в 12 г 12 С содержится 6, 02 · 10²³ атомов. Количество вещества, которое содержит столько же структурных единиц, сколько и 12 г изотопа 12 С, (1811 г. ) обозначается как 1 моль = 6, 02 ∙ 10 23 частиц ( NA – число Авогадро ) 2. Масса одного моля вещества, выраженная в граммах называется молярная масса вещества 1 моль =М (г/моль)
2. Количество вещества моль [n] - это число структурных единиц (атомов, ионов, радикалов, молекул) в системе. 1. Авогадро рассчитал, что в 12 г 12 С содержится 6, 02 · 10²³ атомов. Количество вещества, которое содержит столько же структурных единиц, сколько и 12 г изотопа 12 С, (1811 г. ) обозначается как 1 моль = 6, 02 ∙ 10 23 частиц ( NA – число Авогадро ) 2. Масса одного моля вещества, выраженная в граммах называется молярная масса вещества 1 моль =М (г/моль)
 3. При нормальных условиях (Т=00 C; Р=101325 Па) один моль любого газа занимает один и тот же молярный объем Vm = 22, 4 л/моль 1 моль = 22, 4 л 4. При иных условиях используется уравнение Клапейрона-Менделеева PV = n. RT P -давление газа, Па, V- объем газа, м 3 T- температура, К R – молярная газ. постоянная (8, 314 Па∙м 3/моль∙К) Таким образом, моль вещества можно найти разными способами: n= m/ M = N/NA = V/Vm= PV/RT
3. При нормальных условиях (Т=00 C; Р=101325 Па) один моль любого газа занимает один и тот же молярный объем Vm = 22, 4 л/моль 1 моль = 22, 4 л 4. При иных условиях используется уравнение Клапейрона-Менделеева PV = n. RT P -давление газа, Па, V- объем газа, м 3 T- температура, К R – молярная газ. постоянная (8, 314 Па∙м 3/моль∙К) Таким образом, моль вещества можно найти разными способами: n= m/ M = N/NA = V/Vm= PV/RT

 Объединённый газовый закон Бойля – Мариотта и Гей-Люссака р. V p 0 V 0 = T T 0 где р0 = 101, 3 к. Па, V 0 - объём газа при н. у. T 0 = 273 К (00 С)
Объединённый газовый закон Бойля – Мариотта и Гей-Люссака р. V p 0 V 0 = T T 0 где р0 = 101, 3 к. Па, V 0 - объём газа при н. у. T 0 = 273 К (00 С)
 Задачи 1. Определить количество вещества (моль), содержащегося в 34 граммах, 44, 8 л и 12, 04∙ 1023 молекулах аммиака (NH 3 – газ) при н. у. 2. Вычислить массу 2 л водорода при н. у. 3. Вычислить массу 2 л водорода при Т=150 С и Р=100, 7 к. Па.
Задачи 1. Определить количество вещества (моль), содержащегося в 34 граммах, 44, 8 л и 12, 04∙ 1023 молекулах аммиака (NH 3 – газ) при н. у. 2. Вычислить массу 2 л водорода при н. у. 3. Вычислить массу 2 л водорода при Т=150 С и Р=100, 7 к. Па.
 Задача. Масса ортофосфорной кислоты равна 49 г. Определить: – количество кислоты (моль) – массу атомов водорода в ней (г)
Задача. Масса ортофосфорной кислоты равна 49 г. Определить: – количество кислоты (моль) – массу атомов водорода в ней (г)
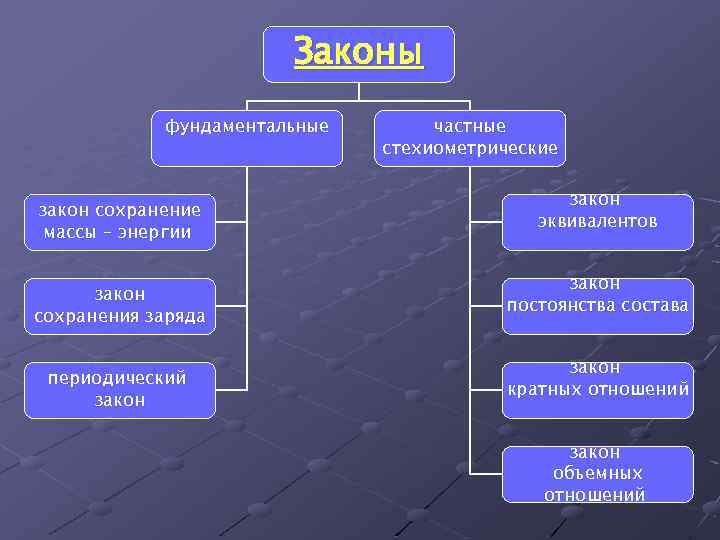 Законы фундаментальные закон сохранение массы – энергии закон сохранения заряда периодический закон частные стехиометрические закон эквивалентов закон постоянства состава закон кратных отношений закон объемных отношений
Законы фундаментальные закон сохранение массы – энергии закон сохранения заряда периодический закон частные стехиометрические закон эквивалентов закон постоянства состава закон кратных отношений закон объемных отношений
 Фундаментальный закон сохранения массы М. В. Ломоносов (1748 г. ) - масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции. 2 Н 2 + O 2 = 2 Н 2 O (материальный баланс по атомам элементов, стехиометрические коэффициенты) Атомы элементов при химических реакциях сохраняются, не возникают из ничего, так же как и не исчезают в никуда.
Фундаментальный закон сохранения массы М. В. Ломоносов (1748 г. ) - масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции. 2 Н 2 + O 2 = 2 Н 2 O (материальный баланс по атомам элементов, стехиометрические коэффициенты) Атомы элементов при химических реакциях сохраняются, не возникают из ничего, так же как и не исчезают в никуда.
 Фундаментальный закон сохранения энергии 1841, Г. И. Гесс Энергия изолированной системы есть величина постоянная, возможнен лишь переход одного вида энергии в другой Н 2 + ½ О 2 = Н 2 О + 241 к. Дж энергетический баланс (термохимическое уравнение реакции).
Фундаментальный закон сохранения энергии 1841, Г. И. Гесс Энергия изолированной системы есть величина постоянная, возможнен лишь переход одного вида энергии в другой Н 2 + ½ О 2 = Н 2 О + 241 к. Дж энергетический баланс (термохимическое уравнение реакции).
 Фундаментальный закон сохранения заряда Сумма зарядов реагентов равна сумме зарядов продуктов электронный баланс (окислительно – восстановительные реакции).
Фундаментальный закон сохранения заряда Сумма зарядов реагентов равна сумме зарядов продуктов электронный баланс (окислительно – восстановительные реакции).
 Фундаментальный периодический закон 1869 г Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядер их атомов.
Фундаментальный периодический закон 1869 г Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядер их атомов.
 Стехиометрические законы 1803 г. Атомы элементов соединяются в химические соединения только в определенных массовых отношениях (как простые целые числа), которые задаются их валентностью. Валентность- число связей, которое может образовать атом данного элемента с атомами других элементов: -принято, что валентность H (I), О(II) - максим. валентность элементов = № группы -миним. валентность элементов = 8 - № группы
Стехиометрические законы 1803 г. Атомы элементов соединяются в химические соединения только в определенных массовых отношениях (как простые целые числа), которые задаются их валентностью. Валентность- число связей, которое может образовать атом данного элемента с атомами других элементов: -принято, что валентность H (I), О(II) - максим. валентность элементов = № группы -миним. валентность элементов = 8 - № группы
 Закон постоянства состава Пруст (1806 г) - всякое чистое вещество имеет постоянный и неизменный качественный и количественный состав, независимо от способа получения и места нахождения: Cu(OH)2 = H 2 O + Cu. O 2 Н 2 + O 2 = 2 Н 2 O Са(ОН) 2 + H 2 SO 4 = 2 Н 2 O + Ca. SO 4 Молекула воды всегда состоит из двух атомов водорода и одного атома кислорода.
Закон постоянства состава Пруст (1806 г) - всякое чистое вещество имеет постоянный и неизменный качественный и количественный состав, независимо от способа получения и места нахождения: Cu(OH)2 = H 2 O + Cu. O 2 Н 2 + O 2 = 2 Н 2 O Са(ОН) 2 + H 2 SO 4 = 2 Н 2 O + Ca. SO 4 Молекула воды всегда состоит из двух атомов водорода и одного атома кислорода.
 3. Закон объемных отношений для газов (Гей-Люссак, 1808 г. ) - объемы газов, нацело реагирующих друг с другом, относятся между собой и к объемам образующихся газов, как небольшие целые числа 2 Н 2 + О 2 = 2 Н 2 О Объясняется законом Авогадро : в равных объемах различных газов при одинаковых условиях (Т и Р) содержится одно и то же число молекул.
3. Закон объемных отношений для газов (Гей-Люссак, 1808 г. ) - объемы газов, нацело реагирующих друг с другом, относятся между собой и к объемам образующихся газов, как небольшие целые числа 2 Н 2 + О 2 = 2 Н 2 О Объясняется законом Авогадро : в равных объемах различных газов при одинаковых условиях (Т и Р) содержится одно и то же число молекул.
 Из законов Гей-Люссака и Авогадро следует: масса одного газа во столько раз больше другого, во сколько раз больше его молярная масса ρг/л – плотность в-ва в газообразном состоянии Мв-ва=Мгаза∙Dпо газу Мв-ва=ρ ∙Vm
Из законов Гей-Люссака и Авогадро следует: масса одного газа во столько раз больше другого, во сколько раз больше его молярная масса ρг/л – плотность в-ва в газообразном состоянии Мв-ва=Мгаза∙Dпо газу Мв-ва=ρ ∙Vm
 4. Закон эквивалентов Рихтер, Волластон 1804 А +В = С + D m. A : m. B = Mэк. А : Mэк. В Эквивалентная масса (молярная масса эквивалента) – это масса 1 моль эквивалентов (г/моль-экв) М эк. = М·f
4. Закон эквивалентов Рихтер, Волластон 1804 А +В = С + D m. A : m. B = Mэк. А : Mэк. В Эквивалентная масса (молярная масса эквивалента) – это масса 1 моль эквивалентов (г/моль-экв) М эк. = М·f
 Эквивалент – это реальная или условная частица (часть частицы), которая взаимодействует с 1 атомом водорода или 1 электроном. Фактор эквивалентности (f) - доля частицы, составляющая эквивалент f = 1/ ω·n. ω – степень окисления частицы n – число таких частиц М эк. = М·f
Эквивалент – это реальная или условная частица (часть частицы), которая взаимодействует с 1 атомом водорода или 1 электроном. Фактор эквивалентности (f) - доля частицы, составляющая эквивалент f = 1/ ω·n. ω – степень окисления частицы n – число таких частиц М эк. = М·f
 Расчет эквивалентных масс элемента Задача. Определить, в каком из веществ фактор эквивалентности элемента марганца (Mn) равен 1/4 KMn. O 4 K 2 Mn. O 4 Mn. O 2 Mn. SO 4
Расчет эквивалентных масс элемента Задача. Определить, в каком из веществ фактор эквивалентности элемента марганца (Mn) равен 1/4 KMn. O 4 K 2 Mn. O 4 Mn. O 2 Mn. SO 4
 Расчет эквивалентных масс вещества Задача. Рассчитать молярные эквивалентные массы для веществ H 2 O 2 NH 3 CH 4
Расчет эквивалентных масс вещества Задача. Рассчитать молярные эквивалентные массы для веществ H 2 O 2 NH 3 CH 4
 Расчет эквивалентных масс кислоты в ионообменной реакции
Расчет эквивалентных масс кислоты в ионообменной реакции
 Расчет эквивалентных масс гидроксида в ионообменной реакции
Расчет эквивалентных масс гидроксида в ионообменной реакции
 Расчет эквивалентных масс вещества в окислительновосстановительных реакциях Определить эквивалентную массу перманганата калия в следующих реакциях: KMn. O 4 Mn. SO 4 Mn+7 + 5 e = Mn+2 Мэк (KMn. O 4) = 158/5 = 31, 6 г/моль-экв KMn. O 4 K 2 Mn. O 4 Mn+7 + 1 e = Mn+6 Мэк (KMn. O 4) = 158/1 = 158 г/моль-экв
Расчет эквивалентных масс вещества в окислительновосстановительных реакциях Определить эквивалентную массу перманганата калия в следующих реакциях: KMn. O 4 Mn. SO 4 Mn+7 + 5 e = Mn+2 Мэк (KMn. O 4) = 158/5 = 31, 6 г/моль-экв KMn. O 4 K 2 Mn. O 4 Mn+7 + 1 e = Mn+6 Мэк (KMn. O 4) = 158/1 = 158 г/моль-экв
 Задача. Определить металл, если он 2 -х валентен и в его оксиде содержится 22, 2 % кислорода.
Задача. Определить металл, если он 2 -х валентен и в его оксиде содержится 22, 2 % кислорода.
 Задача. При взаимодействии 7, 8 г одновалентного металла с водой выделилось 2, 24 л (н. у. ) водорода. Определить: – массу (г) прореагировавшей воды – молярную массу (г/моль) образовавшейся щелочи
Задача. При взаимодействии 7, 8 г одновалентного металла с водой выделилось 2, 24 л (н. у. ) водорода. Определить: – массу (г) прореагировавшей воды – молярную массу (г/моль) образовавшейся щелочи
 ТЕСТ 1. Определить молярную массу газа, если 1 л его при давлении 1, 2∙ 105 па и температуре 270 С имеет массу 0, 96 г.
ТЕСТ 1. Определить молярную массу газа, если 1 л его при давлении 1, 2∙ 105 па и температуре 270 С имеет массу 0, 96 г.


