Атомная физика.ppt
- Количество слайдов: 69

Атомная физика для фотона 1. Де Бройль обобщил соотношение связанные с частицами, импульс которых равен р. Тогда, если скорость частиц одинакова, то наименьшей длиной волны обладают … 1) нейтроны 2) электроны 3) протоны 4) - частицы

для фотона 2. Де Бройль обобщил соотношение связанные с частицами, импульс которых равен р. Тогда, если скорость частиц одинакова, то наибольшей длиной волны обладают … 1) нейтроны 2) позитроны 3) протоны 4) - частицы

для фотона 3. Де Бройль обобщил соотношение на любые волновые процессы, связанные с частицами, импульс которых равен р. Тогда, если длины волн частиц одинаковы, то наименьшей скоростью обладают … 1) нейтроны 2) электроны 3) протоны 4) - частицы

для фотона 4. Де Бройль обобщил соотношение на любые волновые процессы, связанные с частицами, импульс которых равен р. Тогда, если длины волн частиц одинаковы, то наибольшей скоростью обладают … 1) нейтроны 2) электроны 3) протоны 4) - частицы

5. Длина волны де Бройля классической частицы увеличилась вдвое. Кинетическая энергия этой частицы. . . 1) уменьшилась в 4 раза 2) увеличилась вдвое 3) увеличилась в 4 раза 4) не изменилась 5) уменьшилась вдвое

6. Длина волны де Бройля частицы уменьшилась вдвое. Скорость этой частицы. . . 1) увеличилась в 4 раза 2) не изменилась 3) уменьшилась вдвое 4) увеличилась вдвое 5) уменьшилась в 4 раза

7. Если протон и нейтрон двигаются с одинаковыми скоростями, то отношения их длин волн де Бройля равно … 1) 1 2) 2 3) 4 4) 1/2

8. Если частицы имеют одинаковую скорость, то наименьшей длиной волны де Бройля обладает. . . 1) электрон 2) - частицы 3) нейтрон 4) протон

9. Если частицы имеют одинаковую длину волны де Бройля, то наибольшей скоростью обладает. . . 1) нейтрон 2) протон 3) позитрон 4) - частицы

10. Кинетическая энергия классической частицы увеличилась в 2 раза. Длина волны де Бройля этой частицы. . . 1) увеличилась в раз 2) увеличилась в 2 раза 3) уменьшилась в раз 4) уменьшилась в два раза 5) не изменилась

11. Групповая скорость волны де Бройля. . . 1) зависит от квадрата длины волны 2) больше скорости света в вакууме 3) равна скорости света в вакууме 4) равна скорости частицы 5) не имеет смысла как физическая величина

12. Положение атома углерода в кристаллической решетке алмаза определено с погрешностью , а Учитывая, что постоянная Планка масса атома углерода , неопределенность скорости , его теплового движения (в м/с) составляет не менее … 1) 106 2) 0, 943 3) 1, 06 -3 4) 9, 43· 10

13. Электрон локализован в пространстве в пределах Учитывая, что постоянная Планка , а масса электрона неопределенность скорости (в м/с) составляет не менее … 1) 115 2) 8, 7 3) 0, 115 -3 4) 87· 10

14. Протон локализован в пространстве в пределах Учитывая, что постоянная Планка , а масса протона неопределенность скорости (в м/с) составляет не менее … -5 1) 6, 29· 10 -2 2) 1, 59· 10 -5 3) 1, 59· 10 -2 4) 6, 29· 10

15. Положение пылинки массой m=1 мкг определено с Учитывая, что неопределенностью постоянная Планка неопределенность скорости (в м/с) составляет не менее … -27 1) 1, 05· 10 -21 2) 1, 05· 10 3) 1, 05· 10 -18 4) 1, 05· 10 -24

16. Время жизни атома в возбужденном состоянии = 10 нс. Учитывая, что постоянная Планка ħ = -16 6, 6· 10 э. В·с, ширина энергетического уровня (в э. В) составляет не менее. . . 1) 6, 6· 10 -10 2) 1, 5· 10 -10 -8 3) 6, 6· 10 -8 4) 1, 5· 10

17. Высокая монохроматичность лазерного излучения обусловлена относительно большим временем жизни электронов в метастабильном состоянии Учитывая, что постоянная Планка ħ = 6, 6· 10 -16 э. В с, ширина метастабильного уровня (в э. В) не менее … -13 1) 6, 6· 10 2) 1, 5· 10 -13 3) 6, 6· 10 -19 4) 1, 5· 10 -19

18. Стационарным уравнением Шредингера для частицы в одномерном ящике с бесконечно высокими стенками является уравнение … 1) 2) 3) 4)

19. Стационарным уравнением Шредингера для частицы в трехмерном ящике с бесконечно высокими стенками является уравнение … 1) 2) 3) 4)

20. Стационарным уравнением Шредингера для электрона в водородоподобном ионе является уравнение… 1) 2) 3) 4)

21. Нестационарным является уравнение … 1) 2) 3) 4) уравнением Шредингера

22. Установите соответствие уравнений Шредингера их физическому смыслу: 1) 1 -А, 2 -Е, 3 -Г, 4 -В 2) 1 -Г, 2 -В, 3 -А, 4 -Б 3) 1 -Г, 2 -Б, 3 -А, 4 -В 4) 1 -В, 2 -Е, 3 -А, 4 -Д

23. Частица массой m с энергией подлетает к потенциальному барьеру Для области I уравнение высотой Шредингера имеет вид … 1) 2) 3) 4)

24. Частица массой m с энергией подлетает к потенциальному барьеру Для области II уравнение высотой Шредингера имеет вид … 1) 2) 3) 4)

25. С помощью волновой функции Ψ, входящей в уравнение Шрёдингера, можно определить. . . 1) с какой вероятностью частица может быть обнаружена в различных точках пространства 2) импульс частицы в любой точке пространства 3) траекторию, по которой движется частица в пространстве

26. Квадрат модуля волновой функции Ψ, входящей в уравнение Шредингера, равен. . . 1) импульсу частицы в соответствующем месте пространства 2) плотности вероятности обнаружения частицы в соответствующем месте пространства 3) энергии частицы в соответствующем месте пространства

27. Вероятность d. P(x) обнаружения электрона вблизи точки с координатой х на участке dx, равна. . . 1) 2) 3) 4)

28. Задана пси-функция Ψ(x, y, z) частицы. Вероятность того, что частица будет обнаружена в объёме V определяется выражением. . . 1) 2) 3) 4)

29. Волновая функция частицы в потенциальной яме с бесконечно высокими стенками шириной L имеет Величина импульса этой частицы вид: в основном состоянии равна. . . 1) 2) 3) 4)

30. Вероятность обнаружить электрон на участке (a, b) одномерного потенциального ящика с бесконечно высокими стенками вычисляется по , где – плотность вероятности, формуле определяемая – функцией. Если – функция имеет вид, указанный на рисунке, то вероятность обнаружить электрон на участке 1) 2/3 2) 1/3 3) 5/6 4) 1/2 равна …

31. Вероятность обнаружить электрон на участке (a, b) одномерного потенциального ящика с бесконечно высокими стенками вычисляется по , где – плотность вероятности, формуле определяемая – функцией. Если – функция имеет вид, указанный на рисунке, то вероятность обнаружить электрон на участке 1) 2) 3) 4) 1/3 1/2 5/6 2/3 равна …

32. Вероятность обнаружить электрон на участке (a, b) одномерного потенциального ящика с бесконечно высокими стенками вычисляется по , где – плотность вероятности, формуле определяемая – функцией. Если – функция имеет вид, указанный на рисунке, то вероятность обнаружить электрон на участке 1) 2) 3) 4) 1/3 1/2 5/6 2/3 равна …

33. Вероятность обнаружить электрон на участке (a, b) одномерного потенциального ящика с бесконечно высокими стенками вычисляется по , где – плотность вероятности, формуле определяемая Ψ – функцией. Если – функция имеет вид, указанный на рисунке, то вероятность обнаружить электрон на участке 1) 2) 3) 4) 5/8 1/4 1/2 3/8 равна … 0 L

34. Вероятность обнаружить электрон на участке (a, b) одномерного потенциального ящика с бесконечно высокими стенками вычисляется по , где – плотность вероятности, формуле определяемая Ψ – функцией. Если – функция имеет вид, указанный на рисунке, то вероятность обнаружить электрон на участке 1) 5/8 2) 1/4 3) 1/2 4) 3/8 равна … 0 L

35. На рисунке изображена плотность вероятности обнаружения микрочастицы на различных расстояниях от «стенок» ямы. Вероятность ее обнаружения на участке l/4 < х < l/2 равна. . . 1) 0 2) 1/2 3) 1/4 4) 3/4
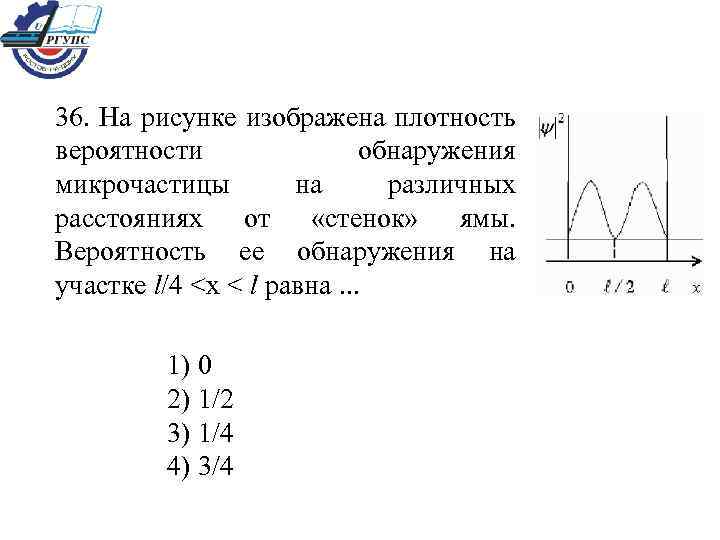
36. На рисунке изображена плотность вероятности обнаружения микрочастицы на различных расстояниях от «стенок» ямы. Вероятность ее обнаружения на участке l/4 <х < l равна. . . 1) 0 2) 1/2 3) 1/4 4) 3/4
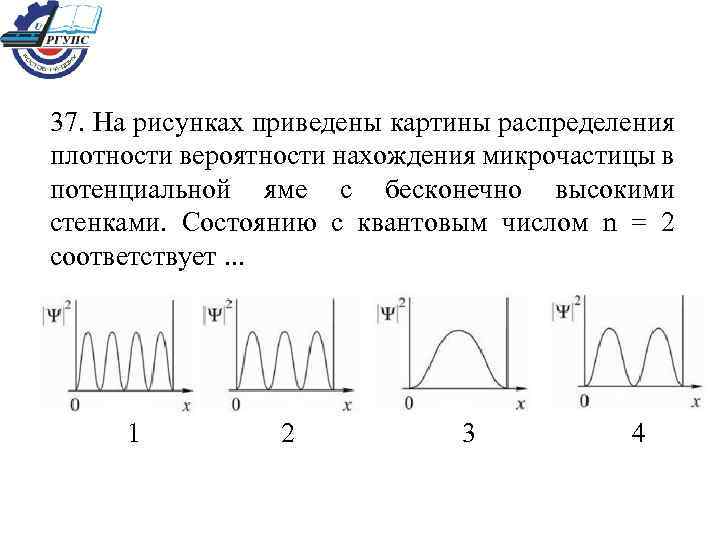
37. На рисунках приведены картины распределения плотности вероятности нахождения микрочастицы в потенциальной яме с бесконечно высокими стенками. Состоянию с квантовым числом n = 2 соответствует. . . 1 2 3 4
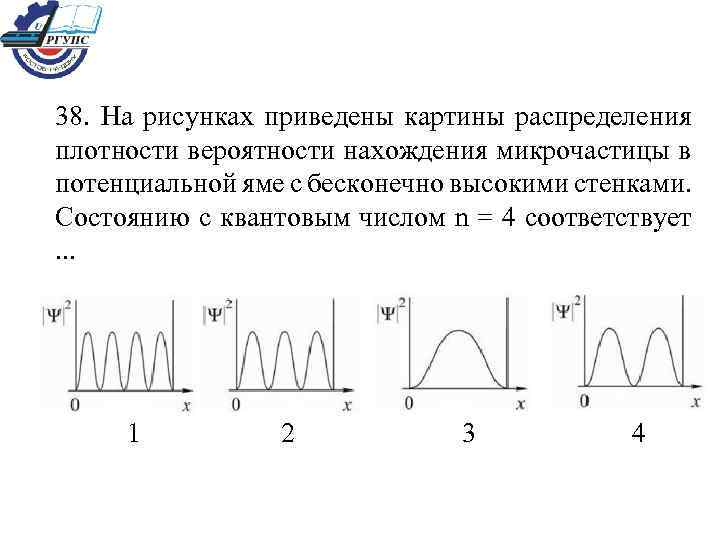
38. На рисунках приведены картины распределения плотности вероятности нахождения микрочастицы в потенциальной яме с бесконечно высокими стенками. Состоянию с квантовым числом n = 4 соответствует . . . 1 2 3 4

39. Электрон находится в одномерном потенциальном ящике шириной а с бесконечно высокими стенками. Плотность вероятности нахождения электрона на первом и втором энергетических уровнях одинакова в точках с координатами. . . 1) 2) 3) 4)

40. Установить соответствие квантовых чисел, определяющих волновую функцию электрона в атоме водорода, их физическому смыслу: 1) 1 -А, 2 -Б, 3 -В 2) 1 -В, 2 -Б, 3 -А 3) 1 -Г, 2 -Б, 3 -А 4) 1 -В, 2 -А, 3 -Г

41. Главное квантовое число n определяет. . . 1) орбитальный механический момент электрона в атоме собственный механический момент электрона в атоме 2) проекцию орбитального момента импульса электрона на заданное направление 3) энергию стационарного состояния электрона в атоме

42. Магнитное квантовое число m определяет … 1) орбитальный механический момент электрона в атоме 2) проекцию орбитального момента импульса электрона на заданное направление 3) энергию стационарного состояния электрона в атоме 4) собственный механический момент электрона в атоме

43. Спиновое квинтовое число S определяет… 1) энергию стационарного состояния электрона в атоме 2) собственный механический момент электрона в атоме 3) проекцию орбитального момента импульса электрона на заданное направление 4) орбитальный механический момент электрона в атоме

44. Азимутальное квантовое число l определяет. . . 1) энергию стационарного состояния электрона в атоме 2) проекцию орбитального момента импульса электрона на заданное направление 3) собственный механический момент электрона в атоме 4) орбитальный механический момент электрона в атоме

45. Схема энергетических уровней атома водорода показана на рисунке. . . 1 2 3

46. В атоме К и L оболочки заполнены полностью. Общее число электронов в атоме равно. . . 1) 10 2) 28 3) 8 4) 18 5) 6

47. Возбужденный атом водорода, электрон которого находится на уровне с n = 3, может испустить количество различных по энергии фотонов, равное … 1) 9 2) 3 3) 4 4) 6

48. Электрон находится на четвёртой стационарной орбите атома водорода. В соответствии с постулатами Бора атом может испускать … квантов с различной энергией. 1) 2 2) 3 3) 4 4) 5 5) 6
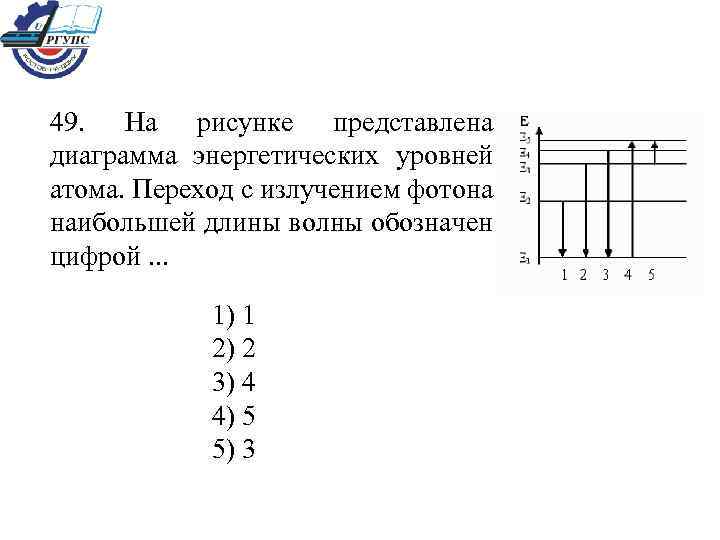
49. На рисунке представлена диаграмма энергетических уровней атома. Переход с излучением фотона наибольшей длины волны обозначен цифрой. . . 1) 1 2) 2 3) 4 4) 5 5) 3

50. На рисунке представлена диаграмма энергетических уровней атома. Переход с излучением фотона наибольшей частоты обозначен цифрой. . . 1) 1 2) 2 3) 4 4) 5 5) 3

51. На рисунке представлена диаграмма энергетических уровней атома водорода. Поглощение фотона с наибольшей длиной волны происходит при переходе, обозначенном стрелкой под номером. . . 1) 1 2) 2 3) 3 4) 4 5) 5

52. Из перечисленных ниже случаев наименьшая длина волны в спектре излучения атома водорода соответствует переходу между уровнями с номерами. . . 1) n = 4 и m = 3 2) n = 3 и m = 2 3) n = 2 и m = 1 4) n = 6 и m = 2

53. Электрон в атоме водорода перешел из основного состояния в возбужденное с n = 3. Радиус его боровской орбиты. . . 1) не изменился 2) уменьшился в 3 раз 3) увеличился в 9 раз 4) увеличился в 2 раза 5) увеличился в 3 раза

54. Видимой части спектра излучения атома водорода соответствует формула. . . 1) 2) 3) 4)

55. На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. Наибольшей частоте кванта света в серии Лаймана соответствует переход … 1) n = 5 → n = 1 2) n = 5 → n = 3 3) n = 2 → n = 1 4) n = 3 → n = 2

56. На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. Наименьшей частоте кванта в серии Бальмера соответствует переход. . . 1) n = 5 n = 2 2) n = 3 n = 2 3) n = 5 n = 1 4) n = 4 n = 3

57. На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. Наибольшей частоте кванта в серии Бальмера соответствует переход. . . 1) n = 5 n = 2 2) n = 3 n = 2 3) n = 5 n = 1 4) n = 4 n = 3

58. На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую, сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. Наименьшей частоте кванта в серии Пашена соответствует переход. . . 1) n = 5 n = 3 2) n = 3 n = 2 3) n = 5 n = 2 4) n = 4 n = 3

59. На рисунке приведена одна из возможных ориентаций момента импульса электронов в p-состоянии. Какие ещё значения может принимать проекция момента импульса на направление Z внешнего магнитного поля? 1) –h 2) h 3) -2 h 4) 2 h

60. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). Если система энергетических уровней атома водорода имеет вид, представленный на рисунке, то запрещенными переходами являются: 1) 3 s – 2 p 2) 3 s – 2 s 3) 4 s – 3 p 4) 4 f – 2 p s 4 3 2 1 p d f

61. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). Если система энергетических уровней атома водорода имеет вид, представленный на рисунке, то запрещенными переходами являются: 1) 4 f – 3 p 2) 3 p – 2 s 3) 4 s – 3 p 4) 3 s – 2 s s 4 3 2 1 p d f

62. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). Если система энергетических уровней атома водорода имеет вид, представленный на рисунке, то запрещенными переходами являются: 1) 2 p – 1 s 2) 3 d – 2 p 3) 4 f – 2 p 4) 2 s – 1 s s 4 3 2 1 p d f

63. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). Если система энергетических уровней атома водорода имеет вид, представленный на рисунке, то запрещенными переходами являются: 1) 4 s - 3 p 2) 2 p - 1 s 3) 2 s - 1 s 4) 4 s - 3 d s 4 3 2 1 p d f

64. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). В энергетическом спектре атома водорода (рис. ) запрещенным переходом является … 1) 4 p – 3 d 2) 2 p - 1 s 3) 3 s – 2 p 4) 4 f – 2 p

65. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). В энергетическом спектре атома водорода (рис. ) запрещенным переходом является … 1) 4 f – 3 d 2) 2 p - 1 s 3) 2 s - 1 s 4) 3 d – 2 s

66. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). В энергетическом спектре атома водорода (рис. ) запрещенным переходом является … 1) 4 s – 3 p 2) 3 d – 2 p 3) 2 p – 1 s 4) 4 d – 2 s

67. В атоме водорода электрон переходит с одного энергетического уровня на другой, как показано на рисунке. В соответствии с правилом отбора разрешенным является переход … 1) 4 s – 3 d 2) 4 s – 2 p 3) 2 s – 1 s 4) 3 d – 2 s

68. Серия Пашена в спектре излучения атомарного водорода характеризует переходы электрона на третий энергетический уровень. Согласно правилам отбора в ней запрещены переходы между электронными состояниями. . . 1) 5 d → 3 p 2) 5 s → 3 d 3) 4 d → 3 p 4) 4 р → 3 s

69. Серия Бальмера в спектре излучения атомарного водорода характеризует переходы электрона на второй энергетический уровень. Согласно правилам отбора в ней возможны переходы между электронными состояниями. . . 1) 4 p → 2 s 2) 3 p → 2 p 3) 4 s → 2 s 4) 3 d → 2 s
Атомная физика.ppt