История открытия строение атома .ppt
- Количество слайдов: 17

 Атомизм В древнегреческой философии, а позднее и в средние века, люди предполагали, что вещи вокруг них состоят из двух частей: неделимые атомы, каким-то образом сцепленные друг с другом, и из пустоты между атомами. Атомы считались вечными и неразрушимыми корпускулами. Эта позиция была отражена в трудах таких философов, как Демокрит или Левкипп, но никаких доказательств этой теории в то время не было.
Атомизм В древнегреческой философии, а позднее и в средние века, люди предполагали, что вещи вокруг них состоят из двух частей: неделимые атомы, каким-то образом сцепленные друг с другом, и из пустоты между атомами. Атомы считались вечными и неразрушимыми корпускулами. Эта позиция была отражена в трудах таких философов, как Демокрит или Левкипп, но никаких доказательств этой теории в то время не было.
 Демокрит В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Неделимость атома аналогична неделимости «бытия» .
Демокрит В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие космоса. Атом есть мельчайшее «неделимое» тело, не подверженное никаким изменениям. Неделимость атома аналогична неделимости «бытия» .
 Модель Томсона В 1904 году Томсон представил свою новую модель атома. Она представляла собой также равномерно заряженную положительным электричеством сферу, внутри которой вращались отрицательно заряженные корпускулы, число и расположение которых зависело от природы атома. « Пудинг с изюмом »
Модель Томсона В 1904 году Томсон представил свою новую модель атома. Она представляла собой также равномерно заряженную положительным электричеством сферу, внутри которой вращались отрицательно заряженные корпускулы, число и расположение которых зависело от природы атома. « Пудинг с изюмом »
 Модель Томсона (иногда называемая «пудинговая модель атома» ) - модель атома, предложенная в 1904 году Джозефом Джоном Томсоном. После открытия им в 1897 году электрона, Томсон предположил, что отрицательно заряженные «корпускулы» (так Томсон называл электроны.
Модель Томсона (иногда называемая «пудинговая модель атома» ) - модель атома, предложенная в 1904 году Джозефом Джоном Томсоном. После открытия им в 1897 году электрона, Томсон предположил, что отрицательно заряженные «корпускулы» (так Томсон называл электроны.
 Резерфорд Модель атома Томсона была опровергнута в 1909 году учеником Томсона - Эрнестом Резерфордом. Последний обнаружил, что атом не однороден по своей структуре: в центре находится массивное положительное плотное ядро, а вокруг него, как планеты вокруг Солнца, летают электроны.
Резерфорд Модель атома Томсона была опровергнута в 1909 году учеником Томсона - Эрнестом Резерфордом. Последний обнаружил, что атом не однороден по своей структуре: в центре находится массивное положительное плотное ядро, а вокруг него, как планеты вокруг Солнца, летают электроны.
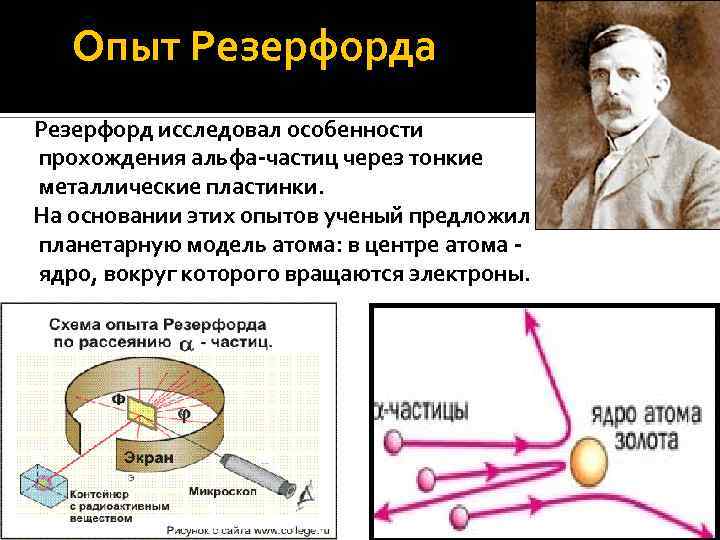 Опыт Резерфорда Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. На основании этих опытов ученый предложил планетарную модель атома: в центре атома ядро, вокруг которого вращаются электроны.
Опыт Резерфорда Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. На основании этих опытов ученый предложил планетарную модель атома: в центре атома ядро, вокруг которого вращаются электроны.
 Планетарная модель Резерфорда Положительный заряд сконцентрирован в ядре атома, а отрицательно заряженные электроны находятся вокруг него
Планетарная модель Резерфорда Положительный заряд сконцентрирован в ядре атома, а отрицательно заряженные электроны находятся вокруг него
 Модель Бора У планетарной модели был ряд недостатков, из которых самым существенным был недостаток, связанный с теоретически верной потерей энергии электрона: так как электрон вращается вокруг атома, то на него действует центростремительное ускорение, а любая заряженная частица, движущаяся с ускорением, излучает. То есть теряет энергию. А если электрон теряет энергию, то в конце концов он должен упасть на ядро, чего в реальности не происходит. В 1913 году Нильс Бор предположил, что электрон может вращаться не как угодно, а на строго определённых орбитах, не меняя своей энергии сколь угодно долгое время. Переход с орбиты на орбиту требует определённой энергии — кванта энергии.
Модель Бора У планетарной модели был ряд недостатков, из которых самым существенным был недостаток, связанный с теоретически верной потерей энергии электрона: так как электрон вращается вокруг атома, то на него действует центростремительное ускорение, а любая заряженная частица, движущаяся с ускорением, излучает. То есть теряет энергию. А если электрон теряет энергию, то в конце концов он должен упасть на ядро, чего в реальности не происходит. В 1913 году Нильс Бор предположил, что электрон может вращаться не как угодно, а на строго определённых орбитах, не меняя своей энергии сколь угодно долгое время. Переход с орбиты на орбиту требует определённой энергии — кванта энергии.
 Открытие делимости ядра В 1930 году было обнаружено, что если высокоэнергетичные альфа -частицы попадают на некоторые лёгкие элементы, то последние излучают лучи с необычно большой проникающей способностью. Это излучение обладает гораздо большей проникающей способностью, чем все известные остальные лучи. В 1932 году Ирен и Фредерик Жолио-Кюри показали, что если это неизвестное излучение попадает на парафин, то образуются протоны высоких энергий, не сходящиеся с теоретическими расчётами. Физик Джеймс Чедвик предположил, что это излучение состоит из незаряженных частиц с массой, близкой к массе протона, и провёл серию экспериментов, подтвердивших эту гипотезу. Эти незаряженные частицы были названы нейтронами
Открытие делимости ядра В 1930 году было обнаружено, что если высокоэнергетичные альфа -частицы попадают на некоторые лёгкие элементы, то последние излучают лучи с необычно большой проникающей способностью. Это излучение обладает гораздо большей проникающей способностью, чем все известные остальные лучи. В 1932 году Ирен и Фредерик Жолио-Кюри показали, что если это неизвестное излучение попадает на парафин, то образуются протоны высоких энергий, не сходящиеся с теоретическими расчётами. Физик Джеймс Чедвик предположил, что это излучение состоит из незаряженных частиц с массой, близкой к массе протона, и провёл серию экспериментов, подтвердивших эту гипотезу. Эти незаряженные частицы были названы нейтронами
 Открытие атомных орбиталей В 1924 году Луи Де Бройлем было предположено, что все частицы связаны с волной, названной впоследствии волной де Бройля с частотой и с длиной волны
Открытие атомных орбиталей В 1924 году Луи Де Бройлем было предположено, что все частицы связаны с волной, названной впоследствии волной де Бройля с частотой и с длиной волны
 В 1926 году было записано уравнение Шрёдингера, описывающее субатомные частицы как волны. Чуть позже Макс Борн (на фото) предположил, что корпускулярноволновой дуализм верен не только для фотонов, но и в принципе для всех частиц. Было введено понятие орбитали — место наиболее вероятного нахождения электрона данного атома. Ведь теоретически электрон может быть очень редко обнаружен на любом расстоянии от атома, но чаще всего он находится где-то рядом с ионым, как раз «на орбитали» .
В 1926 году было записано уравнение Шрёдингера, описывающее субатомные частицы как волны. Чуть позже Макс Борн (на фото) предположил, что корпускулярноволновой дуализм верен не только для фотонов, но и в принципе для всех частиц. Было введено понятие орбитали — место наиболее вероятного нахождения электрона данного атома. Ведь теоретически электрон может быть очень редко обнаружен на любом расстоянии от атома, но чаще всего он находится где-то рядом с ионым, как раз «на орбитали» .
 Различные атомные орбитали
Различные атомные орбитали
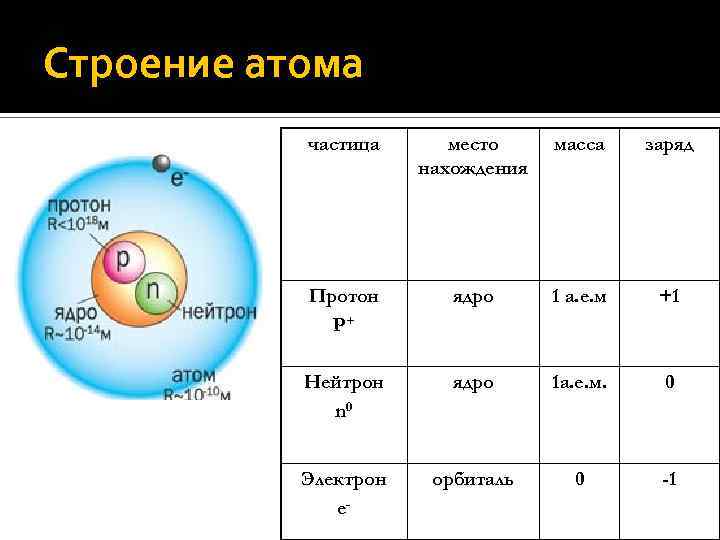 Строение атома частица место нахождения масса заряд Протон P+ ядро 1 а. е. м +1 Нейтрон n 0 ядро 1 а. е. м. 0 Электрон e- орбиталь 0 -1
Строение атома частица место нахождения масса заряд Протон P+ ядро 1 а. е. м +1 Нейтрон n 0 ядро 1 а. е. м. 0 Электрон e- орбиталь 0 -1
 Периодическая система и строение атома Порядковый номер элемента Число нейтронов N =A r -Z Число протонов Число электронов Заряд ядра (Z )
Периодическая система и строение атома Порядковый номер элемента Число нейтронов N =A r -Z Число протонов Число электронов Заряд ядра (Z )
 НАПРИМЕР 6 протонов 6 электронов 6 нейтронов
НАПРИМЕР 6 протонов 6 электронов 6 нейтронов
 Изотопы ИЗОТОПЫ – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но разное нейтронов и разные массовые числа. 35 17 Сl и 37 17 Cl
Изотопы ИЗОТОПЫ – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но разное нейтронов и разные массовые числа. 35 17 Сl и 37 17 Cl


