
Атом

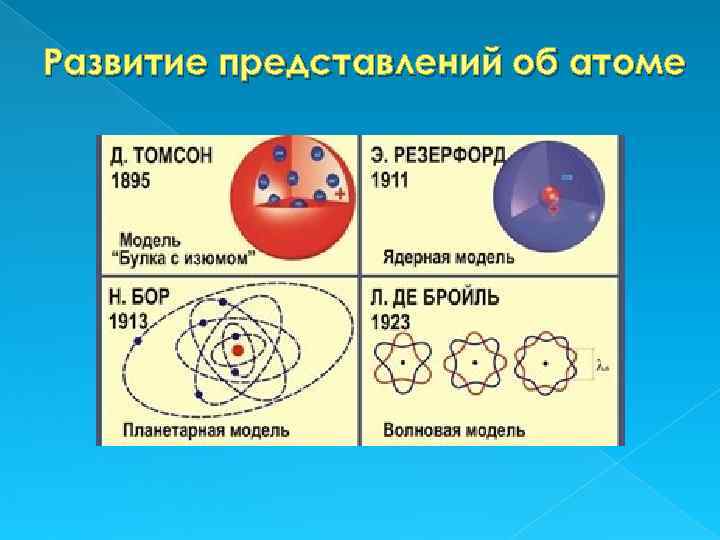
А том (от др. -греч. ἄτομος — том неделимый, неразрезаемый) — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Первая модель строения атома была предложена англ. физиком Дж. Томсоном, открывшим электрон. Открытие электрона позволило создать электронную теорию: электроны входят в состав атома.

Модель Томсона Представляла собой положительно заряженный шар, радиусом 10 -10 м, в котором плавают отрицательно заряженные электроны, нейтрализующие положительный заряд. Условно, модель Томсона можно назвать «Пудинг с изюмом» , где электроны выступают в качестве изюма. Эта модель не объясняла дискретный характер излучения атома и его устойчивость.
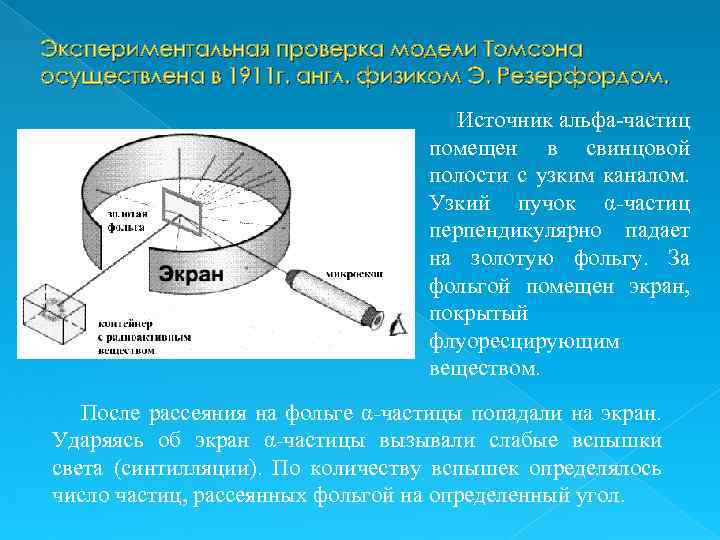
Экспериментальная проверка модели Томсона осуществлена в 1911 г. англ. физиком Э. Резерфордом. Источник альфа-частиц помещен в свинцовой полости с узким каналом. Узкий пучок α‑частиц перпендикулярно падает на золотую фольгу. За фольгой помещен экран, покрытый флуоресцирующим веществом. После рассеяния на фольге α‑частицы попадали на экран. Ударяясь об экран α‑частицы вызывали слабые вспышки света (синтилляции). По количеству вспышек определялось число частиц, рассеянных фольгой на определенный угол.

Подсчет показал, что: Небольшое число α‑частиц отклонилось на углы, бóльшие 90° и даже отразилась от фольги. Большинство α‑частиц проходит через фольгу практически беспрепятственно, отклоняясь на углы менее 1°. Столкновение α‑частиц с электроном не может так существенно изменить ее траекторию, т. к. масса электрона в 73 000 раз меньше массы α‑частицы (α‑частицы – это полностью ионизированные атомы гелия). Рассеяние (изменение направления движения) α‑частиц может вызвать только положительно заряженная часть атома. Т. о. по рассеянию α‑частиц можно определить характер распределения положительного заряда и массы внутри атома. Малая доля частиц, рассеянных на большие углы, означает, что положительный заряд атома сосредоточен в объеме, малом по сравнению с объемом атома – ядре атома. Подсчитывая число α‑частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра: диаметр ядра оказался порядка 10 -13 – 10 -14 м, что в 10 000 раз меньше размера атома.

Обобщая результаты опытов, Резерфорд предложил планетарную (ядерную) модель строения атома, где весь положительный заряд и 99, 4% массы атома сосредоточено в атомном ядре. Вокруг ядра по замкнутым эллиптическим орбитам (подобно планетам вокруг Солнца) движутся электроны, образуя электронную оболочку атома. Положительный заряд ядра равен суммарному отрицательному заряду электронов, т. е. атом электронейтрален (не имеет заряда).

Протонно-нейтронной модель ядра, предложена в 1932 г. рос. физиком Д. Д. Иваненко и В. Гейзенбергом Ядро атома любого химического элемента состоит из положительно заряженных частиц (протонов) и нейтральных частиц, лишенных заряда (нейтронов). Обе эти частицы обычно называют нуклонами.

Протон – материальная частица, представляющая собой атом водорода, из которого удален единственный электрон. Имеет массу mр = 1, 6726∙ 10‑ 27 кг. Положительный заряд равен +1 е. Поскольку масса нейтрона всего на 0, 14 % больше массы протона, в расчетах эта разница обычно во внимание не принимается, и масса нейтрона практически считается равной массе протона. Размеры ядра очень малы: 10‑ 14– 10‑ 15 м (ядро в 100 000 раз меньше атома). Несмотря на малые размеры ядра в нем сосредоточено 99, 95 % массы атома. Ввиду этого плотность ядерного вещества очень велика и составляет величину порядка 1017 кг/м 3.

Заряд ядра, выраженный в элементарных единицах, численно равен порядковому номеру элемента в периодической системе Д. И. Менделеева. Это дает возможность по порядковому номеру элемента Z определить число протонов в ядре данного атома. Общее число нуклонов в ядре атома можно определить по так называемому массовому числу А. Массовое число – это округленный до целых единиц атомный вес элемента (М). Поскольку число протонов в ядре численно равно порядковому номеру элемента Z, то число нейтронов равно разности массового числа А и порядкового номера Z, т. е. N = А – Z. Ядра химических элементов обозначают символом , где X – химический символ элемента. Например, гелий имеет Z = 2 и А = 4, значит, в ядре атома гелия два протона и два нейтрона.

Таким образом, место элемента в периодической системе элементов Д. И. Менделеева и его атомный вес раскрывают не только строение атома, но и структуру его ядра. Вид атомов с данными числами протонов и нейтронов называют нуклидом. Значение атомного веса в таблице элементов почти всегда выражается дробным числом. Это объясняется тем, что почти каждый элемент в действительности состоит из нескольких разновидностей этого элемента, имеющих одинаковый электрический заряд, но различную массу, т. е. одинаковое количество протонов в ядре, но различное количество нейтронов. Атомы одного и того же химического элемента, имеющие в ядре одинаковое количество протонов Z, но различное количество нейтронов N, называются изотопами.

Силы, связывающие нуклоны (протоны и нейтроны) в ядре, называются ядерными силами. Ядерные силы - одно из проявлений сильных взаимодействий. Они являются короткодействующими, радиус их действия соответствует размеру ядра. Ядерные силы не зависят от заряда нуклонов. По своей природе эти силы не могут быть ни электрическими, ни гравитационными, а по величине они на много порядков превышают силы, связывающие электроны с ядром.

Само существование атомных ядер заставляет предположить, что в ядерных силах имеется существенное притяжение, которое и обеспечивает энергию связи нуклонов в ядрах порядка нескольких Мэ. В на Кулон. Кроме того, с увеличением числа нуклонов A в ядре энергия связи на нуклон остается примерно постоянной, а объем ядра растет пропорционально A. Про системы с такими свойствами говорят, что в них имеется насыщение сил, и потому ядерные силы называют насыщающими. Подобно молекулам, находящимся на поверхности воды, нуклоны втягиваются внутрь ядра, испытывая поверхностное натяжение. Вот почему ядра имеют сферическую форму. Ядро является как бы каплей ядерного вещества.

Энергия связи ядер – энергия, необходимая для полного расщепления ядра на отдельные нуклоны. По закону сохранения энергии можно утверждать, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных нуклонов. Энергию связи можно определить как Измерение масс ядер показывает, что масса покоя ядра всегда меньше суммы масс покоя составляющих ядро протонов и нейтронов: . Т. о. существует «дефект масс» - разность между суммарной массой всех нуклонов ядра в свободном состоянии и массой ядра: . Т. о.
Развитие представлений об атоме

1896 г фр. Антуан Беккерель - радиоактивное излучение В 1903 г. Эрнест Резерфорд и Фредерик Содди выдвинули теорию, согласно которой радиоактивные излучения возникают при распаде атомных ядер. При распаде (испускании некоторых частиц, образующих ядро) радиоактивные ядра претерпевают трансмутацию – превращение в ядра других элементов). Явление самопроизвольного превращения атомных ядер неустойчивых изотопов одного химического элемента в устойчивые изотопы другого хим. элемента, сопровождающееся испусканием частиц и излучением энергии называется естественной радиоактивностью.

Примерно 90% из 2500 ядер изотопов, известных в настоящее время, нестабильны, т. е. радиоактивны. Естественной радиоактивностью обладают тяжелые ядра с зарядовым числом Z>83 или массовым числом А>209. Радиоактивным распадом называется самопроизвольное превращение атома изотопа одного химического элемента в атом изотопа другого химического элемента, сопровождающееся испусканием заряженных частиц или фотонов. Исходный изотоп называется материнским элементом, а полученный - дочерним.
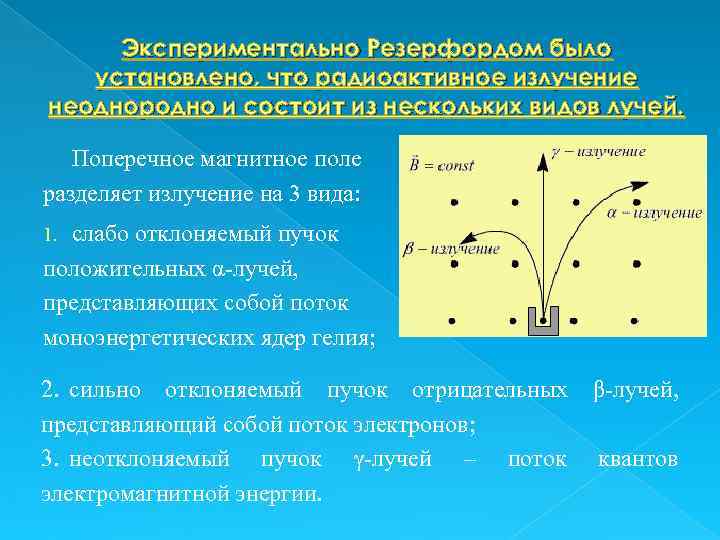
Экспериментально Резерфордом было установлено, что радиоактивное излучение неоднородно и состоит из нескольких видов лучей. Поперечное магнитное поле разделяет излучение на 3 вида: слабо отклоняемый пучок положительных α-лучей, представляющих собой поток моноэнергетических ядер гелия; 1. 2. сильно отклоняемый пучок отрицательных β-лучей, представляющий собой поток электронов; 3. неотклоняемый пучок γ-лучей – поток квантов электромагнитной энергии.

В зависимости от этого выделяют три вида радиоактивных распадов: α-распад – радиоактивный распад, происходящий с испусканием α-частицы 1. С учетом закона сохранения заряда и числа нуклонов, уравнение альфа-распада: Пример: изотоп свинца В результате альфа-распада порядковый номер элемента в таблице Менделеева уменьшается на 2 единицы, а массовое число на 4 единицы.

β-распад – радиоактивный распад, происходящий с испусканием электрона: 2. С учетом закона сохранения заряда и числа нуклонов, уравнение бета-распада: изотоп висмута В результате бета-распада порядковый номер элемента в таблице Менделеева увеличивается на единицу.

Термина гамма-распад не существует, т. к. альфа- и бета-распад сопровождаются гаммаизлучением. 3. Гамма-излучение – электромагнитное излучение, возникающее при переходе ядра из возбужденного состояния в невозбужденное стационарное состояние.