АТОМ КУРЫЛЫС МОДЕЛЬДЕРИ.ppt
- Количество слайдов: 32

Атом құрылысы Орыстың көрнекті химигі Б. Н. Чигерин - (1888 жылы) математикалық есептеулер арқылы атомның қүрылымын күн жүйесі сияқты деген қорытындыға келген. Ағылшын ғалымы Дж. Томсон - (1904 жылы) атомның ішіндегі оң заряд бір жерінде емес бар жерінде бірдей орналасқан (атом – R=1010 м шар), ал оларды нейтралдайтын электрондар осы оң зарядтың арасында (су тамшысының ішінде жүзіп жүрген түйіршіктер тәрізді қозғалып жүреді), концентрлі шеңберлер сияқты болып орналасқан; периодтық жүйеде үқсас элементтердің шеңберлеріндегі электрондардың орналасуы да үқсас деп, периодтылықты түсіндіруге тырысқан. У. Томсон, 1902 ж.

Эрнест Резерфорд тәжірибесі Бір шоқ альфа-бөлшектерін жұқа металға бағыттап жібергенде, олардың басым көпшілігі жұқа металдан өтіп, түзу бағытта жүретінін экраннан көріп, альфа-бөлшектерінің біразы бағытынан ауытқып, әр түрлі бұрыш бұрылғанын байқаған, кейбір өте сирек жағдайда жеке альфа-бөлшектерінің кейін қайтқаны да байқалды. Альфа-бөлшектерінің тебілуі, атомның ішінде, бір жерге жиналған өте көп оң зарядтардың болуына байланысты. Э. Резерфордтың планетарлық моделі (1911 ж. ) §Атомның орталығында оң зарядталған ядро орналасқан. §Барлық оң заряд және атомның барлық массасы ядрода шоғырланған. §Электрондар – Күн жүйесіндегі планеталар тәрізді ядроны айнала қозғалып жүреді. §Ядроның оң заряды мен электрон саны тең, сондықтан атом нейтрал бөлшек.

Нильс Бор теориясы Дания ғалымы Нильс Бор (1885 ж. туған) 1913 жылы ядролық модельге квант теориясын қолданып, атом құрылысының жаңа теориясын ұсынды. Бұл теория спектр құбылыстарын түсіндірумен қатар, жалпы электрон қауыздары жайындағы білімді біраз ілгері дамытты. Бор теориясының негізгі 3 жорамалы немесе постулаты: 1. Электрон ядроны айналғанда, кез келген емес, квант, теориясынан шығатын кесімді шарттарға сай орбиталар бойымен ғана жүреді. Ол орбиталар орнықты яки квантталған деп аталады. 2. Электрон өзіне мүмкін квантталған орбитамен айналғанда энергия шығармайды. 3. Электрон бір орбитадан басқа орбитаға көшкенде ғана энергия бөлініп шығады.

Бұл энергия бүтін квант түрінде болады: Е=Е 1 -Е 2=hv, (мұндағы Е 1 мен Е 2 әр түрлі орбитадағы энергия, v - сәуленің тербеліс жиілігі, h = 2πћ = 6, 62∙ 10 -34 Дж∙с. - Планк тұрақтылығы). АТОМ МОДЕЛЬДЕРІ : а) Томсоның (“сливовый пудинг”) моделі, б) Резерфордтың ядро кеңістігіндегі «электрондық рой» моделі, в) Бордың планетарлық моделі

Атом құрлысының кванттық моделі Н. Бор электронды бөлшек ретінде қарастырып, оған материалдық бөлшекті суреттейтін классикалық заңдарды қолданды. Сондықтан Бор теориясы элементарлы бөлшектердің толқындық қасиеттерін ескермей, микробөлшектердің қозғалысын бір мезгілде материалды бөлшектер және толқындық қасиеттері тұрғысынан түсіндіре алмады. Бұл мақсат тек квантты механика теориясын қолдану арқылы ғана шешілді. Кванттық механика теориясы 1924 -1926 жж. де Бройльдің, Шредингердің, Гейзенбергтің және Дирактың қатысуымен қалыптасты. Кванттык механика - қозғалыстың заңдылықтарын, микробөлшектердің өзара әрекеттесуін және өте кіші массасы бар бөлшектерді (элементарлы бөлшектер, атомдардың ядролары, атомдар, молекулалар) зерттейтін физикалық теория.

Атом құрылысының қазіргі заманғы теориясы Австрия физигі Э. Шредиигердін еңбегінен басталады. Ол І926 ж. электронның толқындық қасиетін кванттықмеханикалық жуықтаумен сипаттады. Электрон толқындық қасиетке ие болғандықтан, оны математикалық тұ. рғыдан сипаттау үшін толқындық теңдеуді қолдану тиімді. һ 2 + д 2Ψ + д 2 Ψ (Ек-U)Ψ=0 8πm дx 2 ду 2 dz 2 мұнда, һ - Планк тұрақтысы, Ек — кинетикалық энергия, m - масса, Ψ(пси) - толқындық функция. Электронның кеңістіктегі белгілі бір нүктелеріндегі болу ықтималдылығын, тығыздығын толқындық функция модулінің квадратымен - | Ψ | 2 анықталады.

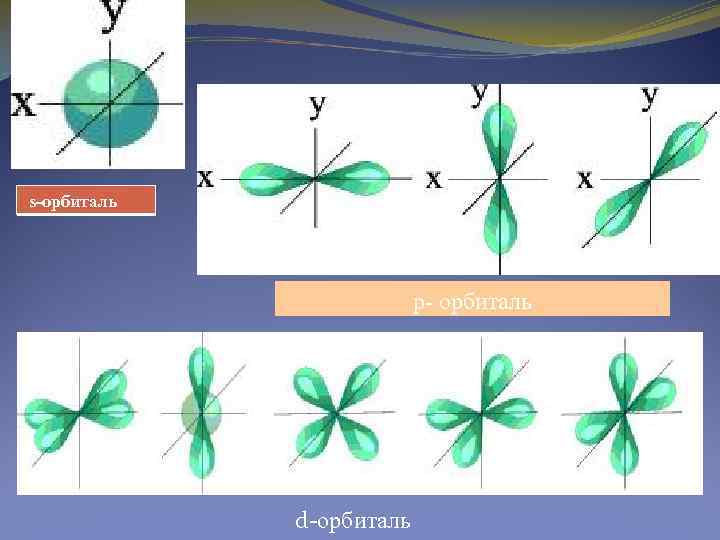
Электрондық бұліт. Атомдық орбитал. Кванттық механикада Бор енгізген "орбита" орнына "электрондық бұлт" түсінігі енгізілген. Бұл жағдайда электронның атомның бүкіл көлемі бойынша таралуын ескере отырып, оның әр түрлі аймақтарындағы болу ықтималдылығына сәйкес, атомдағы электрон зарядын "жайылған" деп шартты түрде қабылдауға болады. Осыған сэйкес электрондық тығыздық – электр зарядының тығыздығы осы берілген аймақтағы электронның пайда болу ықтималдылығының тығыздығына пропорционал. Электрондық бұлт - ядро өрісі аймағының белгілі бір шегінде таралған электрон тығыздығы. Бұл аймақта белгілі Ежалпы энергиясы бар электрон болуы мүмкін. Атомдық орбитал Ψ функциямен анықталатын шекаралық бет және электрондық бұлт.
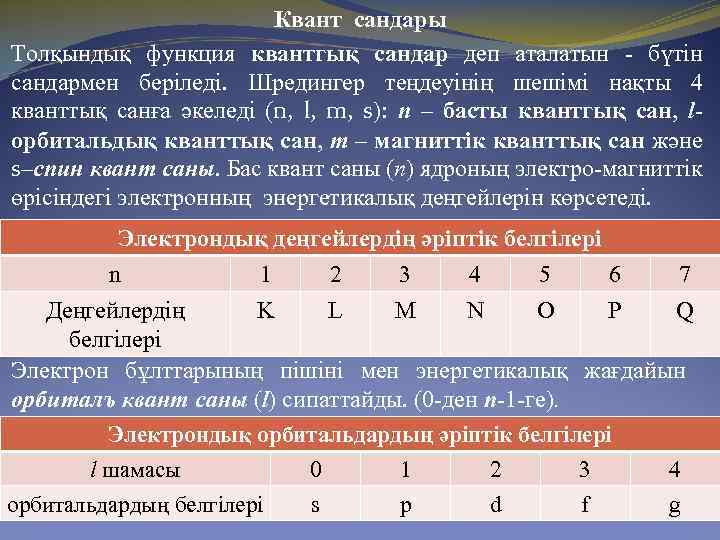
Квант сандары Толқындық функция квантгық сандар деп аталатын - бүтін сандармен беріледі. Шредингер теңдеуінің шешімі нақты 4 кванттық санға әкеледі (n, l, m, s): п – басты квантгық сан, l- орбитальдық кванттық сан, т – магниттік кванттық сан және s–спин квант саны. Бас квант саны (п) ядроның электро-магниттік өрісіндегі электронның энергетикалық деңгейлерін көрсетеді. Электрондық деңгейлердің әріптік белгілері n 1 2 3 4 5 6 7 Деңгейлердің K L M N O P Q белгілері Электрон бұлттарының пішіні мен энергетикалық жағдайын орбиталъ квант саны (l) сипаттайды. (0 -ден п-1 -ге). Электрондық орбитальдардың әріптік белгілері l шамасы 0 1 2 3 4 орбитальдардың белгілері s p d f g
s-орбиталь p- орбиталь d-орбиталь
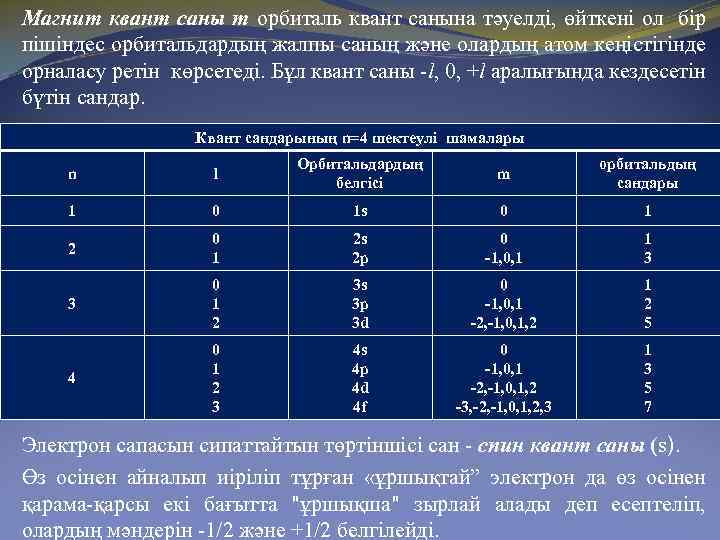
Магнит квант саны т орбиталь квант санына тәуелді, өйткені ол бір пішіндес орбитальдардың жалпы саның және олардың атом кеңістігінде орналасу ретін көрсетеді. Бұл квант саны -l, 0, +l аралығында кездесетін бүтін сандар. Квант сандарының n=4 шектеулі шамалары n l Орбитальдардың белгісі m орбитальдың сандары 1 0 1 s 0 1 2 s 2 p 0 -1, 0, 1 1 3 3 0 1 2 3 s 3 p 3 d 0 -1, 0, 1 -2, -1, 0, 1, 2 1 2 5 4 0 1 2 3 4 s 4 p 4 d 4 f 0 -1, 0, 1 -2, -1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 1 3 5 7 Электрон сапасын сипаттайтын төртіншіcі сан - спин квант саны (s). Өз осінен айналып иіріліп тұрған «ұршықтай” электрон да өз осінен қарама-қарсы екі бағытта "ұршықша" зырлай алады деп есептеліп, олардың мәндерін -1/2 және +1/2 белгілейді.

Көп электронды элемент атомдарының электрондық құрылымы Атомдағы электрондарды деңгейлер, деңгейшелер және орбитальдар бойынша таратып жазуды элементтің электрондық конфигурациясы деп атайды. Көп электронды атомдардың электрондық конфигурациясын құрастырғанда: минимал энергия принципін, Хунд және Клечковский ережелерін ескеру керек. Минимал энергия принципі. Бұл принцип бойынша электрондар әуелі энергиясы ең кіші орбитальдарға орналасады. Ең кіші энергия n=1 энергетикалық деңгей. Осы орбитальда электрон өте тұрақты. Сондықтан, көп электронды атомдарда әуелі n=1 деңгейі, содан кейін n=2, n=3. . . деңгейлері толтырылады. Бір бас квант саны шектігінде “n” орбитальдардың электрондарға толуы мына тәртіппен жүреді : s→ p→ d→ f


Паули принципі Күрделі атомдардың орбитальдарын электрондармен толтыру үшін орбитальдардың әрқайсысында бола алатын электрондар санын анықтап алу қажет. 1925 ж Паули элементтердің периодтық жүйедегі орнына қарап және спектрлерін талдай отырып, квант сандарын электронның реалды күйін сипаттай алатындай етіп комбинациялаудың жалпы принципін ұсынды. Бір атомның ішінде барлық жағынан ұқсас екі электрон болуы мүмкін емес. Бұл принциптен бір орбитальда спиндері қарама – қарсы екі электрон ғана бола алады деген тұжырым жасауға болады. Паули принципін пайдаланып алғашқы екі квант қабатында бола алатын электрондардың санын табуға болады. n l m ms l 0 0 +1/2 l 0 0 -1/2
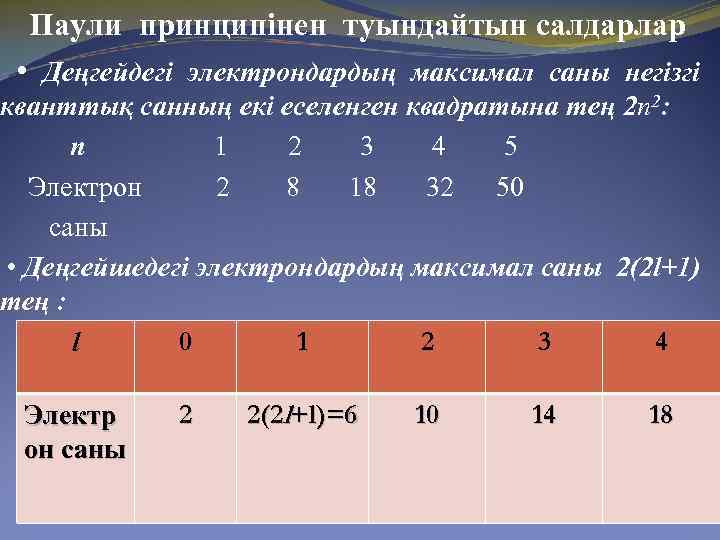
Паули принципінен туындайтын салдарлар • Деңгейдегі электрондардың максимал саны негізгі кванттық санның екі еселенген квадратына тең 2 n 2: n 1 2 3 4 5 Электрон 2 8 18 32 50 саны • Деңгейшедегі электрондардың максимал саны 2(2 l+1) тең : 0 1 2 3 4 l Электр он саны 2 2(2 l+l)=6 10 14 18

Клечковский ережелері Бойындағы энергиясының артуы бойынша орналастырсақ энергетикалық деңгейшелердің қатары мынадай болып шығады: Клечковский қатардың ретін табудың қарапайым жолын ұсынады: 1. Электронның берілген екі жағдайының қайсысында бас және орбиталь квант сандарының қосындысы (n+l) үлкен болса, соның энергиясы үлкен болады. 3 d мен 4 s: 3 d(3+2=5); 4 s(4+0=4). 2. Егер n мен l қосындысы (n+l) бірдей мәнге ие болса, энергия бас квант санының мәніне тәуелді болады: қай орбитальдің “n” мәні үлкендеу болса, соның энергиясы молырақ. Мысалы: 3 d мен 4 p (3+2=5; 4+1=5).
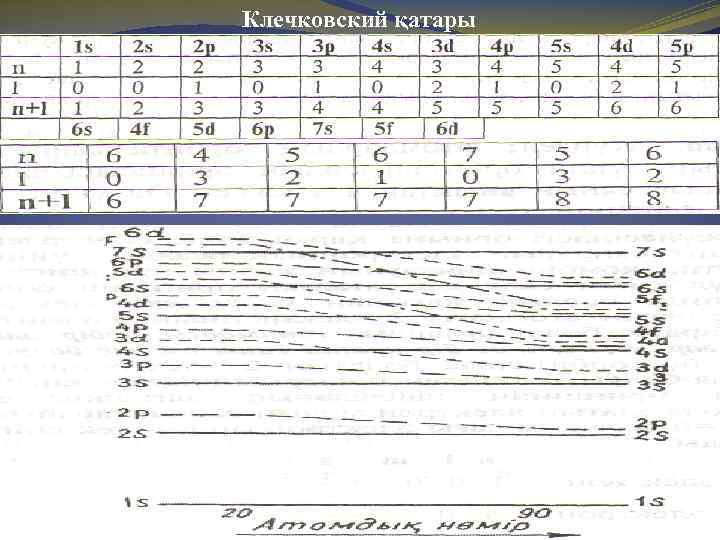
Клечковский қатары

Гунд ережесі. Орбитальдарды электрондармен толтыру тәртібі Гунд ережесі бойынша жүреді: Бір деңгейшелер аралығында сәйкес орбитальдарды электрондармен толтырған кезде, электрондар спиндерінің косындысы максимал болуы керек. Барлық орбитальдарда бір электроннан орналасқаннан кейін, келесі электрондар жұптасып орналасады. а)дұрыс; б) дұрыс емес
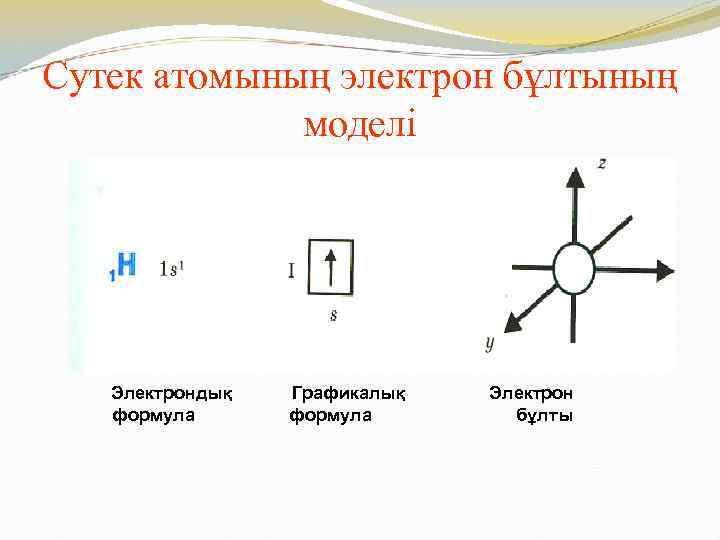
Сутек атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты
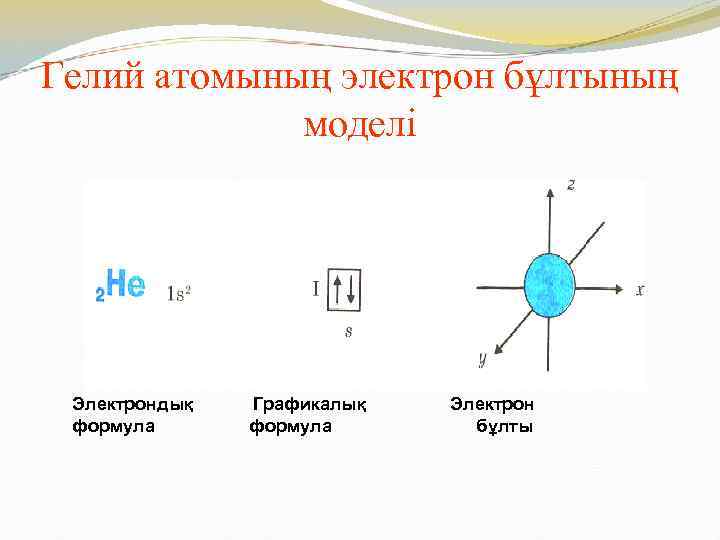
Гелий атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты
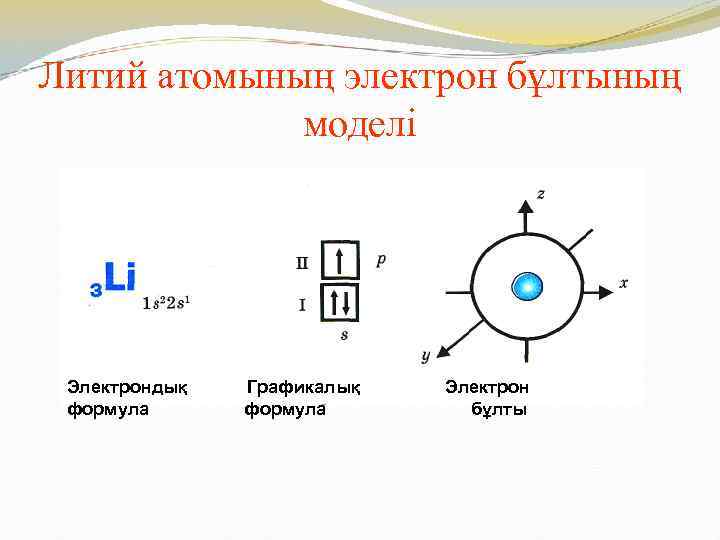
Литий атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты
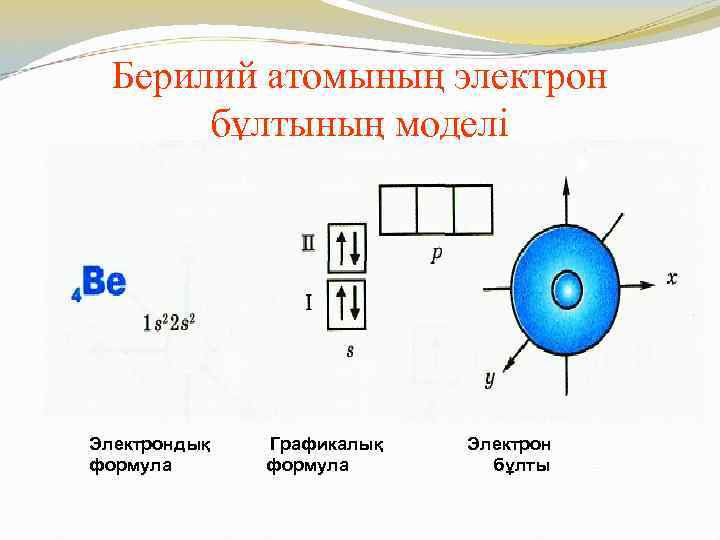
Берилий атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты
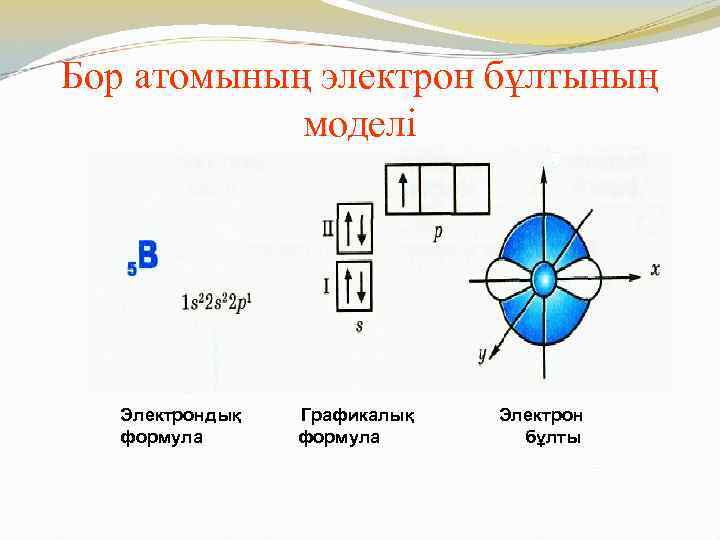
Бор атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты
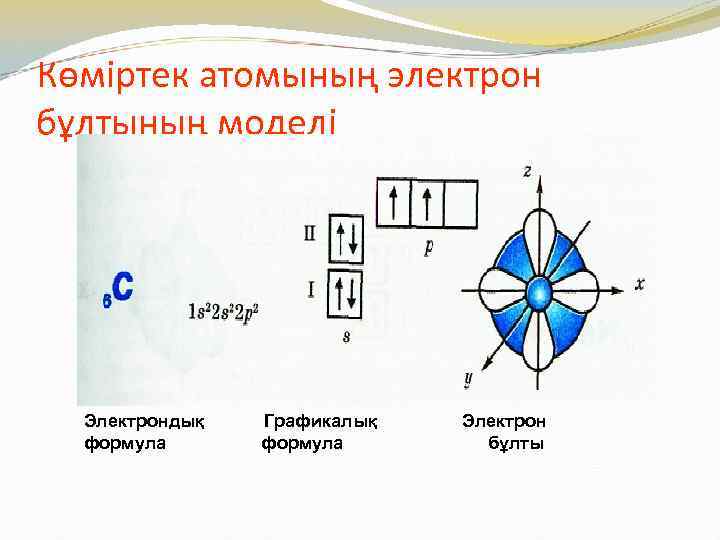
Көміртек атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты
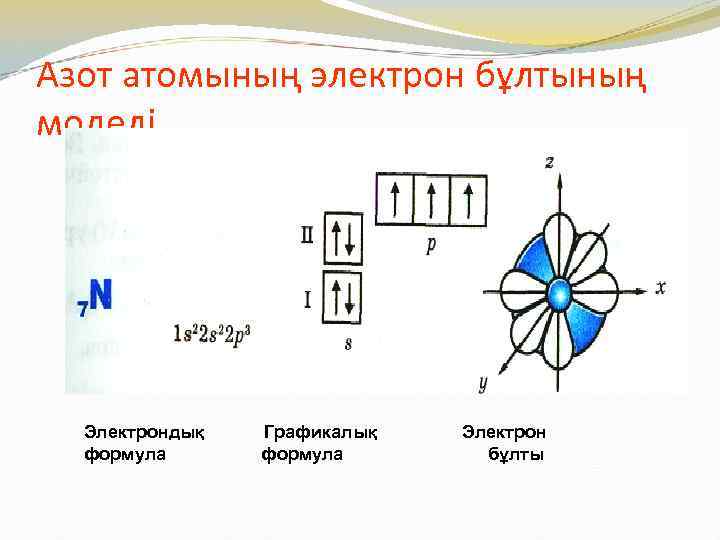
Азот атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты
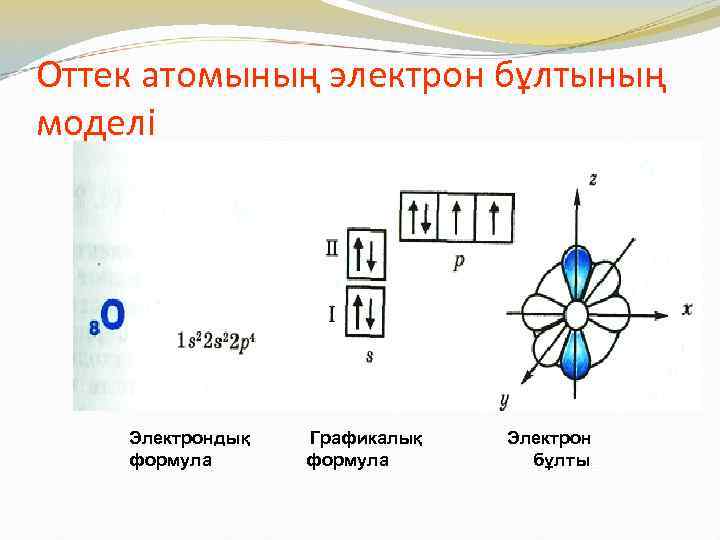
Оттек атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты
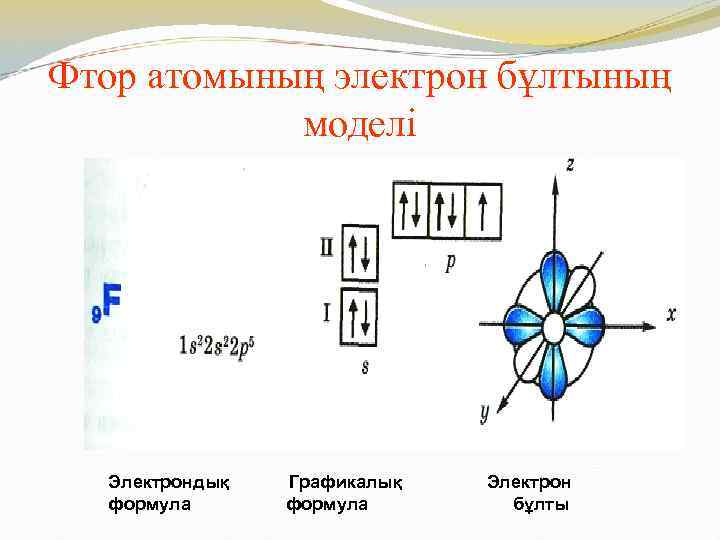
Фтор атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты
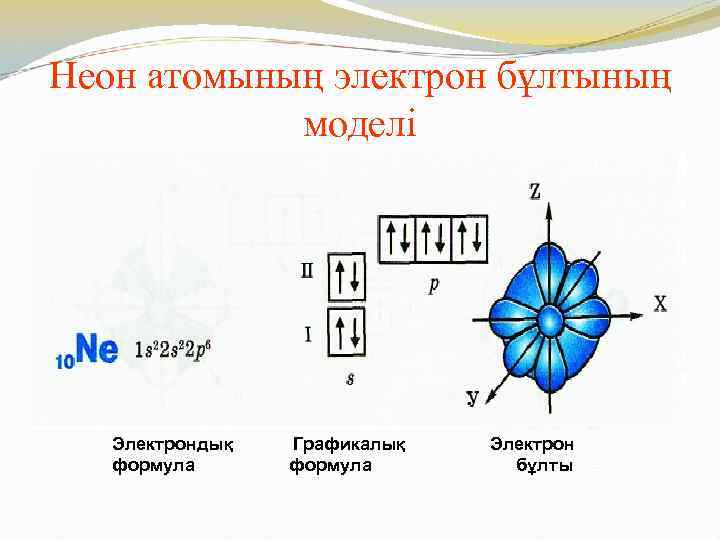
Неон атомының электрон бұлтының моделі Электрондық формула Графикалық формула Электрон бұлты





АТОМ КУРЫЛЫС МОДЕЛЬДЕРИ.ppt