Лекция-Атмосфера-Загрязнение-1.ppt
- Количество слайдов: 28
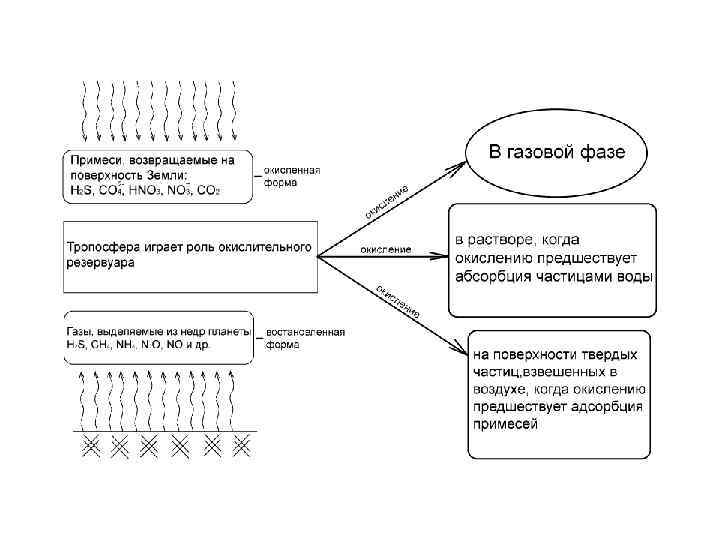
 Атмосфера. Загрязнение атмосферы.
Атмосфера. Загрязнение атмосферы.
 Концентрация некоторых примесных и случайных компонентов тропосферы. Примесь Содержание, ppm Примесь CO CH 4 Cx. Hy N 2 O NO NO 2 NH 3 H 2 S SO 2 Cl 2 I 2 HF H 2 OH˙ HO 2˙ H 2 O 2 0. 1 1. 4 <1*10 -3 0. 25 (0. 2 -2)*10 -3 (0. 5 -4)*10 -3 (6 -20)*10 -3 0. 2 *10 -3 Содержание, ppm 0. 2 *10 -3 (3 -15)10 -4 (0. 4 -4)*10 -5 (0. 08 -18)*10 -3 0. 58 10 -9÷ 10 -6 10 -5÷ 10 -7 10 -2÷ 10 -4
Концентрация некоторых примесных и случайных компонентов тропосферы. Примесь Содержание, ppm Примесь CO CH 4 Cx. Hy N 2 O NO NO 2 NH 3 H 2 S SO 2 Cl 2 I 2 HF H 2 OH˙ HO 2˙ H 2 O 2 0. 1 1. 4 <1*10 -3 0. 25 (0. 2 -2)*10 -3 (0. 5 -4)*10 -3 (6 -20)*10 -3 0. 2 *10 -3 Содержание, ppm 0. 2 *10 -3 (3 -15)10 -4 (0. 4 -4)*10 -5 (0. 08 -18)*10 -3 0. 58 10 -9÷ 10 -6 10 -5÷ 10 -7 10 -2÷ 10 -4
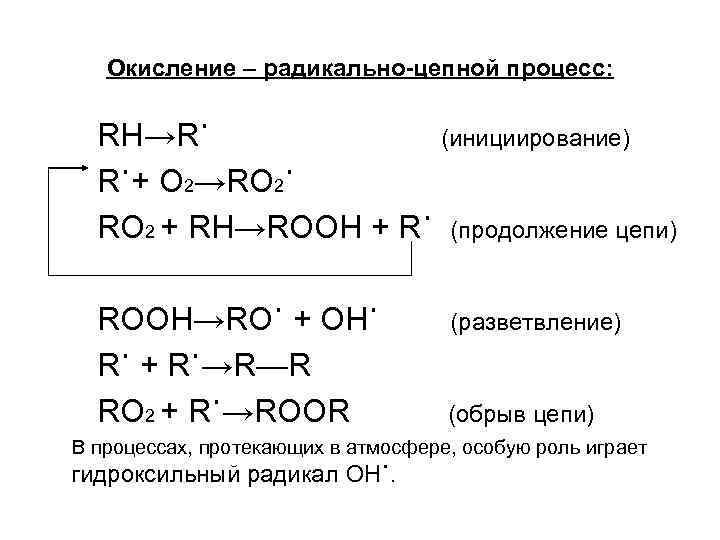 Окисление – радикально-цепной процесс: RH→R˙ (инициирование) R˙+ O 2→RO 2˙ RO 2 + RH→ROOH + R˙ (продолжение цепи) ROOH→RO˙ + OH˙ R˙ + R˙→R—R RO 2 + R˙→ROOR (разветвление) (обрыв цепи) В процессах, протекающих в атмосфере, особую роль играет гидроксильный радикал OH˙.
Окисление – радикально-цепной процесс: RH→R˙ (инициирование) R˙+ O 2→RO 2˙ RO 2 + RH→ROOH + R˙ (продолжение цепи) ROOH→RO˙ + OH˙ R˙ + R˙→R—R RO 2 + R˙→ROOR (разветвление) (обрыв цепи) В процессах, протекающих в атмосфере, особую роль играет гидроксильный радикал OH˙.
 Образование гидроксильного радикала OH˙: λ<175 нм O 2 + h→ ט O(1 D) + O(3 P) λ<310 нм O 3 + h→ ט O 2 + O(1 D) λ<240 нм N 2 O + h→ ט N 2 + O(1 D) λ<244 нм NO 2 + h→ ט NO + O(1 D) Источником OH˙ становится возбужденный атом O(1 D) O(3 P) используется для полезной реакции – синтеза O 3 O(1 D) + H 2 O→ 2 OH˙ O(1 D) + CH 4→CH 3˙ + OH˙ O(1 D) + H 2→H˙+ OH˙ Другие источники образование гидроксильного радикала OH˙: λ<340 нм HNO 2→NO + OH˙ λ<335 нм HNO 3→NO 2 + OH˙ λ<300 нм H 2 O 2→ 2 OH˙
Образование гидроксильного радикала OH˙: λ<175 нм O 2 + h→ ט O(1 D) + O(3 P) λ<310 нм O 3 + h→ ט O 2 + O(1 D) λ<240 нм N 2 O + h→ ט N 2 + O(1 D) λ<244 нм NO 2 + h→ ט NO + O(1 D) Источником OH˙ становится возбужденный атом O(1 D) O(3 P) используется для полезной реакции – синтеза O 3 O(1 D) + H 2 O→ 2 OH˙ O(1 D) + CH 4→CH 3˙ + OH˙ O(1 D) + H 2→H˙+ OH˙ Другие источники образование гидроксильного радикала OH˙: λ<340 нм HNO 2→NO + OH˙ λ<335 нм HNO 3→NO 2 + OH˙ λ<300 нм H 2 O 2→ 2 OH˙
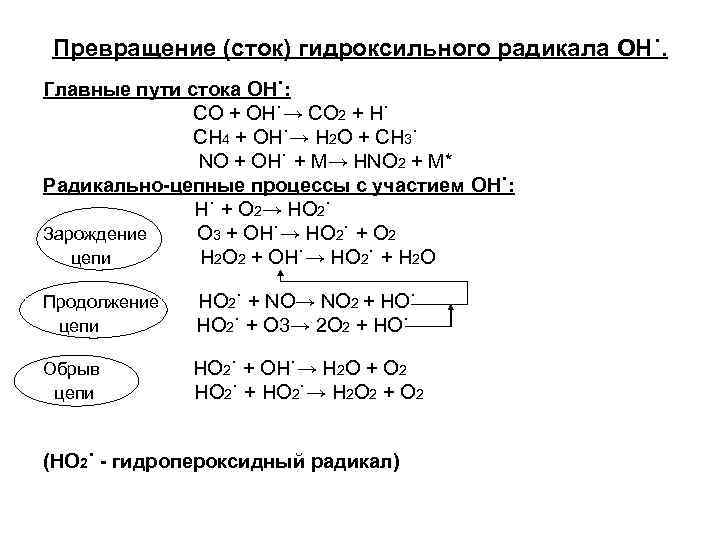 Превращение (сток) гидроксильного радикала OH˙. Главные пути стока OH˙: CO + OH˙→ CO 2 + H˙ CH 4 + OH˙→ H 2 O + CH 3˙ NO + OH˙ + M→ HNO 2 + M* Радикально-цепные процессы с участием OH˙: H˙ + O 2→ HO 2˙ Зарождение O 3 + OH˙→ HO 2˙ + O 2 цепи H 2 O 2 + OH˙→ HO 2˙ + H 2 O Продолжение цепи HO 2˙ + NO→ NO 2 + HO˙ HO 2˙ + O 3→ 2 O 2 + HO˙ Обрыв цепи HO 2˙ + OH˙→ H 2 O + O 2 HO 2˙ + HO 2˙→ H 2 O 2 + O 2 (HO 2˙ - гидропероксидный радикал)
Превращение (сток) гидроксильного радикала OH˙. Главные пути стока OH˙: CO + OH˙→ CO 2 + H˙ CH 4 + OH˙→ H 2 O + CH 3˙ NO + OH˙ + M→ HNO 2 + M* Радикально-цепные процессы с участием OH˙: H˙ + O 2→ HO 2˙ Зарождение O 3 + OH˙→ HO 2˙ + O 2 цепи H 2 O 2 + OH˙→ HO 2˙ + H 2 O Продолжение цепи HO 2˙ + NO→ NO 2 + HO˙ HO 2˙ + O 3→ 2 O 2 + HO˙ Обрыв цепи HO 2˙ + OH˙→ H 2 O + O 2 HO 2˙ + HO 2˙→ H 2 O 2 + O 2 (HO 2˙ - гидропероксидный радикал)
 Фоновые загрязнения атмосферы – техногенные загрязнения, образующиеся под влиянием промышленных выбросов и регионального и глобального переноса загрязняющих веществ в атмосфере. Фоновые загрязнения в основном определяются: 1. Географией региона. 2. Периодом года. Фоновые концентрации: Свинец: - ЕТР (8 -15)*10 -9 г/м 3 - Сибирь 3. 7*10 -9 г/м 3 Бенз(а)пирен: - индустриальные районы (0. 4 -0. 5)*10 -9 г/м 3 - оз. Байкал (0. 01 -0. 1)*10 -9 г/м 3 Фоновые концентрации в индустриальных районах РФ ~ аналогичны для соответствующих районов Западной Европы.
Фоновые загрязнения атмосферы – техногенные загрязнения, образующиеся под влиянием промышленных выбросов и регионального и глобального переноса загрязняющих веществ в атмосфере. Фоновые загрязнения в основном определяются: 1. Географией региона. 2. Периодом года. Фоновые концентрации: Свинец: - ЕТР (8 -15)*10 -9 г/м 3 - Сибирь 3. 7*10 -9 г/м 3 Бенз(а)пирен: - индустриальные районы (0. 4 -0. 5)*10 -9 г/м 3 - оз. Байкал (0. 01 -0. 1)*10 -9 г/м 3 Фоновые концентрации в индустриальных районах РФ ~ аналогичны для соответствующих районов Западной Европы.
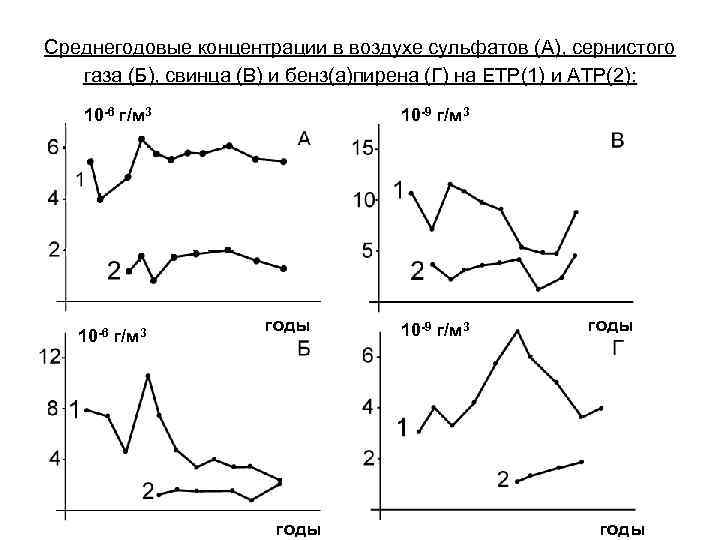 Среднегодовые концентрации в воздухе сульфатов (А), сернистого газа (Б), свинца (В) и бенз(а)пирена (Г) на ЕТР(1) и АТР(2): 10 -6 г/м 3 10 -9 г/м 3 годы
Среднегодовые концентрации в воздухе сульфатов (А), сернистого газа (Б), свинца (В) и бенз(а)пирена (Г) на ЕТР(1) и АТР(2): 10 -6 г/м 3 10 -9 г/м 3 годы
 Трансграничный перенос загрязняющих веществ в атмосфере. Различают: -глобальные воздушные течения. -местные циркуляции воздушных масс.
Трансграничный перенос загрязняющих веществ в атмосфере. Различают: -глобальные воздушные течения. -местные циркуляции воздушных масс.
 Движение воздушных масс в атмосфере носит турбулентный характер и описывается уравнением турбулентной диффузии: диффузии ∂c/∂t + X(∂c/∂x) + Y(∂c/∂y) + Z(∂c/∂z)= =(∂/∂x)Kx(∂c/∂x)+ (∂/∂y)Ky(∂c/∂y) + (∂/∂z)Kz(∂c/∂z)+αc c-концентрация загрязнений; t-время; αc-учет превращений загрязнений; X, Y, Z-турбулентные пульсации в направлении соответствующих осей: X-параллельно ветру; Y-перпендикулярно ветру; Z-перпендикулярно поверхности Земли; Kx, Ky, Kz-коэффициент турбулентной диффузии в направлении соответствующих координат.
Движение воздушных масс в атмосфере носит турбулентный характер и описывается уравнением турбулентной диффузии: диффузии ∂c/∂t + X(∂c/∂x) + Y(∂c/∂y) + Z(∂c/∂z)= =(∂/∂x)Kx(∂c/∂x)+ (∂/∂y)Ky(∂c/∂y) + (∂/∂z)Kz(∂c/∂z)+αc c-концентрация загрязнений; t-время; αc-учет превращений загрязнений; X, Y, Z-турбулентные пульсации в направлении соответствующих осей: X-параллельно ветру; Y-перпендикулярно ветру; Z-перпендикулярно поверхности Земли; Kx, Ky, Kz-коэффициент турбулентной диффузии в направлении соответствующих координат.
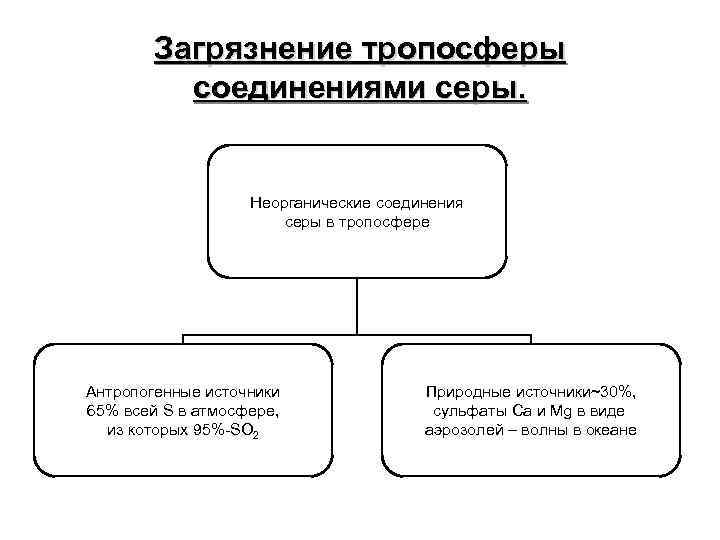 Загрязнение тропосферы соединениями серы. Неорганические соединения серы в тропосфере Антропогенные источники 65% всей S в атмосфере, из которых 95%-SO 2 Природные источники~30%, сульфаты Ca и Mg в виде аэрозолей – волны в океане
Загрязнение тропосферы соединениями серы. Неорганические соединения серы в тропосфере Антропогенные источники 65% всей S в атмосфере, из которых 95%-SO 2 Природные источники~30%, сульфаты Ca и Mg в виде аэрозолей – волны в океане
 Биологические источники неорганических соединений серы выделяют в атмосферу в основном H 2 S~23 -49% всех неорганических соединений серы. H 2 S в атмосфере: -[H 2 S] над океанами: 0. 0076÷ 0. 076 мкг/м 3; -[H 2 S] над континентами: 0. 05÷ 0. 1 мкг/м 3; -Время жизни в атмосфере несколько часов. H 2 S + OH˙→H 2 O + HS¯ + O 2→[SO] + OH˙ [SO] + HO 2→SO 2 + OH˙ Полученный SO 2 далее химически превращается в атмосфере.
Биологические источники неорганических соединений серы выделяют в атмосферу в основном H 2 S~23 -49% всех неорганических соединений серы. H 2 S в атмосфере: -[H 2 S] над океанами: 0. 0076÷ 0. 076 мкг/м 3; -[H 2 S] над континентами: 0. 05÷ 0. 1 мкг/м 3; -Время жизни в атмосфере несколько часов. H 2 S + OH˙→H 2 O + HS¯ + O 2→[SO] + OH˙ [SO] + HO 2→SO 2 + OH˙ Полученный SO 2 далее химически превращается в атмосфере.
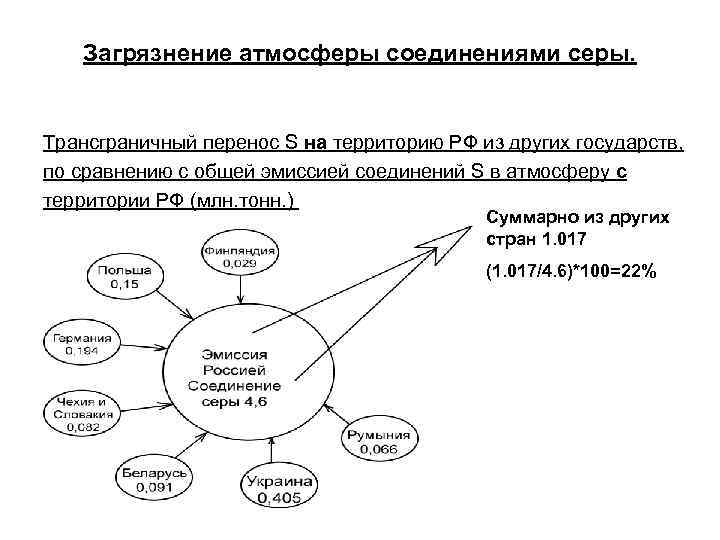 Загрязнение атмосферы соединениями серы. Трансграничный перенос S на территорию РФ из других государств, по сравнению с общей эмиссией соединений S в атмосферу с территории РФ (млн. тонн. ) Суммарно из других стран 1. 017 (1. 017/4. 6)*100=22%
Загрязнение атмосферы соединениями серы. Трансграничный перенос S на территорию РФ из других государств, по сравнению с общей эмиссией соединений S в атмосферу с территории РФ (млн. тонн. ) Суммарно из других стран 1. 017 (1. 017/4. 6)*100=22%
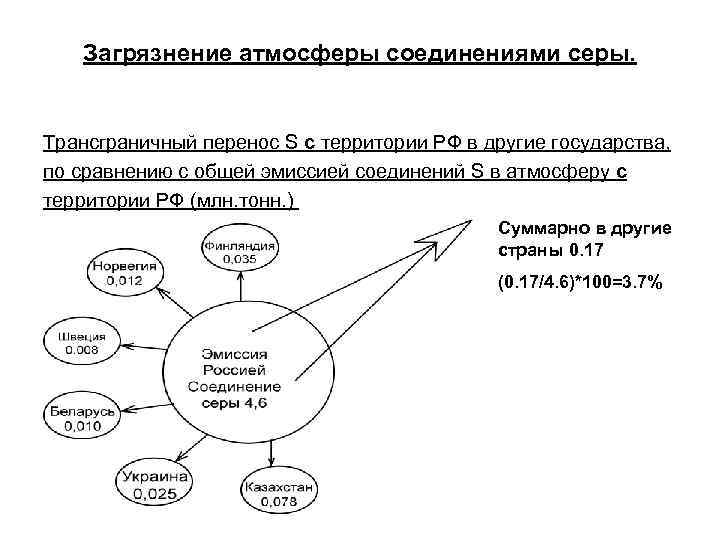 Загрязнение атмосферы соединениями серы. Трансграничный перенос S с территории РФ в другие государства, по сравнению с общей эмиссией соединений S в атмосферу с территории РФ (млн. тонн. ) Суммарно в другие страны 0. 17 (0. 17/4. 6)*100=3. 7%
Загрязнение атмосферы соединениями серы. Трансграничный перенос S с территории РФ в другие государства, по сравнению с общей эмиссией соединений S в атмосферу с территории РФ (млн. тонн. ) Суммарно в другие страны 0. 17 (0. 17/4. 6)*100=3. 7%
 Превращение соединений S в тропосфере. Газофазное окисление SO 2: SO 2 + h→ ט SO 2* 290 нм<λ<400 нм SO 2* + 2 O 2→SO 3 + O 3 I путь или с участием «третьего тела» : окисления SO 2* + O 2 + M→SO 42 - + M* SO 42 - + O 2→SO 3 + O 3 далее с молекулой воды: SO 3 + H 2 O→H 2 SO 4→ (кислотные дожди) Эти процессы вероятны, но не являются основными при окислении SO 2 в газовой фазе. Эти реакции - крайне вредны: смог(O 3)+кислотные дожди.
Превращение соединений S в тропосфере. Газофазное окисление SO 2: SO 2 + h→ ט SO 2* 290 нм<λ<400 нм SO 2* + 2 O 2→SO 3 + O 3 I путь или с участием «третьего тела» : окисления SO 2* + O 2 + M→SO 42 - + M* SO 42 - + O 2→SO 3 + O 3 далее с молекулой воды: SO 3 + H 2 O→H 2 SO 4→ (кислотные дожди) Эти процессы вероятны, но не являются основными при окислении SO 2 в газовой фазе. Эти реакции - крайне вредны: смог(O 3)+кислотные дожди.
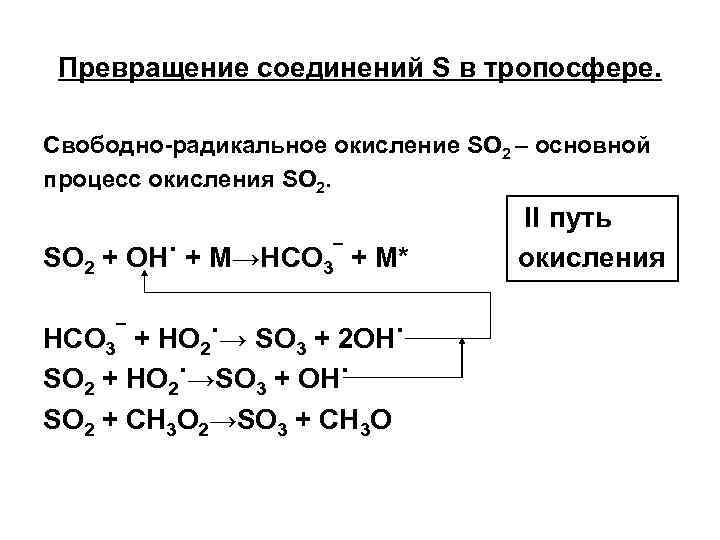 Превращение соединений S в тропосфере. Свободно-радикальное окисление SO 2 – основной процесс окисления SO 2 + OH˙ + M→HCO 3¯ + M* HCO 3¯ + HO 2˙→ SO 3 + 2 OH˙ SO 2 + HO 2˙→SO 3 + OH˙ SO 2 + CH 3 O 2→SO 3 + CH 3 O II путь окисления
Превращение соединений S в тропосфере. Свободно-радикальное окисление SO 2 – основной процесс окисления SO 2 + OH˙ + M→HCO 3¯ + M* HCO 3¯ + HO 2˙→ SO 3 + 2 OH˙ SO 2 + HO 2˙→SO 3 + OH˙ SO 2 + CH 3 O 2→SO 3 + CH 3 O II путь окисления
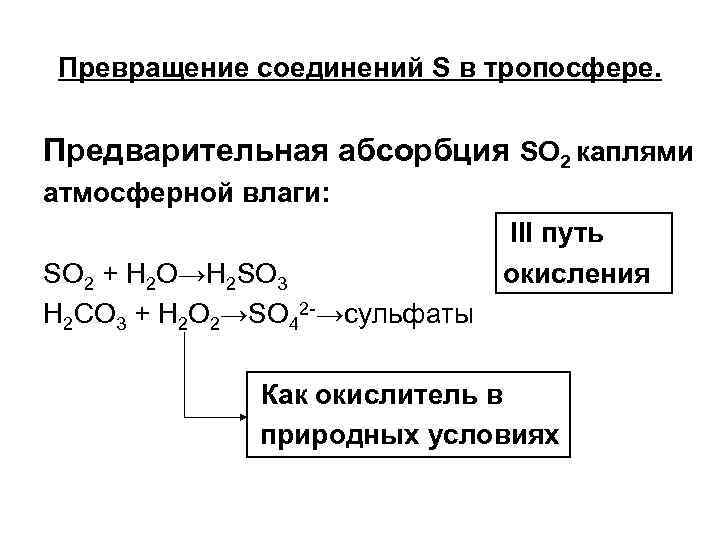 Превращение соединений S в тропосфере. Предварительная абсорбция SO 2 каплями атмосферной влаги: SO 2 + H 2 O→H 2 SO 3 H 2 CO 3 + H 2 O 2→SO 42 -→сульфаты III путь окисления Как окислитель в природных условиях
Превращение соединений S в тропосфере. Предварительная абсорбция SO 2 каплями атмосферной влаги: SO 2 + H 2 O→H 2 SO 3 H 2 CO 3 + H 2 O 2→SO 42 -→сульфаты III путь окисления Как окислитель в природных условиях
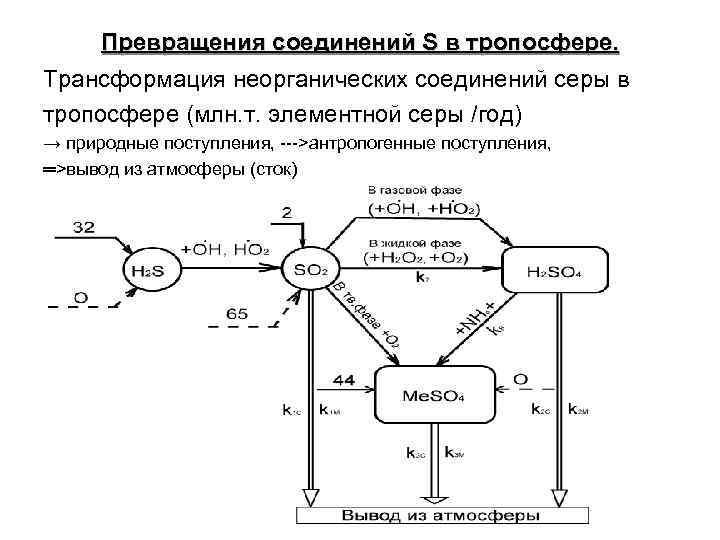 Превращения соединений S в тропосфере. Трансформация неорганических соединений серы в тропосфере (млн. т. элементной серы /год) → природные поступления, --->антропогенные поступления, ═>вывод из атмосферы (сток)
Превращения соединений S в тропосфере. Трансформация неорганических соединений серы в тропосфере (млн. т. элементной серы /год) → природные поступления, --->антропогенные поступления, ═>вывод из атмосферы (сток)
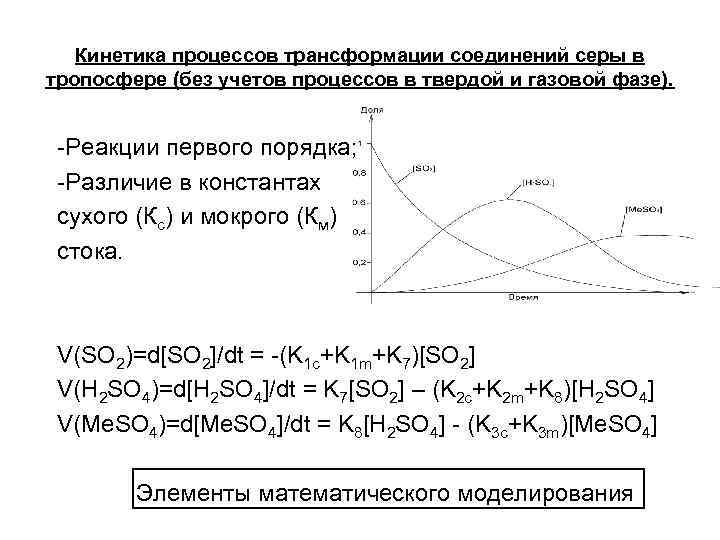 Кинетика процессов трансформации соединений серы в тропосфере (без учетов процессов в твердой и газовой фазе). -Реакции первого порядка; -Различие в константах сухого (Кс) и мокрого (Км) стока. V(SO 2)=d[SO 2]/dt = -(K 1 c+K 1 m+K 7)[SO 2] V(H 2 SO 4)=d[H 2 SO 4]/dt = K 7[SO 2] – (K 2 c+K 2 m+K 8)[H 2 SO 4] V(Me. SO 4)=d[Me. SO 4]/dt = K 8[H 2 SO 4] - (K 3 c+K 3 m)[Me. SO 4] Элементы математического моделирования
Кинетика процессов трансформации соединений серы в тропосфере (без учетов процессов в твердой и газовой фазе). -Реакции первого порядка; -Различие в константах сухого (Кс) и мокрого (Км) стока. V(SO 2)=d[SO 2]/dt = -(K 1 c+K 1 m+K 7)[SO 2] V(H 2 SO 4)=d[H 2 SO 4]/dt = K 7[SO 2] – (K 2 c+K 2 m+K 8)[H 2 SO 4] V(Me. SO 4)=d[Me. SO 4]/dt = K 8[H 2 SO 4] - (K 3 c+K 3 m)[Me. SO 4] Элементы математического моделирования
 Превращение соединений S в тропосфере. Выводы: - Со временем доля SO 2 уменьшается, доля H 2 SO 4 увеличивается, проходит через максимум через 10 -15 ч. после выброса. Содержание сульфатов в атмосфере будет постепенно возрастать в течение 40 -50 ч. , затем медленно начинает снижаться. - Опасность загрязнений атмосферы соединениями S, связанная с трансграничным переносом примесей. Пример: Ветер со скоростью 30 км/ч. Через 10 часов примеси SO 2 будут удалены на 300 км и уже будут представлены в основном H 2 SO 4 – кислотный дождь. - Серная кислота остается основным компонентом, закисляющим атмосферные осадки. - Необходимость мониторинга не только SO 2 , но и H 2 SO 4 и сульфатов.
Превращение соединений S в тропосфере. Выводы: - Со временем доля SO 2 уменьшается, доля H 2 SO 4 увеличивается, проходит через максимум через 10 -15 ч. после выброса. Содержание сульфатов в атмосфере будет постепенно возрастать в течение 40 -50 ч. , затем медленно начинает снижаться. - Опасность загрязнений атмосферы соединениями S, связанная с трансграничным переносом примесей. Пример: Ветер со скоростью 30 км/ч. Через 10 часов примеси SO 2 будут удалены на 300 км и уже будут представлены в основном H 2 SO 4 – кислотный дождь. - Серная кислота остается основным компонентом, закисляющим атмосферные осадки. - Необходимость мониторинга не только SO 2 , но и H 2 SO 4 и сульфатов.
 Превращение соединений N в тропосфере. - В тропосфере соединения азота находятся в виде: оксидов азота, аммиака, солей аммония, азотной кислоты, нитратов. - Оксиды азота делятся на две группы: 1)Устойчивые в тропосфере: N 2 O, NO 2. 2)Неустойчивые в тропосфере: NO 3, N 2 O 4, N 2 O 5: N 2 O 3 + h→ ט NO + NO 2 N 2 O 4 + h→ 2ט NO 2 NO 3 + NO→ 2 NO 2 NO 3 + h → ט NO + O 2 N 2 O 5 → N 2 O 3 + O 2 N 2 O 5 + H 2 O→ 2 HNO 3 Превращения неустойчивых оксидов.
Превращение соединений N в тропосфере. - В тропосфере соединения азота находятся в виде: оксидов азота, аммиака, солей аммония, азотной кислоты, нитратов. - Оксиды азота делятся на две группы: 1)Устойчивые в тропосфере: N 2 O, NO 2. 2)Неустойчивые в тропосфере: NO 3, N 2 O 4, N 2 O 5: N 2 O 3 + h→ ט NO + NO 2 N 2 O 4 + h→ 2ט NO 2 NO 3 + NO→ 2 NO 2 NO 3 + h → ט NO + O 2 N 2 O 5 → N 2 O 3 + O 2 N 2 O 5 + H 2 O→ 2 HNO 3 Превращения неустойчивых оксидов.
 Превращение соединений N в тропосфере. - Поэтому: NOx ≡ NO, NO 2, N 2 O. - Среднее значение N 2 O в тропосфере незначительно меняется с высотой и составляет в среднем 0. 26 -0. 33 ppm. - За счет процессов денитрификации N 2 O поступает в атмосферу в количестве 100 млн. т. /год - Всего N 2 O в атмосфере ~ 2000 млн. т. - Время жизни молекул N 2 O в атмосфере ~ 20 лет.
Превращение соединений N в тропосфере. - Поэтому: NOx ≡ NO, NO 2, N 2 O. - Среднее значение N 2 O в тропосфере незначительно меняется с высотой и составляет в среднем 0. 26 -0. 33 ppm. - За счет процессов денитрификации N 2 O поступает в атмосферу в количестве 100 млн. т. /год - Всего N 2 O в атмосфере ~ 2000 млн. т. - Время жизни молекул N 2 O в атмосфере ~ 20 лет.
 Превращение соединений N в тропосфере. - Сток N 2 O из атмосферы – фотодиссоциация: N 2 O + h→ ט N 2 + O λ<250 нм или N 2 O + O(1 D)→N 2 + O 2 N 2 O + O(1 D)→ 2 NO - NO и NO 2 в тропосфере подвергается взаимным превращениям: NO + HO 2˙→NO 2 + OH˙ NO + O 3→NO 2 + O 2 NO 2 + h→ ט NO + O(3 P) λ<398 нм
Превращение соединений N в тропосфере. - Сток N 2 O из атмосферы – фотодиссоциация: N 2 O + h→ ט N 2 + O λ<250 нм или N 2 O + O(1 D)→N 2 + O 2 N 2 O + O(1 D)→ 2 NO - NO и NO 2 в тропосфере подвергается взаимным превращениям: NO + HO 2˙→NO 2 + OH˙ NO + O 3→NO 2 + O 2 NO 2 + h→ ט NO + O(3 P) λ<398 нм
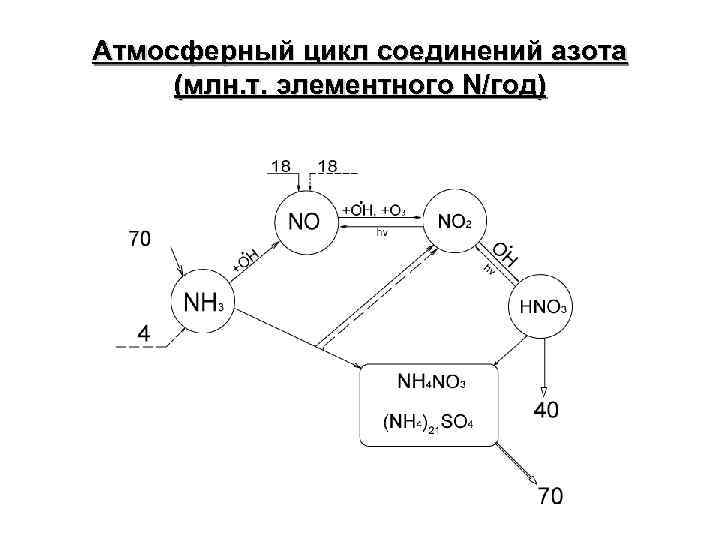 Атмосферный цикл соединений азота (млн. т. элементного N/год)
Атмосферный цикл соединений азота (млн. т. элементного N/год)
 Превращение соединений N в тропосфере. - Основные природные источники оксидов азота: денитрификация, окисление NH 3 и N 2 (в разрядах молний)~ ~21 -89 млн. т. NOx - Антропогенные выбросы NOx~20 млн. т. В основном – процессы сжигания топлива - ~40 -50% HNO 3 в тропосфере образуется по реакции: NO 2 + OH˙→HNO 3 ~25% HNO 3 – по реакции: N 2 O 5 + H 2 O→ 2 HNO 3 ~25% HNO 3 – по реакции NO 3 с органическими кислородсодержащими радикалами
Превращение соединений N в тропосфере. - Основные природные источники оксидов азота: денитрификация, окисление NH 3 и N 2 (в разрядах молний)~ ~21 -89 млн. т. NOx - Антропогенные выбросы NOx~20 млн. т. В основном – процессы сжигания топлива - ~40 -50% HNO 3 в тропосфере образуется по реакции: NO 2 + OH˙→HNO 3 ~25% HNO 3 – по реакции: N 2 O 5 + H 2 O→ 2 HNO 3 ~25% HNO 3 – по реакции NO 3 с органическими кислородсодержащими радикалами
 Превращение соединений N в тропосфере. - Сток HNO 3: HNO 3→OH˙ + NO 2 HNO 3 + OH˙→NO 3 + H 2 O - Основное количество HNO 3 выводится из тропосферы с атмосферными осадками в виде растворов HNO 3 и ее солей - Среди нитратов – основное количество NH 4 NO 3 – как продукт взаимодействия аэрозолей HNO 3 с NH 3 - NH 3 поступает в атмосферу ~70 млн. т. /год (природные источники) ~4 млн. т. /год (антропогенный вклад). Основное количество NH 3 – биологического происхождения - Сток NH 3 + OH˙→NH 2 + H 2 O NH 2 + O 2→NO + H 2 O
Превращение соединений N в тропосфере. - Сток HNO 3: HNO 3→OH˙ + NO 2 HNO 3 + OH˙→NO 3 + H 2 O - Основное количество HNO 3 выводится из тропосферы с атмосферными осадками в виде растворов HNO 3 и ее солей - Среди нитратов – основное количество NH 4 NO 3 – как продукт взаимодействия аэрозолей HNO 3 с NH 3 - NH 3 поступает в атмосферу ~70 млн. т. /год (природные источники) ~4 млн. т. /год (антропогенный вклад). Основное количество NH 3 – биологического происхождения - Сток NH 3 + OH˙→NH 2 + H 2 O NH 2 + O 2→NO + H 2 O
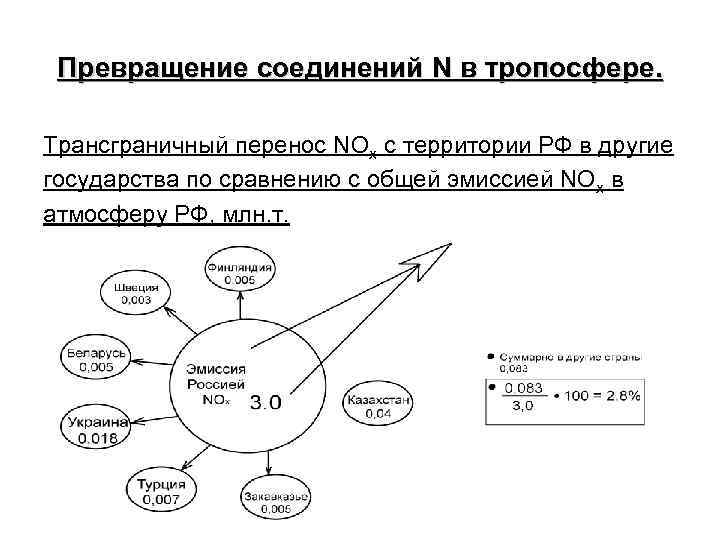 Превращение соединений N в тропосфере. Трансграничный перенос NOx c территории РФ в другие государства по сравнению с общей эмиссией NOx в атмосферу РФ, млн. т.
Превращение соединений N в тропосфере. Трансграничный перенос NOx c территории РФ в другие государства по сравнению с общей эмиссией NOx в атмосферу РФ, млн. т.
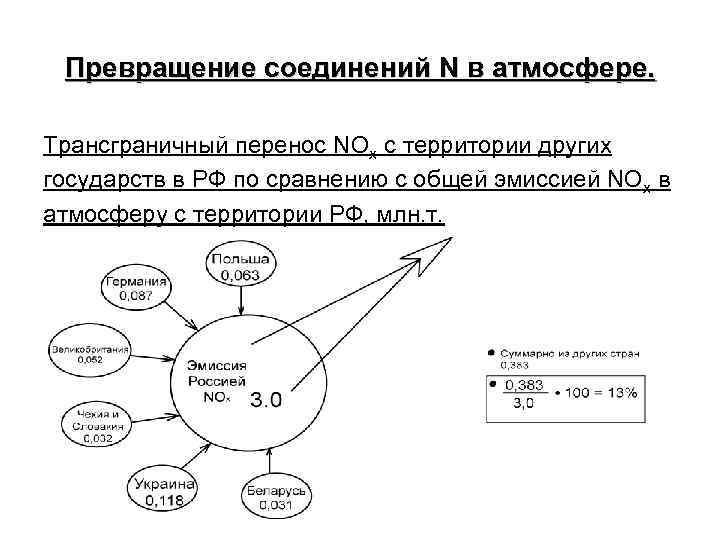 Превращение соединений N в атмосфере. Трансграничный перенос NOx c территории других государств в РФ по сравнению с общей эмиссией NOx в атмосферу с территории РФ, млн. т.
Превращение соединений N в атмосфере. Трансграничный перенос NOx c территории других государств в РФ по сравнению с общей эмиссией NOx в атмосферу с территории РФ, млн. т.


