11-As_Sb_Bi.ppt
- Количество слайдов: 13

As Sb Bi Основні закономірності зміни властивостей

N P As ns 2 np 3 nd 0 0 +3 Sb Bi (крім N) +5 rат. збільшується, стійкість найвищого ступеня окиснення зменшується
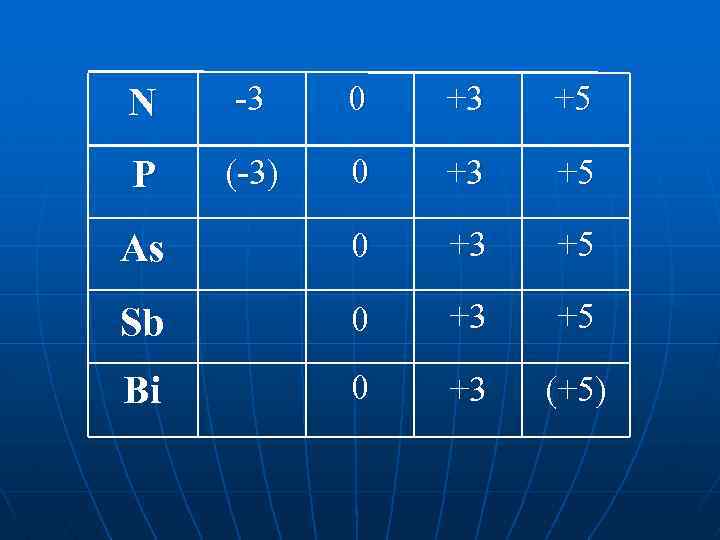
N -3 0 +3 +5 P (-3) 0 +3 +5 As 0 +3 +5 Sb 0 +3 +5 Bi 0 +3 (+5)

P + HNO 3 → H 3 PO 4 + As + HNO 3 → H 3 As. O 4 + Sb + HNO 3 → Sb 2 O 5 + Bi + HNO 3 → Bi(NO 3)3 + E + Mg → Mg 3 E 2 Bi з багатьма металами утворює сплави

NH 3 PH 3 N, P As, Sb, Bi As. H 3 Sb. H 3 Bi. H 3 Mg 3 E 2 + HOH → EH 3 + Mg 3 E 2 + HCl → EH 3 + збільшується довжина зв’язку зменшується енергія зв’язку послаблюються основні властивості зменшується стійкість

Взаємодія з кислотами : NH 3 + + H + → NH 4 : PH 3 + HCl : As. H 3 + + H охолодження → Починаючи з As. H 3 гідроген має більшу ЕН, на атомах відсутній негативний заряд

+3 N 2 O 3 HNO 2 P 2 O 3 H 3 PO 3 кислотні As 2 O 3 Sb 2 O 3 Bi 2 O 3 H 3 As. O 3 Sb(OH)3 Bi(OH)3 амфотерні переважно кислотні основні переважно основні Збільшується радіус атома Збільшується довжина і зменшується єнергія E-OH Основні властивості збільшуються Відновні властивості зменшуються

HNO 2, H 3 PO 3 – кислоти середньої сили H 3 As. O 3 – слабка Sb(OH)3 – амфотерний Sb(OH)3 + HCl → Sb(OH)3 + 3 Na. OH → Na 3[Sb(OH)6] Bi(OH)3 – основний

NCl 3 нітрид хлору PCl 3 As. Cl 3 галогеноангідриди Sb. Cl 3 сіль Bi. Cl 3 сіль
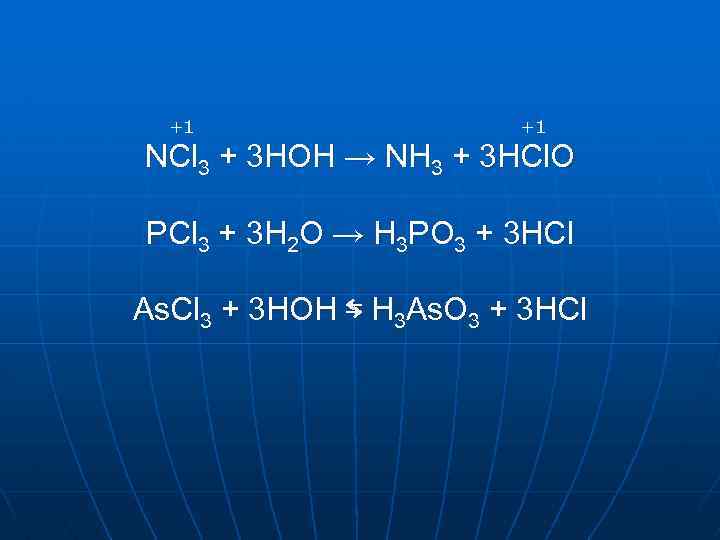
+1 +1 NCl 3 + 3 HOH → NH 3 + 3 HCl. O PCl 3 + 3 H 2 O → H 3 PO 3 + 3 HCl As. Cl 3 + 3 HOH ⇆ H 3 As. O 3 + 3 HCl

Sb. Cl 3 + HOH ⇆ Sb. OHCl 2 + HCl Sb. OHCl 2 + HOH ⇆ Sb(OH)2 Cl + HCl нестійка H 2 O + Sb. OCl↓ оксохлорид Sb(OH)2 Cl → Sb. OCl + H 2 O Bi. Cl 3 аналогічно

+5 P 2 O 5 As 2 O 5 sp 3 HNO 3 сильна кислота сильний окисник сер. сила N 2 O 5 Sb 2 O 5 (Bi 2 O 5) sp 3 d 2 кислота (HPO 3)n H 3 As. O 4 (Sb 2 O 5)x(H 2 O)y поганорозчинна не існує H 4 P 2 O 7 речовина H 3 PO 4 KBi. O 3 K[Sb(OH)6] Зменшення кислотних властивостей Збільшення окисних властивостей
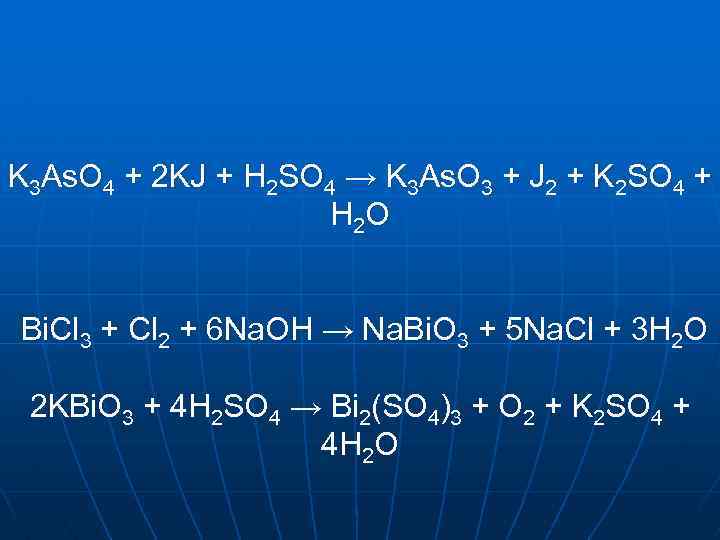
K 3 As. O 4 + 2 KJ + H 2 SO 4 → K 3 As. O 3 + J 2 + K 2 SO 4 + H 2 O Bi. Cl 3 + Cl 2 + 6 Na. OH → Na. Bi. O 3 + 5 Na. Cl + 3 H 2 O 2 KBi. O 3 + 4 H 2 SO 4 → Bi 2(SO 4)3 + O 2 + K 2 SO 4 + 4 H 2 O
11-As_Sb_Bi.ppt