арены.ppt
- Количество слайдов: 62

Ароматичность. Реакционная способность ароматических углеводородов.
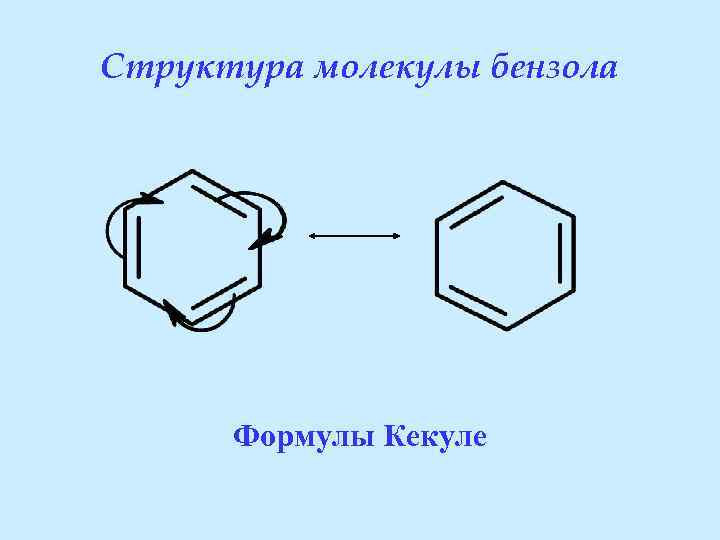
Структура молекулы бензола Формулы Кекуле
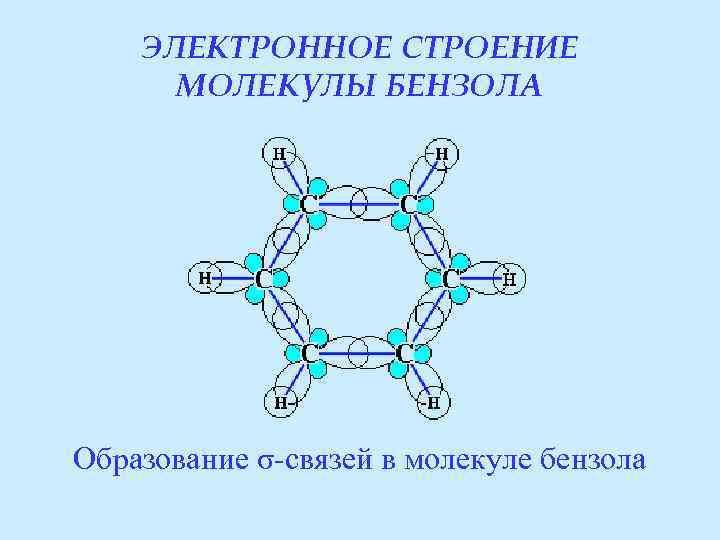
ЭЛЕКТРОННОЕ СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА Образование σ-связей в молекуле бензола
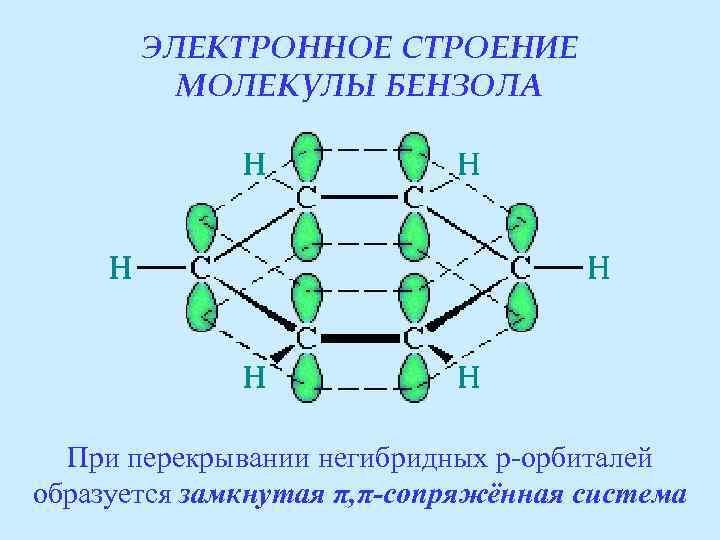
ЭЛЕКТРОННОЕ СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА При перекрывании негибридных p-орбиталей образуется замкнутая π, π-сопряжённая система

Образование общего электронного облака в молекуле бензола Взаимное перекрывание p-орбиталей Образование «электронного бублика» над и под плоскостью молекулы
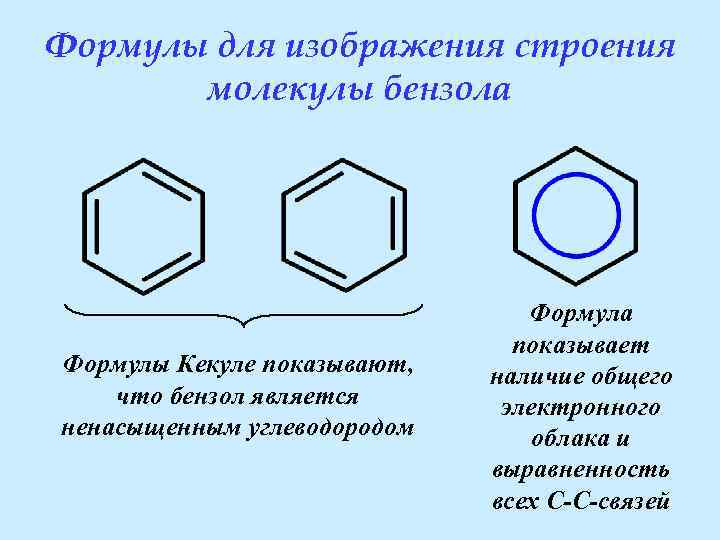
Формулы для изображения строения молекулы бензола Формулы Кекуле показывают, что бензол является ненасыщенным углеводородом Формула показывает наличие общего электронного облака и выравненность всех C-C-связей

Длины углерод-углеродных связей • C-C связь в алканах • C=C связь в алкенах … • С-С связь в аренах 0, 154 нм 0, 134 нм 0, 140 нм

АРОМАТИЧНОСТЬ – ЭТО СОВОКУПНОСТЬ СВОЙСТВ ЗАМКНУТЫХ СОПРЯЖЁННЫХ СИСТЕМ, ПРОЯВЛЯЮЩАЯСЯ В ИХ ВЫСОКОЙ УСТОЙЧИВОСТИ К РЕАКЦИЯМ ПРИСОЕДИНЕНИЯ И ОКИСЛЕНИЯ

Квантово-механические критерии ароматичности • Наличие плоского цикла (все атомы цикла должны быть sp 2 -гибридизованы) • Наличие замкнутой сопряжённой системы (все атомы должны участвовать в сопряжении) • Выполнение правила Хюккеля: число делокализованных электронов должно быть равно (4 n+2), где n – целое число.
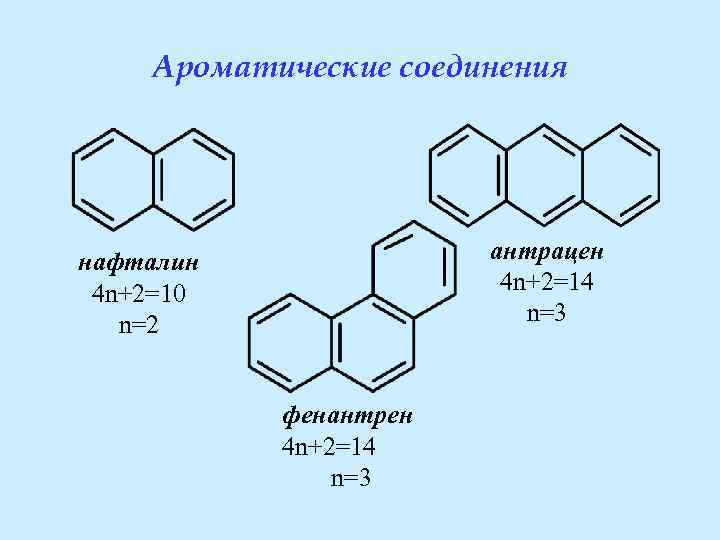
Ароматические соединения антрацен 4 n+2=14 n=3 нафталин 4 n+2=10 n=2 фенантрен 4 n+2=14 n=3

Химические свойства бензола

Для бензола характерны реакции электрофильного замещения (SE)
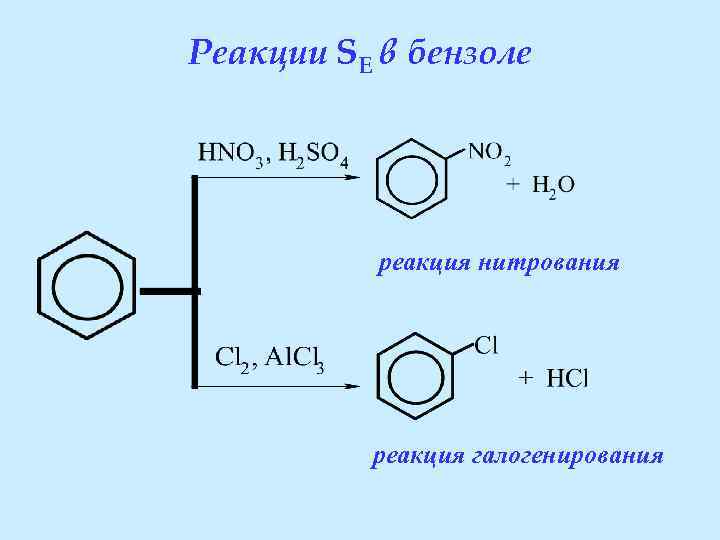
Реакции SE в бензоле реакция нитрования реакция галогенирования
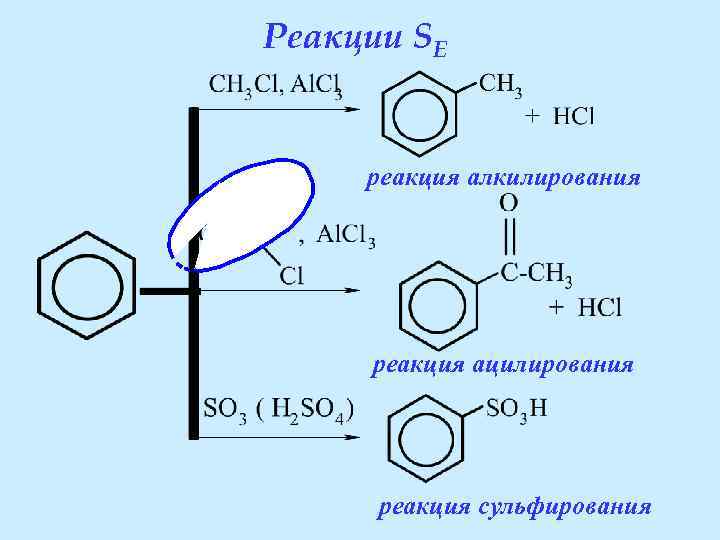
Реакции SE реакция алкилирования реакция ацилирования реакция сульфирования

Механизм реакций электрофильного замещения в бензоле
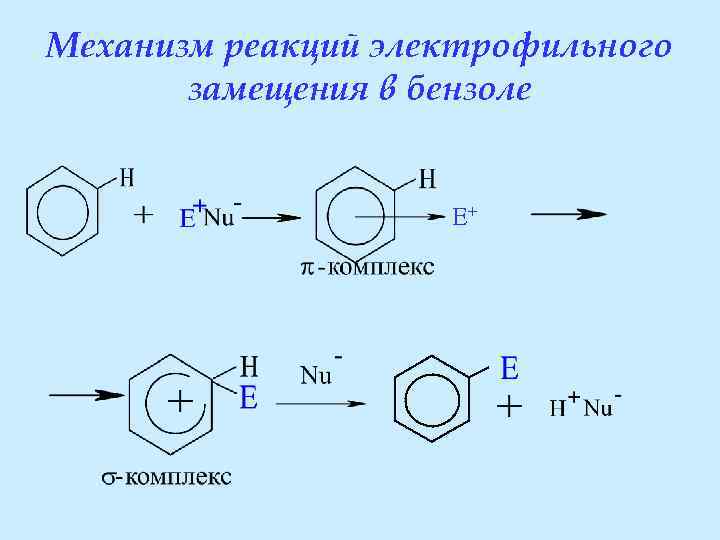
Механизм реакций электрофильного замещения в бензоле E+
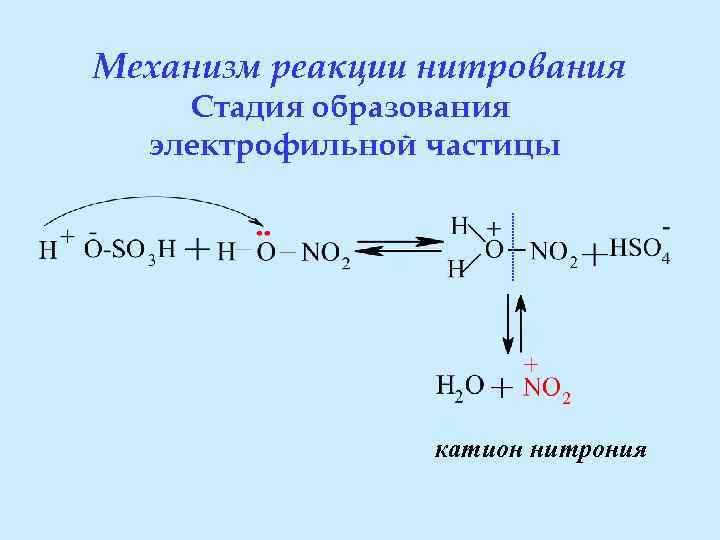
Механизм реакции нитрования Стадия образования электрофильной частицы катион нитрония

Роль концентрированной серной кислоты в реакции нитрования: • Является катализатором, принимая участие в образовании электрофильной частицы – катиона нитрония • Является водоотнимающим средством
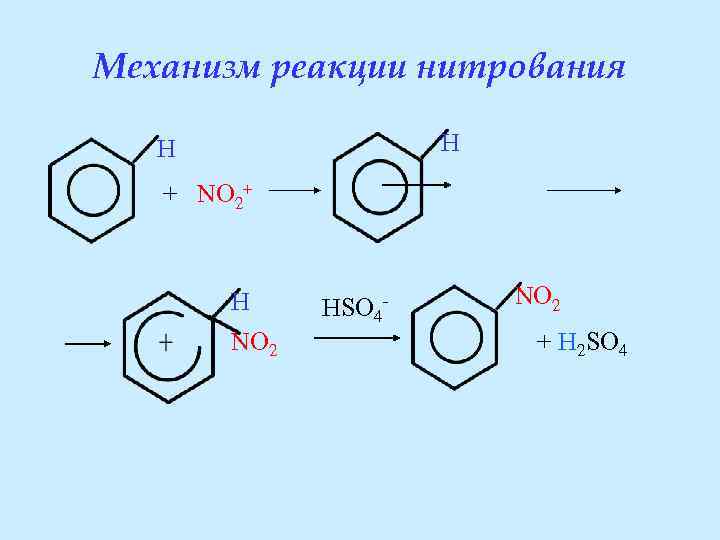
Механизм реакции нитрования H H + NO 2+ H NO 2 HSO 4 - NO 2 + H 2 SO 4

Механизм реакции галогенирования Катализаторами галогенирования являются кислоты Льюиса: Fe. Cl 3, Fe. Br 3, Al. Cl 3, Al. Br 3. Кислоты Льюиса – это нейтральные молекулы и ионы, способные принимать пару электронов.
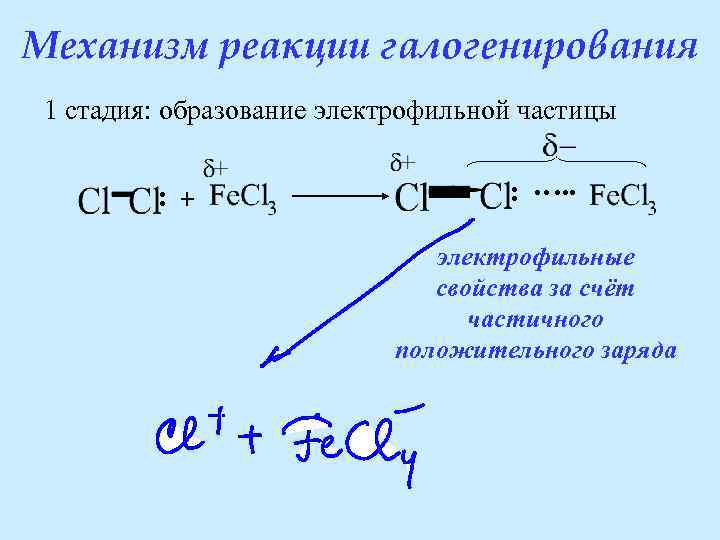
Механизм реакции галогенирования 1 стадия: образование электрофильной частицы : + : …. . электрофильные свойства за счёт частичного положительного заряда
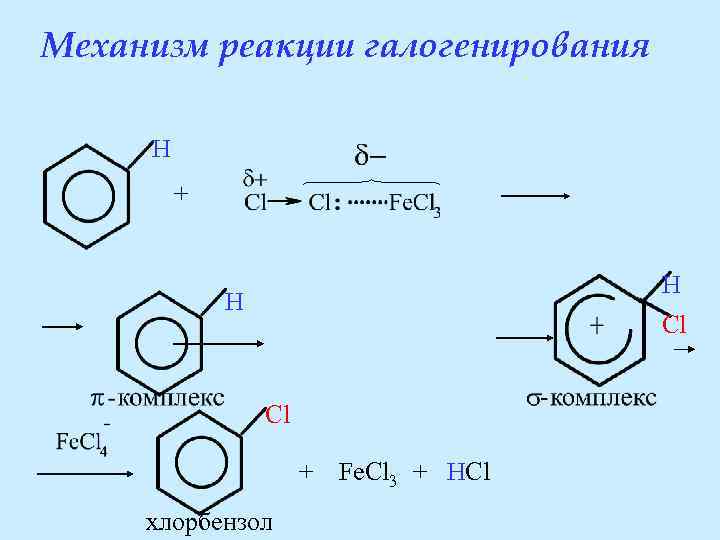
Механизм реакции галогенирования H + H H Cl Cl + Fe. Cl 3 + HCl хлорбензол

Механизм реакции алкилирования : + : …. . электрофильные свойства за счёт частичного положительного заряда
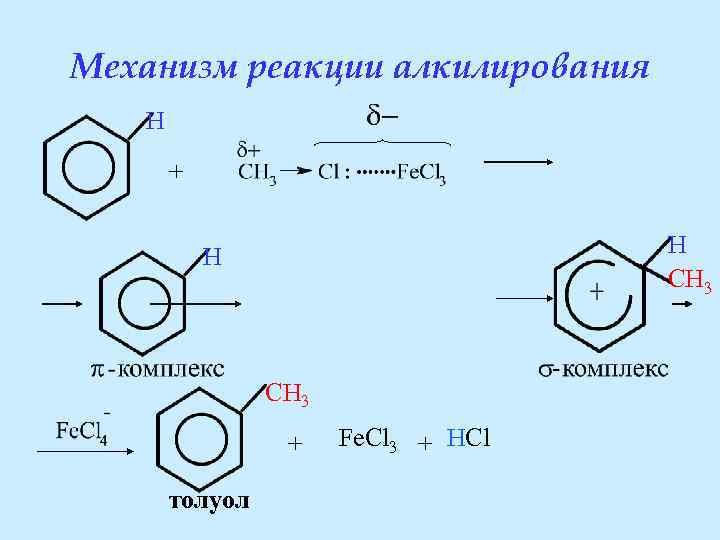
Механизм реакции алкилирования H + H CH 3 + толуол Fe. Cl 3 + HCl
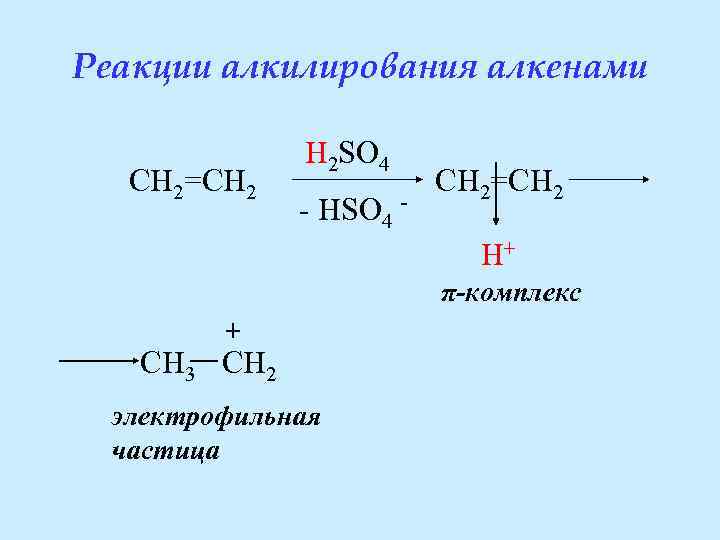
Реакции алкилирования алкенами CH 2=CH 2 H 2 SO 4 - HSO 4 - CH 2=CH 2 H+ π-комплекс + CH 3 CH 2 электрофильная частица

Механизм реакции ацилирования 1 стадия: образование электрофильной частицы ……… + + - [ R-C=O ] Al. Cl 4 ацилий катион

Механизм реакции сульфирования Молекула серного ангидрида является электрофилом из-за большого частичного положительного заряда на атоме серы

Механизм реакции сульфирования H H + SO 3 H H бензолсульфокислота
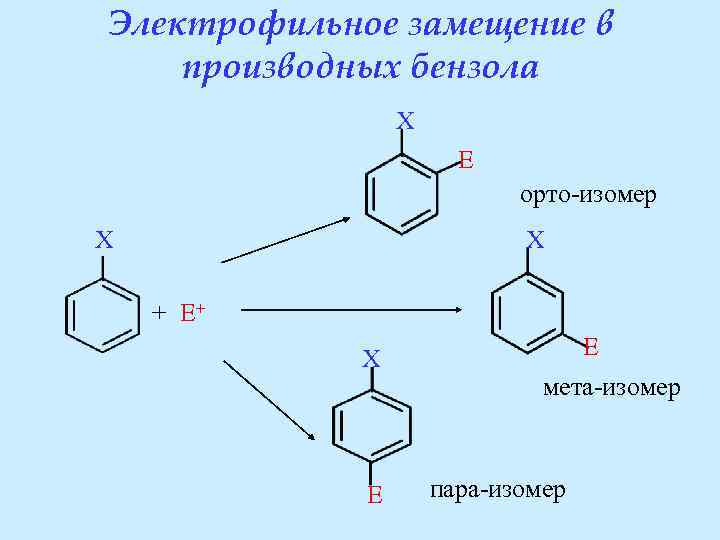
Электрофильное замещение в производных бензола X E орто-изомер X X + E+ X E E мета-изомер пара-изомер

Влияние заместителей на ход реакций электрофильного замещения • влияние на скорость реакции: электронодонорные заместители облегчают реакции, электроноакцепторные - затрудняют • влияние на положение введения второго заместителя

-I < +M +I содержат электронодонорные заместители -I -M -I > +M содержат электроноакцепторные заместители Убывание активности в реакциях SE

Относительные скорости реакций нитрования Фенол Толуол Бензол Хлорбензол Нитробензол 1000 24, 5 1, 0 0, 033 0, 000001

Заместители 1 рода (орто-, пара-ориентанты) -OH, -O-, -NH 2, -Alk (CH 3, C 2 H 5 и т. д. ) Облегчают реакции SE -F, -Cl, -Br, -I Затрудняют реакции SE

+ о-бромфенол п-бромфенол + HBr
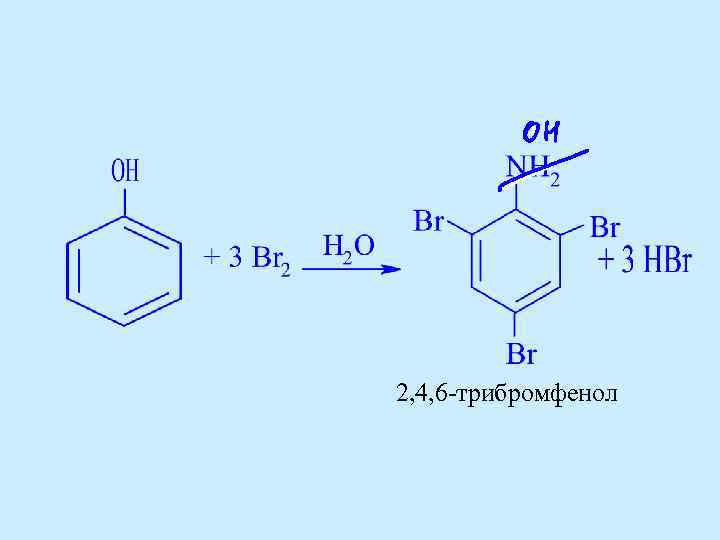
2, 4, 6 -трибромфенол

Заместители 2 рода мета-ориентанты -NH 3+, -COOH, -CHO, >C=O, -NO 2, -SO 3 H Затрудняют реакции SE

м-хлорбензойная кислота

Правила ориентации в дизамещенных аренах ** ** * согласованная ориентация * * * несогласованная ориентация

Реакции бензола с потерей ароматичности

Реакция гидрирования бензола циклогексан
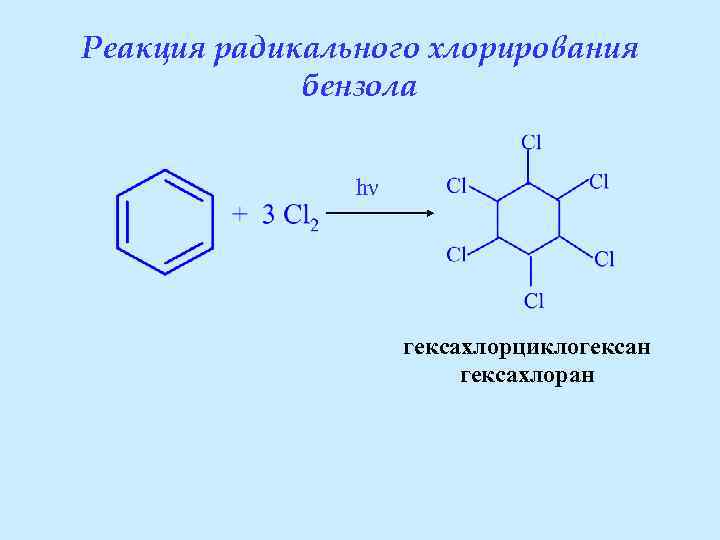
Реакция радикального хлорирования бензола hν гексахлорциклогексан гексахлоран
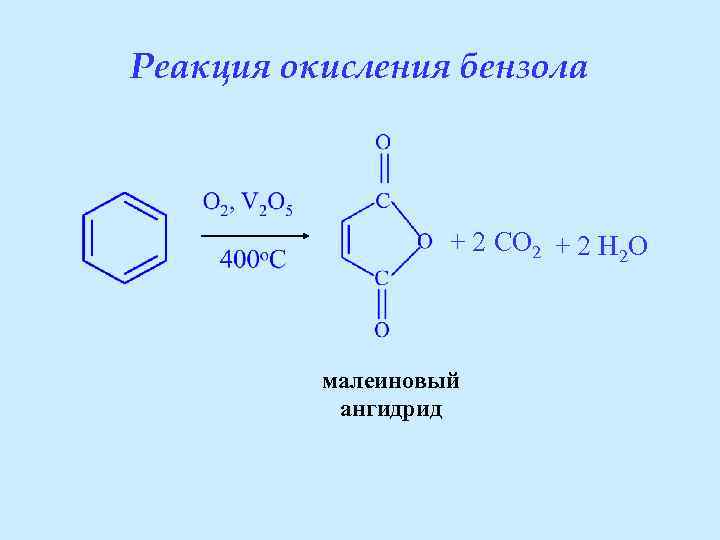
Реакция окисления бензола + 2 CO 2 + 2 H 2 O малеиновый ангидрид

Реакции алкилбензолов по боковой цепи
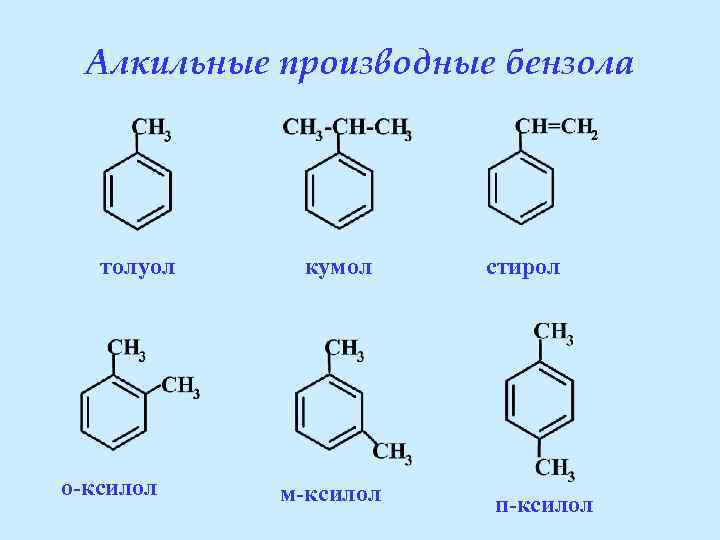
Алкильные производные бензола толуол o-ксилол кумол м-ксилол стирол п-ксилол

Реакция окисления боковой цепи толуол бензойная кислота
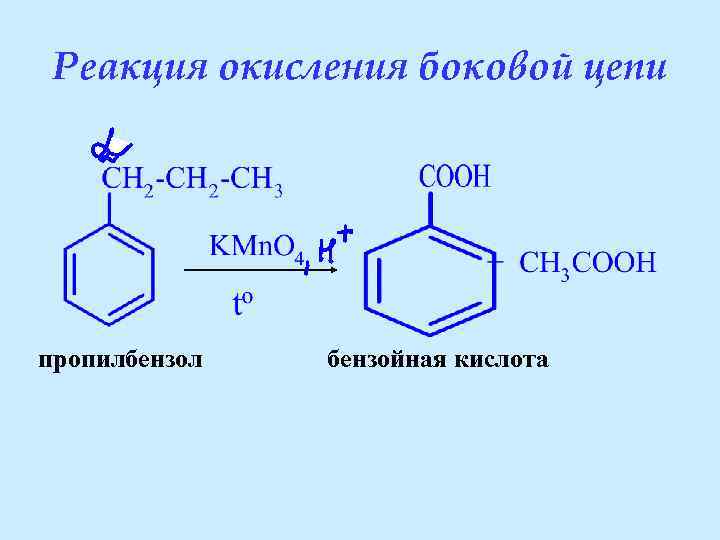
Реакция окисления боковой цепи пропилбензол бензойная кислота
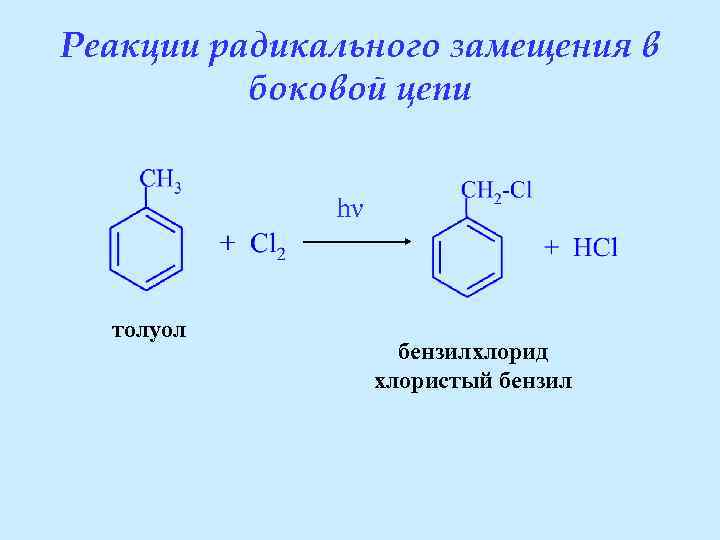
Реакции радикального замещения в боковой цепи hν толуол бензилхлорид хлористый бензил
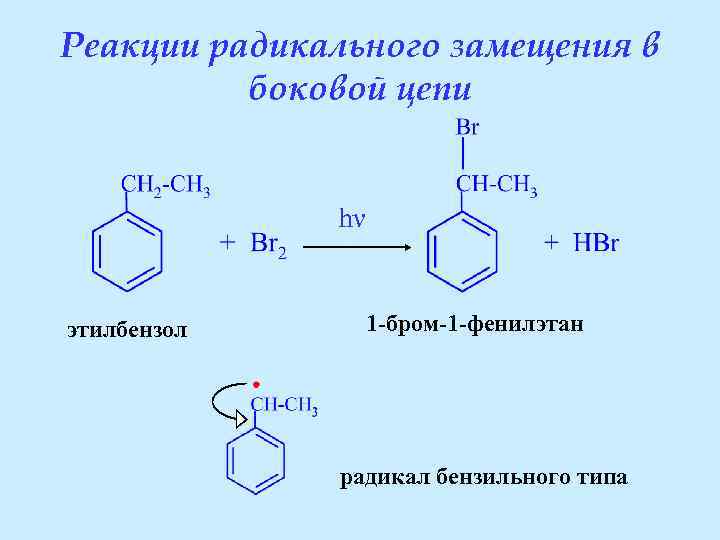
Реакции радикального замещения в боковой цепи hν этилбензол 1 -бром-1 -фенилэтан радикал бензильного типа

Химические свойства нафталина

-HBr α-бромнафталин

α-нафталинсульфокислота β-нафталинсульфокислота

Ориентация заместителей в реакциях электрофильного замещения в нафталине

Ориентация заместителей в реакциях электрофильного замещения в нафталине

Реакции нафталина с потерей ароматичности

Реакции гидрирования нафталина спирт, Na нафталин тетралин декалин
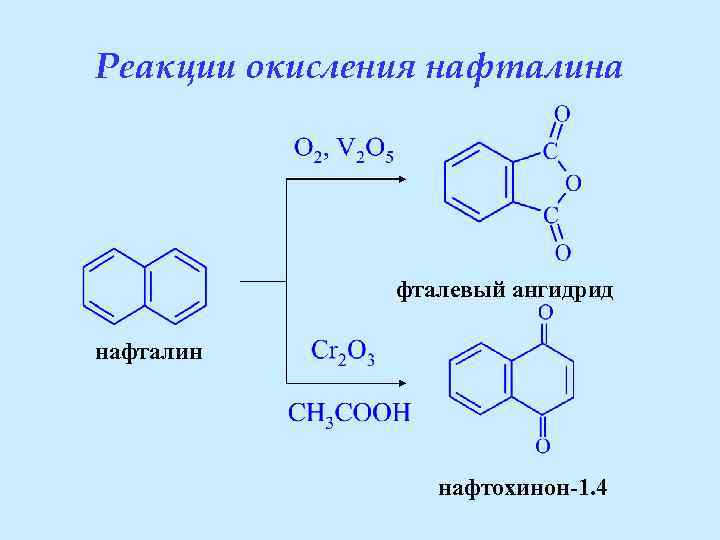
Реакции окисления нафталина фталевый ангидрид нафталин нафтохинон-1. 4

Химические свойства антрацена и фенантрена

Реакции электрофильного замещения антрацен 9 -бромантрацен to 9, 10 -дибром 9, 10 -дигидроантрацен

Реакции электрофильного замещения фенантрен 9 -бромфенантрен
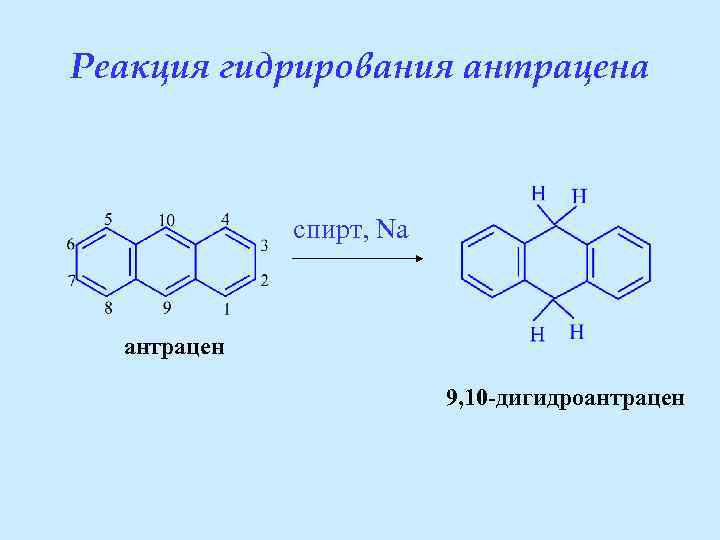
Реакция гидрирования антрацена спирт, Na антрацен 9, 10 -дигидроантрацен
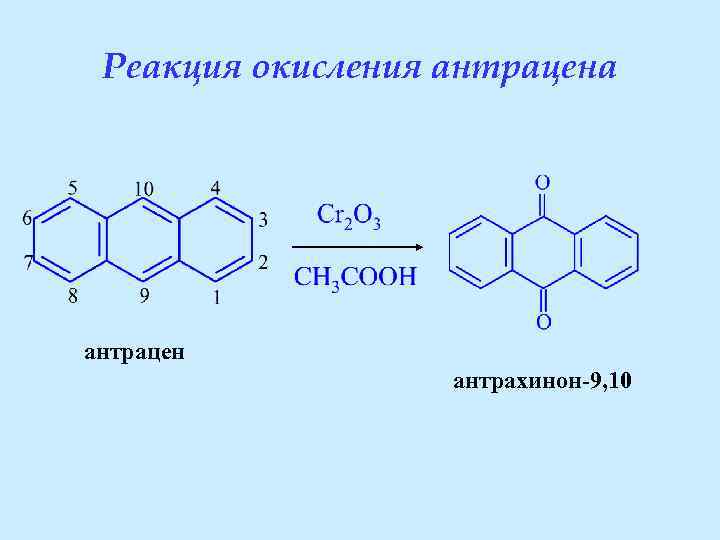
Реакция окисления антрацена антрацен антрахинон-9, 10

Производные антрахинона-9, 10 ализарин франгулоэмодин
арены.ppt