АРОМАТИЧНІ АМІНИ — сполуки, в молекулах яких міститься





ar-nhr-11.ppt
- Количество слайдов: 8
 АРОМАТИЧНІ АМІНИ - сполуки, в молекулах яких міститься аміногрупа, безпосередньо сполучена з атомом Карбону ароматичного ядра. Ароматичні аміни - похідні амоніаку. За кількістю заміщених атомів Гідрогену в молекулі амоніаку їх поділяють на первинні (Ar–NH2), вторинні (Аr–NH–Ar) і третинні (Ar3N, де Ar – ароматичний радикал, наприклад C6H5– -феніл, о-, м-, п-СН3–C6H4– -о-, м-, п-толіл і т. д.). Найпростішим первинним ароматичним аміном є анілін C6H5–NH2, вторинним – дифеніламін (C6H5)2NH, третинним – трифеніламін (C6H5)3N. Жирно-ароматичні аміни - метиланілін C6H5–NH–CH3, диметиланілін C6H5–N(CH3)2. Крім того, відомі аміни з аміногрупою в бічному ланцюгу, наприклад бензиламін C6H5–CH2–NH2. Номенклатура. За систематичною номенклатурою назви ариламінів утворюють від слова „анілін” (традиційна назва). Нумерацію атомів Карбону в ядрі починають з атома С, сполученого з NRR1. Для жирно-ароматичних амінів перелік алкільних замісників у назві здійснюють за алфавітом, наприклад, 3-етил-5-метиланілін (І). Назви ароматичних ді- та триамінів утворюють від слова „бензен” шляхом додавання суфікса –амін з відповідними множними префіксами за принципом найменших локантів, наприклад бензен-1,3-діамін (ІІ), 4-етил-5-метилбензен-1,2-діамін (ІІІ), або 3-метил-6-пропілбензен-1,2,4-триамін (IV): За IUPAC (1993 р.) анілін може мати назви фенілазан і феніламін, (С6Н5)2NH - дифеніламін або дифенілазан, (С6Н5)3N – трифеніламін або трифенілазан. Тривіальні назви - анілін, о-, м-, і п-толуїдини тощо). Ізомерія - структурна (орто-, мета- і пара-ізомери), положення аміногрупи в ядрі або в бічному ланцюгу, положення алкільного радикала в ядрі N:
АРОМАТИЧНІ АМІНИ - сполуки, в молекулах яких міститься аміногрупа, безпосередньо сполучена з атомом Карбону ароматичного ядра. Ароматичні аміни - похідні амоніаку. За кількістю заміщених атомів Гідрогену в молекулі амоніаку їх поділяють на первинні (Ar–NH2), вторинні (Аr–NH–Ar) і третинні (Ar3N, де Ar – ароматичний радикал, наприклад C6H5– -феніл, о-, м-, п-СН3–C6H4– -о-, м-, п-толіл і т. д.). Найпростішим первинним ароматичним аміном є анілін C6H5–NH2, вторинним – дифеніламін (C6H5)2NH, третинним – трифеніламін (C6H5)3N. Жирно-ароматичні аміни - метиланілін C6H5–NH–CH3, диметиланілін C6H5–N(CH3)2. Крім того, відомі аміни з аміногрупою в бічному ланцюгу, наприклад бензиламін C6H5–CH2–NH2. Номенклатура. За систематичною номенклатурою назви ариламінів утворюють від слова „анілін” (традиційна назва). Нумерацію атомів Карбону в ядрі починають з атома С, сполученого з NRR1. Для жирно-ароматичних амінів перелік алкільних замісників у назві здійснюють за алфавітом, наприклад, 3-етил-5-метиланілін (І). Назви ароматичних ді- та триамінів утворюють від слова „бензен” шляхом додавання суфікса –амін з відповідними множними префіксами за принципом найменших локантів, наприклад бензен-1,3-діамін (ІІ), 4-етил-5-метилбензен-1,2-діамін (ІІІ), або 3-метил-6-пропілбензен-1,2,4-триамін (IV): За IUPAC (1993 р.) анілін може мати назви фенілазан і феніламін, (С6Н5)2NH - дифеніламін або дифенілазан, (С6Н5)3N – трифеніламін або трифенілазан. Тривіальні назви - анілін, о-, м-, і п-толуїдини тощо). Ізомерія - структурна (орто-, мета- і пара-ізомери), положення аміногрупи в ядрі або в бічному ланцюгу, положення алкільного радикала в ядрі N:
 Методи добування. 1. Відновленням ароматичних нітросполук сульфідом амонію (M.M. Зінін, 1842 р.): C6H5–NO2 + 3(NH4)2S → C6H5–NH2 + 2H2O + 6NH3 +3S. Відновлення ароматичних нітросполук можна здійснювати і залізом (стружками або ошурками) в хлоридній кислоті за наступною схемою: 2. Амонолізом галогенопохідних аренів (O.M. Енгельгардт, П.O. Лачинов, 1870 р.). У сучасних промислових установках реакцію ведуть з надлишком амоніаку, за Т 180–200 °С Р до 1 МПа і за наявності мідних каталізаторів: Орто- і пара-нітрохлорбензени взаємодіють з амоніаком значно легше, ніж хлорбензен, оскільки нітрогрупа підвищує реакційну здатність атома хлору. Фізичні властивості. Ариламіни – рідини або тверді речовини з характерним неприємним запахом, мало розчинні у воді. Ариламіни мають сильну фізіологічну дію на організм людини – є дуже отруйними. Електронна будова молекули аніліну. Середнє значення валентного кута атома Нітрогену досягає 120° (перебуває в sp2-гібридизованому стані. Тому аміногрупа в молекулі ароматичних амінів набуває плоскої конфігурації. Атом Нітрогену в молекулі аніліну дві свої sp2-орбіталі використовує на утворення двох σ-зв’язків з s-орбіталями двох атомів Гідрогену, а третю sp2-орбіталь – на утворення σ-зв’язку з sp2-гібридизованим атомом Карбону бензенового ядра. Четверта sp2-орбіталь амінного Нітрогену зайнята вільною парою електронів.
Методи добування. 1. Відновленням ароматичних нітросполук сульфідом амонію (M.M. Зінін, 1842 р.): C6H5–NO2 + 3(NH4)2S → C6H5–NH2 + 2H2O + 6NH3 +3S. Відновлення ароматичних нітросполук можна здійснювати і залізом (стружками або ошурками) в хлоридній кислоті за наступною схемою: 2. Амонолізом галогенопохідних аренів (O.M. Енгельгардт, П.O. Лачинов, 1870 р.). У сучасних промислових установках реакцію ведуть з надлишком амоніаку, за Т 180–200 °С Р до 1 МПа і за наявності мідних каталізаторів: Орто- і пара-нітрохлорбензени взаємодіють з амоніаком значно легше, ніж хлорбензен, оскільки нітрогрупа підвищує реакційну здатність атома хлору. Фізичні властивості. Ариламіни – рідини або тверді речовини з характерним неприємним запахом, мало розчинні у воді. Ариламіни мають сильну фізіологічну дію на організм людини – є дуже отруйними. Електронна будова молекули аніліну. Середнє значення валентного кута атома Нітрогену досягає 120° (перебуває в sp2-гібридизованому стані. Тому аміногрупа в молекулі ароматичних амінів набуває плоскої конфігурації. Атом Нітрогену в молекулі аніліну дві свої sp2-орбіталі використовує на утворення двох σ-зв’язків з s-орбіталями двох атомів Гідрогену, а третю sp2-орбіталь – на утворення σ-зв’язку з sp2-гібридизованим атомом Карбону бензенового ядра. Четверта sp2-орбіталь амінного Нітрогену зайнята вільною парою електронів.
 У молекулі аніліну аміногрупа впливає на Ar ядро, а воно – на аміногрупу у вигляді двох електронних ефектів: аміногрупа виявляє –I-ефект і +М-ефект, який значно сильніший від її –I-ефекту. У зв’язку із спряженням електронна густина на атомі Нітрогену в молекулі ароматичних амінів зменшується. Хімічні властивості. Реакції за участі аміногрупи. 1. Кислотно-основні властивості. Ароматичні аміни виявляють основні властивості, оскільки в них на атомі Нітрогену аміногрупи є вільна пара електронів. За основністю ароматичні аміни можна розмістити в наступний ряд: NH3 > C6H5–N(Alk)2 > C6H5–NHAlk > C6H5–NH2 > (C6H5) 2NH > (C6H5)3N. Отже, чим більше атомів Гідрогену у молекулі амоніаку заміщено на бензенові ядра, тим нижча основність такого ароматичного аміну. Основні властивості ароматичних амінів виявляються в реакціях з сильними кислотами, з якими вони утворюють солі. Так, анілін з хлоридною кислотою утворює легко розчинну у воді сіль – анілінгідрогенхлорид: Внаслідок цього зменшується здатність N приєднувати протони і основні властивості ариламінів порівняно з NH3 значно послаблюються, але за рахунок +M-ефекту аміногрупи підвищується електронна густина Ar ядра ариламінів в орто- і пара-положеннях і підвищується його активність до реакцій електрофільного заміщення. Солі ароматичних амінів легко гідролізуються водою. Тому їх водні розчини мають кислу реакцію: Зі слабкими кислотами ароматичні аміни солей не утворюють, що свідчить про послаблення основних властивостей ароматичних амінів порівняно з амоніаком.
У молекулі аніліну аміногрупа впливає на Ar ядро, а воно – на аміногрупу у вигляді двох електронних ефектів: аміногрупа виявляє –I-ефект і +М-ефект, який значно сильніший від її –I-ефекту. У зв’язку із спряженням електронна густина на атомі Нітрогену в молекулі ароматичних амінів зменшується. Хімічні властивості. Реакції за участі аміногрупи. 1. Кислотно-основні властивості. Ароматичні аміни виявляють основні властивості, оскільки в них на атомі Нітрогену аміногрупи є вільна пара електронів. За основністю ароматичні аміни можна розмістити в наступний ряд: NH3 > C6H5–N(Alk)2 > C6H5–NHAlk > C6H5–NH2 > (C6H5) 2NH > (C6H5)3N. Отже, чим більше атомів Гідрогену у молекулі амоніаку заміщено на бензенові ядра, тим нижча основність такого ароматичного аміну. Основні властивості ароматичних амінів виявляються в реакціях з сильними кислотами, з якими вони утворюють солі. Так, анілін з хлоридною кислотою утворює легко розчинну у воді сіль – анілінгідрогенхлорид: Внаслідок цього зменшується здатність N приєднувати протони і основні властивості ариламінів порівняно з NH3 значно послаблюються, але за рахунок +M-ефекту аміногрупи підвищується електронна густина Ar ядра ариламінів в орто- і пара-положеннях і підвищується його активність до реакцій електрофільного заміщення. Солі ароматичних амінів легко гідролізуються водою. Тому їх водні розчини мають кислу реакцію: Зі слабкими кислотами ароматичні аміни солей не утворюють, що свідчить про послаблення основних властивостей ароматичних амінів порівняно з амоніаком.
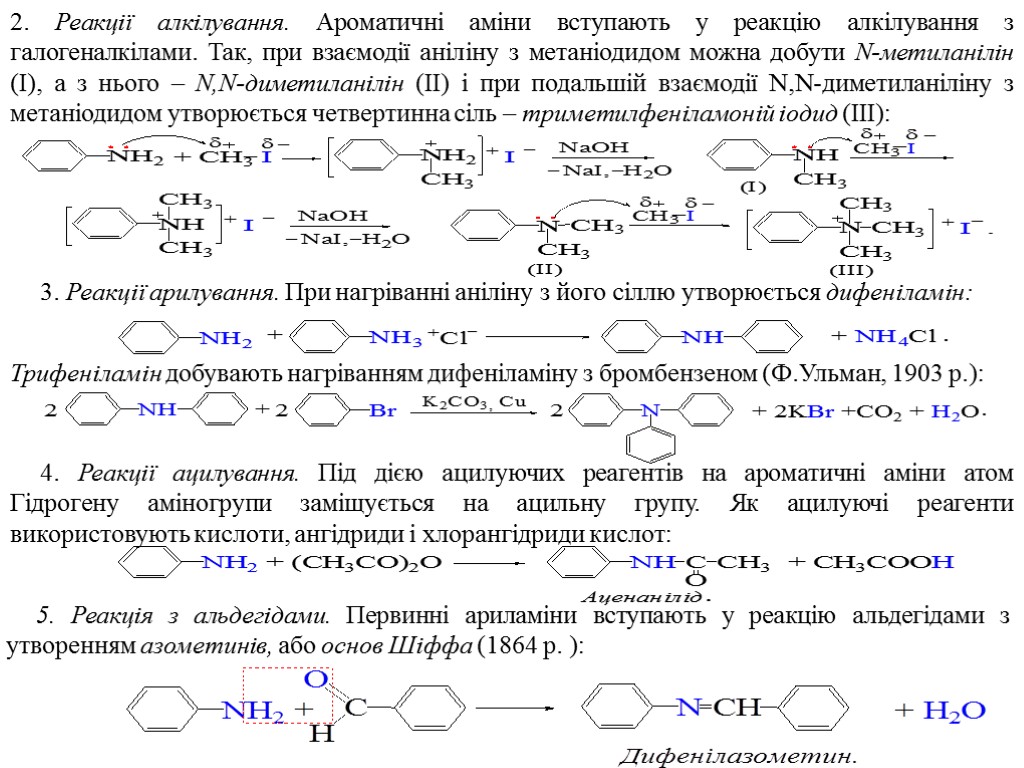
 2. Реакції алкілування. Ароматичні аміни вступають у реакцію алкілування з галогеналкілами. Так, при взаємодії аніліну з метаніодидом можна добути N-метиланілін (І), а з нього – Ν,Ν-диметиланілін (ІІ) і при подальшій взаємодії N,N-диметиланіліну з метаніодидом утворюється четвертинна сіль – триметилфеніламоній іодид (ІІІ): 3. Реакції арилування. При нагріванні аніліну з його сіллю утворюється дифеніламін: Трифеніламін добувають нагріванням дифеніламіну з бромбензеном (Ф.Ульман, 1903 р.): 4. Реакції ацилування. Під дією ацилуючих реагентів на ароматичні аміни атом Гідрогену аміногрупи заміщується на ацильну групу. Як ацилуючі реагенти використовують кислоти, ангідриди і хлорангідриди кислот: 5. Реакція з альдегідами. Первинні ариламіни вступають у реакцію альдегідами з утворенням азометинів, або основ Шіффа (1864 p. ):
2. Реакції алкілування. Ароматичні аміни вступають у реакцію алкілування з галогеналкілами. Так, при взаємодії аніліну з метаніодидом можна добути N-метиланілін (І), а з нього – Ν,Ν-диметиланілін (ІІ) і при подальшій взаємодії N,N-диметиланіліну з метаніодидом утворюється четвертинна сіль – триметилфеніламоній іодид (ІІІ): 3. Реакції арилування. При нагріванні аніліну з його сіллю утворюється дифеніламін: Трифеніламін добувають нагріванням дифеніламіну з бромбензеном (Ф.Ульман, 1903 р.): 4. Реакції ацилування. Під дією ацилуючих реагентів на ароматичні аміни атом Гідрогену аміногрупи заміщується на ацильну групу. Як ацилуючі реагенти використовують кислоти, ангідриди і хлорангідриди кислот: 5. Реакція з альдегідами. Первинні ариламіни вступають у реакцію альдегідами з утворенням азометинів, або основ Шіффа (1864 p. ):
 6. Взаємодія ароматичних амінів з нітритною кислотою з утворенням солей діазонію: Вторинні ароматичні і жирно-ароматичні аміни з нітритною кислотою утворюють N-нітрозаміни: Третинні ариламіни утворюють ароматичні нітрозопохідні в пара- або орто-положенні до аміногрупи: Реакції за участі бензенового ядра. Оскільки NH2-група виявляє сильний +M-ефект, то SE–реакції (галогенування, нітрування і сульфування) відбуваються набагато легше, ніж у бензену, і проходить в орто- і пара-положеннях відносно аміногрупи. 1. Галогенування. Анілін дуже легко вступає в реакцію з бромною водою і утворює важкорозчинний 2,4,6-триброманілін (якісна проба на анілін). Для одержання моноброманіліну, аміногрупу ацетилують, а потім бромують ацетанілід. Після гідролізу ацетамідної групи в пара-бромацетаніліді одержують пара-броманілін: Хлорують ацильні похідні, а хлорацетаніліди гідролізом перетворюють на орто- і пара-хлораніліни:
6. Взаємодія ароматичних амінів з нітритною кислотою з утворенням солей діазонію: Вторинні ароматичні і жирно-ароматичні аміни з нітритною кислотою утворюють N-нітрозаміни: Третинні ариламіни утворюють ароматичні нітрозопохідні в пара- або орто-положенні до аміногрупи: Реакції за участі бензенового ядра. Оскільки NH2-група виявляє сильний +M-ефект, то SE–реакції (галогенування, нітрування і сульфування) відбуваються набагато легше, ніж у бензену, і проходить в орто- і пара-положеннях відносно аміногрупи. 1. Галогенування. Анілін дуже легко вступає в реакцію з бромною водою і утворює важкорозчинний 2,4,6-триброманілін (якісна проба на анілін). Для одержання моноброманіліну, аміногрупу ацетилують, а потім бромують ацетанілід. Після гідролізу ацетамідної групи в пара-бромацетаніліді одержують пара-броманілін: Хлорують ацильні похідні, а хлорацетаніліди гідролізом перетворюють на орто- і пара-хлораніліни:
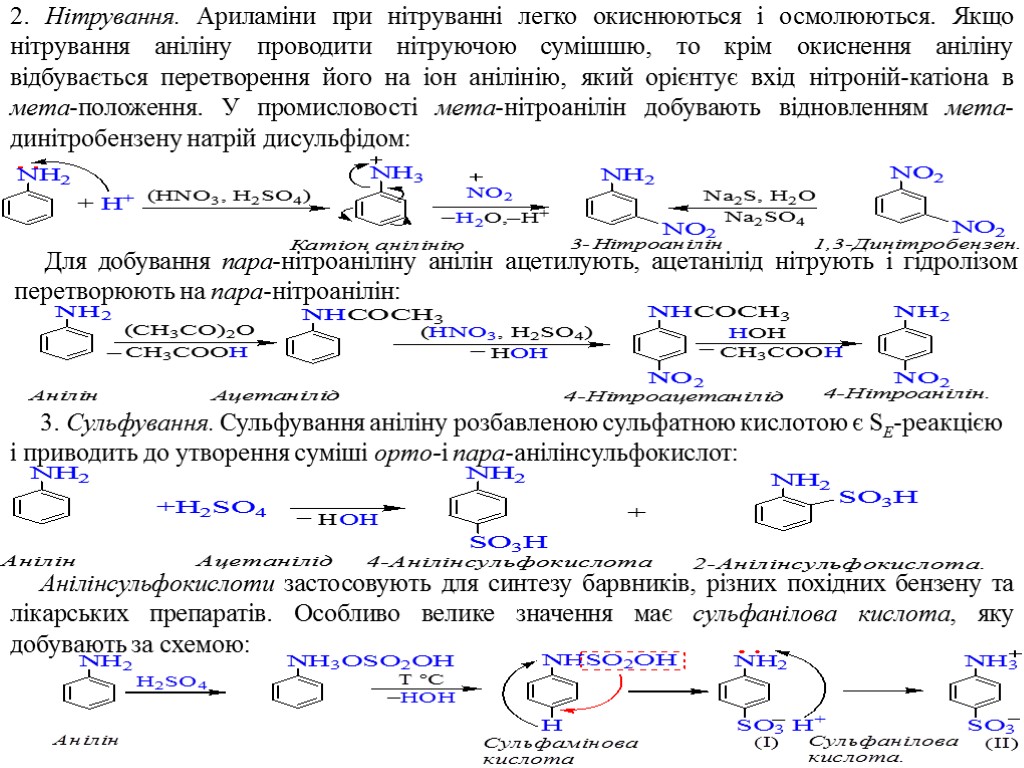
 2. Нітрування. Ариламіни при нітруванні легко окиснюються і осмолюються. Якщо нітрування аніліну проводити нітруючою сумішшю, то крім окиснення аніліну відбувається перетворення його на іон анілінію, який орієнтує вхід нітроній-катіона в мета-положення. У промисловості мета-нітроанілін добувають відновленням мета-динітробензену натрій дисульфідом: Для добування пара-нітроаніліну анілін ацетилують, ацетанілід нітрують і гідролізом перетворюють на пара-нітроанілін: 3. Сульфування. Сульфування аніліну розбавленою сульфатною кислотою є SE-реакцією і приводить до утворення суміші орто-і пара-анілінсульфокислот: Анілінсульфокислоти застосовують для синтезу барвників, різних похідних бензену та лікарських препаратів. Особливо велике значення має сульфанілова кислота, яку добувають за схемою:
2. Нітрування. Ариламіни при нітруванні легко окиснюються і осмолюються. Якщо нітрування аніліну проводити нітруючою сумішшю, то крім окиснення аніліну відбувається перетворення його на іон анілінію, який орієнтує вхід нітроній-катіона в мета-положення. У промисловості мета-нітроанілін добувають відновленням мета-динітробензену натрій дисульфідом: Для добування пара-нітроаніліну анілін ацетилують, ацетанілід нітрують і гідролізом перетворюють на пара-нітроанілін: 3. Сульфування. Сульфування аніліну розбавленою сульфатною кислотою є SE-реакцією і приводить до утворення суміші орто-і пара-анілінсульфокислот: Анілінсульфокислоти застосовують для синтезу барвників, різних похідних бензену та лікарських препаратів. Особливо велике значення має сульфанілова кислота, яку добувають за схемою:
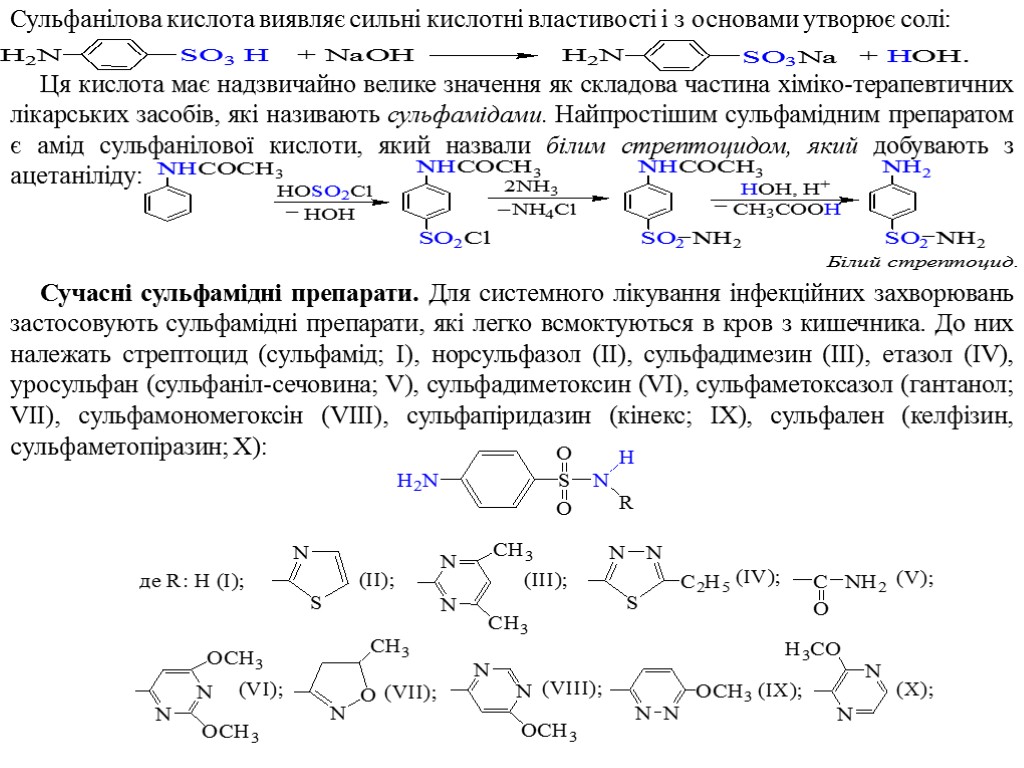
 Сульфанілова кислота виявляє сильні кислотні властивості і з основами утворює солі: Ця кислота має надзвичайно велике значення як складова частина хіміко-терапевтичних лікарських засобів, які називають сульфамідами. Найпростішим сульфамідним препаратом є амід сульфанілової кислоти, який назвали білим стрептоцидом, який добувають з ацетаніліду: Сучасні сульфамідні препарати. Для системного лікування інфекційних захворювань застосовують сульфамідні препарати, які легко всмоктуються в кров з кишечника. До них належать стрептоцид (сульфамід; I), норсульфазол (II), сульфадимезин (III), етазол (IV), уросульфан (сульфаніл-сечовина; V), сульфадиметоксин (VI), сульфаметоксазол (гантанол; VII), сульфамономегоксін (VIII), сульфапіридазин (кінекс; IX), сульфален (келфізин, сульфаметопіразин; X):
Сульфанілова кислота виявляє сильні кислотні властивості і з основами утворює солі: Ця кислота має надзвичайно велике значення як складова частина хіміко-терапевтичних лікарських засобів, які називають сульфамідами. Найпростішим сульфамідним препаратом є амід сульфанілової кислоти, який назвали білим стрептоцидом, який добувають з ацетаніліду: Сучасні сульфамідні препарати. Для системного лікування інфекційних захворювань застосовують сульфамідні препарати, які легко всмоктуються в кров з кишечника. До них належать стрептоцид (сульфамід; I), норсульфазол (II), сульфадимезин (III), етазол (IV), уросульфан (сульфаніл-сечовина; V), сульфадиметоксин (VI), сульфаметоксазол (гантанол; VII), сульфамономегоксін (VIII), сульфапіридазин (кінекс; IX), сульфален (келфізин, сульфаметопіразин; X):
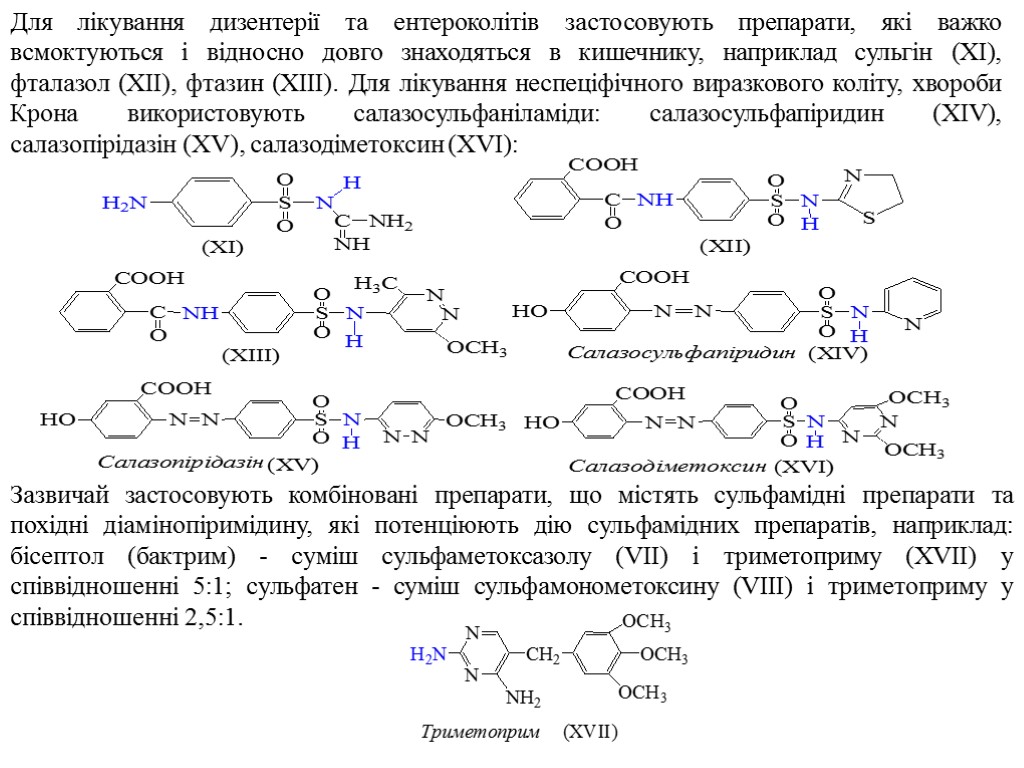
 Для лікування дизентерії та ентероколітів застосовують препарати, які важко всмоктуються і відносно довго знаходяться в кишечнику, наприклад сульгін (XI), фталазол (XII), фтазин (XIII). Для лікування неспеціфічного виразкового коліту, хвороби Крона використовують салазосульфаніламіди: салазосульфапіридин (XIV), салазопірідазін (XV), салазодіметоксин (XVI): Зазвичай застосовують комбіновані препарати, що містять сульфамідні препарати та похідні діамінопіримідину, які потенціюють дію сульфамідних препаратів, наприклад: бісептол (бактрим) - суміш сульфаметоксазолу (VII) і триметоприму (XVII) у співвідношенні 5:1; сульфатен - суміш сульфамонометоксину (VIII) і триметоприму у співвідношенні 2,5:1.
Для лікування дизентерії та ентероколітів застосовують препарати, які важко всмоктуються і відносно довго знаходяться в кишечнику, наприклад сульгін (XI), фталазол (XII), фтазин (XIII). Для лікування неспеціфічного виразкового коліту, хвороби Крона використовують салазосульфаніламіди: салазосульфапіридин (XIV), салазопірідазін (XV), салазодіметоксин (XVI): Зазвичай застосовують комбіновані препарати, що містять сульфамідні препарати та похідні діамінопіримідину, які потенціюють дію сульфамідних препаратів, наприклад: бісептол (бактрим) - суміш сульфаметоксазолу (VII) і триметоприму (XVII) у співвідношенні 5:1; сульфатен - суміш сульфамонометоксину (VIII) і триметоприму у співвідношенні 2,5:1.

