7-Арены.ppt
- Количество слайдов: 17

АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ Общая формула Сn. H 2 n-6 Арены (ароматические углеводороды) – это углеводороды, в молекулах которых содержится специфическая группировка, называемая бензольным кольцом и состоящая из 6 атомов углерода и 6 атомов водорода С 6 Н 6. Простейший представитель этого ряда – бензол С 6 Н 6, открыт Фарадеем в 19 веке (1825 г), в 1865 г немецкий химик Ф. Кекуле предложил циклическую формулу.
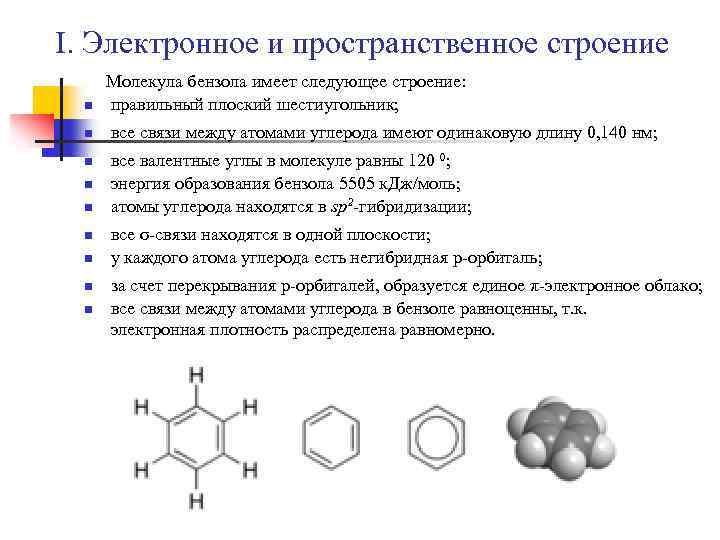
I. Электронное и пространственное строение n n n n n Молекула бензола имеет следующее строение: правильный плоский шестиугольник; все связи между атомами углерода имеют одинаковую длину 0, 140 нм; все валентные углы в молекуле равны 120 0; энергия образования бензола 5505 к. Дж/моль; атомы углерода находятся в sp 2 -гибридизации; все σ-связи находятся в одной плоскости; у каждого атома углерода есть негибридная p-орбиталь; за счет перекрывания р-орбиталей, образуется единое π-электронное облако; все связи между атомами углерода в бензоле равноценны, т. к. электронная плотность распределена равномерно.

II. Номенклатура и изомерия Бензол С 6 Н 6 – родоначальник гомологического ряда, его гомологи - это производные бензола образованные путем замещения водородных атомов на радикалы. Систематическое название: 1. Названия углеводородов составляют из названий радикалов боковой цепи с добавлением слова «бензол» . 2. Нумеруют бензольный цикл таким образом, чтобы радикалы получили наименьшие номера. 3. Радикалы перечисляются в алфавитном порядке. 2 3 4 1 1 -бром-2 -метил-4 -пропилбензол
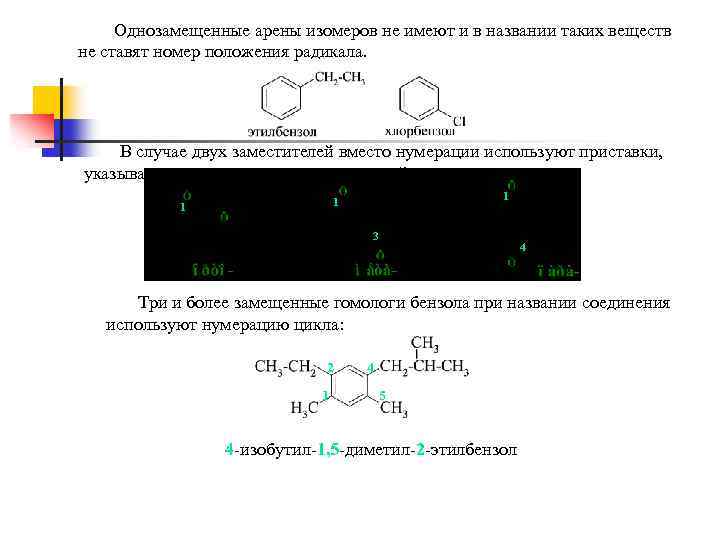
Однозамещенные арены изомеров не имеют и в названии таких веществ не ставят номер положения радикала. В случае двух заместителей вместо нумерации используют приставки, указывающие на положение заместителей: 1 1 1 2 3 4 Три и более замещенные гомологи бензола при названии соединения используют нумерацию цикла: 2 1 4 5 4 -изобутил-1, 5 -диметил-2 -этилбензол

Структурная изомерия аренов связаны с изомерией заместителей: n n n Строение боковой цепи Взаимное расположения заместителей в бензольном кольце орто-диэтилбензол По величине заместителей орто-пропилтолуол мета-диэтилбензол орто-диэтилбензол
Арены имеющие тривиальные названия:

III. Методы получения А. Промышленные методы 1. Природный источник – содержится в каменноугольной смоле. - содержит: бензол, алкилбензолы, нафталин, антрацен и более сложные ароматические соединения, например, 3, 4 -бензпирен 2. Дегидрированием циклоалкана - реакция Зелинского. метилциклогексан толуол 3. Дегидроциклизация алканов. гексан бензол 4. Тримеризация ацетилена. ацетилен бензол

Б. Лабораторные методы 5. Сплавление солей бензойной кислоты со щелочами: натриевая соль бензойной кислоты бензол 6. Реакция Вюрца-Фиттига: хлорбензол хлористый пропилбензол IV. Физические свойства Бензол – бесцветная, летучая, огнеопасная жидкость с неприятным запахом. Он легче воды и не смешивается с водой, но хорошо растворим в органических растворителях. Бензол является хорошим растворителем многих веществ. Кипит при температуре 80, 1 0 С, застывает в кристаллическую массу при охлаждении. Пары бензола ядовиты, вдыхание их вызывает анемию и лейкимию.

V. Химические свойства В молекуле бензола, не имеющего заместителей, реакции замещения водородного атома протекают в любое положение, т. к. атомы углерода равноценны. Правила ориентации: Все заместители в ароматическом ядре делятся на две группы: Ориентанты I рода – повышают химическую активность бензольного кольца (кроме галогенов), являются электронодонорными группами и ориентируют вновь вводимый заместитель в орто- и пара-положение. -R (-CH 3, -C 2 H 5, -C 3 H 7 и т. д. ), -NH 2, -OH, -Cl, -Br, -I. Ориентанты II рода – снижают химическую активность бензольного кольца, являются электроноакцепторными группами и ориентируют вновь вводимый заместитель в мета-положение. - NO 2, -SO 3 H, -COOH, -CN, -CF 3, -COH.
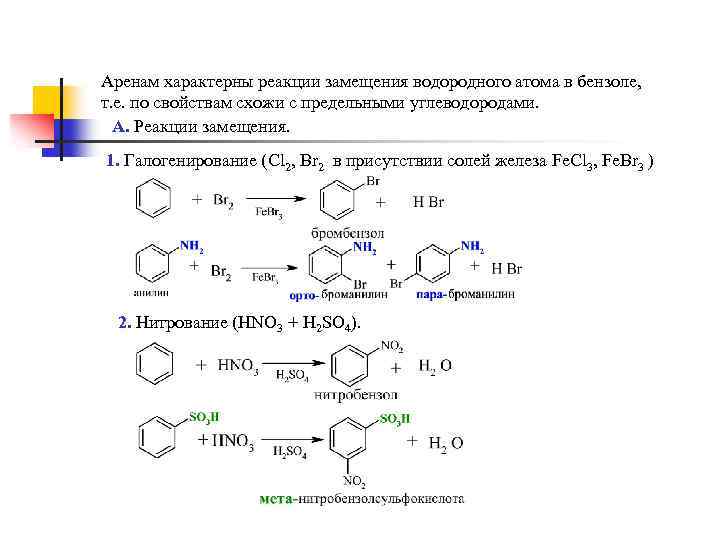
Аренам характерны реакции замещения водородного атома в бензоле, т. е. по свойствам схожи с предельными углеводородами. А. Реакции замещения. 1. Галогенирование (Cl 2, Br 2 в присутствии солей железа Fe. Cl 3, Fe. Br 3 ) 2. Нитрование (HNO 3 + H 2 SO 4).
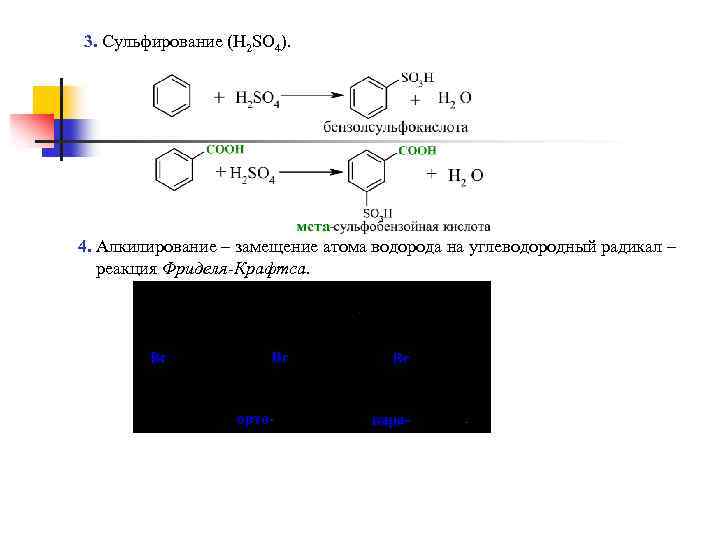
3. Сульфирование (H 2 SO 4). 4. Алкилирование – замещение атома водорода на углеводородный радикал – реакция Фриделя-Крафтса.

Б. Реакции присоединения. 5. Реакция гидрирования с образованием циклоалканов. *Циклогексан – исходное соединение в производстве циклогексанона, из которого затем получают полиамидную смолу – капрон; а также в производстве адипиновой кислоты-мономера при синтезе найлона. 6. Хлорирование бензола на свету. В. 7. Реакции окисления Бензол на воздухе горит коптящим пламенем с выделением продуктов полного окисления оксида углерода (IV) и воды. 2 С 6 Н 6 + 15 О 2 → 12 СО 2 + 6 Н 2 О

Гомологи бензола окисляются с расщеплением связи С-С в боковой цепи и образованием бензойной кислоты и карбоновой кислоты *Бензойная кислота используется в качестве присадки к охлаждающим жидкостям, при производстве РТИ, шин, химволокна. Соль бензойной кислоты –бензоат натрия, используется как консервант в пищевой промышленности.

Особенности химических свойств стирола. 8. Галогенирование стирола – присоединение брома по двойной связи в боковой цепи в комнатных условиях. 9. Мягкое окисление стирола – обесцвечивание перманганата калия 10. Полимеризация стирола:

Влияние ароматических углеводородов на качественные показатели топлив Бензин Ароматические углеводороды бензиновых фракций имеют высокие октановые числа: бензол ОЧ=108, толуол ОЧ=104, изопропилбензол ОЧ=99, 3. Арены гигроскопичны (поглощают влагу из воздуха), увеличивают нагарообразование в двигателе и повышают теплонапряженность двигателя. Дизельное топливо Ароматические углеводороды имеют самые низкие цетановые числа (ЦЧ нафталина=0). Моторные масла Углеводороды с длинными боковыми цепочками и с малым числом конденсированных колец (до 3 -х) – желательные компоненты и для масел, так как отличаются хорошими вязкостно-температурными характеристиками.
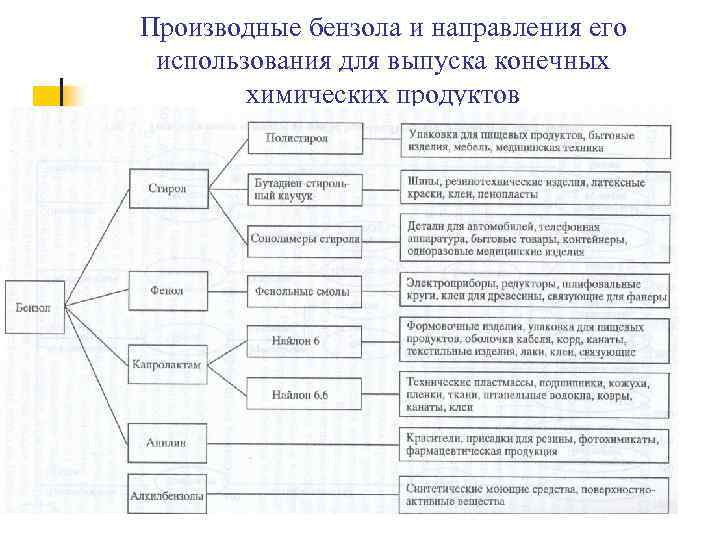
Производные бензола и направления его использования для выпуска конечных химических продуктов

VI. Применение n Бензол С 6 Н 6 – широко используется как растворитель; n Стирол С 6 Н 5 -СН=СН 2 – для производства пластмассы, резины; n Толуол С 6 Н 5 -СН 3 – производство взрывчатых веществ; n Толуол С 6 Н 5 -СН 3 – в производство красителей; n Толуол С 6 Н 5 -СН 3 – хороший растворитель; n Фенол С 6 Н 5 -ОН – для производства лекарственных средств; n Фенол С 6 Н 5 -ОН – для производства красителей и пластмасс.
7-Арены.ppt