8_арены(60).ppt
- Количество слайдов: 62
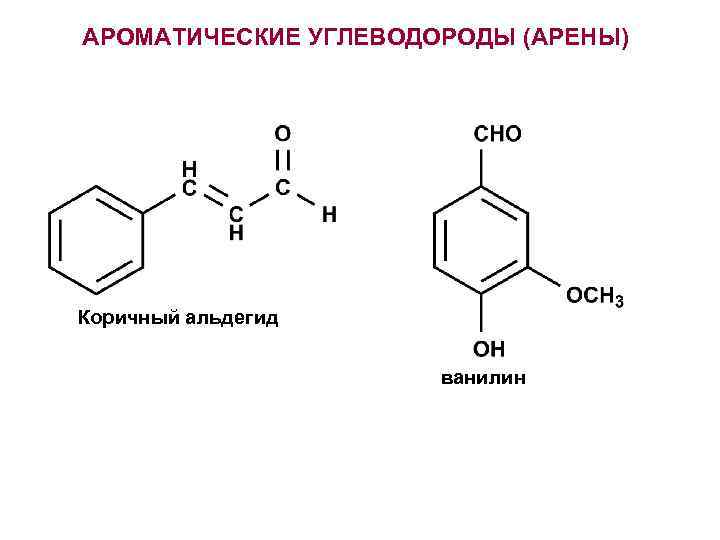 АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ) Коричный альдегид ванилин
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ) Коричный альдегид ванилин
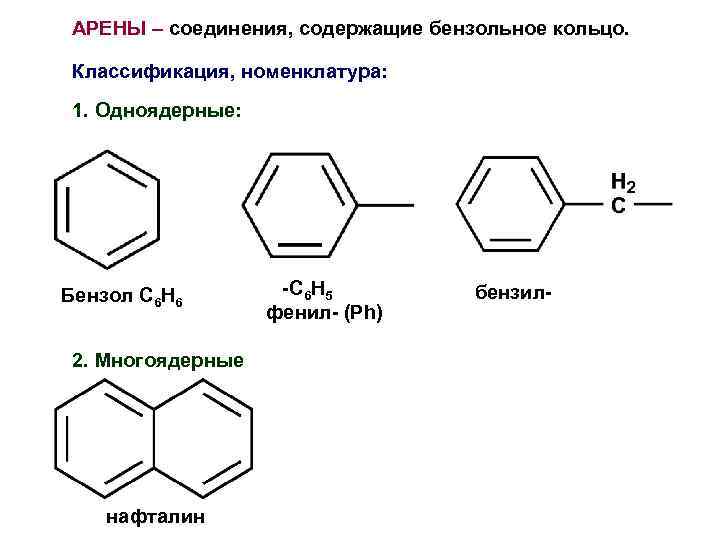 АРЕНЫ – соединения, содержащие бензольное кольцо. Классификация, номенклатура: 1. Одноядерные: Бензол C 6 H 6 2. Многоядерные нафталин -C 6 H 5 фенил- (Ph) бензил-
АРЕНЫ – соединения, содержащие бензольное кольцо. Классификация, номенклатура: 1. Одноядерные: Бензол C 6 H 6 2. Многоядерные нафталин -C 6 H 5 фенил- (Ph) бензил-
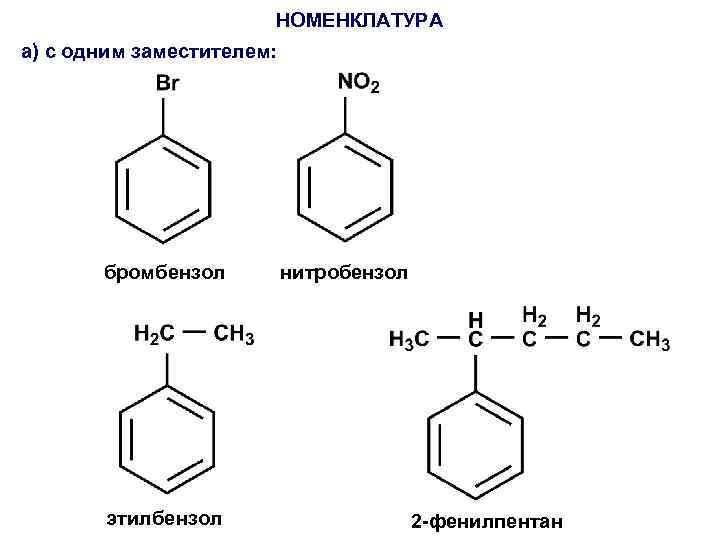 НОМЕНКЛАТУРА а) с одним заместителем: бромбензол этилбензол нитробензол 2 -фенилпентан
НОМЕНКЛАТУРА а) с одним заместителем: бромбензол этилбензол нитробензол 2 -фенилпентан
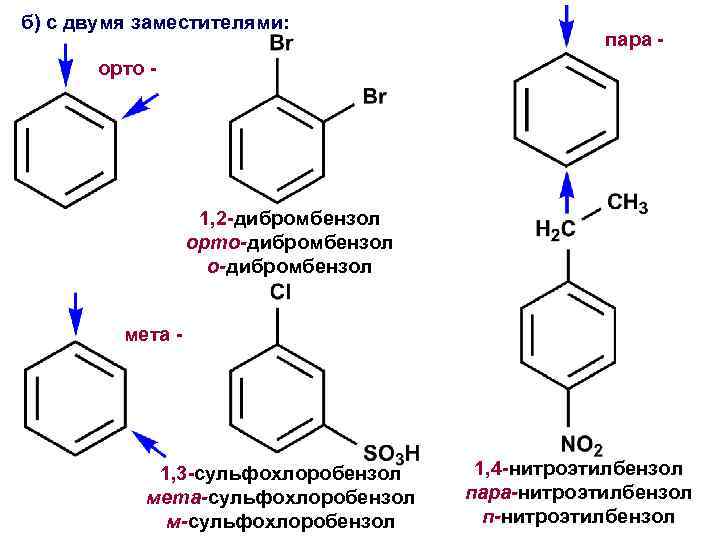 б) с двумя заместителями: пара - орто - 1, 2 -дибромбензол орто-дибромбензол мета - 1, 3 -сульфохлоробензол мета-сульфохлоробензол м-сульфохлоробензол 1, 4 -нитроэтилбензол пара-нитроэтилбензол п-нитроэтилбензол
б) с двумя заместителями: пара - орто - 1, 2 -дибромбензол орто-дибромбензол мета - 1, 3 -сульфохлоробензол мета-сульфохлоробензол м-сульфохлоробензол 1, 4 -нитроэтилбензол пара-нитроэтилбензол п-нитроэтилбензол
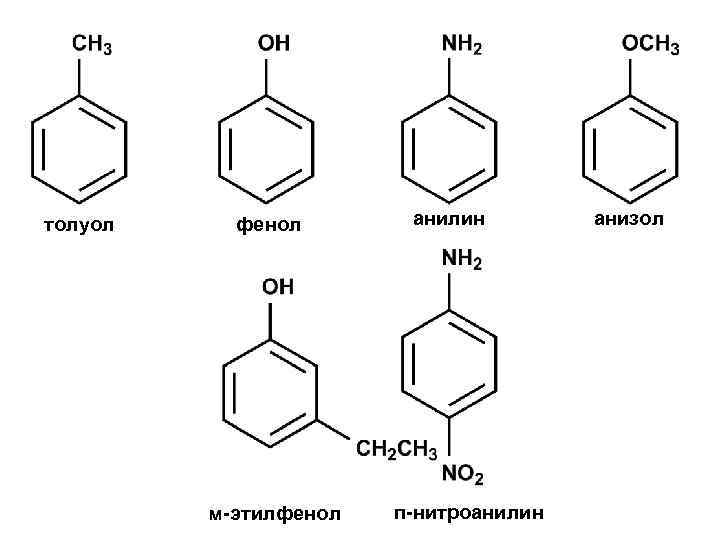 толуол фенол м-этилфенол анилин п-нитроанилин анизол
толуол фенол м-этилфенол анилин п-нитроанилин анизол
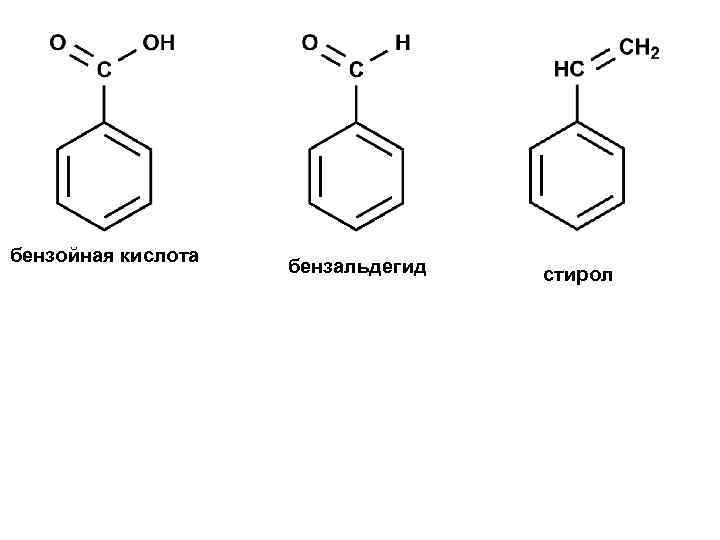 бензойная кислота бензальдегид стирол
бензойная кислота бензальдегид стирол
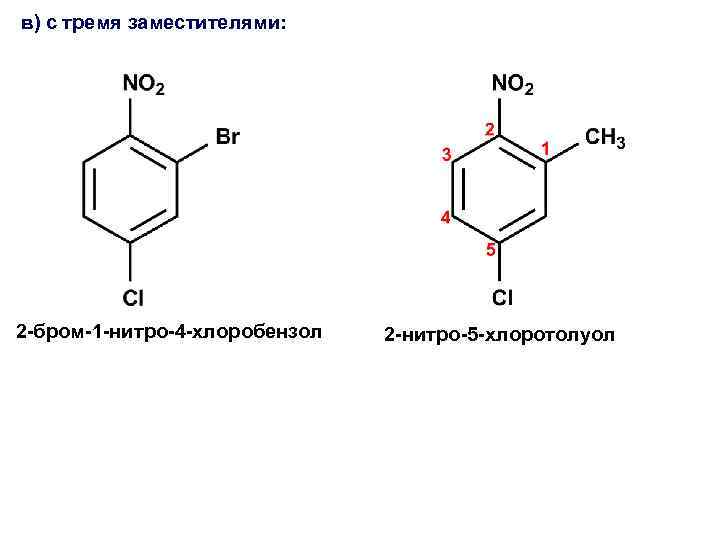 в) с тремя заместителями: 2 -бром-1 -нитро-4 -хлоробензол 2 -нитро-5 -хлоротолуол
в) с тремя заместителями: 2 -бром-1 -нитро-4 -хлоробензол 2 -нитро-5 -хлоротолуол
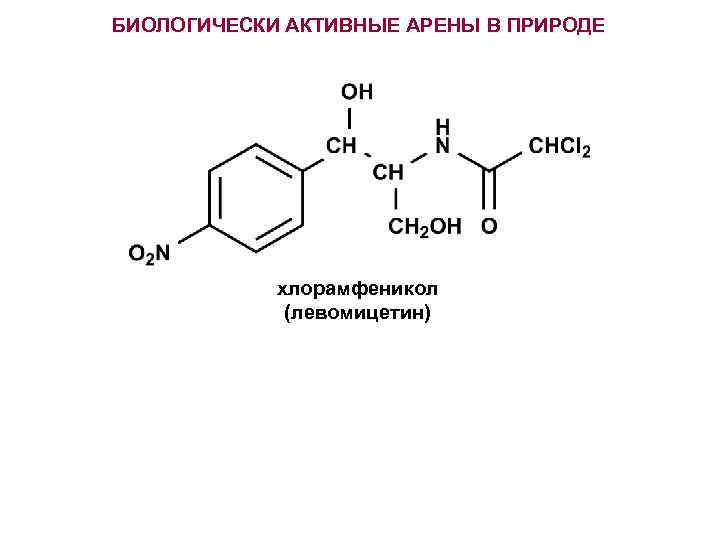 БИОЛОГИЧЕСКИ АКТИВНЫЕ АРЕНЫ В ПРИРОДЕ хлорамфеникол (левомицетин)
БИОЛОГИЧЕСКИ АКТИВНЫЕ АРЕНЫ В ПРИРОДЕ хлорамфеникол (левомицетин)
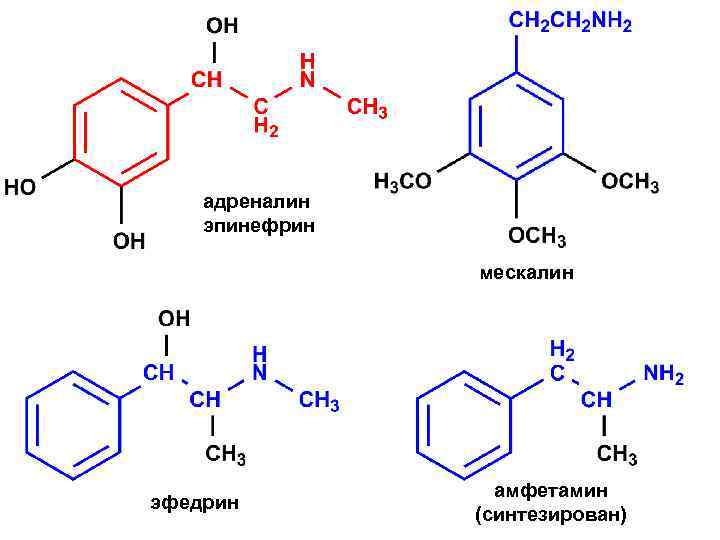 адреналин эпинефрин мескалин эфедрин амфетамин (синтезирован)
адреналин эпинефрин мескалин эфедрин амфетамин (синтезирован)
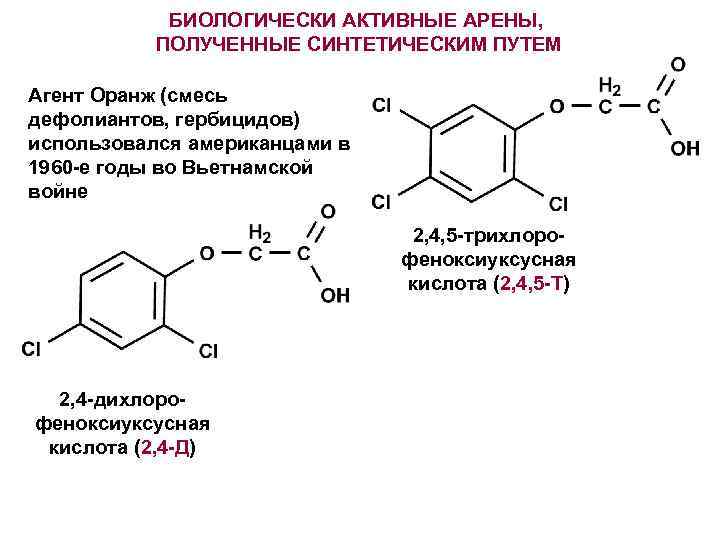 БИОЛОГИЧЕСКИ АКТИВНЫЕ АРЕНЫ, ПОЛУЧЕННЫЕ СИНТЕТИЧЕСКИМ ПУТЕМ Агент Оранж (смесь дефолиантов, гербицидов) использовался американцами в 1960 -е годы во Вьетнамской войне 2, 4, 5 -трихлорофеноксиуксусная кислота (2, 4, 5 -Т) 2, 4 -дихлорофеноксиуксусная кислота (2, 4 -Д)
БИОЛОГИЧЕСКИ АКТИВНЫЕ АРЕНЫ, ПОЛУЧЕННЫЕ СИНТЕТИЧЕСКИМ ПУТЕМ Агент Оранж (смесь дефолиантов, гербицидов) использовался американцами в 1960 -е годы во Вьетнамской войне 2, 4, 5 -трихлорофеноксиуксусная кислота (2, 4, 5 -Т) 2, 4 -дихлорофеноксиуксусная кислота (2, 4 -Д)
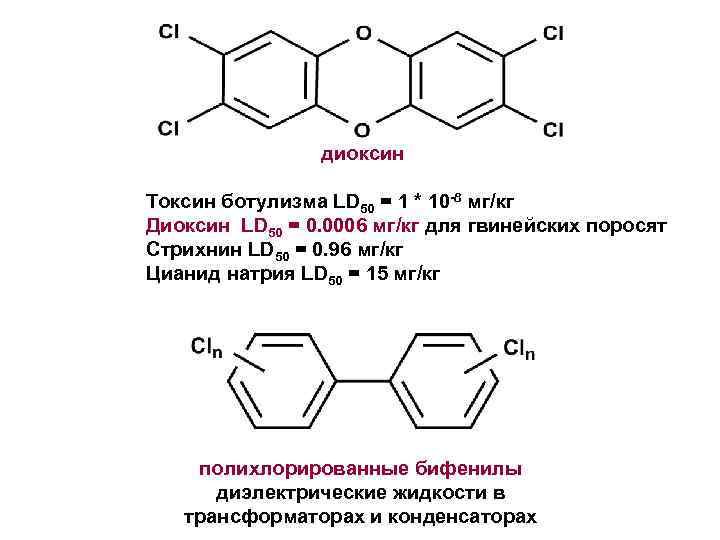 диоксин Токсин ботулизма LD 50 = 1 * 10 -8 мг/кг Диоксин LD 50 = 0. 0006 мг/кг для гвинейских поросят Стрихнин LD 50 = 0. 96 мг/кг Цианид натрия LD 50 = 15 мг/кг полихлорированные бифенилы диэлектрические жидкости в трансформаторах и конденсаторах
диоксин Токсин ботулизма LD 50 = 1 * 10 -8 мг/кг Диоксин LD 50 = 0. 0006 мг/кг для гвинейских поросят Стрихнин LD 50 = 0. 96 мг/кг Цианид натрия LD 50 = 15 мг/кг полихлорированные бифенилы диэлектрические жидкости в трансформаторах и конденсаторах
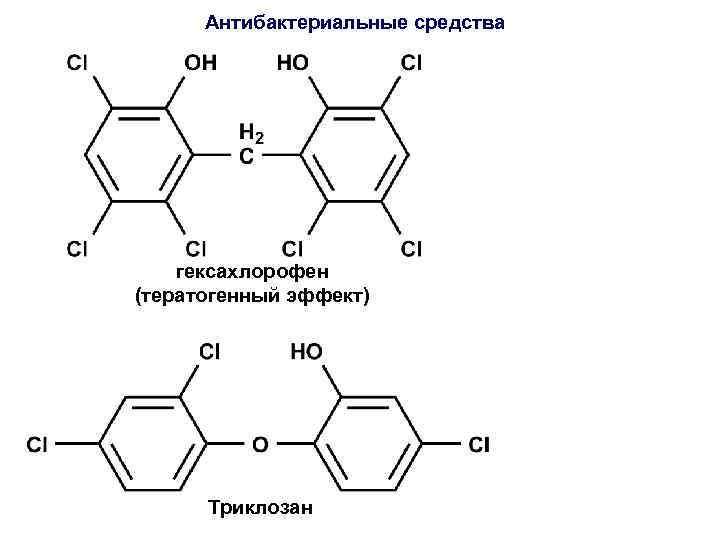 Антибактериальные средства гексахлорофен (тератогенный эффект) Триклозан
Антибактериальные средства гексахлорофен (тератогенный эффект) Триклозан
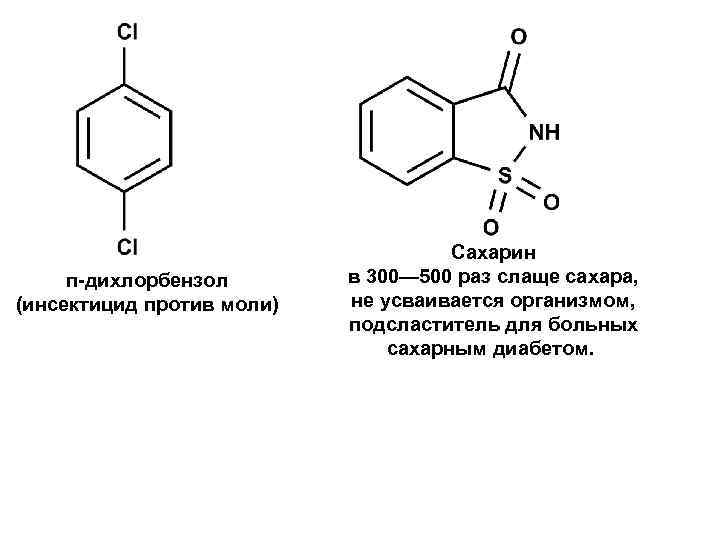 п-дихлорбензол (инсектицид против моли) Сахарин в 300— 500 раз слаще сахара, не усваивается организмом, подсластитель для больных сахарным диабетом.
п-дихлорбензол (инсектицид против моли) Сахарин в 300— 500 раз слаще сахара, не усваивается организмом, подсластитель для больных сахарным диабетом.
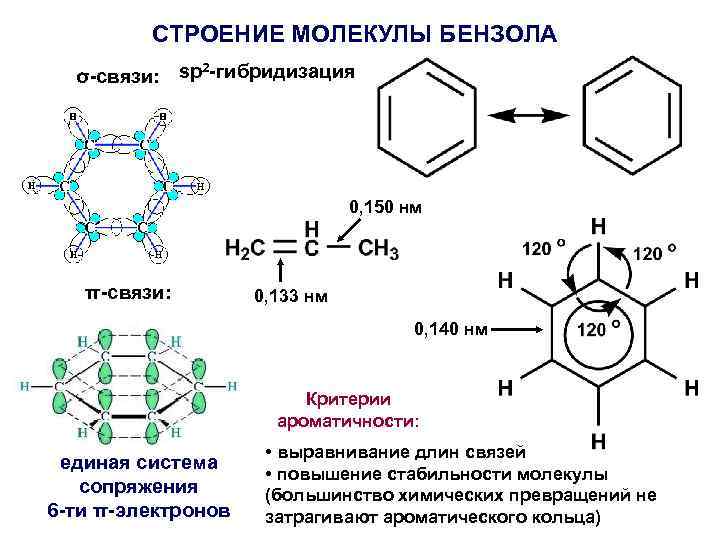 СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА 2 σ-связи: sp -гибридизация 0, 150 нм π-связи: 0, 133 нм 0, 140 нм Критерии ароматичности: единая система сопряжения 6 -ти π-электронов • выравнивание длин связей • повышение стабильности молекулы (большинство химических превращений не затрагивают ароматического кольца)
СТРОЕНИЕ МОЛЕКУЛЫ БЕНЗОЛА 2 σ-связи: sp -гибридизация 0, 150 нм π-связи: 0, 133 нм 0, 140 нм Критерии ароматичности: единая система сопряжения 6 -ти π-электронов • выравнивание длин связей • повышение стабильности молекулы (большинство химических превращений не затрагивают ароматического кольца)
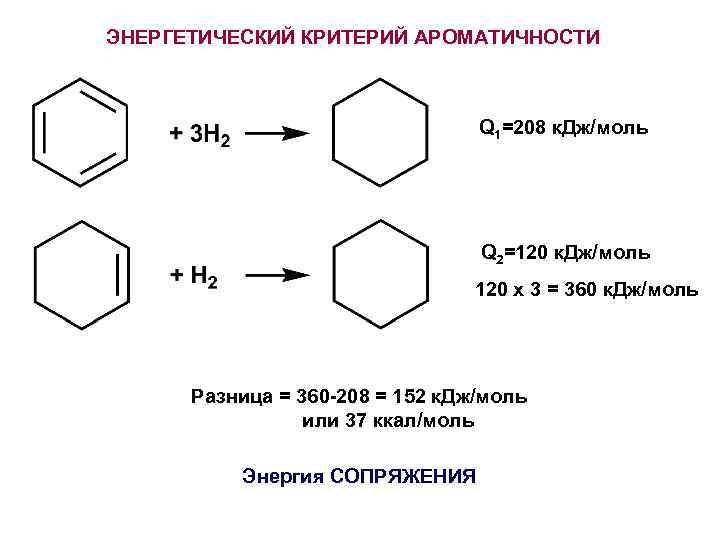 ЭНЕРГЕТИЧЕСКИЙ КРИТЕРИЙ АРОМАТИЧНОСТИ Q 1=208 к. Дж/моль Q 2=120 к. Дж/моль 120 х 3 = 360 к. Дж/моль Разница = 360 -208 = 152 к. Дж/моль или 37 ккал/моль Энергия СОПРЯЖЕНИЯ
ЭНЕРГЕТИЧЕСКИЙ КРИТЕРИЙ АРОМАТИЧНОСТИ Q 1=208 к. Дж/моль Q 2=120 к. Дж/моль 120 х 3 = 360 к. Дж/моль Разница = 360 -208 = 152 к. Дж/моль или 37 ккал/моль Энергия СОПРЯЖЕНИЯ
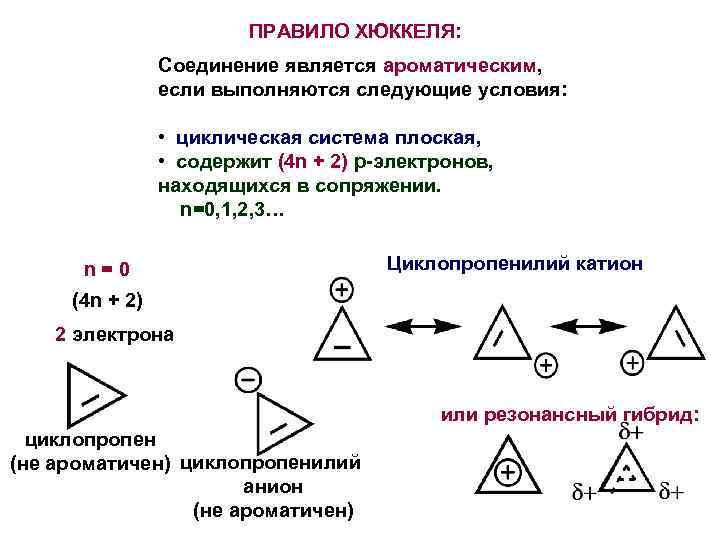 ПРАВИЛО ХЮККЕЛЯ: Соединение является ароматическим, если выполняются следующие условия: • циклическая система плоская, • содержит (4 n + 2) p-электронов, находящихся в сопряжении. n=0, 1, 2, 3… n = 0 Циклопропенилий катион (4 n + 2) 2 электрона или резонансный гибрид: циклопропен (не ароматичен) циклопропенилий анион (не ароматичен)
ПРАВИЛО ХЮККЕЛЯ: Соединение является ароматическим, если выполняются следующие условия: • циклическая система плоская, • содержит (4 n + 2) p-электронов, находящихся в сопряжении. n=0, 1, 2, 3… n = 0 Циклопропенилий катион (4 n + 2) 2 электрона или резонансный гибрид: циклопропен (не ароматичен) циклопропенилий анион (не ароматичен)
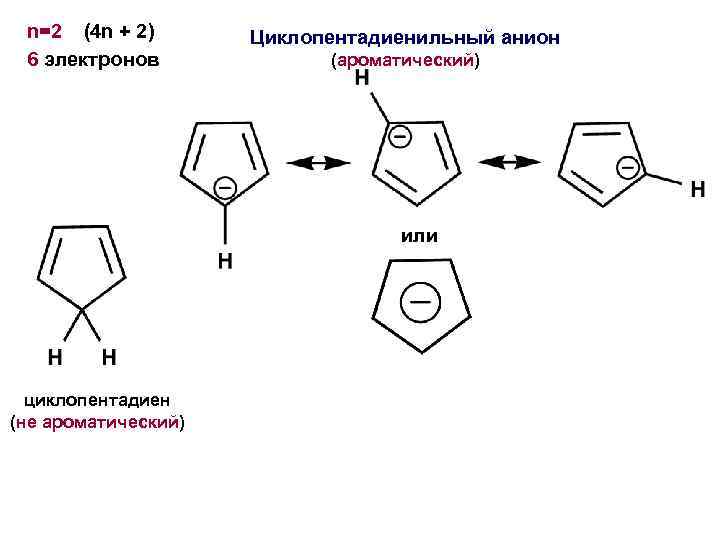 n=2 (4 n + 2) 6 электронов Циклопентадиенильный анион (ароматический) или циклопентадиен (не ароматический)
n=2 (4 n + 2) 6 электронов Циклопентадиенильный анион (ароматический) или циклопентадиен (не ароматический)
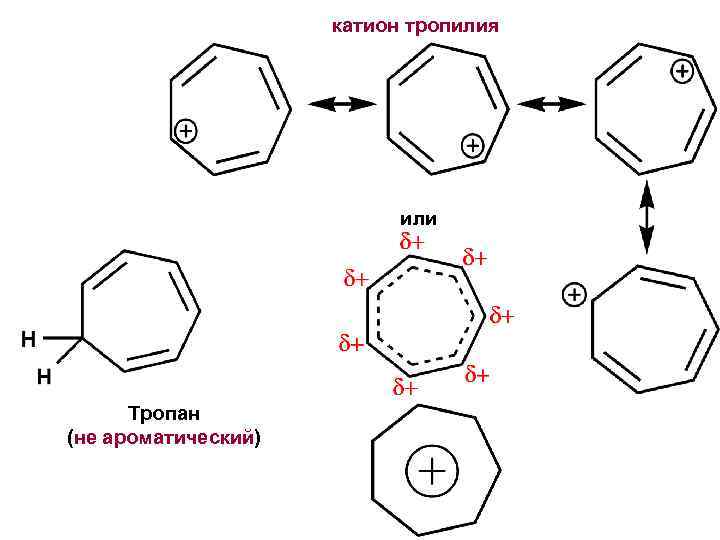 катион тропилия или Тропан (не ароматический)
катион тропилия или Тропан (не ароматический)
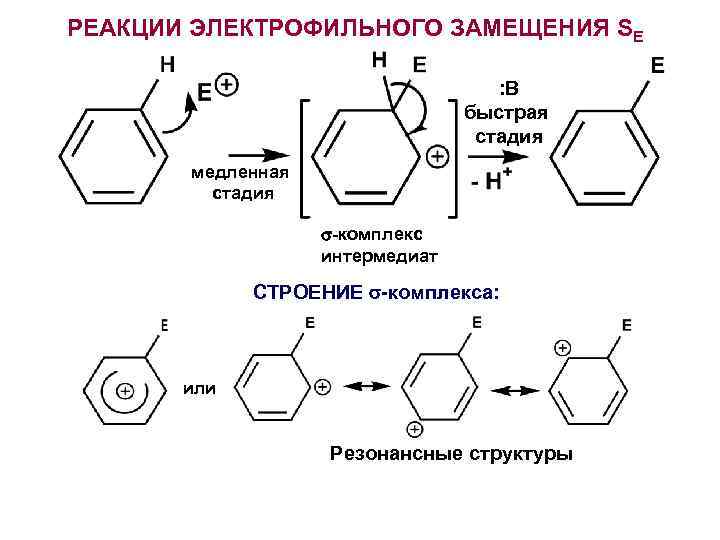 РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ SE : В быстрая стадия медленная стадия -комплекс интермедиат СТРОЕНИЕ -комплекса: или Резонансные структуры
РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ SE : В быстрая стадия медленная стадия -комплекс интермедиат СТРОЕНИЕ -комплекса: или Резонансные структуры
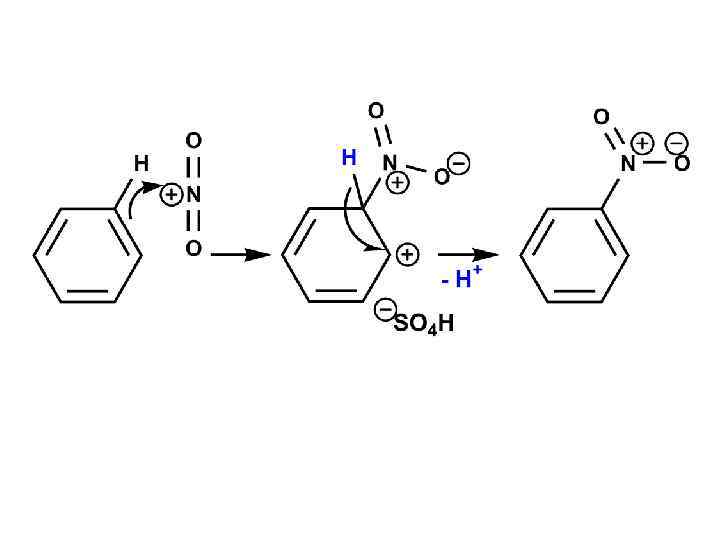
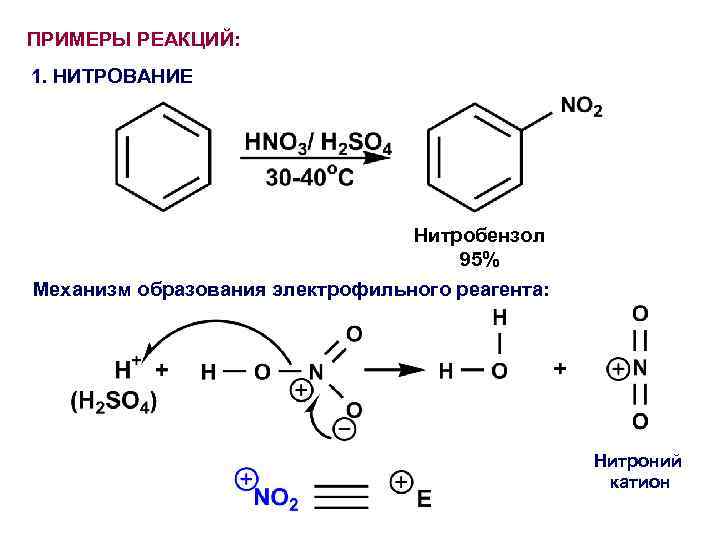 ПРИМЕРЫ РЕАКЦИЙ: 1. НИТРОВАНИЕ Нитробензол 95% Механизм образования электрофильного реагента: Нитроний катион
ПРИМЕРЫ РЕАКЦИЙ: 1. НИТРОВАНИЕ Нитробензол 95% Механизм образования электрофильного реагента: Нитроний катион
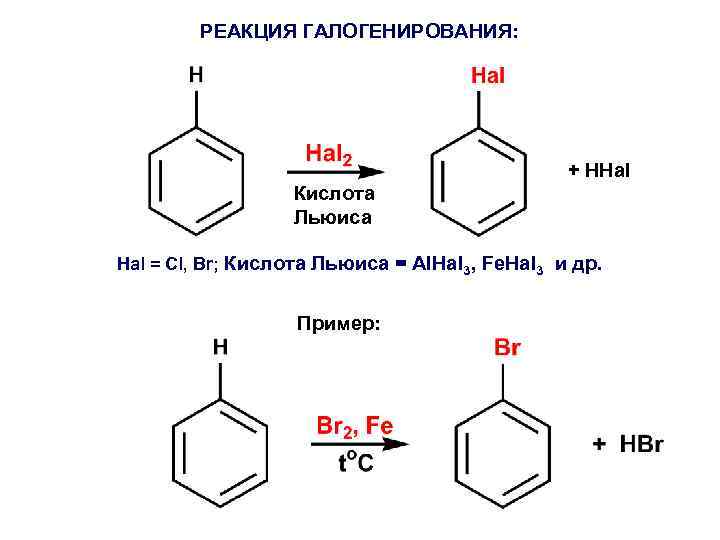 РЕАКЦИЯ ГАЛОГЕНИРОВАНИЯ: + HHal Кислота Льюиса Hal = Cl, Br; Кислота Льюиса = Al. Hal 3, Fe. Hal 3 и др. Пример:
РЕАКЦИЯ ГАЛОГЕНИРОВАНИЯ: + HHal Кислота Льюиса Hal = Cl, Br; Кислота Льюиса = Al. Hal 3, Fe. Hal 3 и др. Пример:
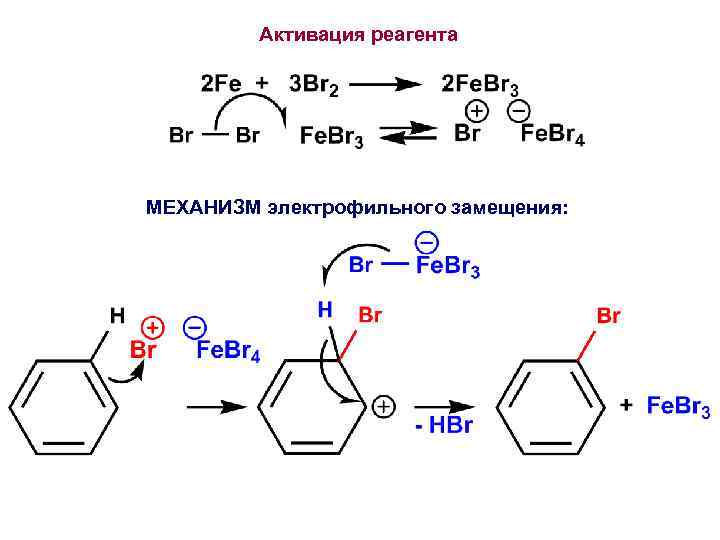 Активация реагента МЕХАНИЗМ электрофильного замещения:
Активация реагента МЕХАНИЗМ электрофильного замещения:
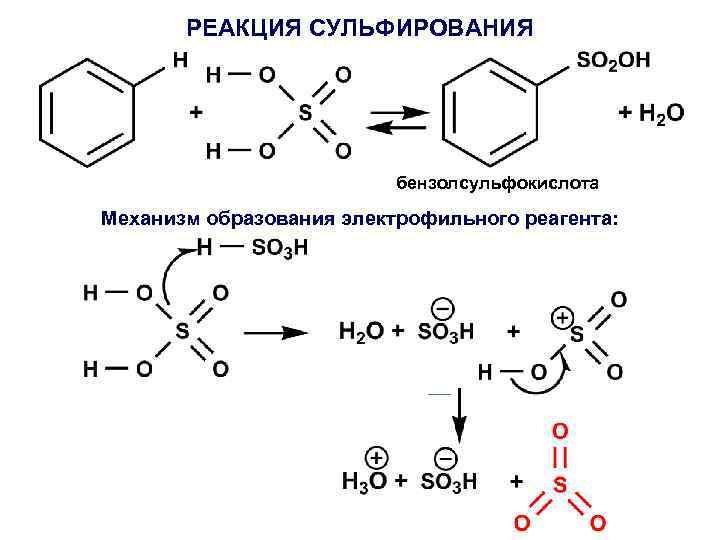 РЕАКЦИЯ СУЛЬФИРОВАНИЯ бензолсульфокислота Механизм образования электрофильного реагента:
РЕАКЦИЯ СУЛЬФИРОВАНИЯ бензолсульфокислота Механизм образования электрофильного реагента:

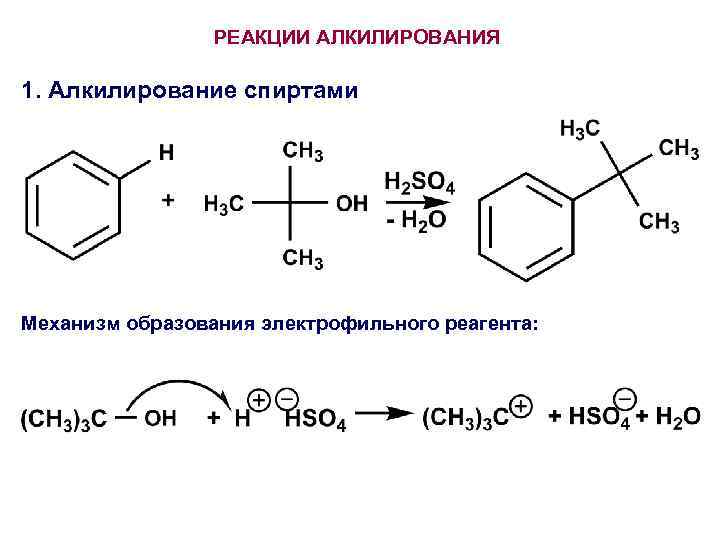 РЕАКЦИИ АЛКИЛИРОВАНИЯ 1. Алкилирование спиртами Механизм образования электрофильного реагента:
РЕАКЦИИ АЛКИЛИРОВАНИЯ 1. Алкилирование спиртами Механизм образования электрофильного реагента:
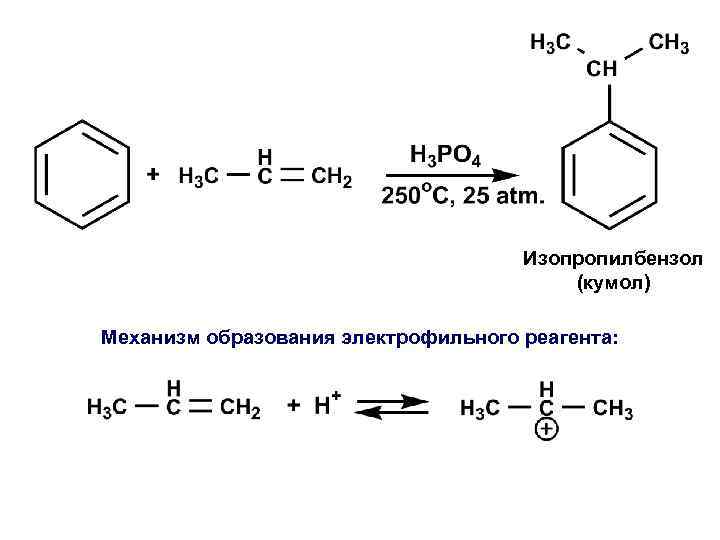 Изопропилбензол (кумол) Механизм образования электрофильного реагента:
Изопропилбензол (кумол) Механизм образования электрофильного реагента:
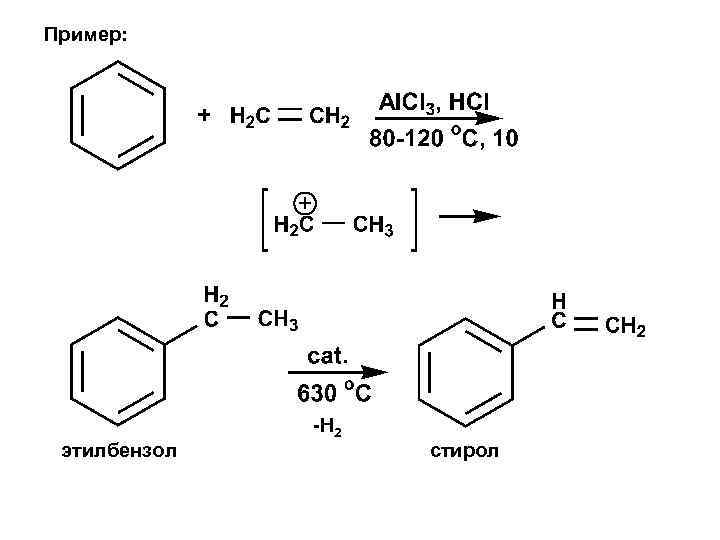 Пример: этилбензол -Н 2 стирол
Пример: этилбензол -Н 2 стирол
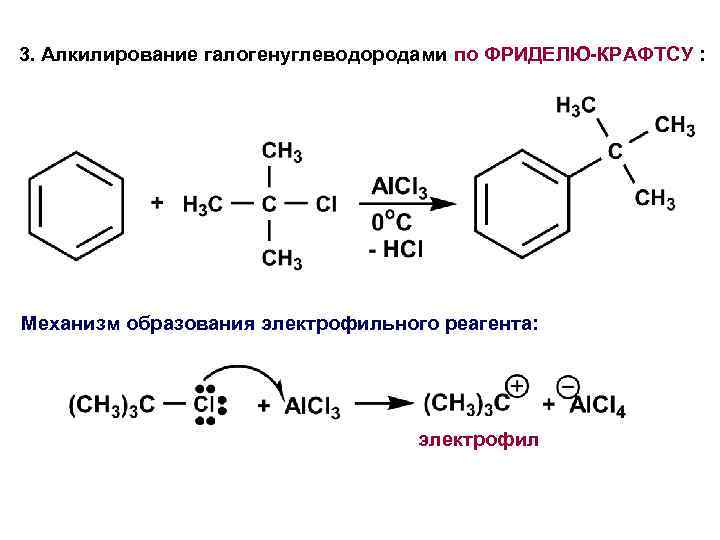 3. Алкилирование галогенуглеводородами по ФРИДЕЛЮ-КРАФТСУ : Механизм образования электрофильного реагента: электрофил
3. Алкилирование галогенуглеводородами по ФРИДЕЛЮ-КРАФТСУ : Механизм образования электрофильного реагента: электрофил
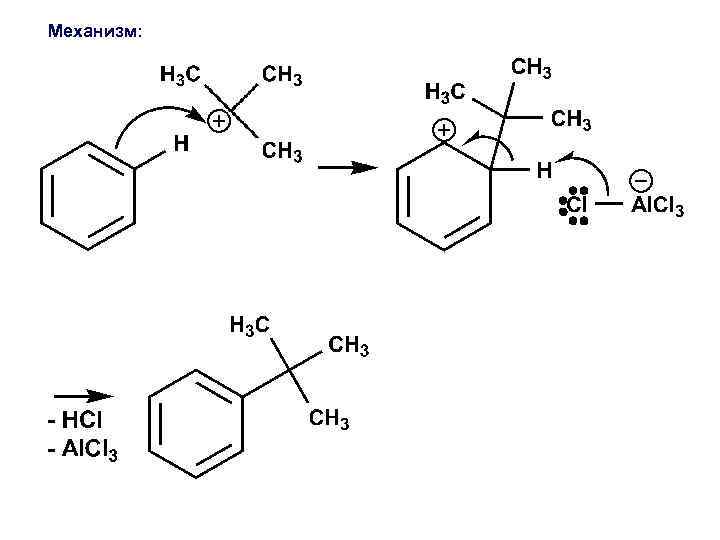 Механизм:
Механизм:
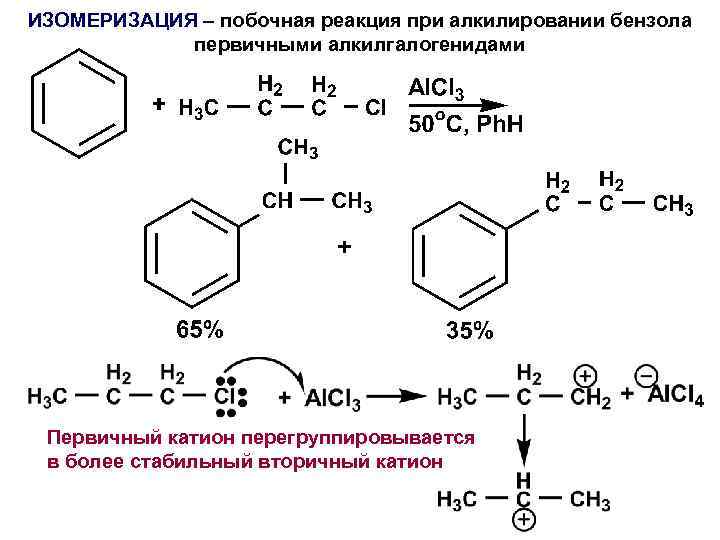 ИЗОМЕРИЗАЦИЯ – побочная реакция при алкилировании бензола первичными алкилгалогенидами Первичный катион перегруппировывается в более стабильный вторичный катион
ИЗОМЕРИЗАЦИЯ – побочная реакция при алкилировании бензола первичными алкилгалогенидами Первичный катион перегруппировывается в более стабильный вторичный катион
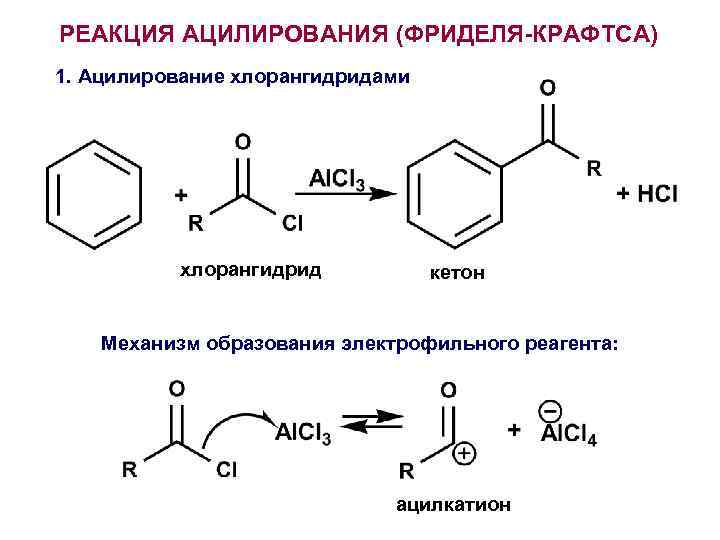 РЕАКЦИЯ АЦИЛИРОВАНИЯ (ФРИДЕЛЯ-КРАФТСА) 1. Ацилирование хлорангидридами хлорангидрид кетон Механизм образования электрофильного реагента: ацилкатион
РЕАКЦИЯ АЦИЛИРОВАНИЯ (ФРИДЕЛЯ-КРАФТСА) 1. Ацилирование хлорангидридами хлорангидрид кетон Механизм образования электрофильного реагента: ацилкатион
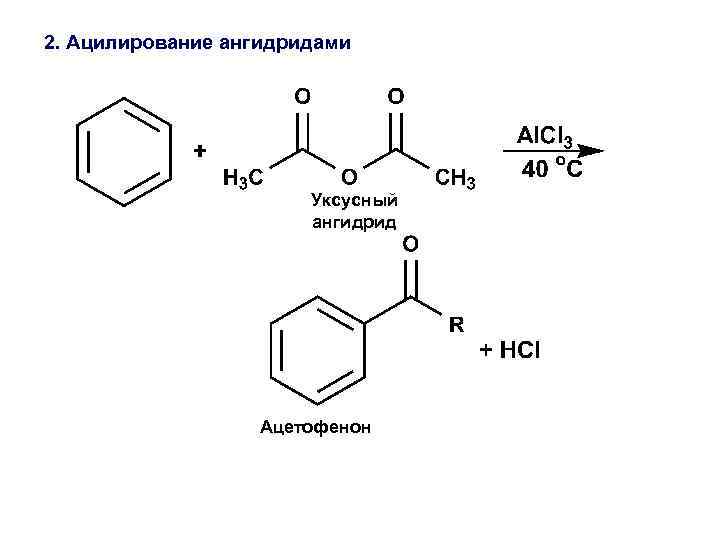 2. Ацилирование ангидридами Уксусный ангидрид Ацетофенон
2. Ацилирование ангидридами Уксусный ангидрид Ацетофенон
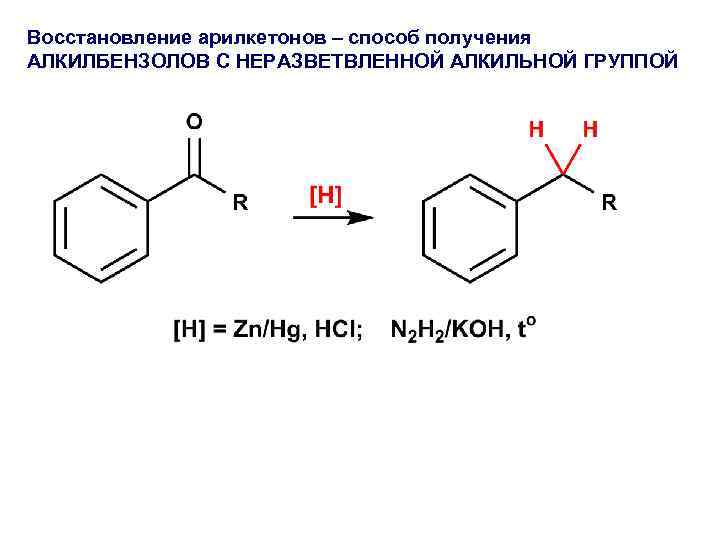 Восстановление арилкетонов – способ получения АЛКИЛБЕНЗОЛОВ С НЕРАЗВЕТВЛЕННОЙ АЛКИЛЬНОЙ ГРУППОЙ
Восстановление арилкетонов – способ получения АЛКИЛБЕНЗОЛОВ С НЕРАЗВЕТВЛЕННОЙ АЛКИЛЬНОЙ ГРУППОЙ
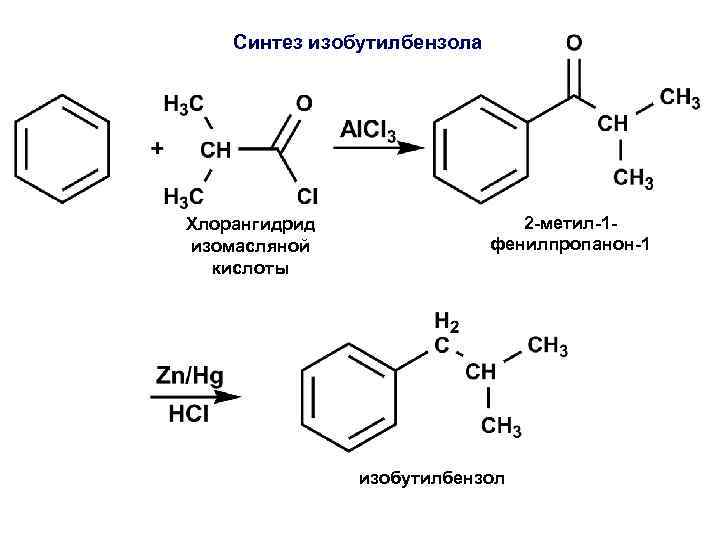 Синтез изобутилбензола Хлорангидрид изомасляной кислоты 2 -метил-1 фенилпропанон-1 изобутилбензол
Синтез изобутилбензола Хлорангидрид изомасляной кислоты 2 -метил-1 фенилпропанон-1 изобутилбензол
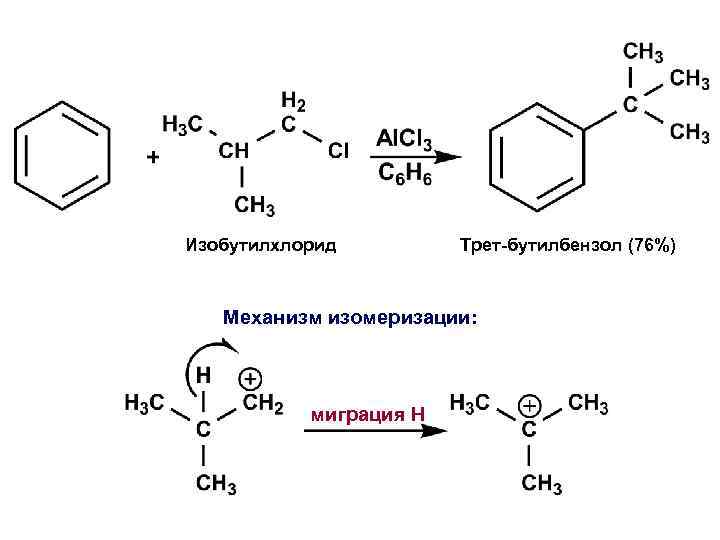 Изобутилхлорид Трет-бутилбензол (76%) Механизм изомеризации: миграция H
Изобутилхлорид Трет-бутилбензол (76%) Механизм изомеризации: миграция H
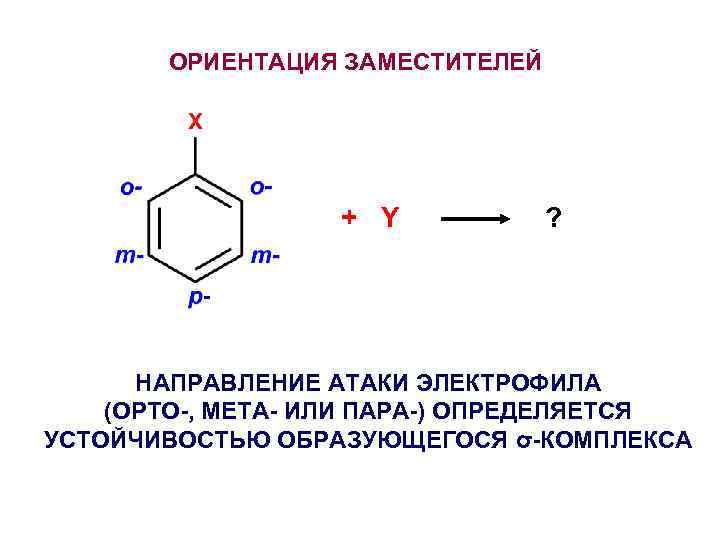 ОРИЕНТАЦИЯ ЗАМЕСТИТЕЛЕЙ + Y ? НАПРАВЛЕНИЕ АТАКИ ЭЛЕКТРОФИЛА (ОРТО-, МЕТА- ИЛИ ПАРА-) ОПРЕДЕЛЯЕТСЯ УСТОЙЧИВОСТЬЮ ОБРАЗУЮЩЕГОСЯ σ-КОМПЛЕКСА
ОРИЕНТАЦИЯ ЗАМЕСТИТЕЛЕЙ + Y ? НАПРАВЛЕНИЕ АТАКИ ЭЛЕКТРОФИЛА (ОРТО-, МЕТА- ИЛИ ПАРА-) ОПРЕДЕЛЯЕТСЯ УСТОЙЧИВОСТЬЮ ОБРАЗУЮЩЕГОСЯ σ-КОМПЛЕКСА
 Х – ориентант 1 рода: Х – ориентант 2 рода: X = - OH, - OR, - SH, - SR, - NH 2, - NR 2, - NHCOR, - CH 3, галогены. • направляет заместитель Y в орто- и пара- положения кольца; • направляет заместитель Y в мето- положения кольца; • активизирует бензольное кольцо (облегчает последующую атаку электрофила Y). • дезактивизирует бензольное кольцо (затрудняет последующую атаку электрофила Y). Исключение: F, Cl, Br, I дезактивизирует бензольное кольцо, затрудняют атаку электрофила Y.
Х – ориентант 1 рода: Х – ориентант 2 рода: X = - OH, - OR, - SH, - SR, - NH 2, - NR 2, - NHCOR, - CH 3, галогены. • направляет заместитель Y в орто- и пара- положения кольца; • направляет заместитель Y в мето- положения кольца; • активизирует бензольное кольцо (облегчает последующую атаку электрофила Y). • дезактивизирует бензольное кольцо (затрудняет последующую атаку электрофила Y). Исключение: F, Cl, Br, I дезактивизирует бензольное кольцо, затрудняют атаку электрофила Y.
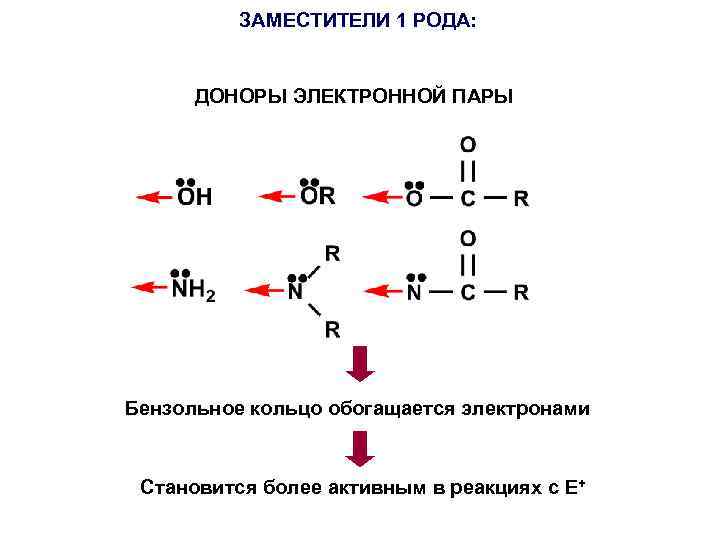 ЗАМЕСТИТЕЛИ 1 РОДА: ДОНОРЫ ЭЛЕКТРОННОЙ ПАРЫ Бензольное кольцо обогащается электронами Становится более активным в реакциях с E+
ЗАМЕСТИТЕЛИ 1 РОДА: ДОНОРЫ ЭЛЕКТРОННОЙ ПАРЫ Бензольное кольцо обогащается электронами Становится более активным в реакциях с E+
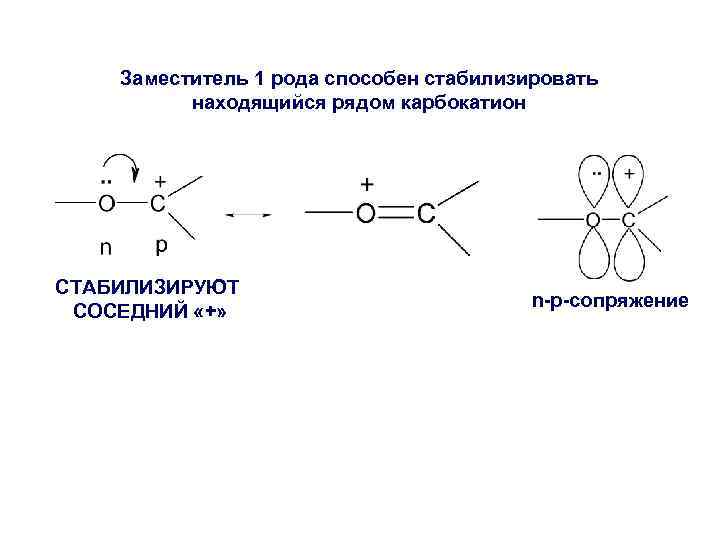 Заместитель 1 рода способен стабилизировать находящийся рядом карбокатион СТАБИЛИЗИРУЮТ СОСЕДНИЙ «+» n-p-сопряжение
Заместитель 1 рода способен стабилизировать находящийся рядом карбокатион СТАБИЛИЗИРУЮТ СОСЕДНИЙ «+» n-p-сопряжение
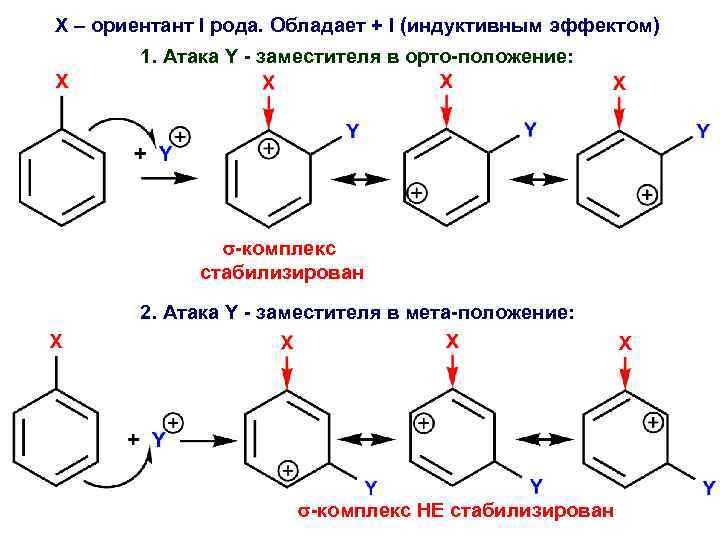 Х – ориентант I рода. Обладает + I (индуктивным эффектом) 1. Атака Y - заместителя в орто-положение: -комплекс стабилизирован 2. Атака Y - заместителя в мета-положение: -комплекс НЕ стабилизирован
Х – ориентант I рода. Обладает + I (индуктивным эффектом) 1. Атака Y - заместителя в орто-положение: -комплекс стабилизирован 2. Атака Y - заместителя в мета-положение: -комплекс НЕ стабилизирован
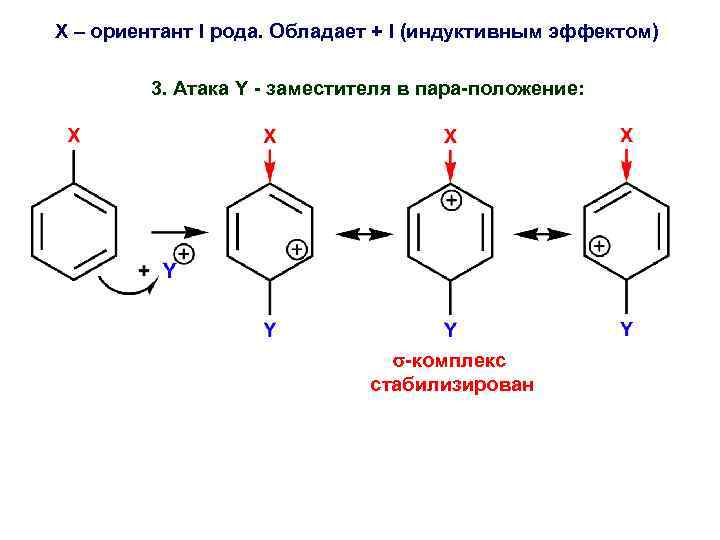 Х – ориентант I рода. Обладает + I (индуктивным эффектом) 3. Атака Y - заместителя в пара-положение: -комплекс стабилизирован
Х – ориентант I рода. Обладает + I (индуктивным эффектом) 3. Атака Y - заместителя в пара-положение: -комплекс стабилизирован
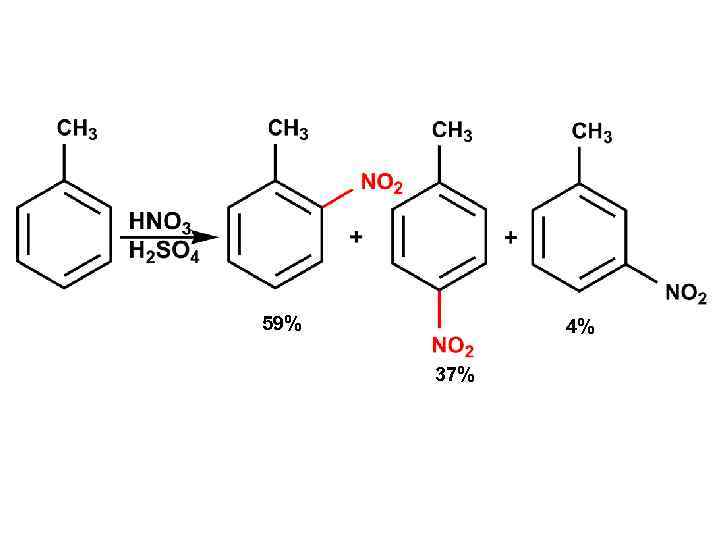 59% 4% 37%
59% 4% 37%
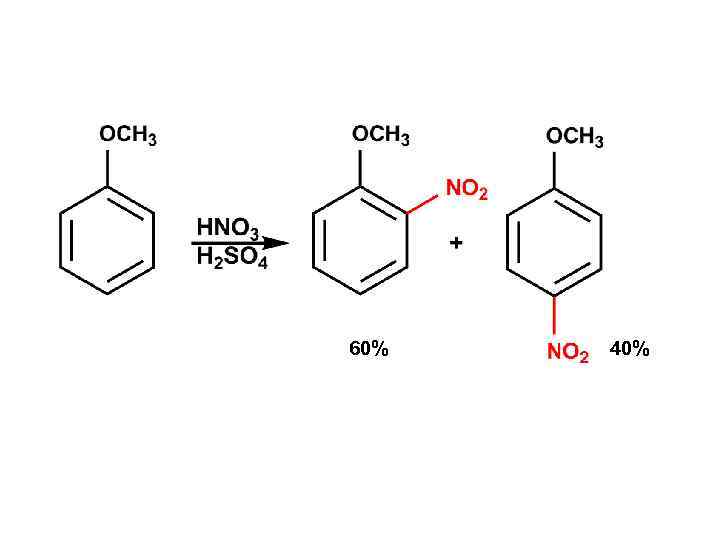 60% 40%
60% 40%
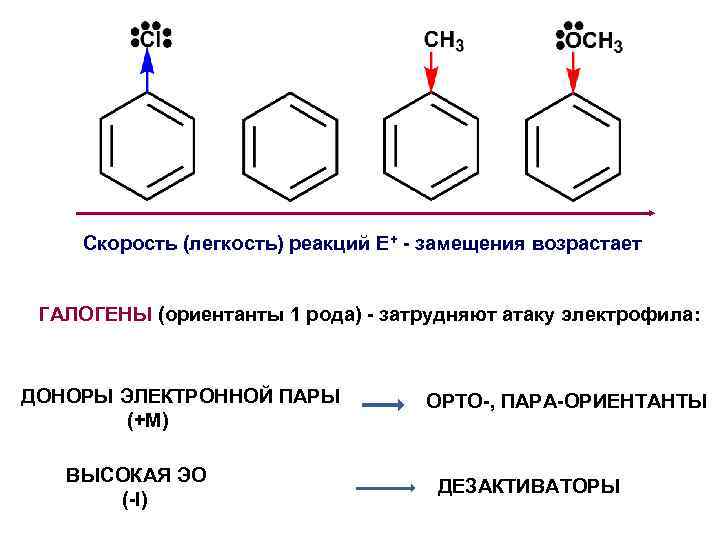 Скорость (легкость) реакций E+ - замещения возрастает ГАЛОГЕНЫ (ориентанты 1 рода) - затрудняют атаку электрофила: ДОНОРЫ ЭЛЕКТРОННОЙ ПАРЫ (+М) ВЫСОКАЯ ЭО (-I) ОРТО-, ПАРА-ОРИЕНТАНТЫ ДЕЗАКТИВАТОРЫ
Скорость (легкость) реакций E+ - замещения возрастает ГАЛОГЕНЫ (ориентанты 1 рода) - затрудняют атаку электрофила: ДОНОРЫ ЭЛЕКТРОННОЙ ПАРЫ (+М) ВЫСОКАЯ ЭО (-I) ОРТО-, ПАРА-ОРИЕНТАНТЫ ДЕЗАКТИВАТОРЫ
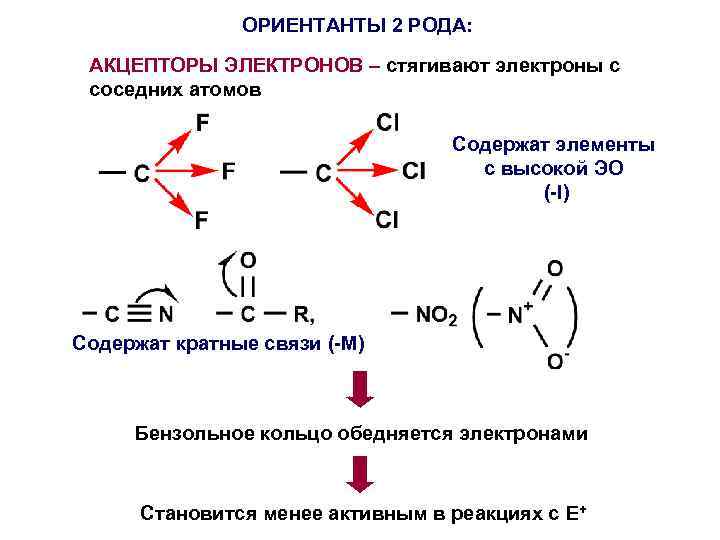 ОРИЕНТАНТЫ 2 РОДА: АКЦЕПТОРЫ ЭЛЕКТРОНОВ – стягивают электроны с соседних атомов Содержат элементы с высокой ЭО (-I) Содержат кратные связи (-M) Бензольное кольцо обедняется электронами Становится менее активным в реакциях с E+
ОРИЕНТАНТЫ 2 РОДА: АКЦЕПТОРЫ ЭЛЕКТРОНОВ – стягивают электроны с соседних атомов Содержат элементы с высокой ЭО (-I) Содержат кратные связи (-M) Бензольное кольцо обедняется электронами Становится менее активным в реакциях с E+
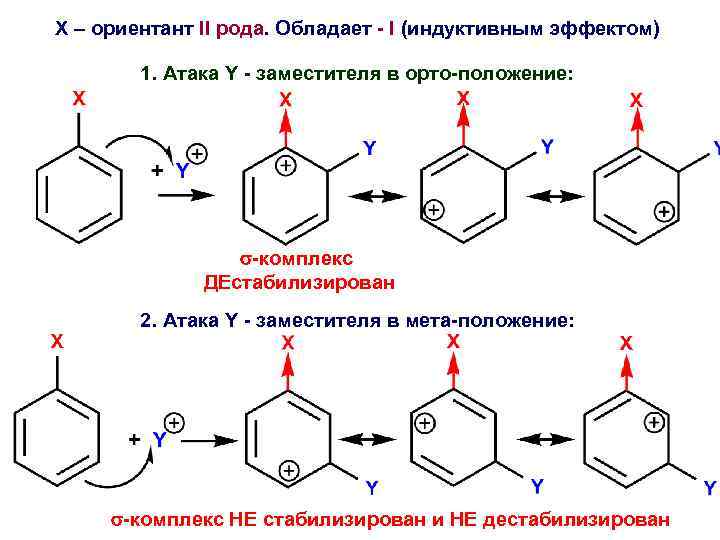 Х – ориентант II рода. Обладает - I (индуктивным эффектом) 1. Атака Y - заместителя в орто-положение: -комплекс ДЕстабилизирован 2. Атака Y - заместителя в мета-положение: -комплекс НЕ стабилизирован и НЕ дестабилизирован
Х – ориентант II рода. Обладает - I (индуктивным эффектом) 1. Атака Y - заместителя в орто-положение: -комплекс ДЕстабилизирован 2. Атака Y - заместителя в мета-положение: -комплекс НЕ стабилизирован и НЕ дестабилизирован
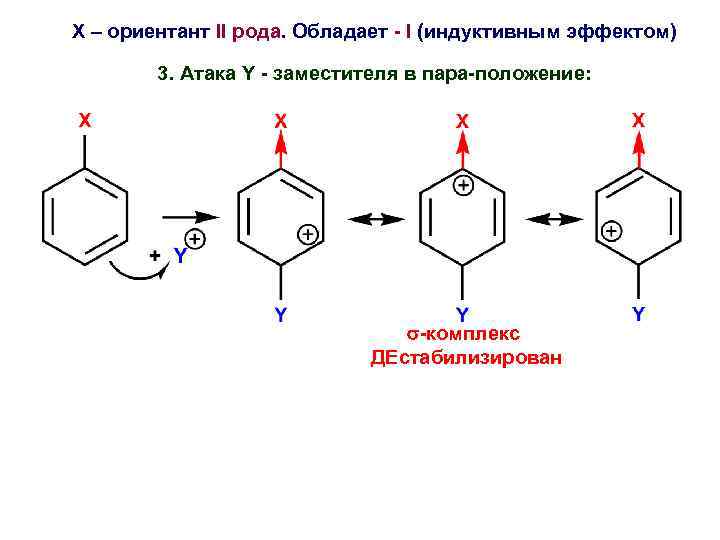 Х – ориентант II рода. Обладает - I (индуктивным эффектом) 3. Атака Y - заместителя в пара-положение: -комплекс ДЕстабилизирован
Х – ориентант II рода. Обладает - I (индуктивным эффектом) 3. Атака Y - заместителя в пара-положение: -комплекс ДЕстабилизирован
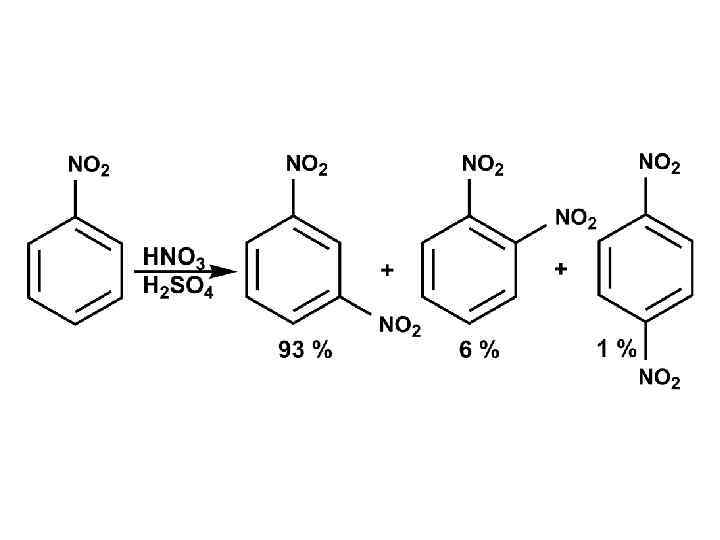
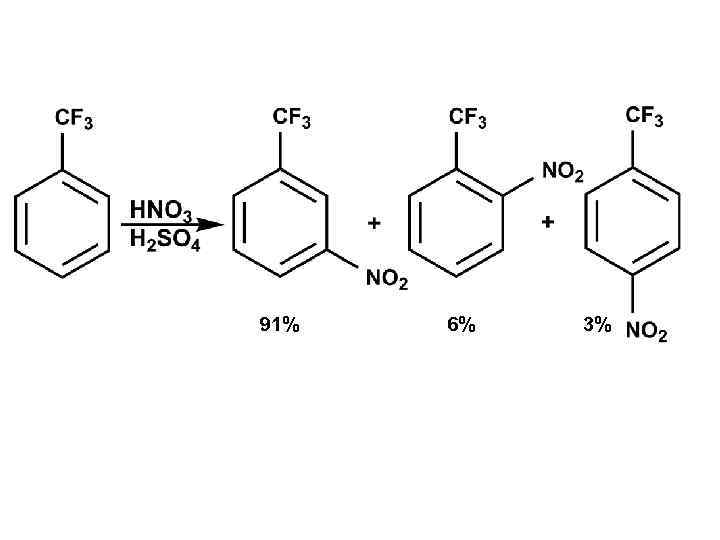 91% 6% 3%
91% 6% 3%
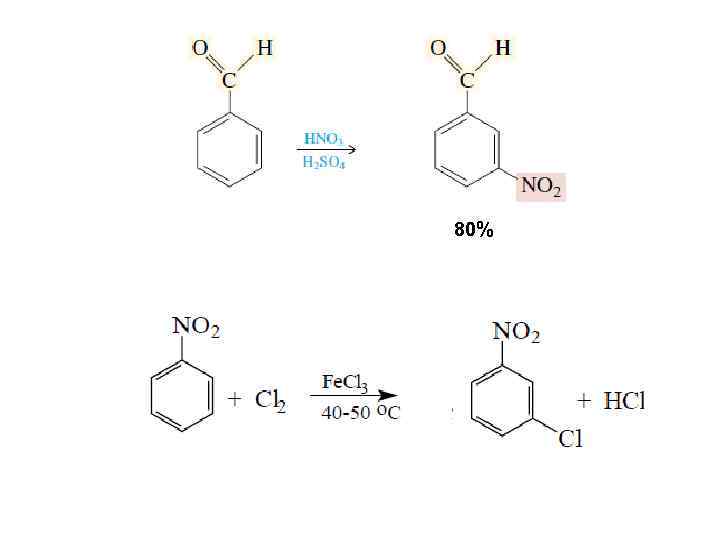 80%
80%
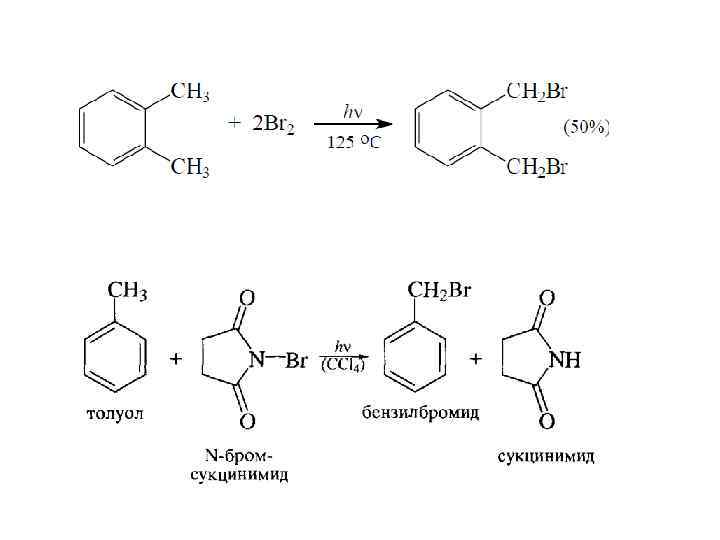
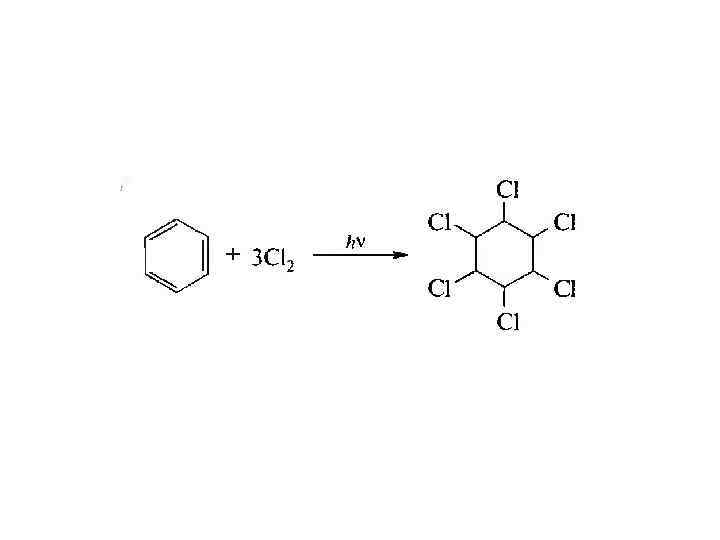
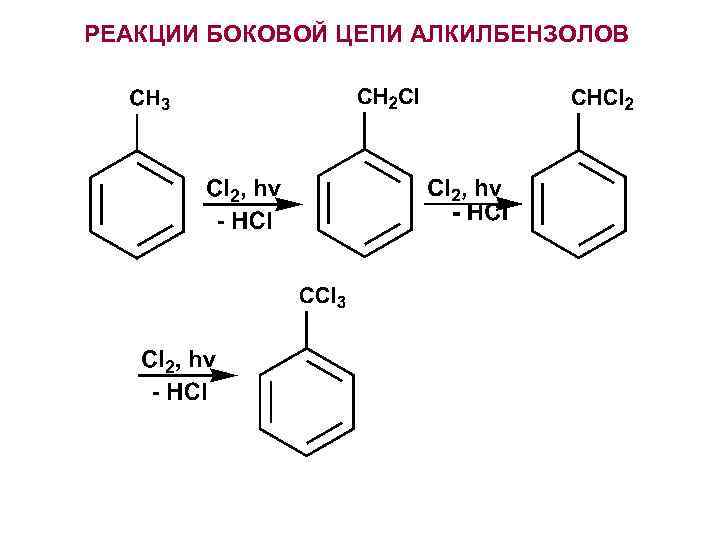 РЕАКЦИИ БОКОВОЙ ЦЕПИ АЛКИЛБЕНЗОЛОВ
РЕАКЦИИ БОКОВОЙ ЦЕПИ АЛКИЛБЕНЗОЛОВ
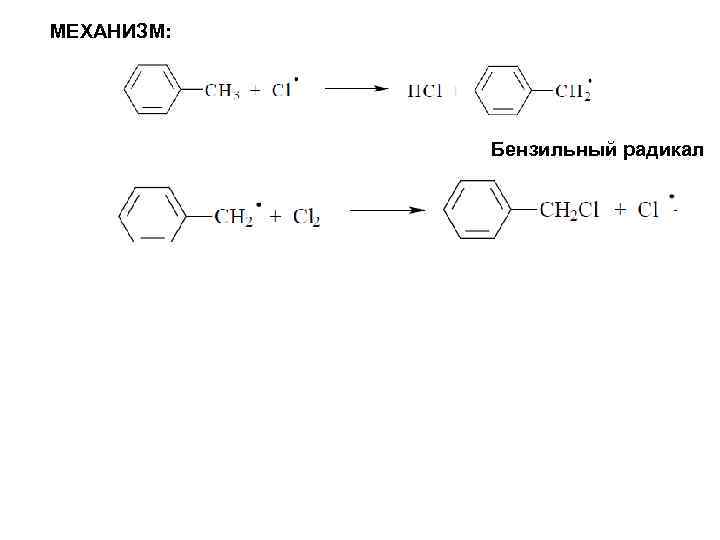 МЕХАНИЗМ: Бензильный радикал
МЕХАНИЗМ: Бензильный радикал
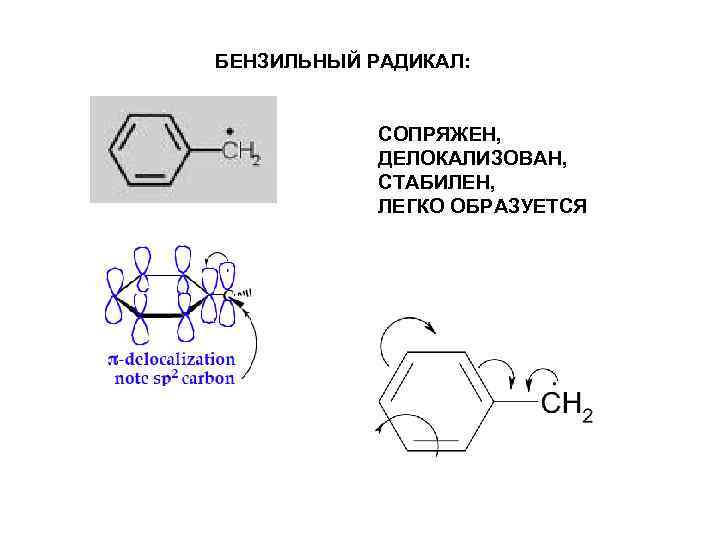 БЕНЗИЛЬНЫЙ РАДИКАЛ: СОПРЯЖЕН, ДЕЛОКАЛИЗОВАН, СТАБИЛЕН, ЛЕГКО ОБРАЗУЕТСЯ
БЕНЗИЛЬНЫЙ РАДИКАЛ: СОПРЯЖЕН, ДЕЛОКАЛИЗОВАН, СТАБИЛЕН, ЛЕГКО ОБРАЗУЕТСЯ
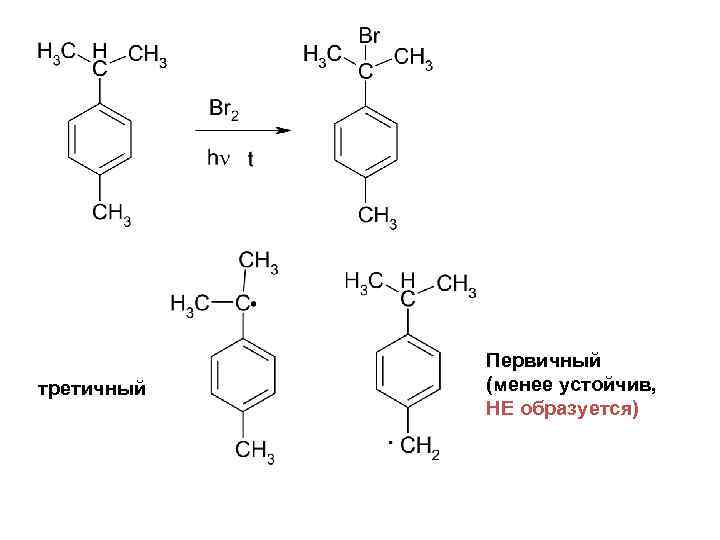 третичный Первичный (менее устойчив, НЕ образуется)
третичный Первичный (менее устойчив, НЕ образуется)
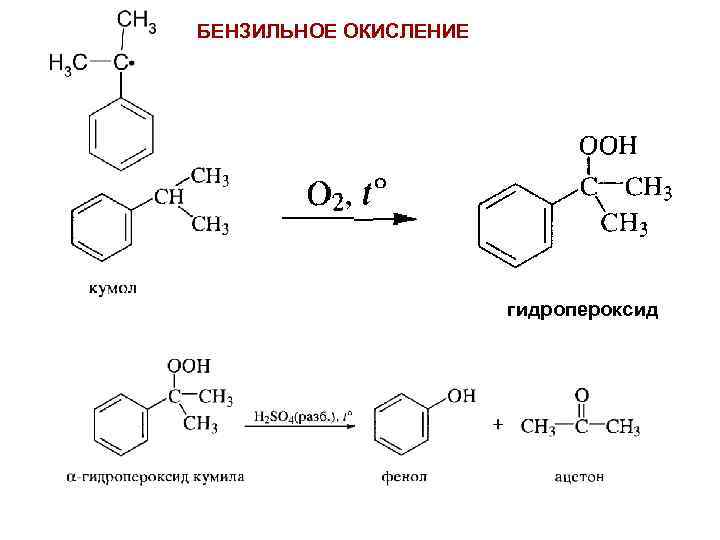 БЕНЗИЛЬНОЕ ОКИСЛЕНИЕ гидропероксид
БЕНЗИЛЬНОЕ ОКИСЛЕНИЕ гидропероксид
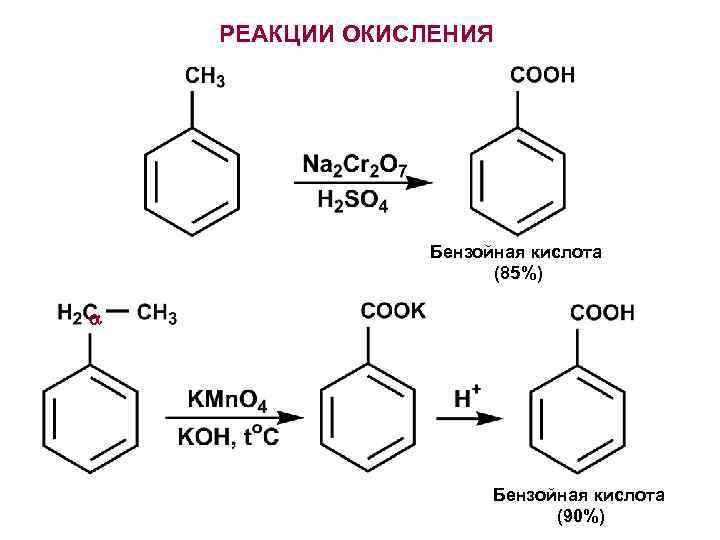 РЕАКЦИИ ОКИСЛЕНИЯ Бензойная кислота (85%) Бензойная кислота (90%)
РЕАКЦИИ ОКИСЛЕНИЯ Бензойная кислота (85%) Бензойная кислота (90%)
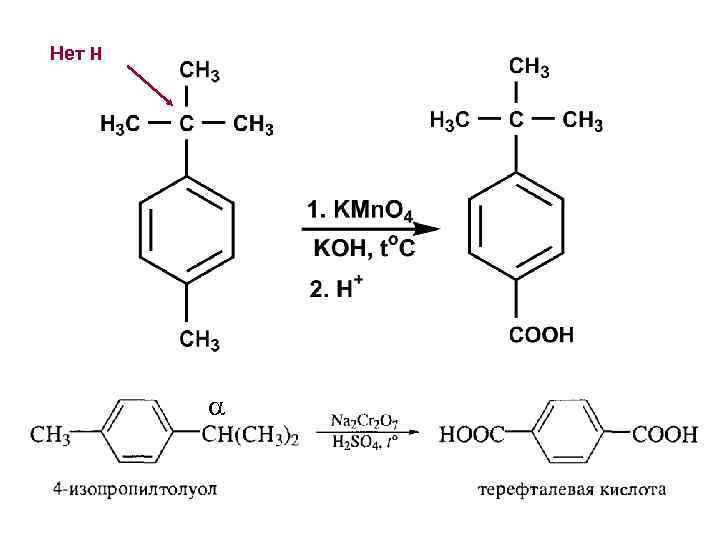 Нет Н
Нет Н
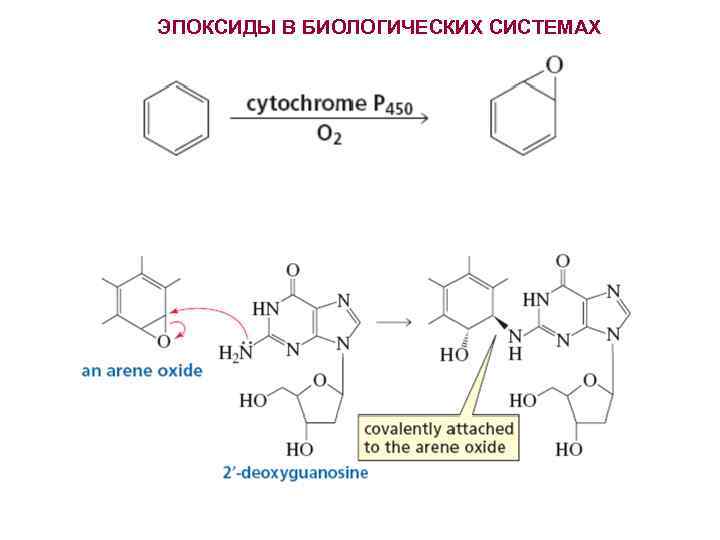 ЭПОКСИДЫ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
ЭПОКСИДЫ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
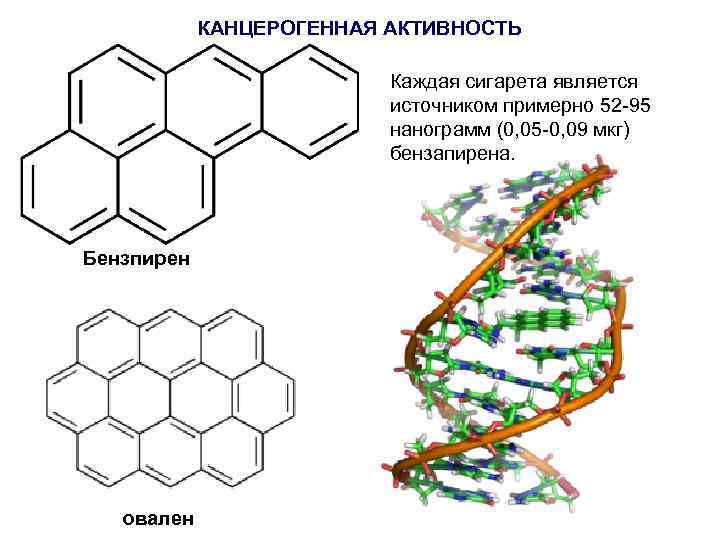 КАНЦЕРОГЕННАЯ АКТИВНОСТЬ Каждая сигарета является источником примерно 52 -95 нанограмм (0, 05 -0, 09 мкг) бензапирена. Бензпирен овален
КАНЦЕРОГЕННАЯ АКТИВНОСТЬ Каждая сигарета является источником примерно 52 -95 нанограмм (0, 05 -0, 09 мкг) бензапирена. Бензпирен овален


