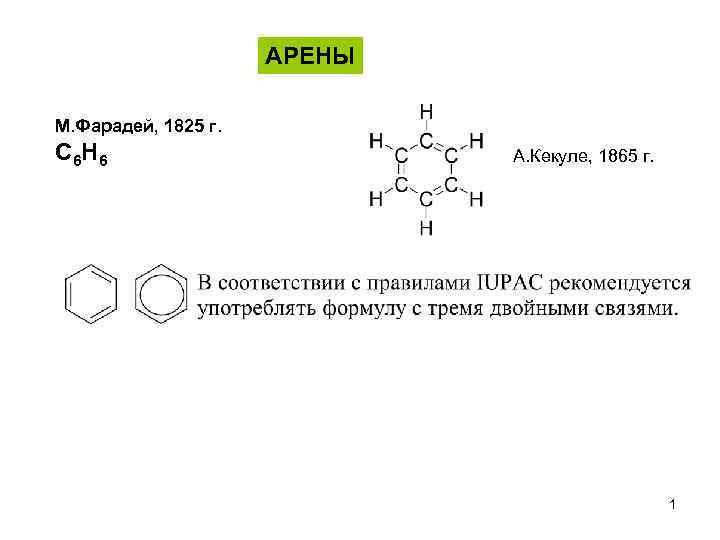
 АРЕНЫ М. Фарадей, 1825 г. С 6 H 6 А. Кекуле, 1865 г. 1
АРЕНЫ М. Фарадей, 1825 г. С 6 H 6 А. Кекуле, 1865 г. 1
 Номенклатура 2
Номенклатура 2
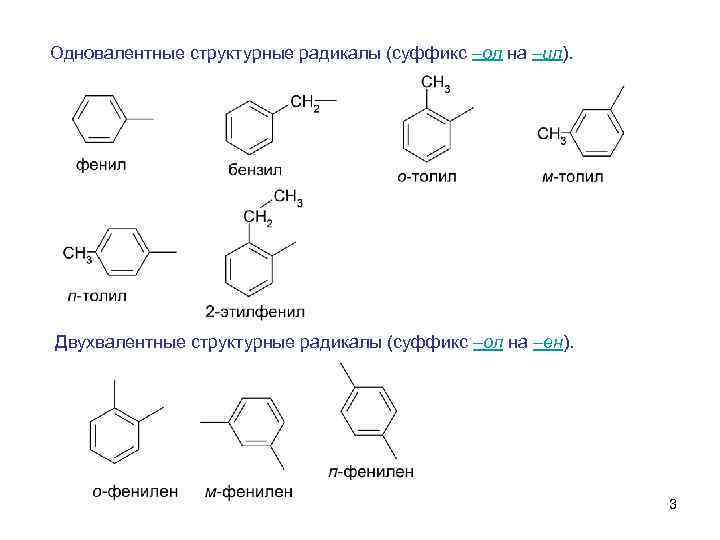 Одновалентные структурные радикалы (суффикс –ол на –ил). Двухвалентные структурные радикалы (суффикс –ол на –ен). 3
Одновалентные структурные радикалы (суффикс –ол на –ил). Двухвалентные структурные радикалы (суффикс –ол на –ен). 3
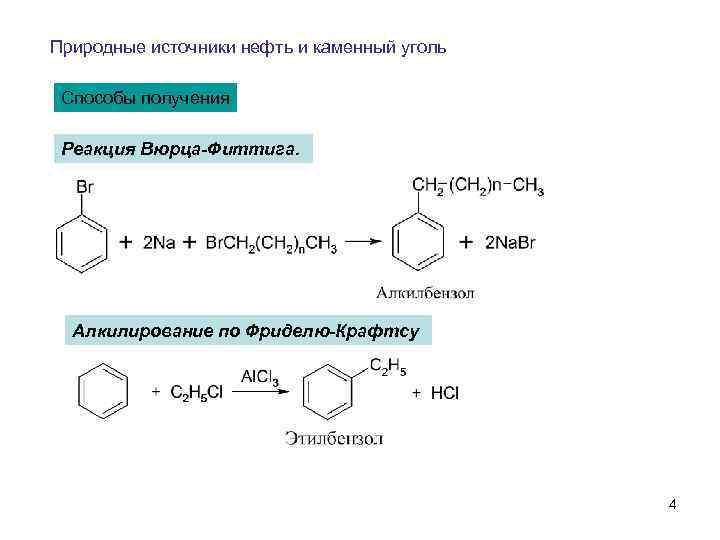 Природные источники нефть и каменный уголь Способы получения Реакция Вюрца-Фиттига. Алкилирование по Фриделю-Крафтсу 4
Природные источники нефть и каменный уголь Способы получения Реакция Вюрца-Фиттига. Алкилирование по Фриделю-Крафтсу 4
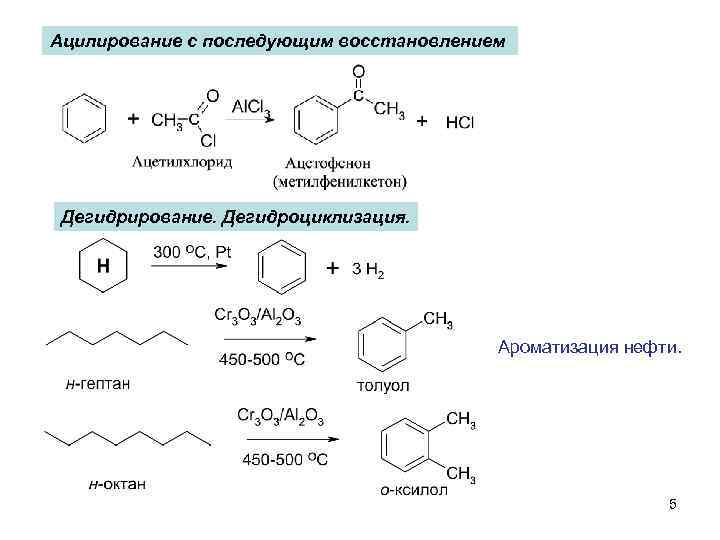 Ацилирование с последующим восстановлением Дегидрирование. Дегидроциклизация. Ароматизация нефти. 5
Ацилирование с последующим восстановлением Дегидрирование. Дегидроциклизация. Ароматизация нефти. 5
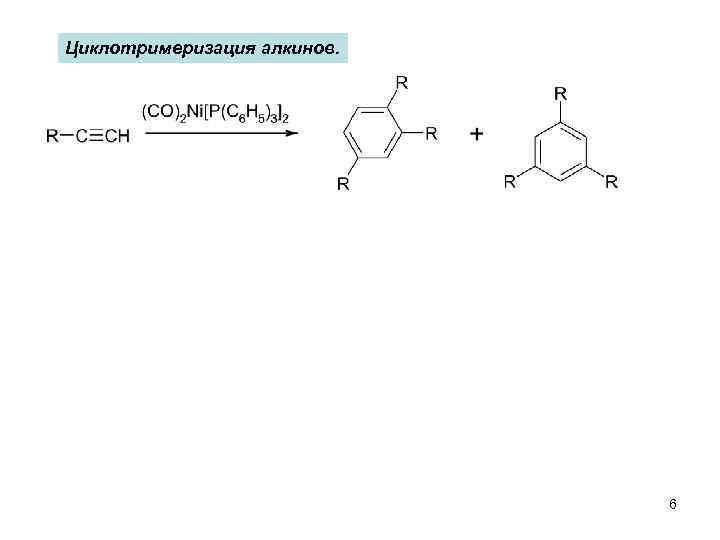 Циклотримеризация алкинов. 6
Циклотримеризация алкинов. 6
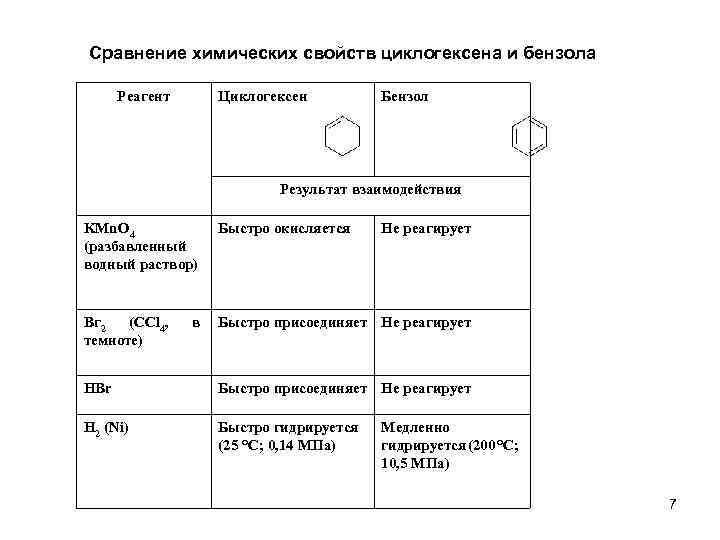 Сравнение химических свойств циклогексена и бензола Реагент Циклогексен Бензол Результат взаимодействия KMn. O 4 (разбавленный водный раствор) Быстро окисляется Вг 2 (CCl 4, темноте) Быстро присоединяет Не реагирует в Не реагирует НВr Быстро присоединяет Не реагирует Н 2 (Ni) Быстро гидрируется (25 °С; 0, 14 МПа) Медленно гидрируется (200 °С; 10, 5 МПа) 7
Сравнение химических свойств циклогексена и бензола Реагент Циклогексен Бензол Результат взаимодействия KMn. O 4 (разбавленный водный раствор) Быстро окисляется Вг 2 (CCl 4, темноте) Быстро присоединяет Не реагирует в Не реагирует НВr Быстро присоединяет Не реагирует Н 2 (Ni) Быстро гидрируется (25 °С; 0, 14 МПа) Медленно гидрируется (200 °С; 10, 5 МПа) 7
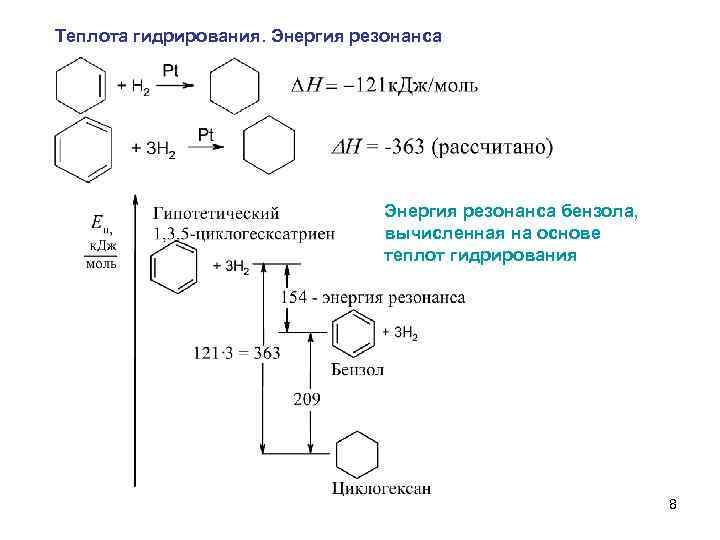 Теплота гидрирования. Энергия резонанса бензола, вычисленная на основе теплот гидрирования 8
Теплота гидрирования. Энергия резонанса бензола, вычисленная на основе теплот гидрирования 8
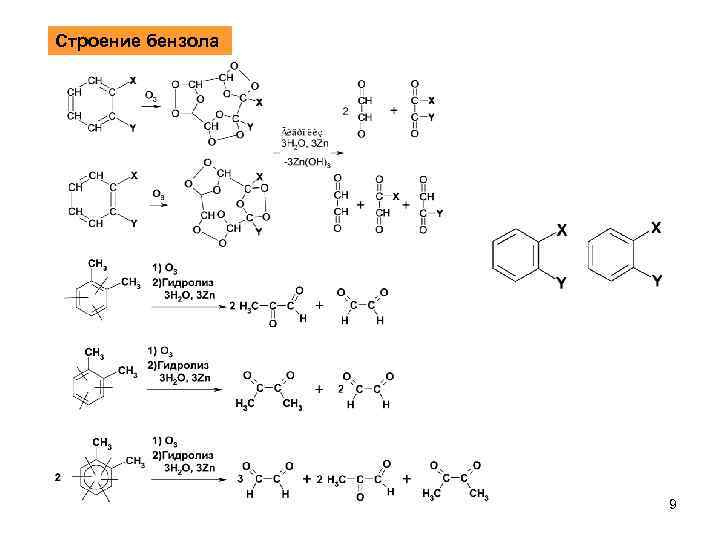 Строение бензола 9
Строение бензола 9
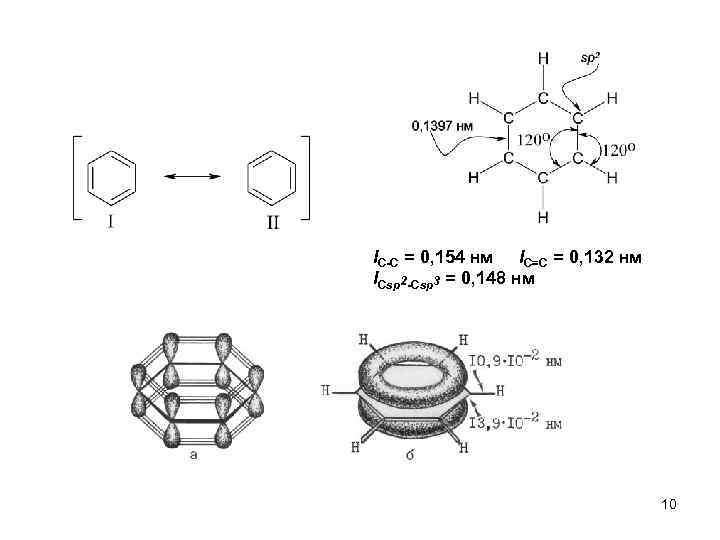 l. С-С = 0, 154 нм l. С=С = 0, 132 нм l. Csp 2 -Csp 3 = 0, 148 нм 10
l. С-С = 0, 154 нм l. С=С = 0, 132 нм l. Csp 2 -Csp 3 = 0, 148 нм 10
 11
11
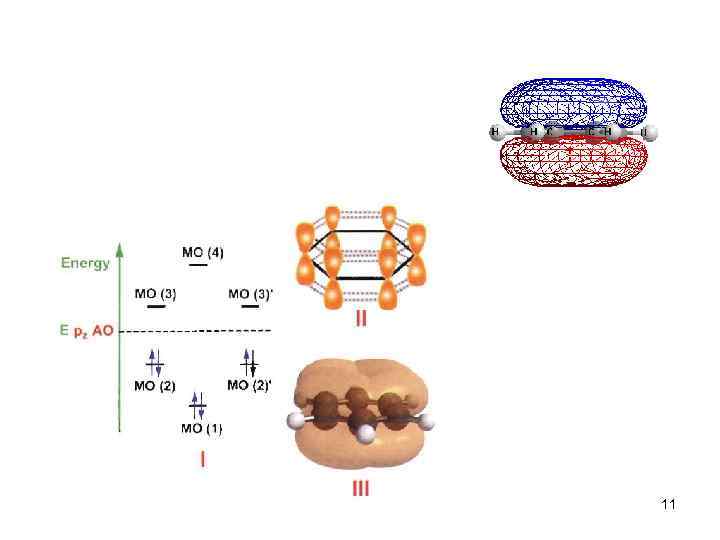
 Ароматичность. Правило Хюккеля. Ароматическими свойствами обладает соединение, если его строение удовлетворяет следующим требованиям: 1. соединение включает в себя плоскую моно- или полициклическую структуру, 2. каждый цикл в этой структуре содержит замкнутую систему делокализованных -электронов, 3. число -электронов в цикле должно равняться (4 n+2), где n= 0, 1, 2, . . . (целое число). Теоретические и экспериментальные критерии ароматичности 1. Термодинамические свойства: дополнительная стабилизация (увеличение устойчивости) ароматических систем. 2. Структурные критерии: замкнутая плоская система делокализованных (сопряженных) -электронов. 3. Магнитные критерии: смещение сигналов протонов ароматических соединений в ЯМР спектрах в область слабого поля. 12
Ароматичность. Правило Хюккеля. Ароматическими свойствами обладает соединение, если его строение удовлетворяет следующим требованиям: 1. соединение включает в себя плоскую моно- или полициклическую структуру, 2. каждый цикл в этой структуре содержит замкнутую систему делокализованных -электронов, 3. число -электронов в цикле должно равняться (4 n+2), где n= 0, 1, 2, . . . (целое число). Теоретические и экспериментальные критерии ароматичности 1. Термодинамические свойства: дополнительная стабилизация (увеличение устойчивости) ароматических систем. 2. Структурные критерии: замкнутая плоская система делокализованных (сопряженных) -электронов. 3. Магнитные критерии: смещение сигналов протонов ароматических соединений в ЯМР спектрах в область слабого поля. 12
 Химические свойства Электрофильное замещение. Механизм SEAr. 13
Химические свойства Электрофильное замещение. Механизм SEAr. 13
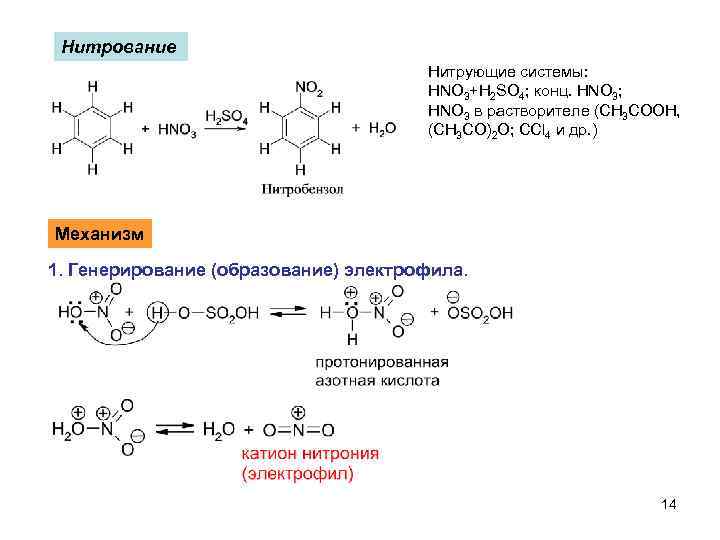 Нитрование Нитрующие системы: HNO 3+H 2 SO 4; конц. HNO 3; HNO 3 в растворителе (CH 3 COOH, (CH 3 CO)2 O; CCl 4 и др. ) Механизм 1. Генерирование (образование) электрофила. 14
Нитрование Нитрующие системы: HNO 3+H 2 SO 4; конц. HNO 3; HNO 3 в растворителе (CH 3 COOH, (CH 3 CO)2 O; CCl 4 и др. ) Механизм 1. Генерирование (образование) электрофила. 14
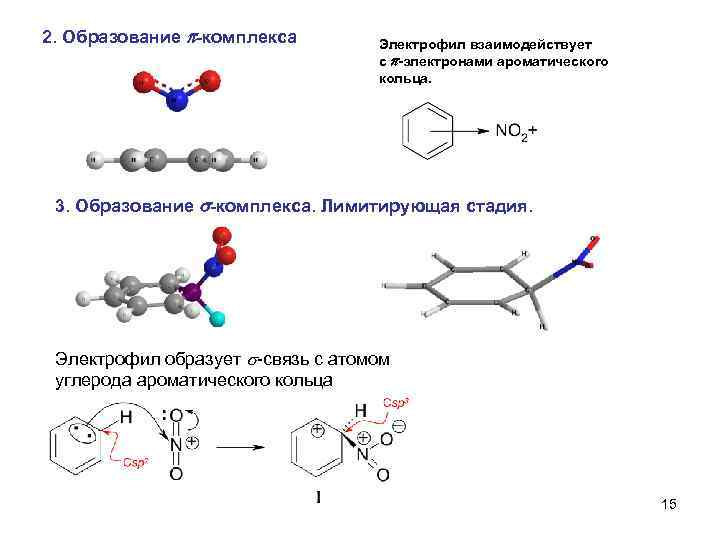 2. Образование -комплекса Электрофил взаимодействует с -электронами ароматического кольца. 3. Образование s-комплекса. Лимитирующая стадия. Электрофил образует s-связь с атомом углерода ароматического кольца 15
2. Образование -комплекса Электрофил взаимодействует с -электронами ароматического кольца. 3. Образование s-комплекса. Лимитирующая стадия. Электрофил образует s-связь с атомом углерода ароматического кольца 15
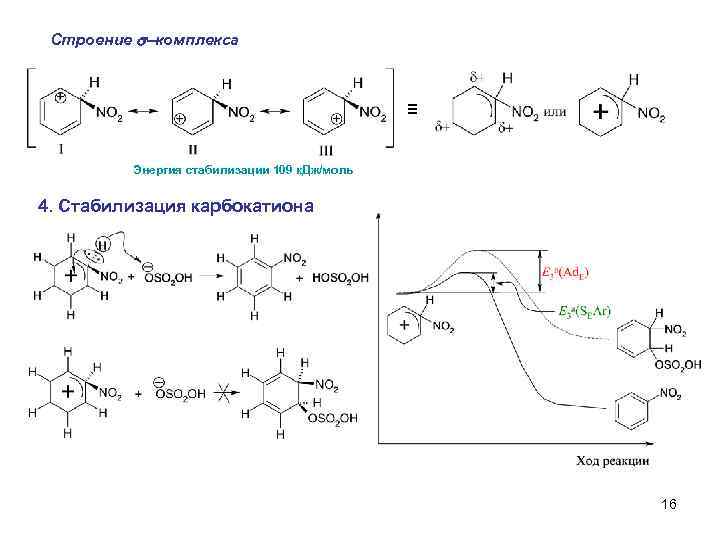 Строение s-комплекса ≡ Энергия стабилизации 109 к. Дж/моль 4. Стабилизация карбокатиона 16
Строение s-комплекса ≡ Энергия стабилизации 109 к. Дж/моль 4. Стабилизация карбокатиона 16
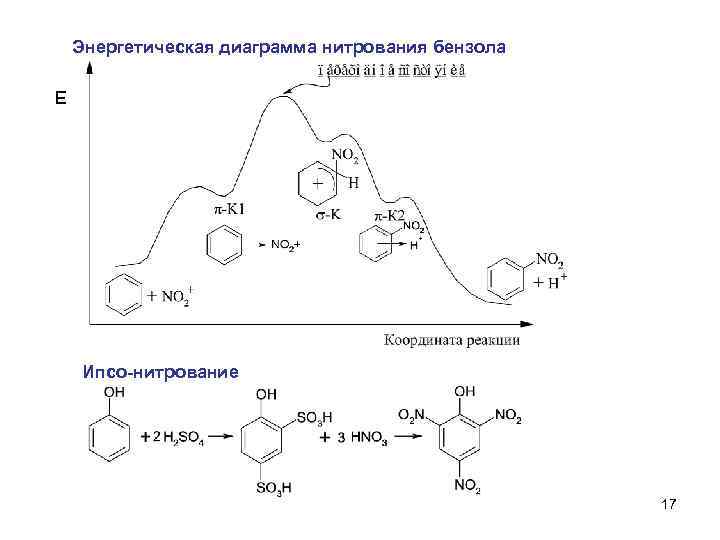 Энергетическая диаграмма нитрования бензола Е Ипсо-нитрование 17
Энергетическая диаграмма нитрования бензола Е Ипсо-нитрование 17
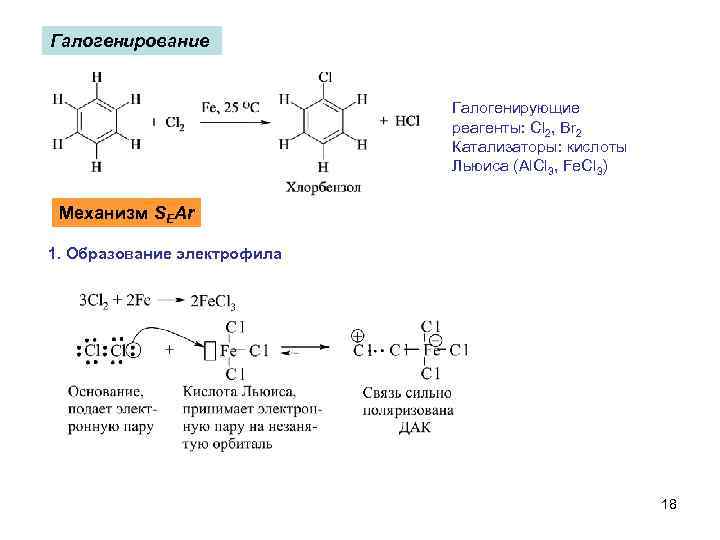 Галогенирование Галогенирующие реагенты: Cl 2, Br 2 Катализаторы: кислоты Льюиса (Al. Cl 3, Fe. Cl 3) Механизм SEAr 1. Образование электрофила 18
Галогенирование Галогенирующие реагенты: Cl 2, Br 2 Катализаторы: кислоты Льюиса (Al. Cl 3, Fe. Cl 3) Механизм SEAr 1. Образование электрофила 18
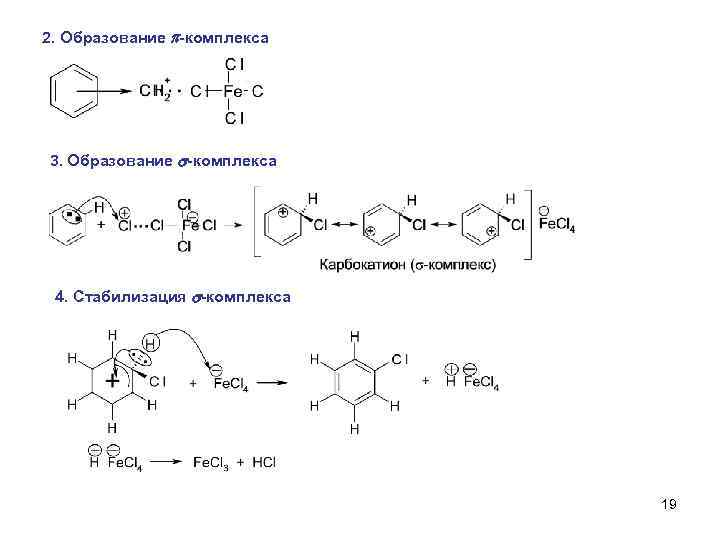 2. Образование -комплекса 3. Образование s-комплекса 4. Стабилизация s-комплекса 19
2. Образование -комплекса 3. Образование s-комплекса 4. Стабилизация s-комплекса 19
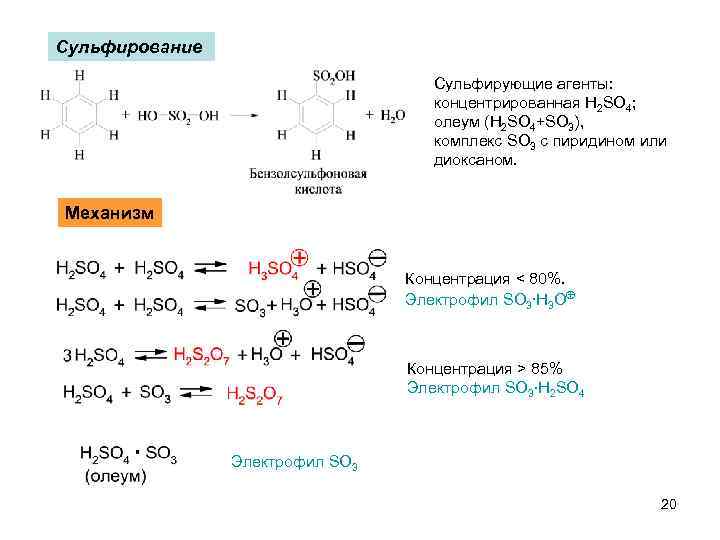 Сульфирование Сульфирующие агенты: концентрированная H 2 SO 4; олеум (H 2 SO 4+SO 3), комплекс SO 3 с пиридином или диоксаном. Механизм Концентрация < 80%. Электрофил SO 3. H 3 O Концентрация > 85% Электрофил SO 3. H 2 SO 4 Электрофил SO 3 20
Сульфирование Сульфирующие агенты: концентрированная H 2 SO 4; олеум (H 2 SO 4+SO 3), комплекс SO 3 с пиридином или диоксаном. Механизм Концентрация < 80%. Электрофил SO 3. H 3 O Концентрация > 85% Электрофил SO 3. H 2 SO 4 Электрофил SO 3 20
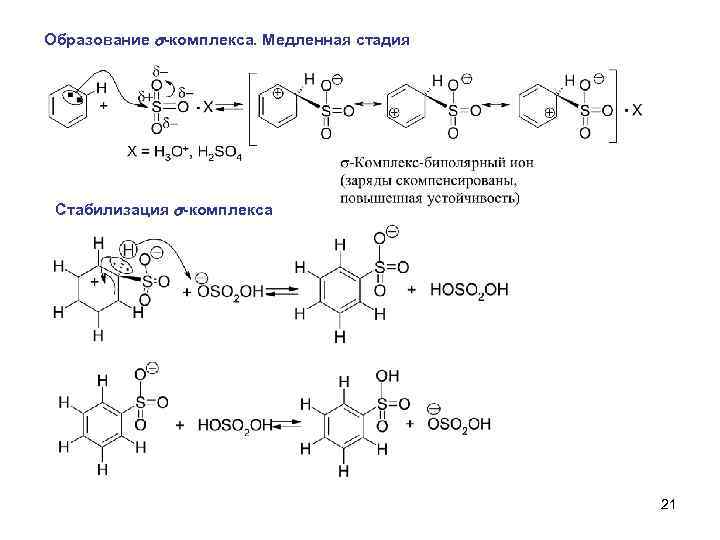 Образование s-комплекса. Медленная стадия Стабилизация s-комплекса 21
Образование s-комплекса. Медленная стадия Стабилизация s-комплекса 21
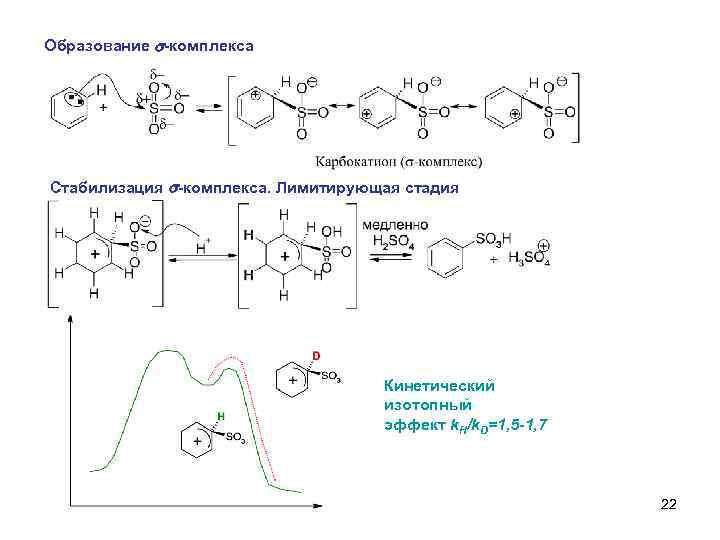 Образование s-комплекса Стабилизация s-комплекса. Лимитирующая стадия Кинетический изотопный эффект k. H/k. D=1, 5 -1, 7 22
Образование s-комплекса Стабилизация s-комплекса. Лимитирующая стадия Кинетический изотопный эффект k. H/k. D=1, 5 -1, 7 22
 Энергетическая диаграмма сульфирования бензола E «Защита» 23
Энергетическая диаграмма сульфирования бензола E «Защита» 23
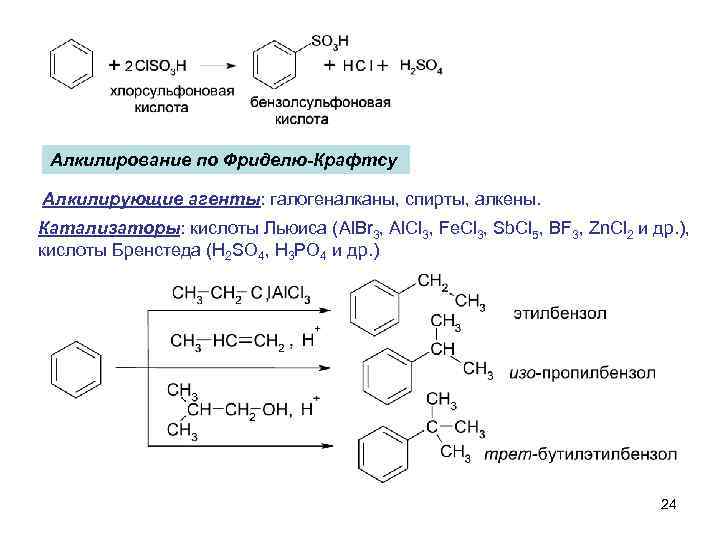 Алкилирование по Фриделю-Крафтсу Алкилирующие агенты: галогеналканы, спирты, алкены. Катализаторы: кислоты Льюиса (Al. Br 3, Al. Cl 3, Fe. Cl 3, Sb. Cl 5, BF 3, Zn. Cl 2 и др. ), кислоты Бренстеда (H 2 SO 4, H 3 PO 4 и др. ) 24
Алкилирование по Фриделю-Крафтсу Алкилирующие агенты: галогеналканы, спирты, алкены. Катализаторы: кислоты Льюиса (Al. Br 3, Al. Cl 3, Fe. Cl 3, Sb. Cl 5, BF 3, Zn. Cl 2 и др. ), кислоты Бренстеда (H 2 SO 4, H 3 PO 4 и др. ) 24
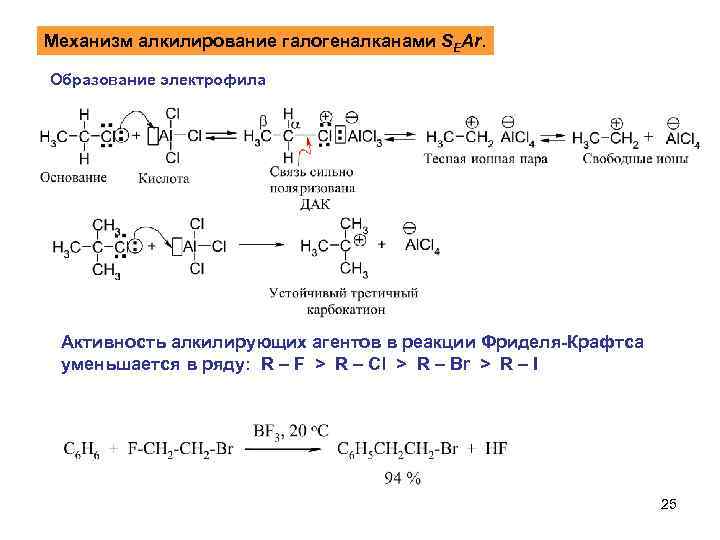 Механизм алкилирование галогеналканами SEAr. Образование электрофила Активность алкилирующих агентов в реакции Фриделя-Крафтса уменьшается в ряду: R – F > R – Cl > R – Br > R – I 25
Механизм алкилирование галогеналканами SEAr. Образование электрофила Активность алкилирующих агентов в реакции Фриделя-Крафтса уменьшается в ряду: R – F > R – Cl > R – Br > R – I 25
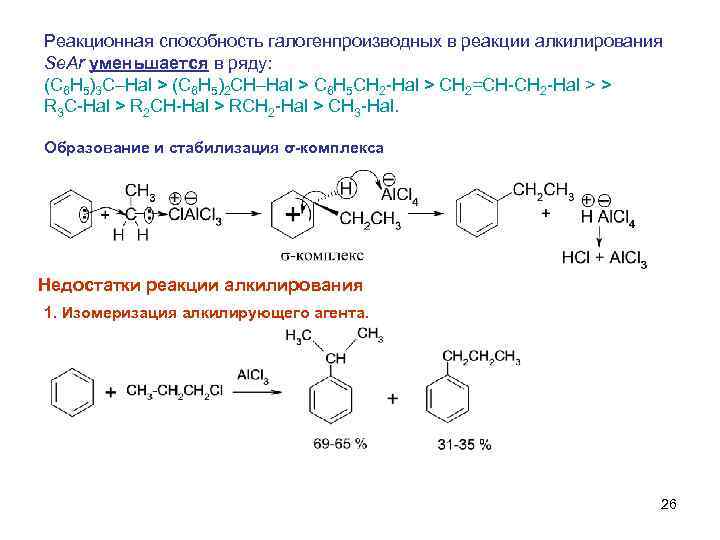 Реакционная способность галогенпроизводных в реакции алкилирования Se. Ar уменьшается в ряду: (C 6 H 5)3 C–Hal > (C 6 H 5)2 CH–Hal > C 6 H 5 CH 2 -Hal > CH 2=CH-CH 2 -Hal > > R 3 C-Hal > R 2 CH-Hal > RCH 2 -Hal > CH 3 -Hal. Образование и стабилизация σ-комплекса Недостатки реакции алкилирования 1. Изомеризация алкилирующего агента. 26
Реакционная способность галогенпроизводных в реакции алкилирования Se. Ar уменьшается в ряду: (C 6 H 5)3 C–Hal > (C 6 H 5)2 CH–Hal > C 6 H 5 CH 2 -Hal > CH 2=CH-CH 2 -Hal > > R 3 C-Hal > R 2 CH-Hal > RCH 2 -Hal > CH 3 -Hal. Образование и стабилизация σ-комплекса Недостатки реакции алкилирования 1. Изомеризация алкилирующего агента. 26
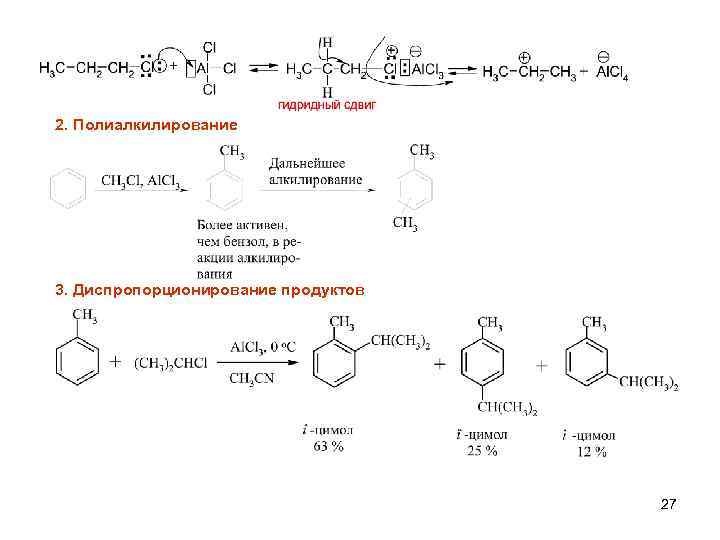 2. Полиалкилирование 3. Диспропорционирование продуктов 27
2. Полиалкилирование 3. Диспропорционирование продуктов 27
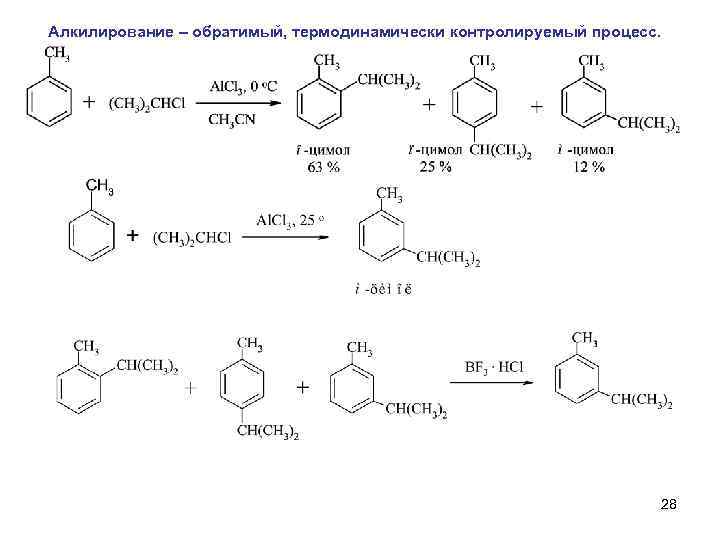 Алкилирование – обратимый, термодинамически контролируемый процесс. 28
Алкилирование – обратимый, термодинамически контролируемый процесс. 28
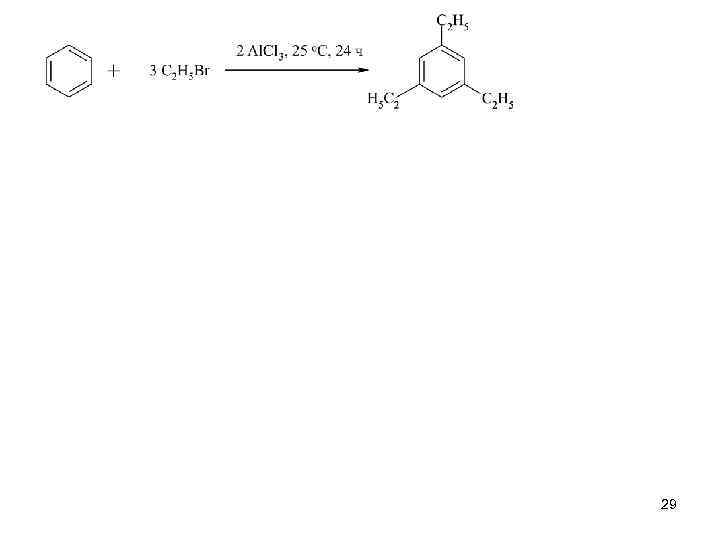 29
29
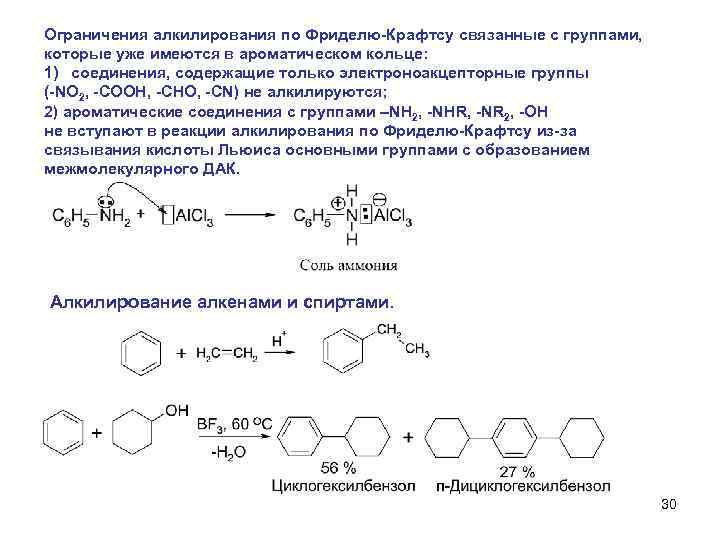 Ограничения алкилирования по Фриделю-Крафтсу связанные с группами, которые уже имеются в ароматическом кольце: 1) соединения, содержащие только электроноакцепторные группы (-NO 2, -COOH, -CHO, -CN) не алкилируются; 2) ароматические соединения с группами –NH 2, -NHR, -NR 2, -OH не вступают в реакции алкилирования по Фриделю-Крафтсу из-за связывания кислоты Льюиса основными группами с образованием межмолекулярного ДАК. Алкилирование алкенами и спиртами. 30
Ограничения алкилирования по Фриделю-Крафтсу связанные с группами, которые уже имеются в ароматическом кольце: 1) соединения, содержащие только электроноакцепторные группы (-NO 2, -COOH, -CHO, -CN) не алкилируются; 2) ароматические соединения с группами –NH 2, -NHR, -NR 2, -OH не вступают в реакции алкилирования по Фриделю-Крафтсу из-за связывания кислоты Льюиса основными группами с образованием межмолекулярного ДАК. Алкилирование алкенами и спиртами. 30
 31
31
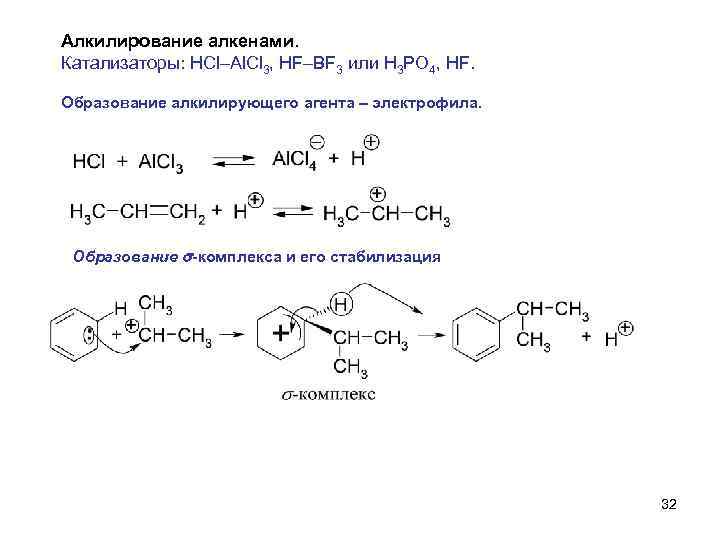 Алкилирование алкенами. Катализаторы: HCl–Al. Cl 3, HF–BF 3 или H 3 PO 4, HF. Образование алкилирующего агента – электрофила. Образование s-комплекса и его стабилизация 32
Алкилирование алкенами. Катализаторы: HCl–Al. Cl 3, HF–BF 3 или H 3 PO 4, HF. Образование алкилирующего агента – электрофила. Образование s-комплекса и его стабилизация 32
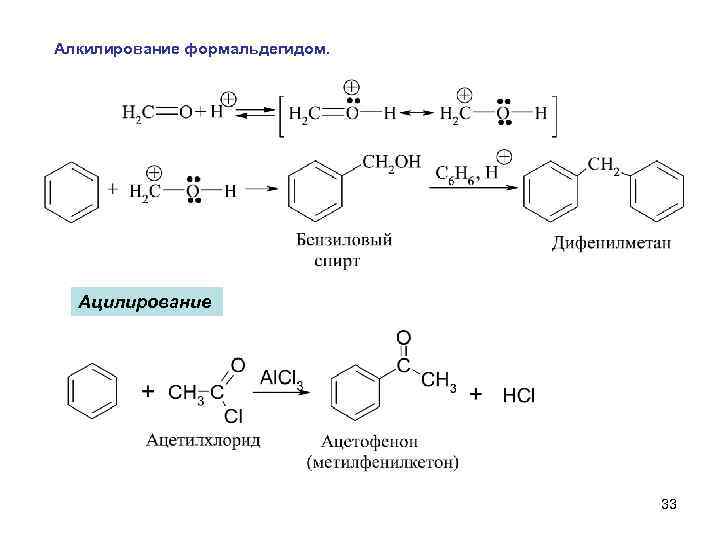 Алкилирование формальдегидом. Ацилирование 33
Алкилирование формальдегидом. Ацилирование 33
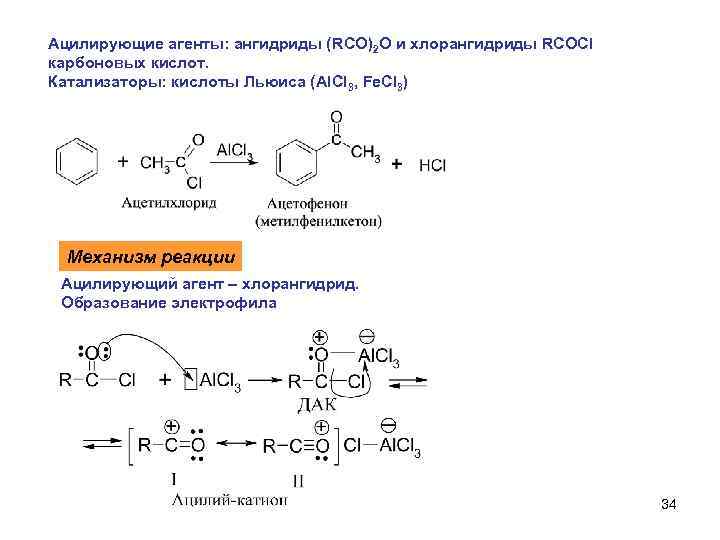 Ацилирующие агенты: ангидриды (RCO)2 O и хлорангидриды RCOCl карбоновых кислот. Катализаторы: кислоты Льюиса (Al. Cl 3, Fe. Cl 3) Механизм реакции Ацилирующий агент – хлорангидрид. Образование электрофила 34
Ацилирующие агенты: ангидриды (RCO)2 O и хлорангидриды RCOCl карбоновых кислот. Катализаторы: кислоты Льюиса (Al. Cl 3, Fe. Cl 3) Механизм реакции Ацилирующий агент – хлорангидрид. Образование электрофила 34
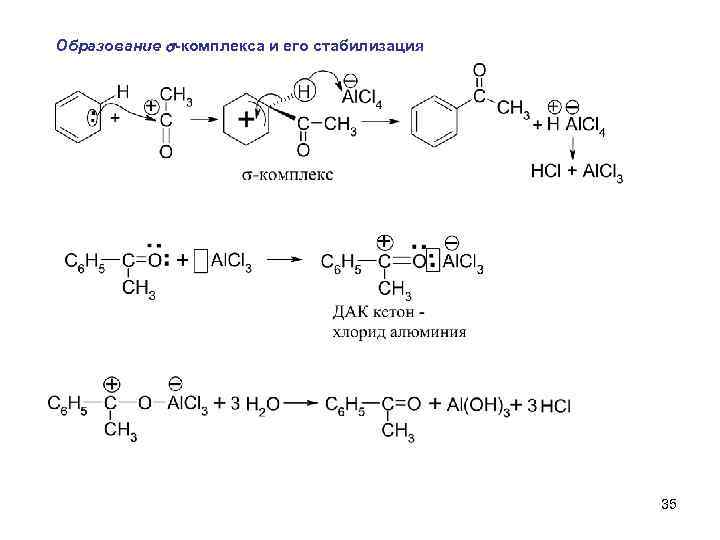 Образование s-комплекса и его стабилизация 35
Образование s-комплекса и его стабилизация 35
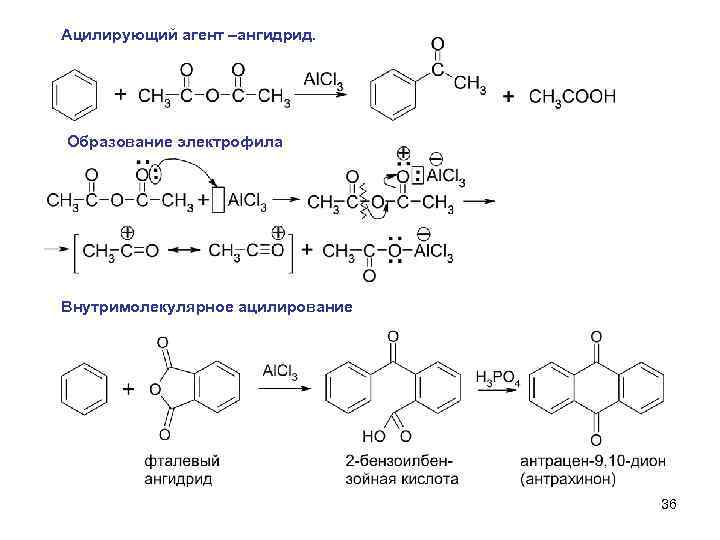 Ацилирующий агент –ангидрид. Образование электрофила Внутримолекулярное ацилирование 36
Ацилирующий агент –ангидрид. Образование электрофила Внутримолекулярное ацилирование 36
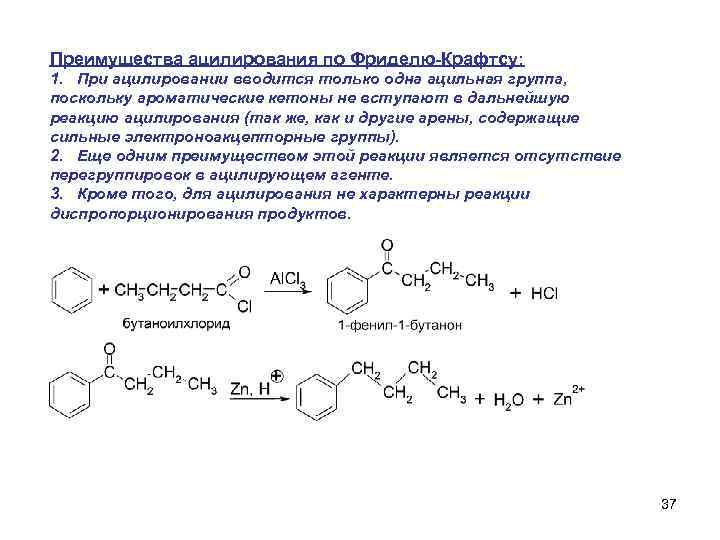 Преимущества ацилирования по Фриделю-Крафтсу: 1. При ацилировании вводится только одна ацильная группа, поскольку ароматические кетоны не вступают в дальнейшую реакцию ацилирования (так же, как и другие арены, содержащие сильные электроноакцепторные группы). 2. Еще одним преимуществом этой реакции является отсутствие перегруппировок в ацилирующем агенте. 3. Кроме того, для ацилирования не характерны реакции диспропорционирования продуктов. 37
Преимущества ацилирования по Фриделю-Крафтсу: 1. При ацилировании вводится только одна ацильная группа, поскольку ароматические кетоны не вступают в дальнейшую реакцию ацилирования (так же, как и другие арены, содержащие сильные электроноакцепторные группы). 2. Еще одним преимуществом этой реакции является отсутствие перегруппировок в ацилирующем агенте. 3. Кроме того, для ацилирования не характерны реакции диспропорционирования продуктов. 37
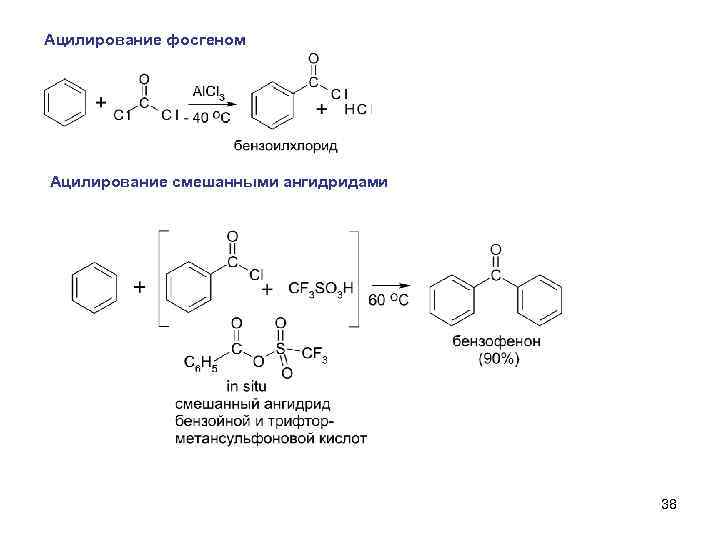 Ацилирование фосгеном Ацилирование смешанными ангидридами 38
Ацилирование фосгеном Ацилирование смешанными ангидридами 38
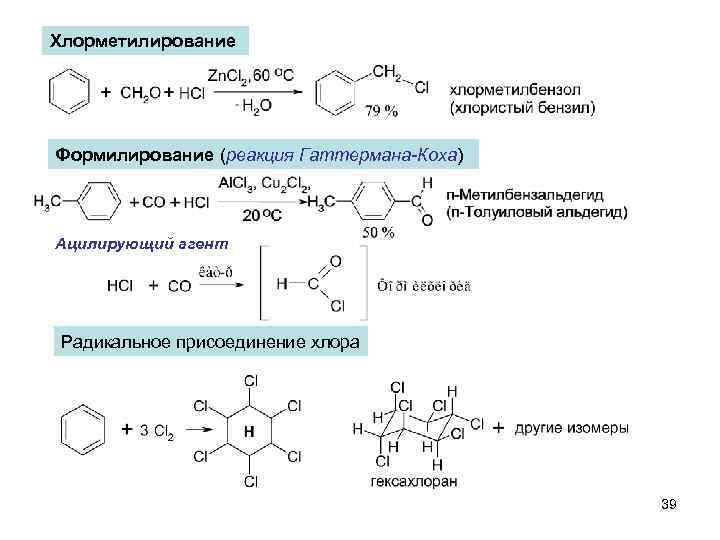 Хлорметилирование Формилирование (реакция Гаттермана-Коха) Ацилирующий агент Радикальное присоединение хлора 39
Хлорметилирование Формилирование (реакция Гаттермана-Коха) Ацилирующий агент Радикальное присоединение хлора 39
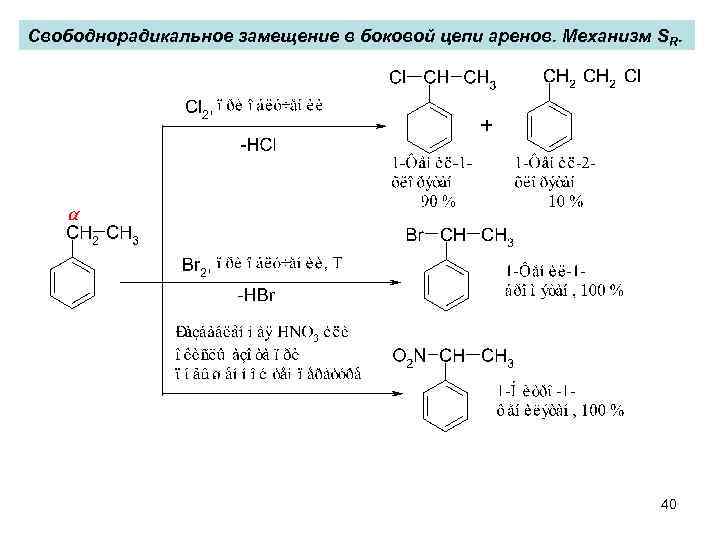 Свободнорадикальное замещение в боковой цепи аренов. Механизм SR. 40
Свободнорадикальное замещение в боковой цепи аренов. Механизм SR. 40
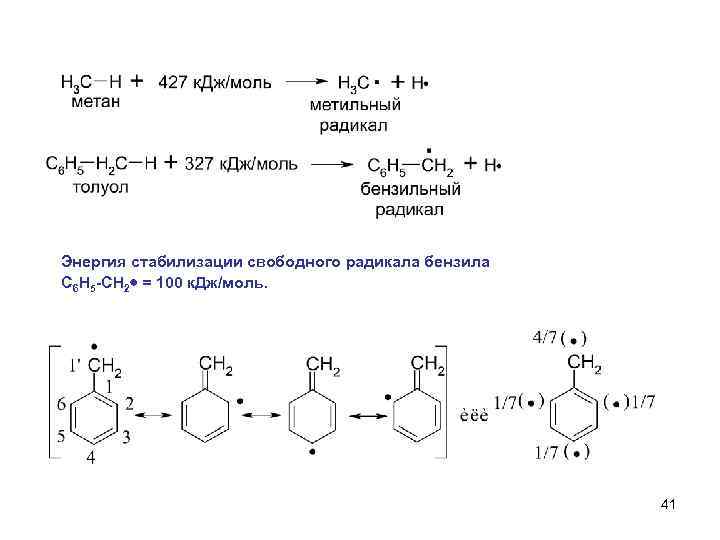 Энергия стабилизации свободного радикала бензила С 6 Н 5 -СН 2 = 100 к. Дж/моль. 41
Энергия стабилизации свободного радикала бензила С 6 Н 5 -СН 2 = 100 к. Дж/моль. 41
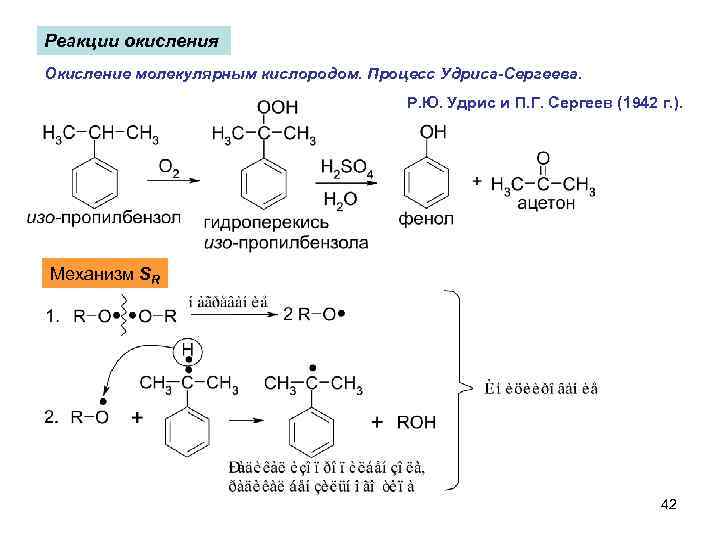 Реакции окисления Окисление молекулярным кислородом. Процесс Удриса-Сергеева. Р. Ю. Удрис и П. Г. Сергеев (1942 г. ). Механизм SR 42
Реакции окисления Окисление молекулярным кислородом. Процесс Удриса-Сергеева. Р. Ю. Удрис и П. Г. Сергеев (1942 г. ). Механизм SR 42
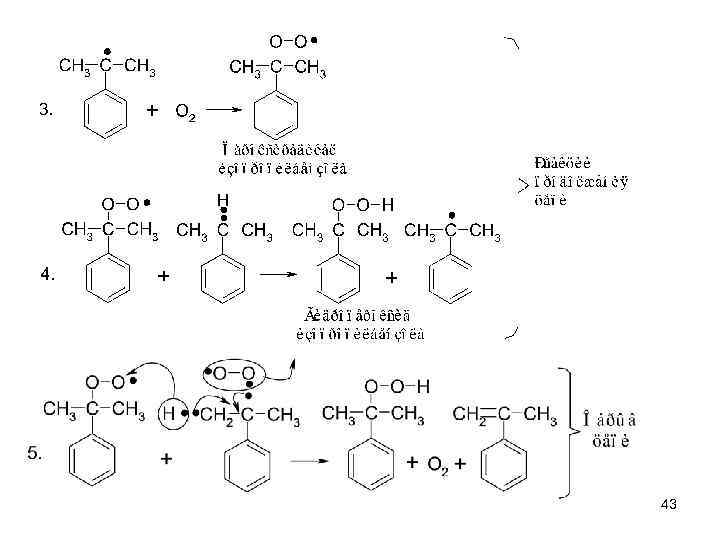 43
43
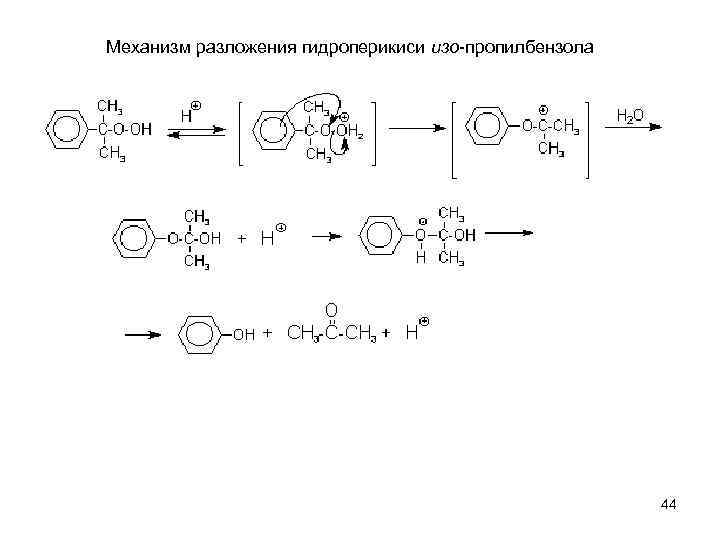 Механизм разложения гидроперикиси изо-пропилбензола 44
Механизм разложения гидроперикиси изо-пропилбензола 44
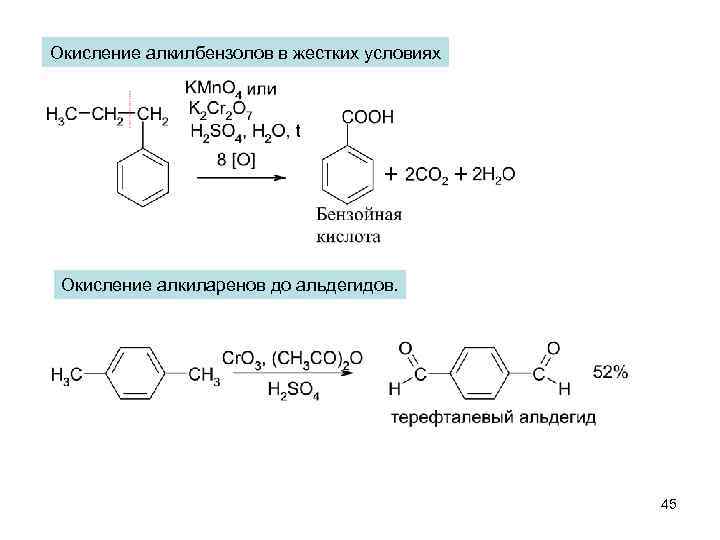 Окисление алкилбензолов в жестких условиях Окисление алкиларенов до альдегидов. 45
Окисление алкилбензолов в жестких условиях Окисление алкиларенов до альдегидов. 45
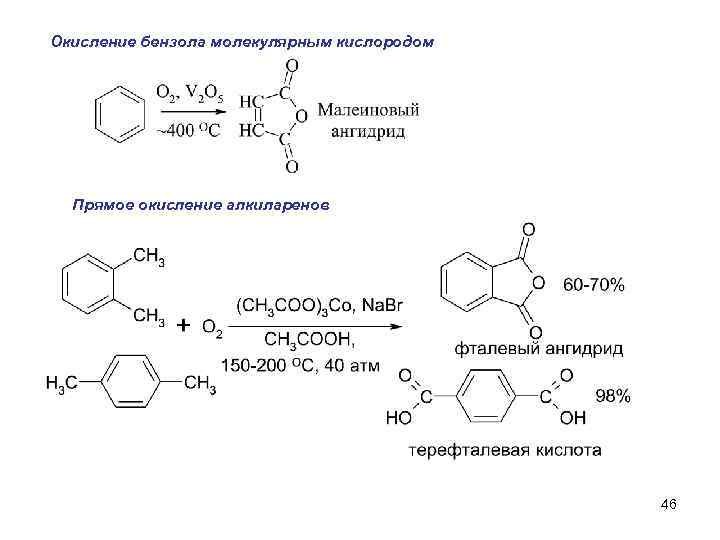 Окисление бензола молекулярным кислородом Прямое окисление алкиларенов 46
Окисление бензола молекулярным кислородом Прямое окисление алкиларенов 46
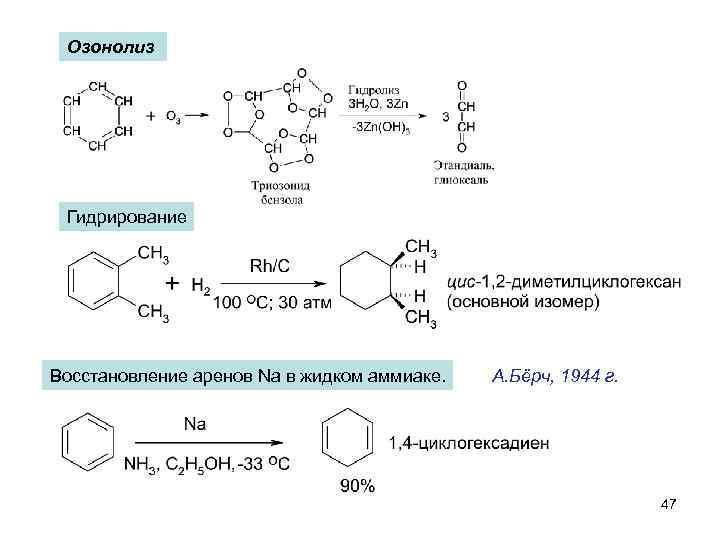 Озонолиз Гидрирование Восстановление аренов Na в жидком аммиаке. А. Бёрч, 1944 г. 47
Озонолиз Гидрирование Восстановление аренов Na в жидком аммиаке. А. Бёрч, 1944 г. 47
 48
48


