 АРЕНЫ
АРЕНЫ
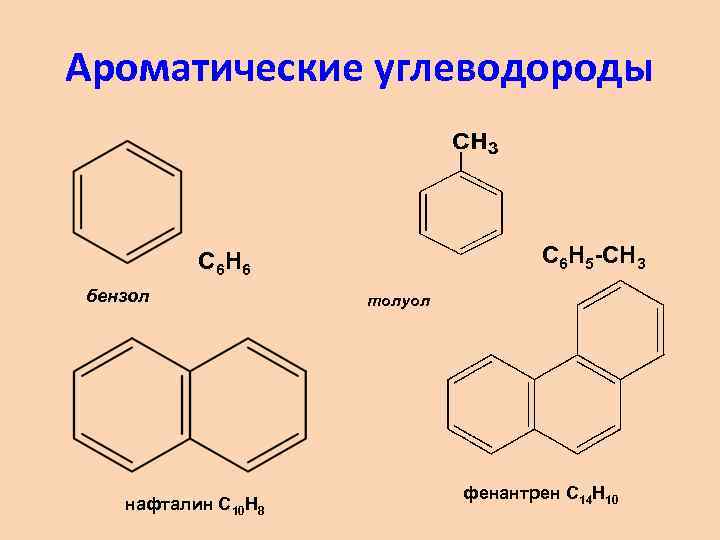 Ароматические углеводороды С 6 Н 5 -СН 3 С 6 Н 6 бензол нафталин С 10 Н 8 толуол фенантрен С 14 Н 10
Ароматические углеводороды С 6 Н 5 -СН 3 С 6 Н 6 бензол нафталин С 10 Н 8 толуол фенантрен С 14 Н 10
 Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией -электронов в циклической системе.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией -электронов в циклической системе.
 Критерии ароматичности аренов: • Атомы углерода в sp 2 -гибридизованном состоянии образуют циклическую систему. • Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение). • Замкнутая система сопряженных связей содержит 4 n+2 -электронов (n-целое число).
Критерии ароматичности аренов: • Атомы углерода в sp 2 -гибридизованном состоянии образуют циклическую систему. • Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение). • Замкнутая система сопряженных связей содержит 4 n+2 -электронов (n-целое число).
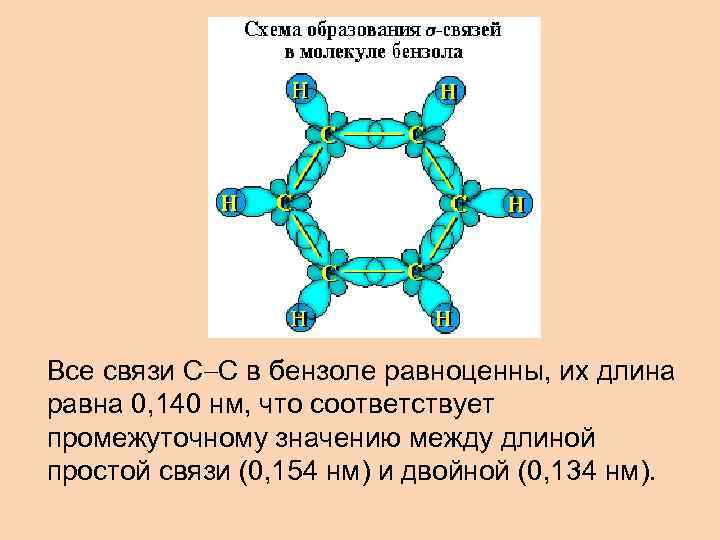 Все связи С С в бензоле равноценны, их длина равна 0, 140 нм, что соответствует промежуточному значению между длиной простой связи (0, 154 нм) и двойной (0, 134 нм).
Все связи С С в бензоле равноценны, их длина равна 0, 140 нм, что соответствует промежуточному значению между длиной простой связи (0, 154 нм) и двойной (0, 134 нм).
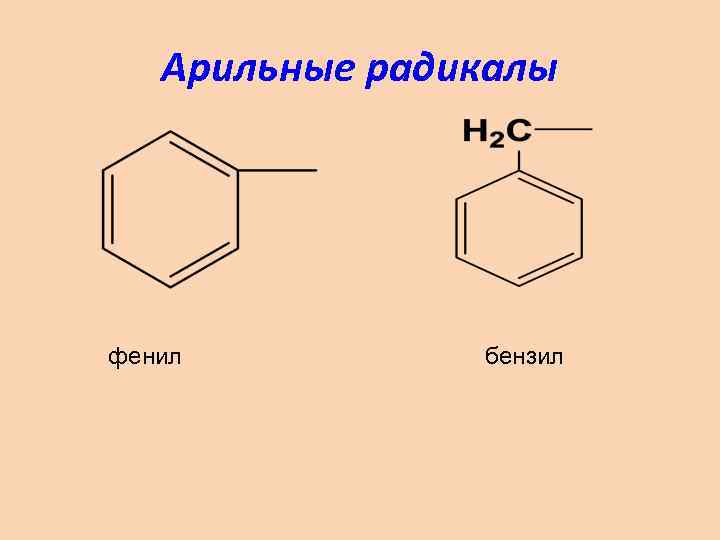 Арильные радикалы фенил бензил
Арильные радикалы фенил бензил
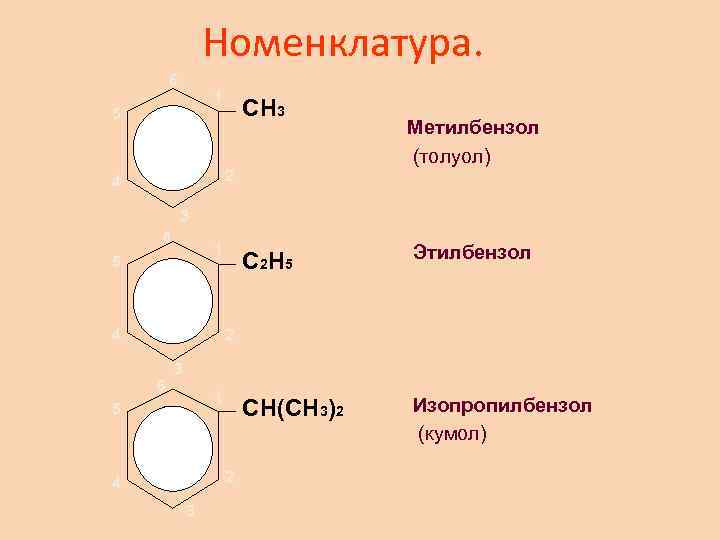 Номенклатура. 6 1 5 CH 3 Метилбензол (толуол) 2 4 3 6 1 5 4 C 2 H 5 Этилбензол CH(CH 3)2 Изопропилбензол (кумол) 2 6 3 1 5 2 4 3
Номенклатура. 6 1 5 CH 3 Метилбензол (толуол) 2 4 3 6 1 5 4 C 2 H 5 Этилбензол CH(CH 3)2 Изопропилбензол (кумол) 2 6 3 1 5 2 4 3
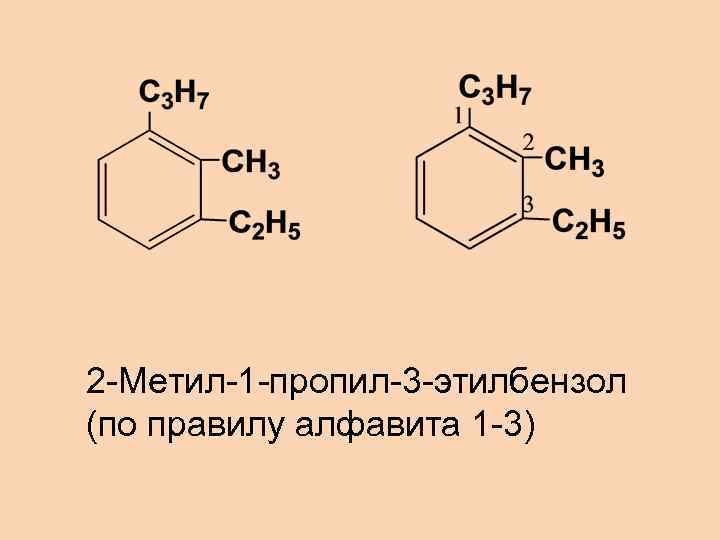 2 -Метил-1 -пропил-3 -этилбензол (по правилу алфавита 1 -3)
2 -Метил-1 -пропил-3 -этилбензол (по правилу алфавита 1 -3)
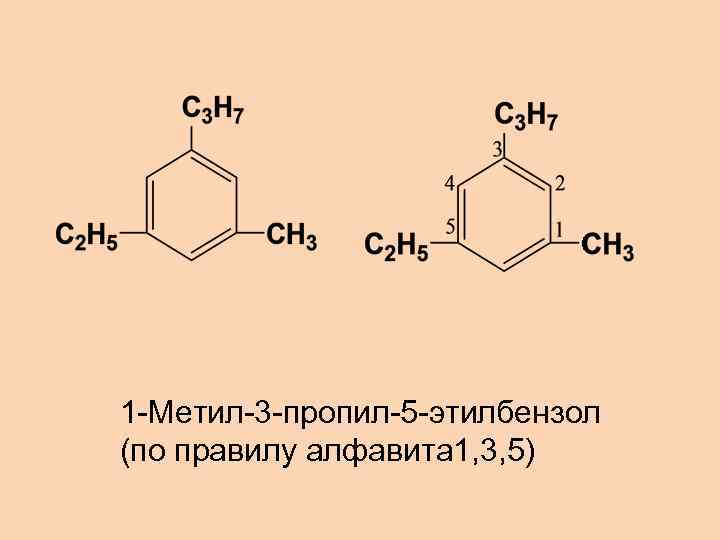 1 -Метил-3 -пропил-5 -этилбензол (по правилу алфавита 1, 3, 5)
1 -Метил-3 -пропил-5 -этилбензол (по правилу алфавита 1, 3, 5)
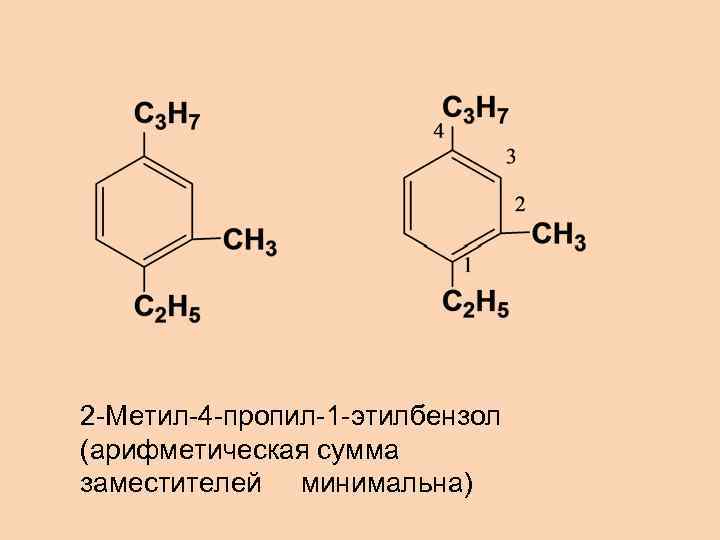 2 -Метил-4 -пропил-1 -этилбензол (арифметическая сумма заместителей минимальна)
2 -Метил-4 -пропил-1 -этилбензол (арифметическая сумма заместителей минимальна)
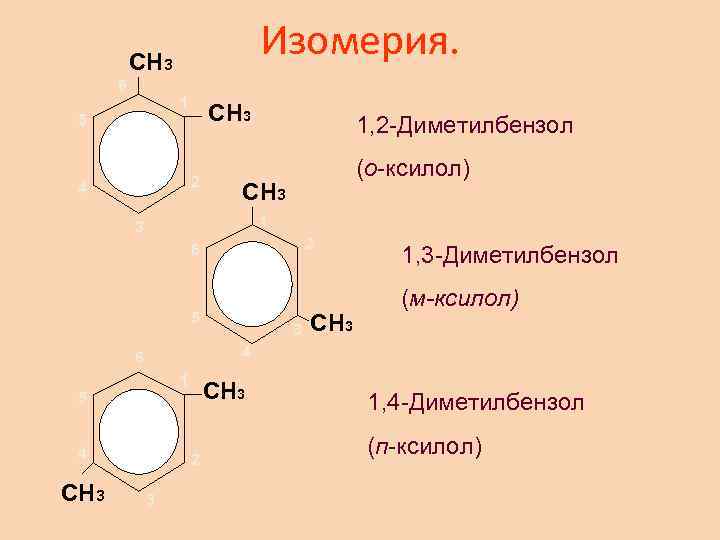 Изомерия. CH 3 6 1 5 CH 3 2 4 1, 2 -Диметилбензол (о-ксилол) CH 3 1 3 2 6 5 CH 3 (м-ксилол) 4 6 1 5 4 CH 3 3 1, 3 -Диметилбензол CH 3 2 3 1, 4 -Диметилбензол (п-ксилол)
Изомерия. CH 3 6 1 5 CH 3 2 4 1, 2 -Диметилбензол (о-ксилол) CH 3 1 3 2 6 5 CH 3 (м-ксилол) 4 6 1 5 4 CH 3 3 1, 3 -Диметилбензол CH 3 2 3 1, 4 -Диметилбензол (п-ксилол)
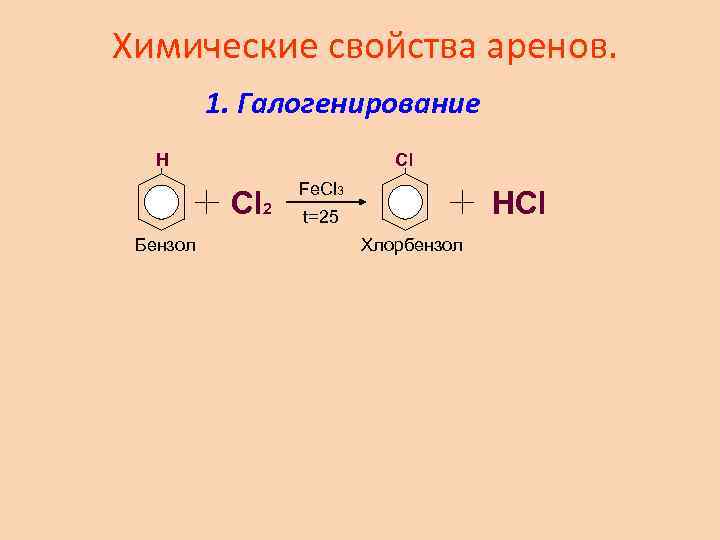 Химические свойства аренов. 1. Галогенирование H Cl Cl 2 Бензол Fe. Cl 3 HCl t=25 Хлорбензол
Химические свойства аренов. 1. Галогенирование H Cl Cl 2 Бензол Fe. Cl 3 HCl t=25 Хлорбензол
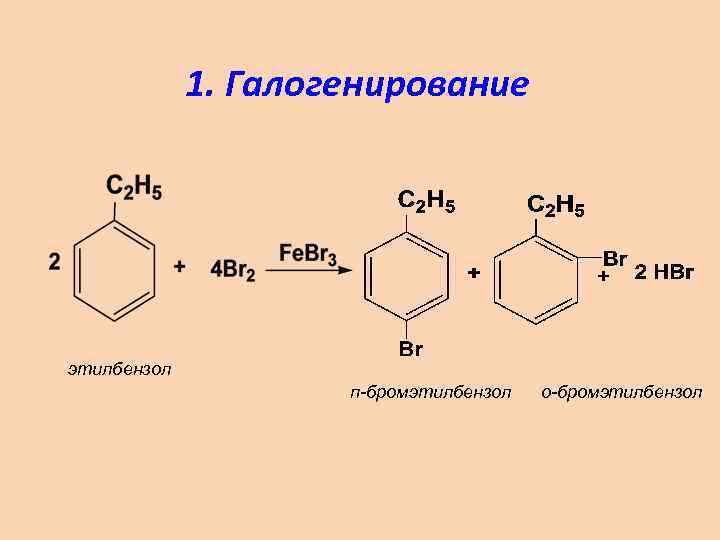 1. Галогенирование этилбензол п-бромэтилбензол о-бромэтилбензол
1. Галогенирование этилбензол п-бромэтилбензол о-бромэтилбензол
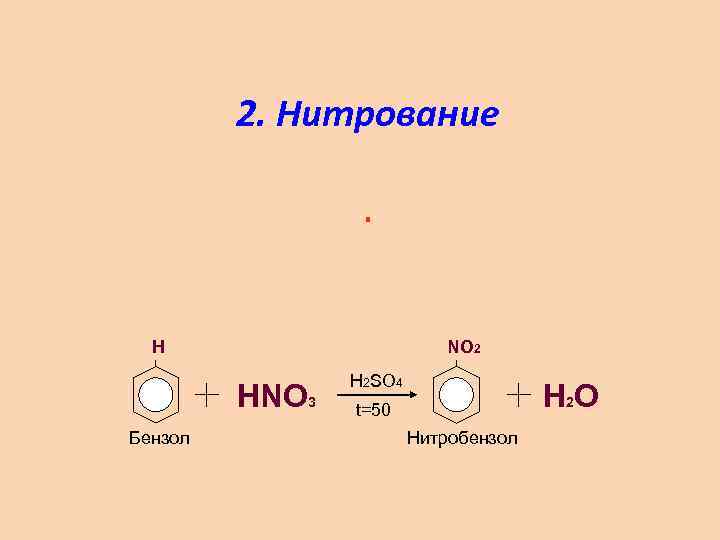 2. Нитрование. H NO 2 HNO 3 Бензол H 2 SO 4 Н 2 О t=50 Нитробензол
2. Нитрование. H NO 2 HNO 3 Бензол H 2 SO 4 Н 2 О t=50 Нитробензол
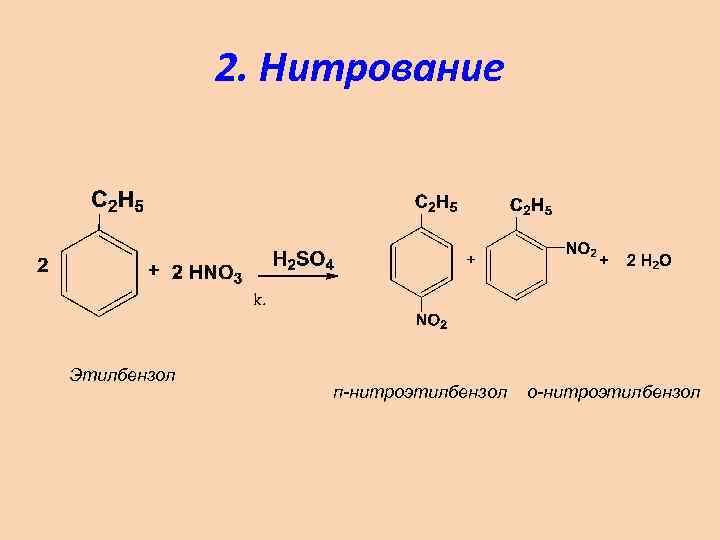 2. Нитрование Этилбензол п-нитроэтилбензол о-нитроэтилбензол
2. Нитрование Этилбензол п-нитроэтилбензол о-нитроэтилбензол
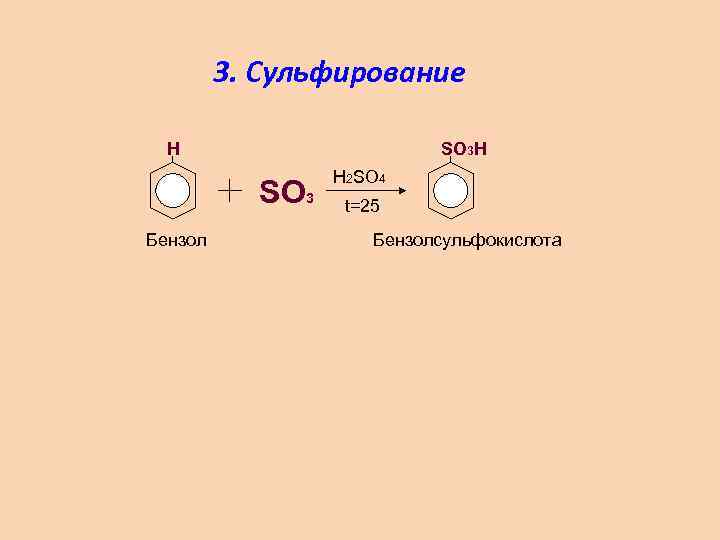 3. Сульфирование H SO 3 Бензол H 2 SO 4 t=25 Бензолсульфокислота
3. Сульфирование H SO 3 Бензол H 2 SO 4 t=25 Бензолсульфокислота
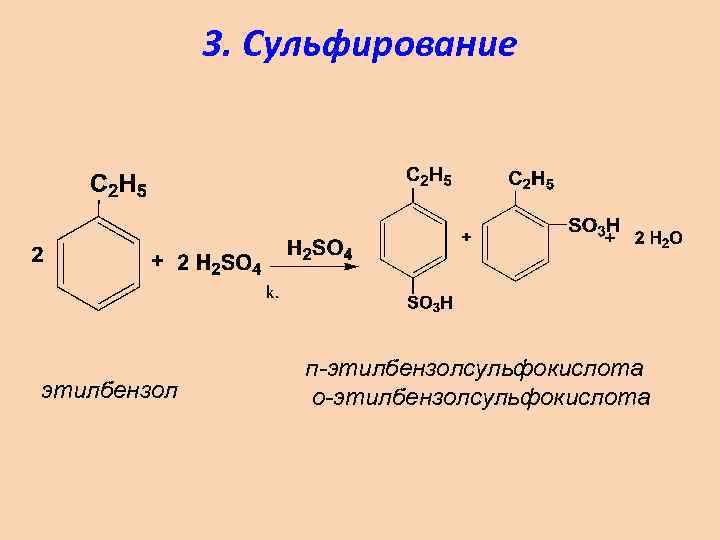 3. Сульфирование этилбензол п-этилбензолсульфокислота о-этилбензолсульфокислота
3. Сульфирование этилбензол п-этилбензолсульфокислота о-этилбензолсульфокислота
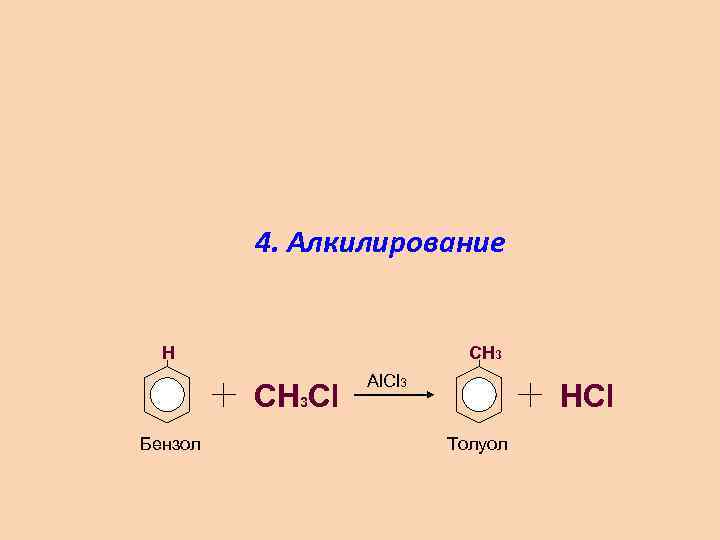 4. Алкилирование H CH 3 Cl Бензол Al. Cl 3 HCl Толуол
4. Алкилирование H CH 3 Cl Бензол Al. Cl 3 HCl Толуол
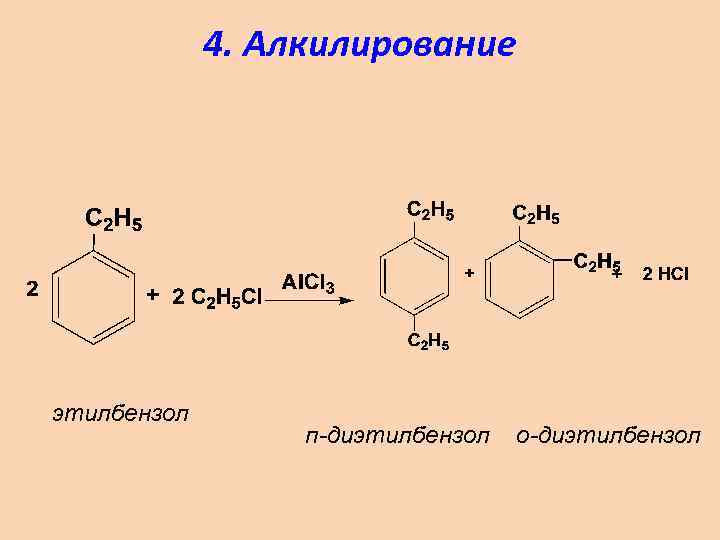 4. Алкилирование этилбензол п-диэтилбензол о-диэтилбензол
4. Алкилирование этилбензол п-диэтилбензол о-диэтилбензол
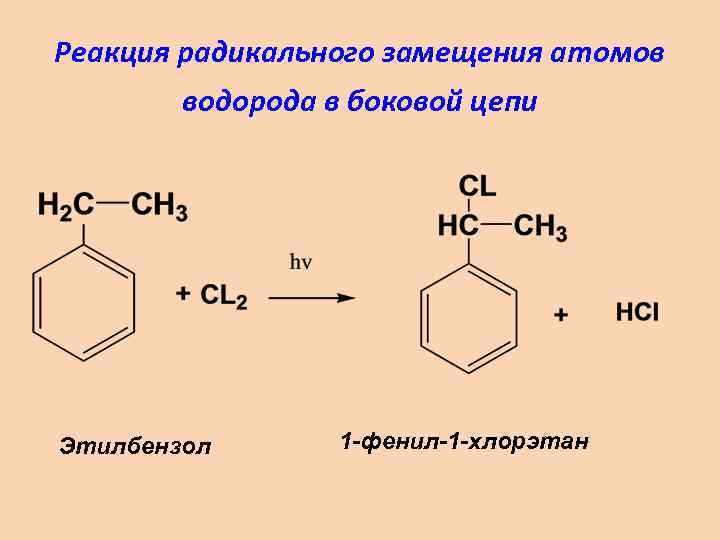 Реакция радикального замещения атомов водорода в боковой цепи Этилбензол 1 -фенил-1 -хлорэтан
Реакция радикального замещения атомов водорода в боковой цепи Этилбензол 1 -фенил-1 -хлорэтан
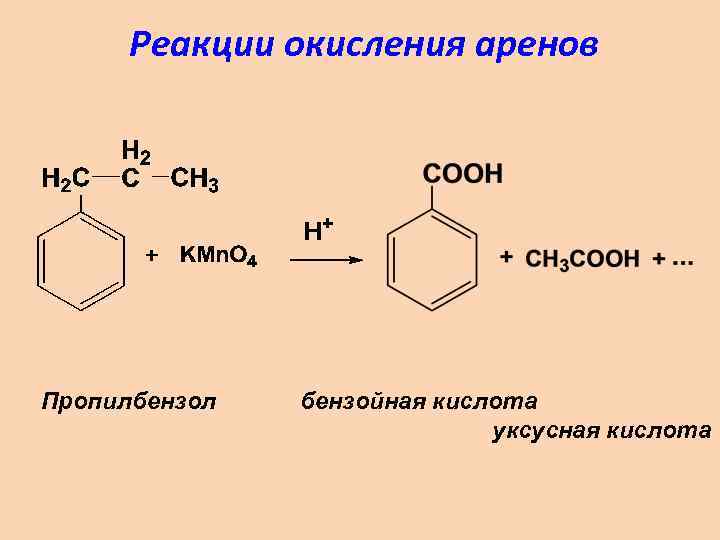 Реакции окисления аренов Пропилбензол бензойная кислота уксусная кислота
Реакции окисления аренов Пропилбензол бензойная кислота уксусная кислота