Л. 9 Арены.ppt
- Количество слайдов: 22
 АРЕНЫ (ароматические углеводороды) - это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей
АРЕНЫ (ароматические углеводороды) - это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей
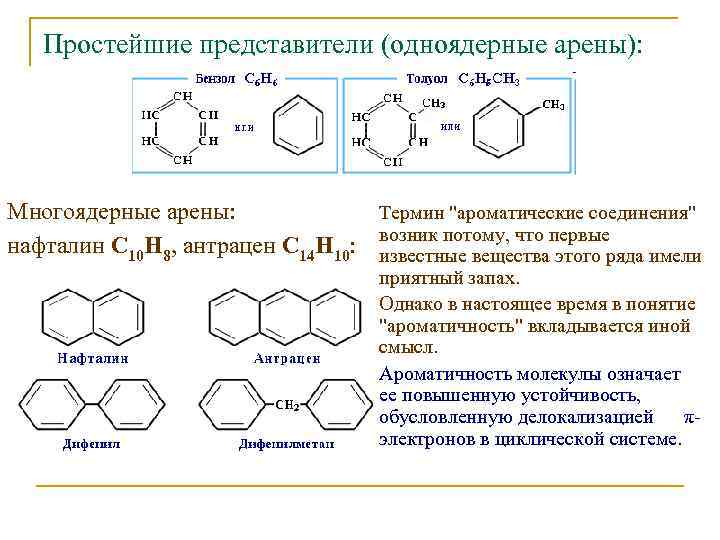 Простейшие представители (одноядерные арены): Многоядерные арены: Термин "ароматические соединения" возник потому, что первые нафталин С 10 Н 8, антрацен С 14 Н 10: известные вещества этого ряда имели приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается иной смысл. Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией πэлектронов в циклической системе.
Простейшие представители (одноядерные арены): Многоядерные арены: Термин "ароматические соединения" возник потому, что первые нафталин С 10 Н 8, антрацен С 14 Н 10: известные вещества этого ряда имели приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается иной смысл. Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией πэлектронов в циклической системе.
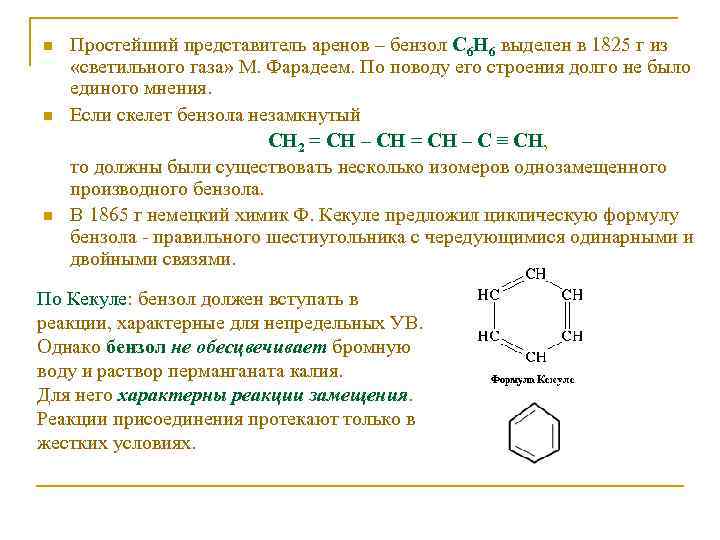 n n n Простейший представитель аренов – бензол С 6 Н 6 выделен в 1825 г из «светильного газа» М. Фарадеем. По поводу его строения долго не было единого мнения. Если скелет бензола незамкнутый СН 2 = СН – СН = СН – С ≡ СН, то должны были существовать несколько изомеров однозамещенного производного бензола. В 1865 г немецкий химик Ф. Кекуле предложил циклическую формулу бензола - правильного шестиугольника с чередующимися одинарными и двойными связями. По Кекуле: бензол должен вступать в реакции, характерные для непредельных УВ. Однако бензол не обесцвечивает бромную воду и раствор перманганата калия. Для него характерны реакции замещения. Реакции присоединения протекают только в жестких условиях.
n n n Простейший представитель аренов – бензол С 6 Н 6 выделен в 1825 г из «светильного газа» М. Фарадеем. По поводу его строения долго не было единого мнения. Если скелет бензола незамкнутый СН 2 = СН – СН = СН – С ≡ СН, то должны были существовать несколько изомеров однозамещенного производного бензола. В 1865 г немецкий химик Ф. Кекуле предложил циклическую формулу бензола - правильного шестиугольника с чередующимися одинарными и двойными связями. По Кекуле: бензол должен вступать в реакции, характерные для непредельных УВ. Однако бензол не обесцвечивает бромную воду и раствор перманганата калия. Для него характерны реакции замещения. Реакции присоединения протекают только в жестких условиях.
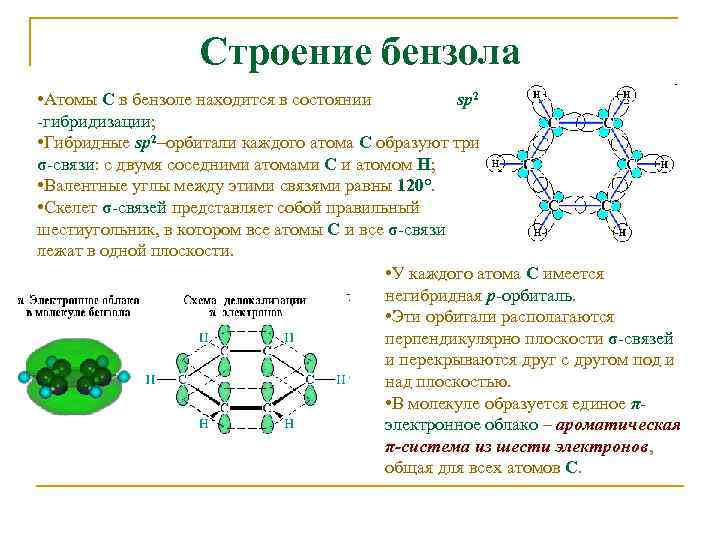 Строение бензола • Атомы С в бензоле находится в состоянии sp 2 -гибридизации; • Гибридные sp 2–орбитали каждого атома С образуют три σ-связи: с двумя соседними атомами С и атомом Н; • Валентные углы между этими связями равны 120°. • Скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы С и все σ-связи лежат в одной плоскости. • У каждого атома С имеется негибридная р-орбиталь. • Эти орбитали располагаются перпендикулярно плоскости σ-связей и перекрываются друг с другом под и над плоскостью. • В молекуле образуется единое πэлектронное облако – ароматическая π-система из шести электронов, общая для всех атомов С.
Строение бензола • Атомы С в бензоле находится в состоянии sp 2 -гибридизации; • Гибридные sp 2–орбитали каждого атома С образуют три σ-связи: с двумя соседними атомами С и атомом Н; • Валентные углы между этими связями равны 120°. • Скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы С и все σ-связи лежат в одной плоскости. • У каждого атома С имеется негибридная р-орбиталь. • Эти орбитали располагаются перпендикулярно плоскости σ-связей и перекрываются друг с другом под и над плоскостью. • В молекуле образуется единое πэлектронное облако – ароматическая π-система из шести электронов, общая для всех атомов С.
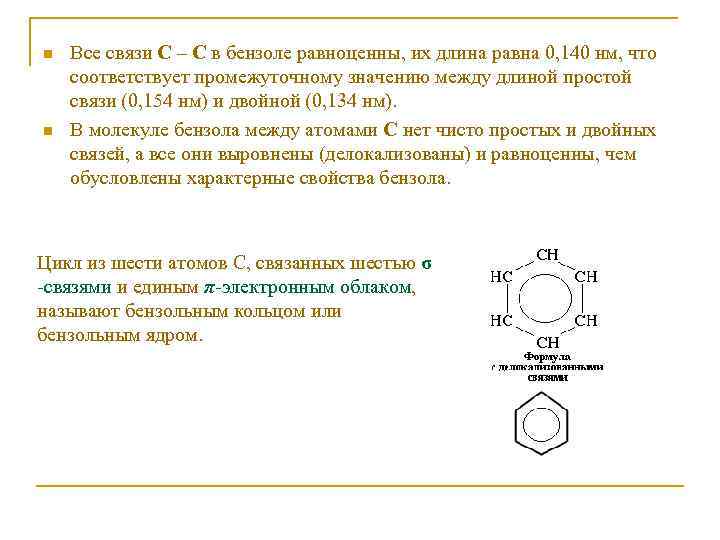 n n Все связи С – С в бензоле равноценны, их длина равна 0, 140 нм, что соответствует промежуточному значению между длиной простой связи (0, 154 нм) и двойной (0, 134 нм). В молекуле бензола между атомами С нет чисто простых и двойных связей, а все они выровнены (делокализованы) и равноценны, чем обусловлены характерные свойства бензола. Цикл из шести атомов С, связанных шестью σ -связями и единым π-электронным облаком, называют бензольным кольцом или бензольным ядром.
n n Все связи С – С в бензоле равноценны, их длина равна 0, 140 нм, что соответствует промежуточному значению между длиной простой связи (0, 154 нм) и двойной (0, 134 нм). В молекуле бензола между атомами С нет чисто простых и двойных связей, а все они выровнены (делокализованы) и равноценны, чем обусловлены характерные свойства бензола. Цикл из шести атомов С, связанных шестью σ -связями и единым π-электронным облаком, называют бензольным кольцом или бензольным ядром.
 Гомологический ряд бензола Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): Общая формула гомологического ряда бензола Cn. H 2 n-6 (n ≥ 6)
Гомологический ряд бензола Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): Общая формула гомологического ряда бензола Cn. H 2 n-6 (n ≥ 6)
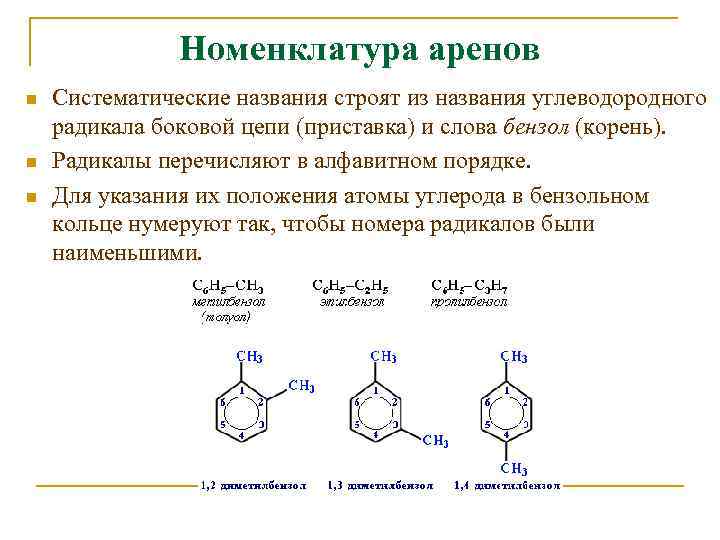 Номенклатура аренов n n n Систематические названия строят из названия углеводородного радикала боковой цепи (приставка) и слова бензол (корень). Радикалы перечисляют в алфавитном порядке. Для указания их положения атомы углерода в бензольном кольце нумеруют так, чтобы номера радикалов были наименьшими.
Номенклатура аренов n n n Систематические названия строят из названия углеводородного радикала боковой цепи (приставка) и слова бензол (корень). Радикалы перечисляют в алфавитном порядке. Для указания их положения атомы углерода в бензольном кольце нумеруют так, чтобы номера радикалов были наименьшими.
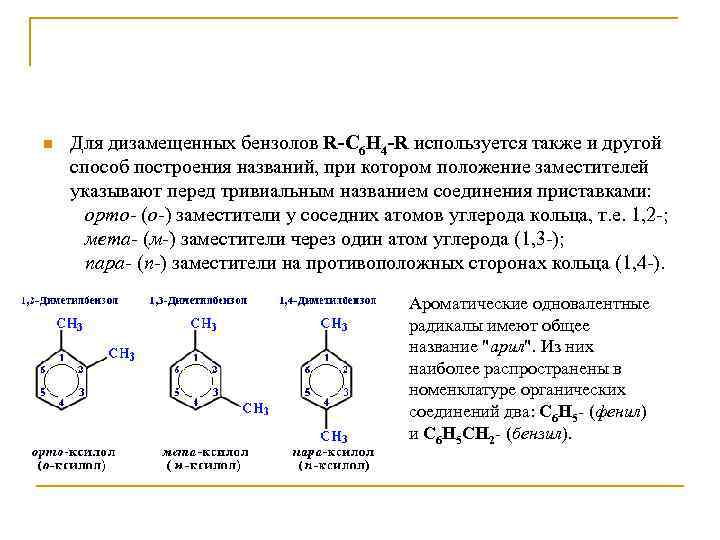 n Для дизамещенных бензолов R-C 6 H 4 -R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто- (о-) заместители у соседних атомов углерода кольца, т. е. 1, 2 -; мета- (м-) заместители через один атом углерода (1, 3 -); пара- (п-) заместители на противоположных сторонах кольца (1, 4 -). Ароматические одновалентные радикалы имеют общее название "арил". Из них наиболее распространены в номенклатуре органических соединений два: C 6 H 5 - (фенил) и C 6 H 5 CH 2 - (бензил).
n Для дизамещенных бензолов R-C 6 H 4 -R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто- (о-) заместители у соседних атомов углерода кольца, т. е. 1, 2 -; мета- (м-) заместители через один атом углерода (1, 3 -); пара- (п-) заместители на противоположных сторонах кольца (1, 4 -). Ароматические одновалентные радикалы имеют общее название "арил". Из них наиболее распространены в номенклатуре органических соединений два: C 6 H 5 - (фенил) и C 6 H 5 CH 2 - (бензил).
 Изомерия аренов Структурная изомерия 1. Изомерия положения заместителей для ди-, три- и тетразамещенных бензолов (например, о-, м- и п-ксилолы); 2. Изомерия углеродного скелета в боковой цепи, содержащей не менее 3 -х атомов углерода: 3. Изомерия заместителей R, начиная с R = С 2 Н 5. Например, молекулярной формуле С 8 Н 10 соответствуют 4 изомера: три ксилола CH 3 -C 6 H 4 -CH 3 (о-, м-, п-) и этилбензол C 6 H 5 -C 2 H 5. Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Изомерия аренов Структурная изомерия 1. Изомерия положения заместителей для ди-, три- и тетразамещенных бензолов (например, о-, м- и п-ксилолы); 2. Изомерия углеродного скелета в боковой цепи, содержащей не менее 3 -х атомов углерода: 3. Изомерия заместителей R, начиная с R = С 2 Н 5. Например, молекулярной формуле С 8 Н 10 соответствуют 4 изомера: три ксилола CH 3 -C 6 H 4 -CH 3 (о-, м-, п-) и этилбензол C 6 H 5 -C 2 H 5. Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
 Физические свойства аренов Бензол и его ближайшие гомологи – бесцветные жидкие вещества, нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (поражает почки, печень, костный мозг, кровь).
Физические свойства аренов Бензол и его ближайшие гомологи – бесцветные жидкие вещества, нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (поражает почки, печень, костный мозг, кровь).
 Химические свойства аренов n n n По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Причина - особенность строения бензольного кольца. Делокализация шести π-электронов в циклической системе понижает энергию молекулы и обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для аренов более характерны реакции, идущие с сохранением ароматической системы - реакции замещения атомов водорода, связанных с циклом.
Химические свойства аренов n n n По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Причина - особенность строения бензольного кольца. Делокализация шести π-электронов в циклической системе понижает энергию молекулы и обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для аренов более характерны реакции, идущие с сохранением ароматической системы - реакции замещения атомов водорода, связанных с циклом.
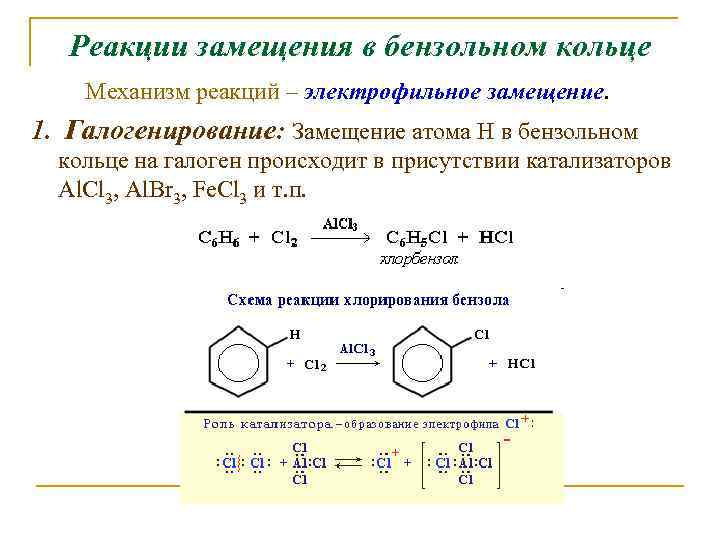 Реакции замещения в бензольном кольце Механизм реакций – электрофильное замещение. 1. Галогенирование: Замещение атома Н в бензольном кольце на галоген происходит в присутствии катализаторов Al. Cl 3, Al. Br 3, Fe. Cl 3 и т. п.
Реакции замещения в бензольном кольце Механизм реакций – электрофильное замещение. 1. Галогенирование: Замещение атома Н в бензольном кольце на галоген происходит в присутствии катализаторов Al. Cl 3, Al. Br 3, Fe. Cl 3 и т. п.
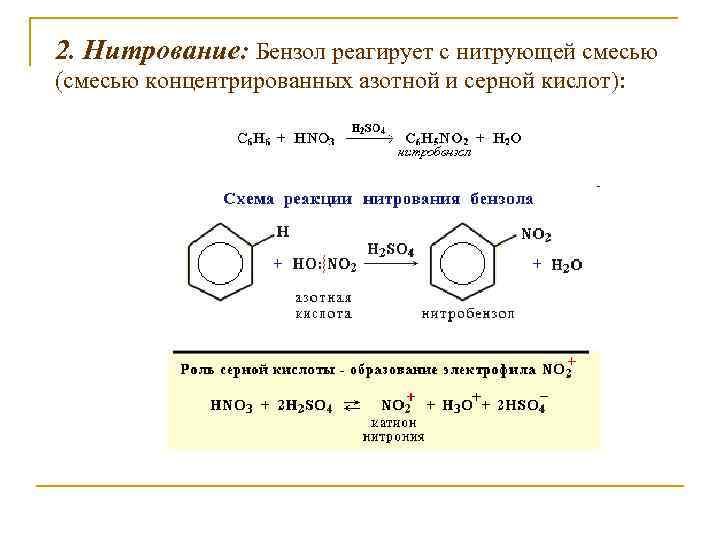 2. Нитрование: Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
2. Нитрование: Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
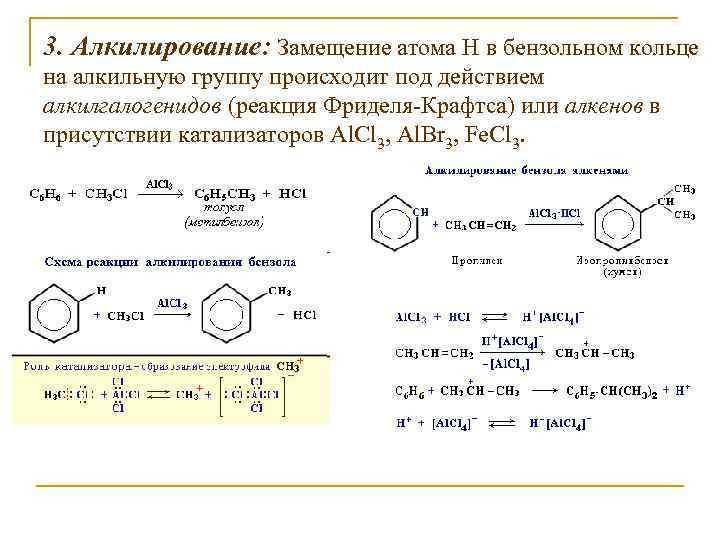 3. Алкилирование: Замещение атома Н в бензольном кольце на алкильную группу происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) или алкенов в присутствии катализаторов Al. Cl 3, Al. Br 3, Fe. Cl 3.
3. Алкилирование: Замещение атома Н в бензольном кольце на алкильную группу происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) или алкенов в присутствии катализаторов Al. Cl 3, Al. Br 3, Fe. Cl 3.
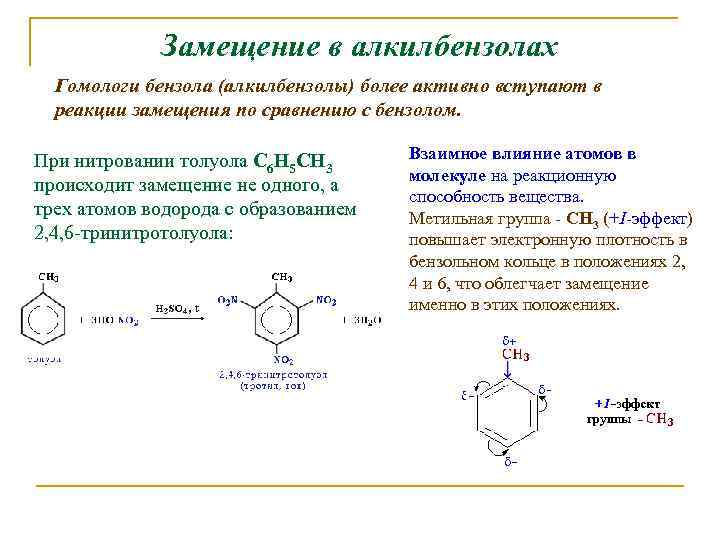 Замещение в алкилбензолах Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. При нитровании толуола С 6 Н 5 CH 3 происходит замещение не одного, а трех атомов водорода с образованием 2, 4, 6 -тринитротолуола: Взаимное влияние атомов в молекуле на реакционную способность вещества. Метильная группа - СH 3 (+I-эффект) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6, что облегчает замещение именно в этих положениях.
Замещение в алкилбензолах Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. При нитровании толуола С 6 Н 5 CH 3 происходит замещение не одного, а трех атомов водорода с образованием 2, 4, 6 -тринитротолуола: Взаимное влияние атомов в молекуле на реакционную способность вещества. Метильная группа - СH 3 (+I-эффект) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6, что облегчает замещение именно в этих положениях.
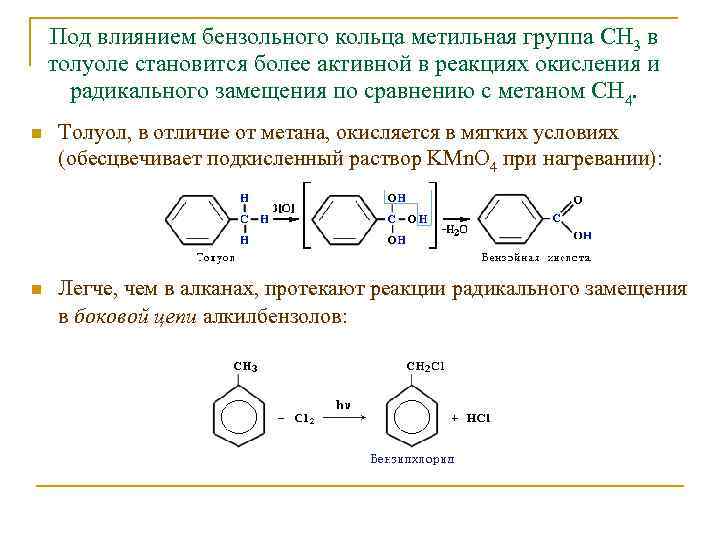 Под влиянием бензольного кольца метильная группа СH 3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH 4. n Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMn. O 4 при нагревании): n Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов:
Под влиянием бензольного кольца метильная группа СH 3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH 4. n Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMn. O 4 при нагревании): n Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов:
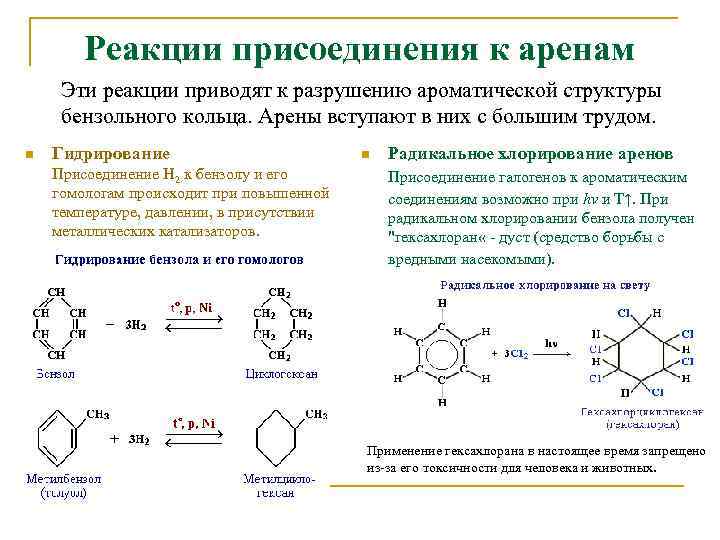 Реакции присоединения к аренам Эти реакции приводят к разрушению ароматической структуры бензольного кольца. Арены вступают в них с большим трудом. n Гидрирование Присоединение Н 2 к бензолу и его гомологам происходит при повышенной температуре, давлении, в присутствии металлических катализаторов. n Радикальное хлорирование аренов Присоединение галогенов к ароматическим соединениям возможно при hν и Т↑. При радикальном хлорировании бензола получен "гексахлоран « - дуст (средство борьбы с вредными насекомыми). Применение гексахлорана в настоящее время запрещено из-за его токсичности для человека и животных.
Реакции присоединения к аренам Эти реакции приводят к разрушению ароматической структуры бензольного кольца. Арены вступают в них с большим трудом. n Гидрирование Присоединение Н 2 к бензолу и его гомологам происходит при повышенной температуре, давлении, в присутствии металлических катализаторов. n Радикальное хлорирование аренов Присоединение галогенов к ароматическим соединениям возможно при hν и Т↑. При радикальном хлорировании бензола получен "гексахлоран « - дуст (средство борьбы с вредными насекомыми). Применение гексахлорана в настоящее время запрещено из-за его токсичности для человека и животных.
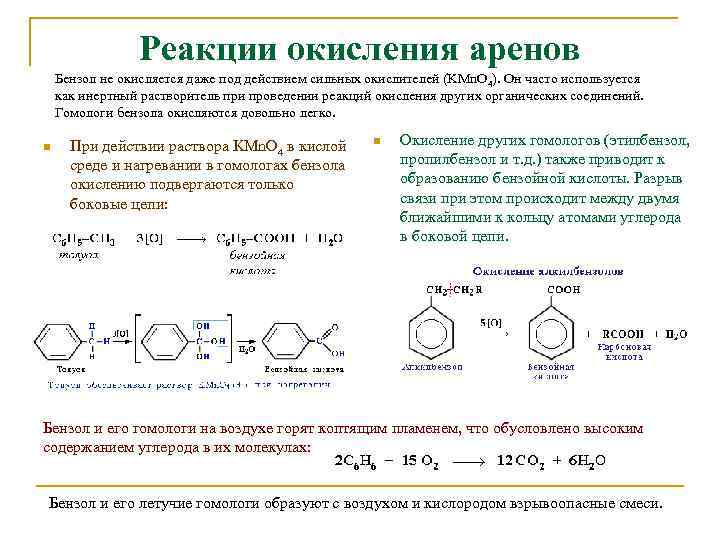 Реакции окисления аренов Бензол не окисляется даже под действием сильных окислителей (KMn. O 4). Он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. Гомологи бензола окисляются довольно легко. n При действии раствора KMn. O 4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи: n Окисление других гомологов (этилбензол, пропилбензол и т. д. ) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи. Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах: Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
Реакции окисления аренов Бензол не окисляется даже под действием сильных окислителей (KMn. O 4). Он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. Гомологи бензола окисляются довольно легко. n При действии раствора KMn. O 4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи: n Окисление других гомологов (этилбензол, пропилбензол и т. д. ) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи. Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах: Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
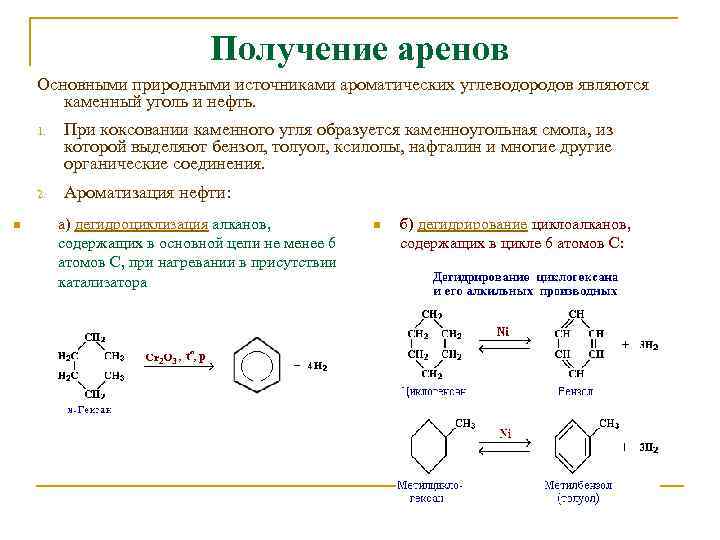 Получение аренов Основными природными источниками ароматических углеводородов являются каменный уголь и нефть. 1. 2. n При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения. Ароматизация нефти: а) дегидроциклизация алканов, содержащих в основной цепи не менее 6 атомов С, при нагревании в присутствии катализатора n б) дегидрирование циклоалканов, содержащих в цикле 6 атомов С:
Получение аренов Основными природными источниками ароматических углеводородов являются каменный уголь и нефть. 1. 2. n При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения. Ароматизация нефти: а) дегидроциклизация алканов, содержащих в основной цепи не менее 6 атомов С, при нагревании в присутствии катализатора n б) дегидрирование циклоалканов, содержащих в цикле 6 атомов С:
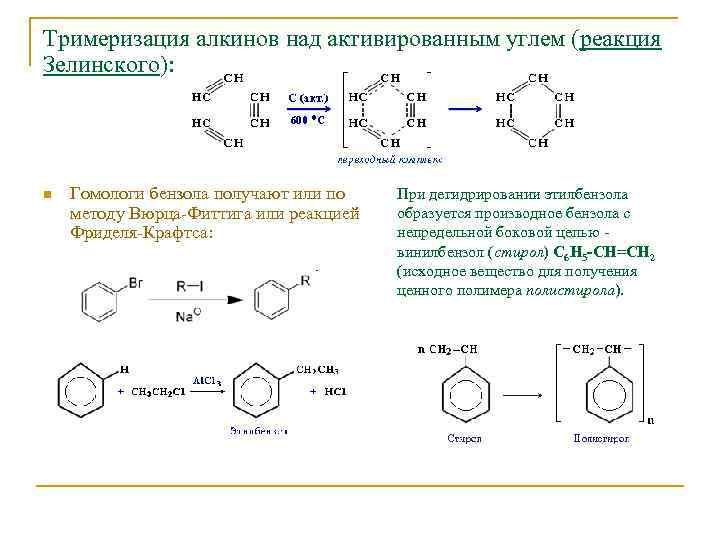 Тримеризация алкинов над активированным углем (реакция Зелинского): n Гомологи бензола получают или по методу Вюрца-Фиттига или реакцией Фриделя-Крафтса: При дегидрировании этилбензола образуется производное бензола с непредельной боковой цепью - винилбензол (стирол) C 6 H 5 -CН=СН 2 (исходное вещество для получения ценного полимера полистирола).
Тримеризация алкинов над активированным углем (реакция Зелинского): n Гомологи бензола получают или по методу Вюрца-Фиттига или реакцией Фриделя-Крафтса: При дегидрировании этилбензола образуется производное бензола с непредельной боковой цепью - винилбензол (стирол) C 6 H 5 -CН=СН 2 (исходное вещество для получения ценного полимера полистирола).
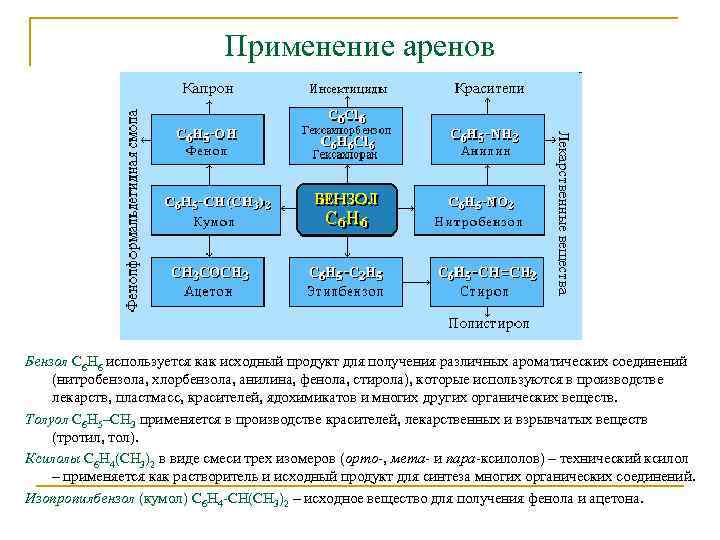 Применение аренов Бензол С 6 Н 6 используется как исходный продукт для получения различных ароматических соединений (нитробензола, хлорбензола, анилина, фенола, стирола), которые используются в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ. Толуол С 6 Н 5–СН 3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол). Ксилолы С 6 Н 4(СН 3)2 в виде смеси трех изомеров (орто-, мета- и пара-ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений. Изопропилбензол (кумол) С 6 Н 4 -СН(СН 3)2 – исходное вещество для получения фенола и ацетона.
Применение аренов Бензол С 6 Н 6 используется как исходный продукт для получения различных ароматических соединений (нитробензола, хлорбензола, анилина, фенола, стирола), которые используются в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ. Толуол С 6 Н 5–СН 3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол). Ксилолы С 6 Н 4(СН 3)2 в виде смеси трех изомеров (орто-, мета- и пара-ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений. Изопропилбензол (кумол) С 6 Н 4 -СН(СН 3)2 – исходное вещество для получения фенола и ацетона.
 Домашнее задание по теме «Арены. Химические свойства и способы получения» : 1. 2. Электронный учебник: часть II: раздел – 7; Учебник Скворцов А. В. : глава 8 (стр. 65 - 72); устно – вопросы 8. 1 - 8. 8, стр. 71; письменно – 8. 9 - 8. 14;
Домашнее задание по теме «Арены. Химические свойства и способы получения» : 1. 2. Электронный учебник: часть II: раздел – 7; Учебник Скворцов А. В. : глава 8 (стр. 65 - 72); устно – вопросы 8. 1 - 8. 8, стр. 71; письменно – 8. 9 - 8. 14;


