773afed2fa4687e0bb80c5257404dd99.ppt
- Количество слайдов: 31

Applications de l’écho- Doppler à la reproduction bovine Revue de la littérature Prof. Ch. Hanzen Université de Liège Faculté de Médecine Vétérinaire Courriel : Christian. hanzen@uliege. be Publications : http: //orbi. ulg. ac. be/ Facebook : https: //www. facebook. com/Theriogenologie 10 février 2018

L’écho Doppler (Johann Christian Doppler, 1903) • • • Echographie : la fréquence de l’écho est équivalente à celle des ultrasons Echo-Doppler : la fréquence de l’écho est différente de celle des US du fait que les US rencontrent une structure en mouvement (le sang par exemple) • cette fréquence de l’écho est plus élevée (+) que celle de l’US lorsque le sang se dirige vers la sonde • cette fréquence de l’écho est moins élevée que celle de l’US (-) lorsque le sang s’écarte de la sonde Ces changements de fréquence sont transformés en couleurs (dont la brillance est d’autant plus élevée que le changement est important • Couleur rouge si le sang se dirige vers la sonde • Couleur bleue si le sang s’écarte de la sonde • A distinguer Echo-Doppler continu et pulsé et le power modecontinuous wave Doppler (CW) and (PW) See : Herzog et Bollwein in Reprod Dom Anim 42 (Suppl. 2), 51– 58 (2007)
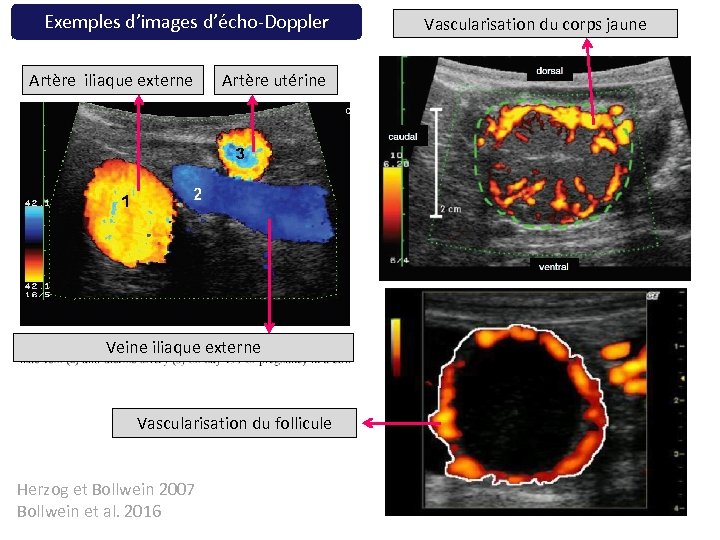
Exemples d’images d’écho-Doppler Artère iliaque externe Artère utérine Veine iliaque externe Vascularisation du follicule Herzog et Bollwein 2007 Bollwein et al. 2016 Vascularisation du corps jaune
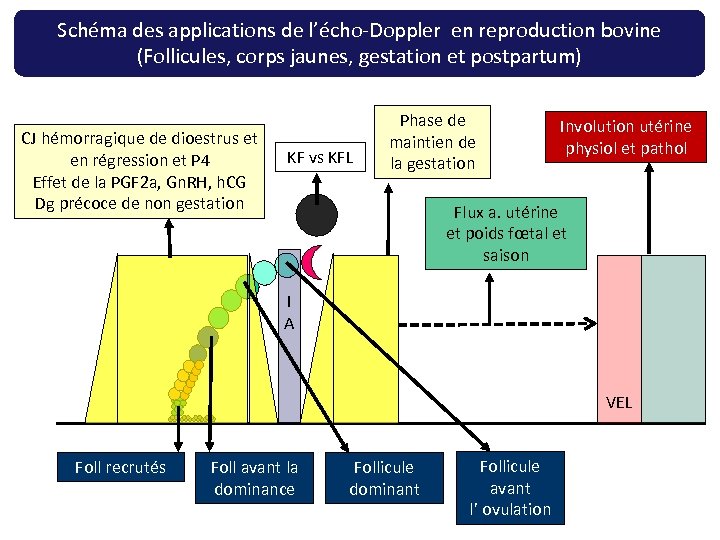
Schéma des applications de l’écho-Doppler en reproduction bovine (Follicules, corps jaunes, gestation et postpartum) CJ hémorragique de dioestrus et en régression et P 4 Effet de la PGF 2 a, Gn. RH, h. CG Dg précoce de non gestation KF vs KFL Phase de maintien de la gestation Involution utérine physiol et pathol Flux a. utérine et poids fœtal et saison I A VEL Foll recrutés Foll avant la dominance Follicule dominant Follicule avant l’ ovulation
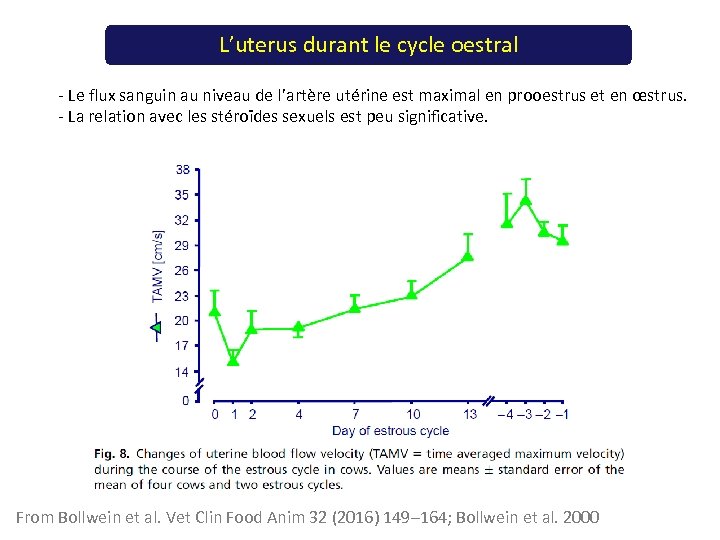
L’uterus durant le cycle oestral - Le flux sanguin au niveau de l’artère utérine est maximal en prooestrus et en œstrus. - La relation avec les stéroïdes sexuels est peu significative. From Bollwein et al. Vet Clin Food Anim 32 (2016) 149– 164; Bollwein et al. 2000
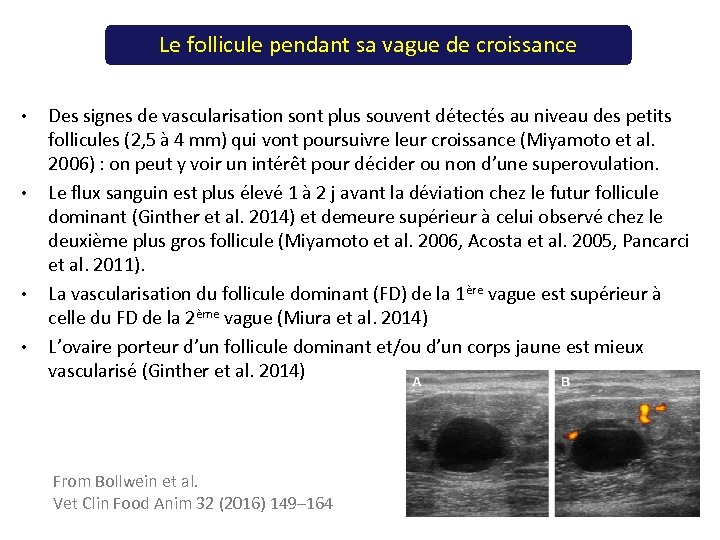
Le follicule pendant sa vague de croissance • • Des signes de vascularisation sont plus souvent détectés au niveau des petits follicules (2, 5 à 4 mm) qui vont poursuivre leur croissance (Miyamoto et al. 2006) : on peut y voir un intérêt pour décider ou non d’une superovulation. Le flux sanguin est plus élevé 1 à 2 j avant la déviation chez le futur follicule dominant (Ginther et al. 2014) et demeure supérieur à celui observé chez le deuxième plus gros follicule (Miyamoto et al. 2006, Acosta et al. 2005, Pancarci et al. 2011). La vascularisation du follicule dominant (FD) de la 1ère vague est supérieur à celle du FD de la 2ème vague (Miura et al. 2014) L’ovaire porteur d’un follicule dominant et/ou d’un corps jaune est mieux vascularisé (Ginther et al. 2014) From Bollwein et al. Vet Clin Food Anim 32 (2016) 149– 164

Le follicule avant l’ovulation • • • l’augmentation de la vascularisation du follicule préovulatoire est associée à celle du taux de gestation (Siddiqui et al. 2009, Varughese et al. 2017) une augmentation du flux sanguin au niveau du follicule preovulatoire a été observé 30 min après l’injection d’un Gn. RH et au cours des suivant le pic de la LH (Acosta et al. 2003); Cette augmentation serait corrélée à l’augmentation des oestrogènes (Pancarci et al. 2012). Elle serait de nature à favoriser l’ovulation (Acosta et al. 2007). l’augmentation de la vascularisation du follicule préovulatoire est associée à • celle du taux de gestation (Siddiqui et al. 2009, Varughese et al. 2017) • un meilleur clivage des ovocytes et un meilleur développement de l’embryon (Siddiqui et al. 2009). • La ponction de COCs de meilleure qualité (Pancarci et al. 2012). • la vascularisation du kyste folliculaire est différente (interne à la paroi) de celle du kyste lutéinisé (en périphérie) (Matsui and Miyamoto 2009, Rauch et al. 2008). From Bollwein et al. Vet Clin Food Anim 32 (2016) 149– 164
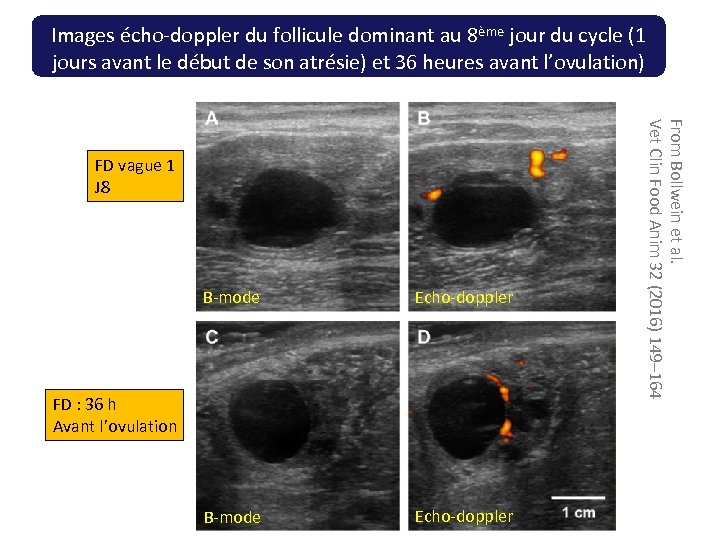
Images écho-doppler du follicule dominant au 8ème jour du cycle (1 jours avant le début de son atrésie) et 36 heures avant l’ovulation) B-mode Echo-doppler FD : 36 h Avant l’ovulation From Bollwein et al. Vet Clin Food Anim 32 (2016) 149– 164 FD vague 1 J 8
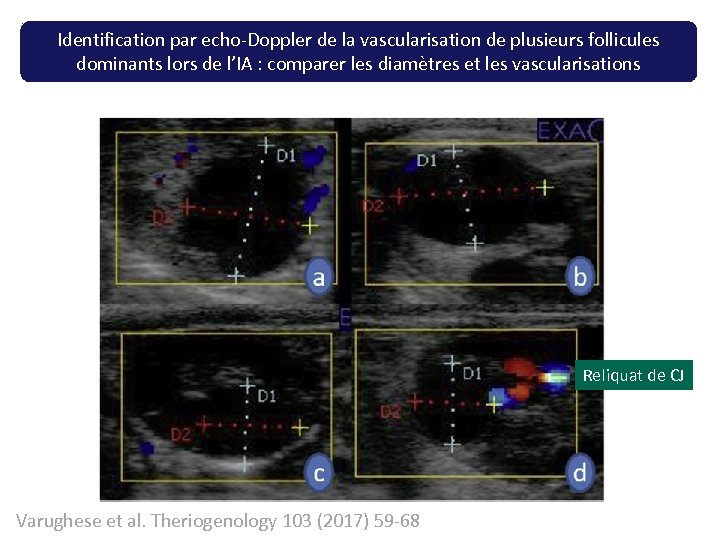
Identification par echo-Doppler de la vascularisation de plusieurs follicules dominants lors de l’IA : comparer les diamètres et les vascularisations Reliquat de CJ Varughese et al. Theriogenology 103 (2017) 59 -68

Le corps jaune • • Le flux sanguin lutéal augmente progressivement entre le 2ème et le 5ème jour du cycle et CJ devient l’un des organes les plus vascularisés du corps (Wiltbank et al. 1988). Le flux sanguin lutéal est multiplié par 1, 5 entre les 7 et 15 du cycle (Utt et al. 2009, Herzog et al. 2011). Le flux sanguin lutéal commence à diminuer entre le 15ème et le 17ème jour du cycle en cas de non gestation (Acosta et al. 2002) La corrélation entre le flux sanguin et la P 4 s’observe davantage, en début de dioestrus (J 9 -12) et après la lutéolyse (5 jours avant l’ovulation) qu’au milieu du dioestrus ou en metoestrus (Luttgenau et al. 2011, Vasconcelos et al. 2001, Herzog et al. 2010, Scully et al. 2014). L’ocytocine ne serait pas impliquée dans la régulation du flux sanguin au niveau de l’ovaire (Brozos et al. 2012) Une augmentation de flux s’observe en début de lutéolyse (Shirasuna et al. 2004). Elle est suivie d’une diminution un jour plus tard (Miyamoto et al. 2005). la synthèse de P 4 est davantage associée au flux sanguin qu’à la taille du corps jaune (Herzog et al. 2010, 2011, Herzog and Bollwein 2007)
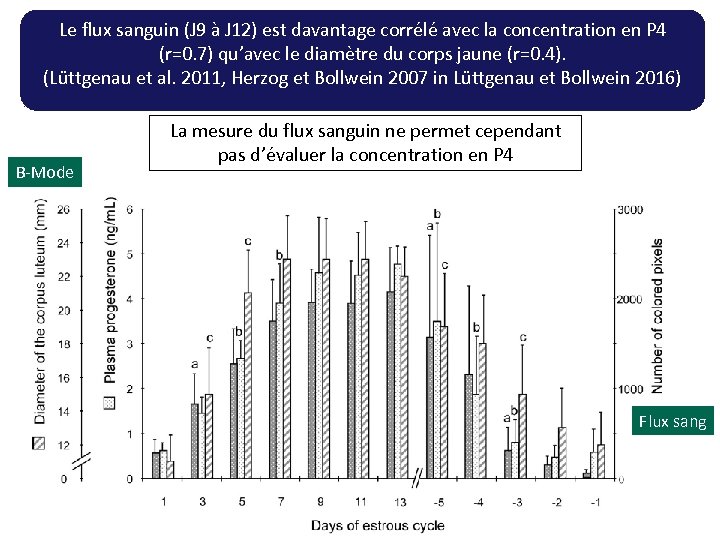
Le flux sanguin (J 9 à J 12) est davantage corrélé avec la concentration en P 4 (r=0. 7) qu’avec le diamètre du corps jaune (r=0. 4). (Lüttgenau et al. 2011, Herzog et Bollwein 2007 in Lüttgenau et Bollwein 2016) B-Mode La mesure du flux sanguin ne permet cependant pas d’évaluer la concentration en P 4 Flux sang

Le corps jaune • • • Le flux sanguin lutéal est comparable jusqu’au jour 13 suivant l’IA en cas ou non de mortalité embryonnaire. Il augmente par la suite en cas de maintien de la gestation (Herzog et al. 2011). . l’injection d’une PGF 2 a en dioestrus se traduit dans un premier temps par une augmentation du flux sanguin (Acosta et al. 2002) , l’oxyde nitrique pouvant constituer le médiateur endothélial de l’effet vasodilatatoire de la PGF 2 a (Shirasuna et al. 2008). L’injection d’une Gn. RH ou d’h. CG au moment de l’œstrus ne se traduit pas par une modification du flux sanguin, de la P 4 et de la surface du CJ 9 à 12 jours plus tard (Aslan et al. 2011). Une injection d’h. CG au 6ème jour du cycle se traduit par une augmentation transitoire (1 h) du flux sanguin La mise en place durant 14 jours d’une spirale vaginal au 5ème jour du cycle réduit le flux sanguin lutéal entre le 7ème et le 12ème jour du cycle L’injection de 0. 5 mg/kg de LPS s’accompagne d’une diminution transitoire de la P 4, de la surface lutéale et du flux sanguin (Herzog et al. 2012)
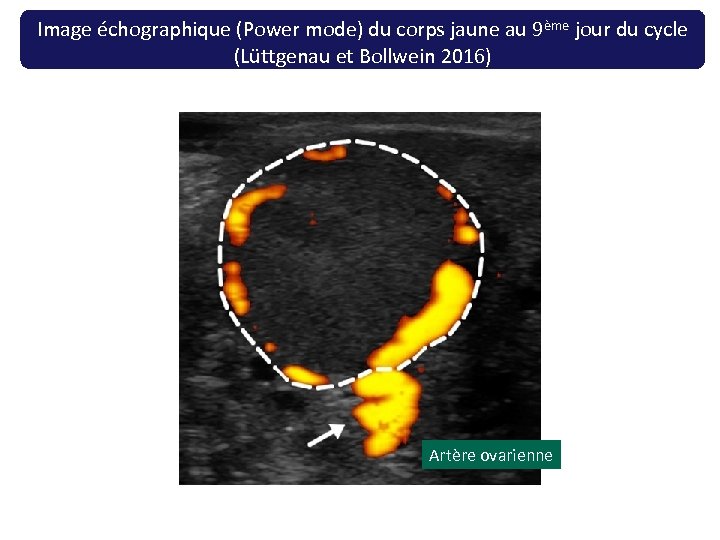
Image échographique (Power mode) du corps jaune au 9ème jour du cycle (Lüttgenau et Bollwein 2016) Artère ovarienne
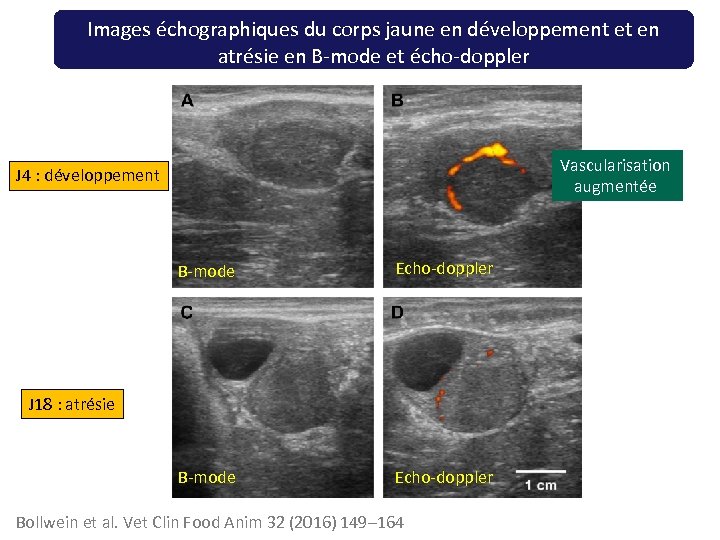
Images échographiques du corps jaune en développement et en atrésie en B-mode et écho-doppler Vascularisation augmentée J 4 : développement B-mode Echo-doppler J 18 : atrésie Bollwein et al. Vet Clin Food Anim 32 (2016) 149– 164
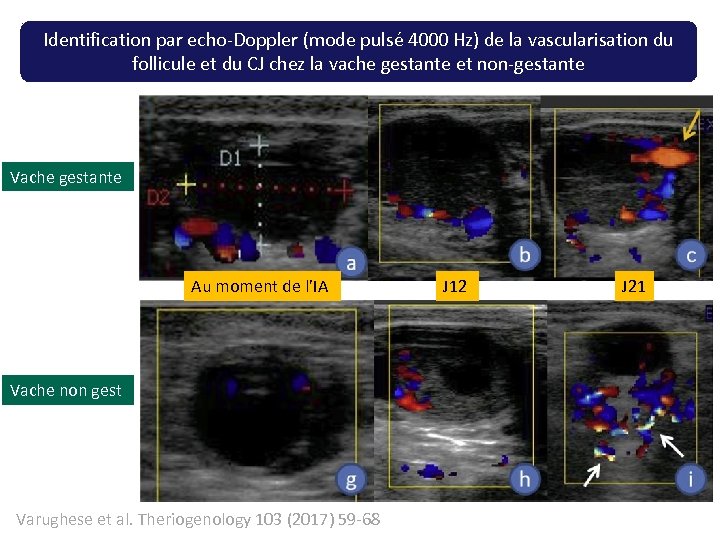
Identification par echo-Doppler (mode pulsé 4000 Hz) de la vascularisation du follicule et du CJ chez la vache gestante et non-gestante Vache gestante Au moment de l’IA Vache non gest Varughese et al. Theriogenology 103 (2017) 59 -68 J 12 J 21
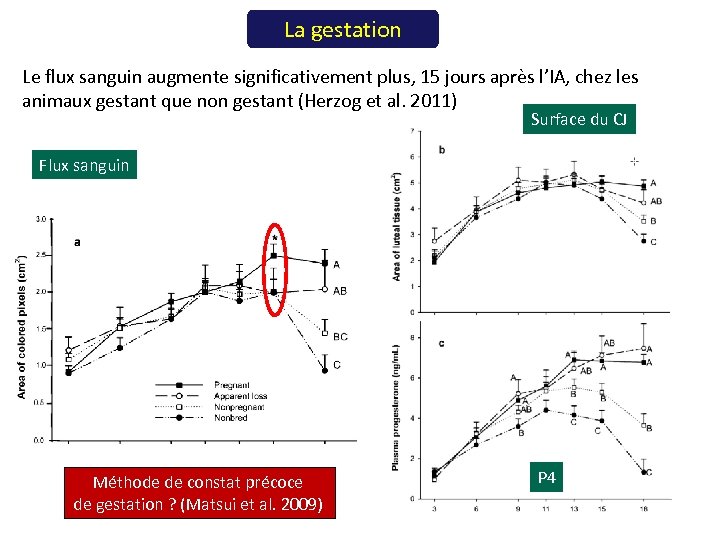
La gestation Le flux sanguin augmente significativement plus, 15 jours après l’IA, chez les animaux gestant que non gestant (Herzog et al. 2011) Surface du CJ Flux sanguin Méthode de constat précoce de gestation ? (Matsui et al. 2009) P 4

La gestation • • Le flux sanguin lutéal serait plus élevé chez les animaux gestants que non gestants ou cyclés entre le 15ème et le 21ème jour suivant l’IA ou l’oestrus (Utt et a. L 2009, Herzog et al. 2011, Scully et al. 2014). L’absence de diminution du flux sanguin lutéal constituerait un signe très précoce de gestation (Matsui and Miyamoto 2009; Utt et al. 2009). L’écho-doppler permettrait un diagnostic précoce de gestation (J 19 -J 21) puisque la régression physiologique du CJ précède sa régression morphologique (Matsui et al. 2009, Miyamoto et al. 2006, Herzog et al. 2010). Du fait de son manque de spécificité (Siqueira et al. 2013, Pugliesi et al. 2014, Utt et al. 2009) l’écho-Doppler permet d’identifier davantage les animaux non gestants que gestants : attention aux spécificités techniques des appareils et à l’expérience du manipulateur.

La gestation • • Les oestrogènes et la progestérone ne sont que peu impliqués dans la régulation du flux sanguin au niveau de l’artère utérine (Bollwein et al. 2000) Le flux sanguin au niveau de l’artère ipsilatérale et contralatérale à la corne gestante a été caractérisée (Bollwein et al. 2002). Au cours deux premiers mois de la gestation le flux sanguin utérin et lutéal est corrélé à la progestéronémie et au développement de l’allantochorion (Pinaffi et al. 2017) Ce flux artériel utérin serait en relation avec le poids du veau à la naissance (r=0. 4 -0. 6) (Panarace et al. 2006, Hartmann et al. 2013)
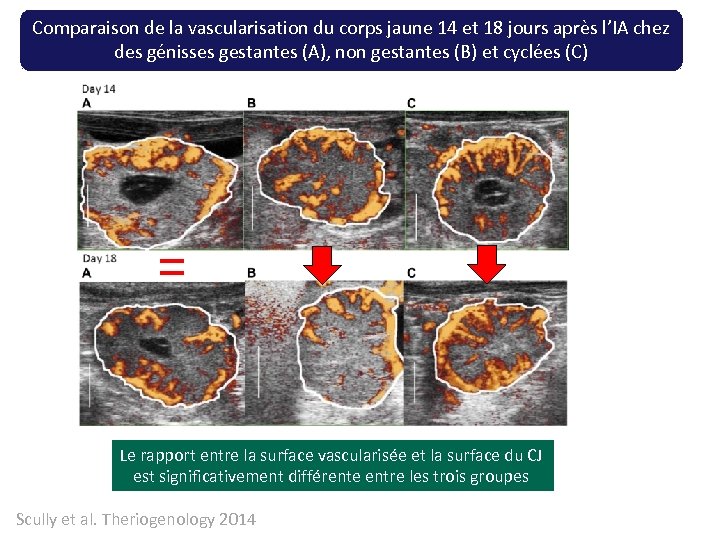
Comparaison de la vascularisation du corps jaune 14 et 18 jours après l’IA chez des génisses gestantes (A), non gestantes (B) et cyclées (C) = Le rapport entre la surface vascularisée et la surface du CJ est significativement différente entre les trois groupes Scully et al. Theriogenology 2014
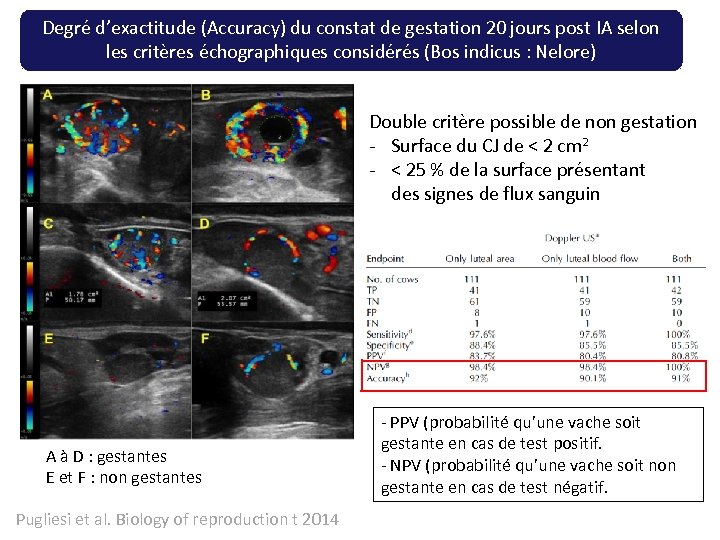
Degré d’exactitude (Accuracy) du constat de gestation 20 jours post IA selon les critères échographiques considérés (Bos indicus : Nelore) Double critère possible de non gestation - Surface du CJ de < 2 cm 2 - < 25 % de la surface présentant des signes de flux sanguin A à D : gestantes E et F : non gestantes Pugliesi et al. Biology of reproduction t 2014 - PPV (probabilité qu’une vache soit gestante en cas de test positif. - NPV (probabilité qu’une vache soit non gestante en cas de test négatif.
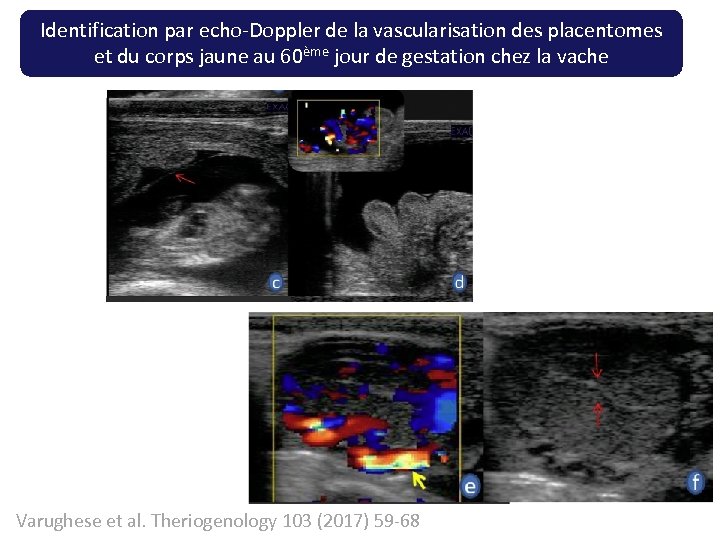
Identification par echo-Doppler de la vascularisation des placentomes et du corps jaune au 60ème jour de gestation chez la vache Varughese et al. Theriogenology 103 (2017) 59 -68
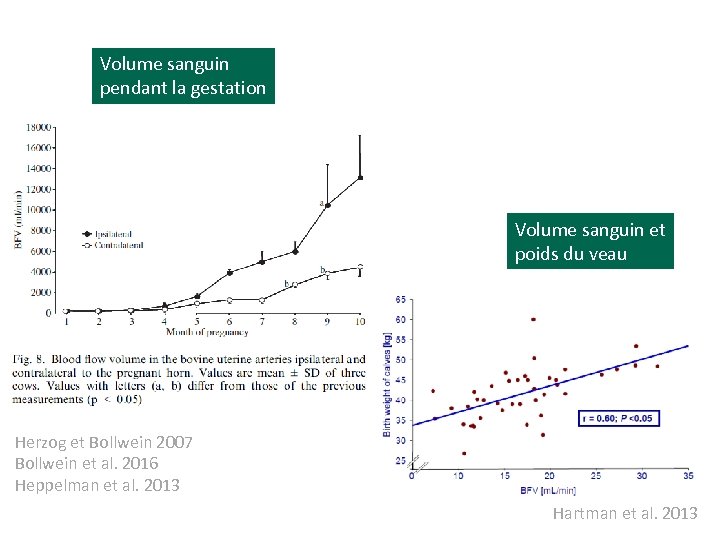
Volume sanguin pendant la gestation Volume sanguin et poids du veau Herzog et Bollwein 2007 Bollwein et al. 2016 Heppelman et al. 2013 Hartman et al. 2013
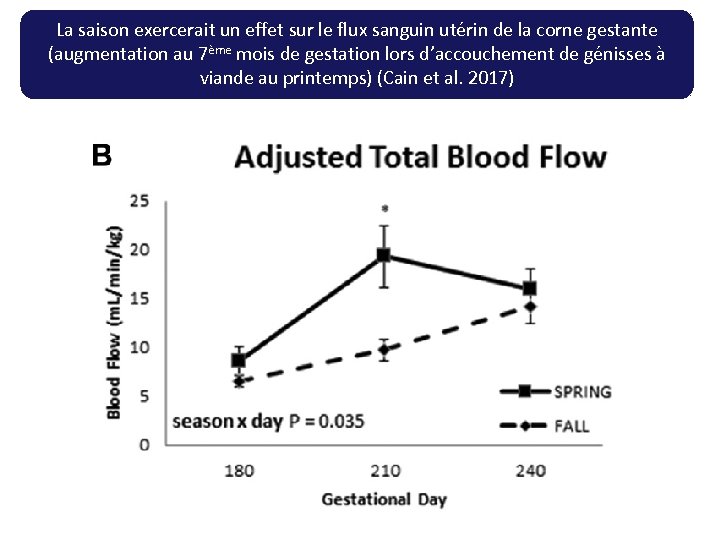
La saison exercerait un effet sur le flux sanguin utérin de la corne gestante (augmentation au 7ème mois de gestation lors d’accouchement de génisses à viande au printemps) (Cain et al. 2017)
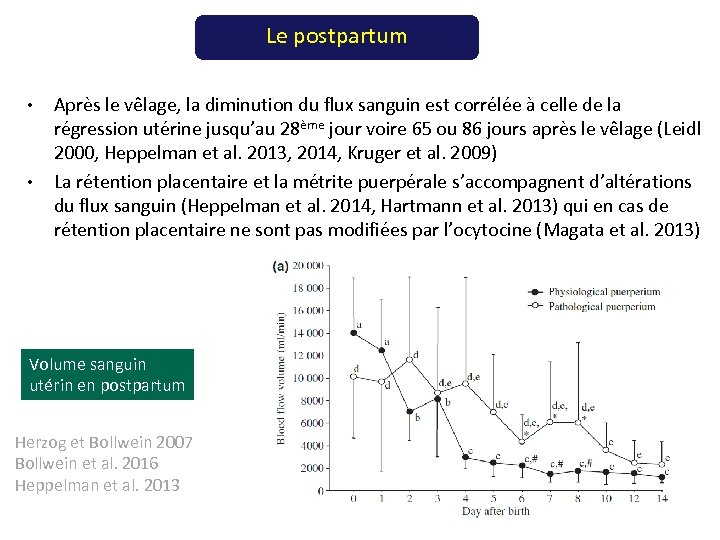
Le postpartum • • Après le vêlage, la diminution du flux sanguin est corrélée à celle de la régression utérine jusqu’au 28ème jour voire 65 ou 86 jours après le vêlage (Leidl 2000, Heppelman et al. 2013, 2014, Kruger et al. 2009) La rétention placentaire et la métrite puerpérale s’accompagnent d’altérations du flux sanguin (Heppelman et al. 2014, Hartmann et al. 2013) qui en cas de rétention placentaire ne sont pas modifiées par l’ocytocine (Magata et al. 2013) Volume sanguin utérin en postpartum Herzog et Bollwein 2007 Bollwein et al. 2016 Heppelman et al. 2013

Bibliographie • • Acosta TJ, Hayashi KG, Matsui M, et al. Changes in follicular vascularity during the first follicular wave in lactating cows. J Reprod Dev 2005; 51: 273– 80. Acosta TJ, Hayashi KG, Ohtani M, Miyamoto A, 2003: Local changes in blood flow within the preovulatory follicle wall and early corpus luteum in cows. Reproduction 125, 759– 767. Acosta TJ, Yoshizawa N, Ohtani M, Miyamoto A, 2002: Local changes in blood flow within the early and midcycle corpus luteum after prostaglandin F 2 a injection in the cow. Biol Reprod 66, 651– 658. Acosta TJ. Studies of follicular vascularity associated with follicle selection and ovulation in cattle. J Reprod Dev 2007; 53: 39– 44. Aslan S, Arslanbas D, Beindorff N, Bollwein H. Effects of induction of ovulation with Gn. RH or h. CG on follicular and luteal blood flow in Holstein–Friesian heifers. Reprod Dom Anim 2011; 46: 781– 6 Baumgartner U, 1998: Farbdopplersonographische Untersuchung der Arteria uterina und des Corpus luteum beim Rind. Tiera¨ rztliche Fakulta¨ t der Ludwig-Maximiliams. Universita ¨t Munchen, Germany. Beindorff N, Honnens A, Penno Y, Paul V, Bollwein H. Effects of human chorionic gonadotropin on luteal blood flow and progesterone secretion in cows and in vitromicrodialyzed corpora lutea. Theriogenology 2009; 72: 528– 34.

• • • Bollwein et al. Ultrasonographic Doppler Use for Female Reproduction Management. Vet Clin Food Anim 32 (2016) 149– 164 http: //dx. doi. org/10. 1016/j. cvfa. 2015. 09. 005. Review Bollwein H, Baumgartner U, Stolla R, 2002 a: Transrectal Doppler sonography of uterine blood flow in cows during pregnancy. Theriogenology 57, 2053– 2061 Bollwein H et al. Transrctal Doppler so, nography of uterine blood flow in cows during the estrous cucle. Theriogenology 2000, 53, 1541 -1552. Bollwein H, Baumgartner U, Stolla R, 2002 a: Transrectal Doppler sonography of uterine blood flow in cows during pregnancy. Theriogenology 57, 2053– 2061 Bollwein H, Meyer HH, Maierl J, Weber F, Baumgartner U, Stolla R, 2000: Transrectal Doppler sonography of uterine blood flow. Theriogenology 53, 1541– 1552. Brozos et al. Effect of oxytocin infusion on luteal blood flow and progesterone secretion in dairy cattle. J. Vet. Sci. (2012), 13(1), 67 -71 Cain AJ et al. Pre-breeding beef heifer management and season affect mid to late gestation uterine artery hemodynamics. Theriogenology 87 (2017) 9– 15 Garcia-Ispierto I, López-Gatius F. Effects of Gn. RH or progesterone treatment on Day 5 post-AI on plasma progesterone, luteal blood flow and leucocyte counts during the luteal phase in dairy cows. Reprod Dom Anim 2012; 47: 224– 9.

• • Ginther et al. Blood flow and echotextural differences between the future dominant and subordinate follicles before the beginning of diameter deviation in Heifers. Theriogenology 100 (2017) 42 -49 Ginther OJ, Rakesh HB, Hoffman MM. Blood flow to follicles and CL during development of the periovulatory follicular wave in heifers. Theriogenology 2014; 82: 304– 11. Hartmann D, Honnens A, Piechotta M, et al. Effects of a protracted induction of parturition on the incidence of retained placenta and assessment of uterine artery blood flow as a measure of placental maturation in cattle. Theriogenology 2013; 80: 176– 84. Heppelmann M, Kru¨ger L, Leidl S, et al. Transrectal Doppler sonography of uterine blood flow during the first two weeks after parturition in Simmenthal heifers. J Vet Sci 2013; 14: 323– 7. Heppelmann M, Weinert M, Bro¨mmling A, et al. The effect of puerperal uterine disease on uterine involution in cows assessed by Doppler sonography of the uterine arteries. Anim Reprod Sci 2014; 143: 1– 7. Herzog K, Bollwein H, 2007: Application of doppler ultrasonography in cattle reproduction. Reprod Dom Anim 42, 51– 58. Review Herzog K, Brockhan-Ludemann M, Kaske M, et al. Luteal blood flow is a more appropriate indicator for luteal function during the bovine estrous cycle than luteal size. Theriogenology 2010; 73: 691– 7.

• • Herzog K, Vossa C, Kastelic JP, Beindorff N, Paul V, Niemann H, Bollwein H, 2011: Luteal blood flow increases during the first three weeks of pregnancy in lactating dairy cows. Theriogenology 75, 549– 554. Herzog K, Strüve K, Kastelic JP, Piechotta M, Ulbrich SE, Pfarrer C, et al. Escherichia coli lipopolysaccharide administration transiently suppresses luteal structure and function in diestrous cows. Reproduction 2012; 144: 467– 76. Kruger L, Koerte J, Tsousis G, et al. Transrectal Doppler sonography of uterine blood flow during the first 12 weeks after parturition in healthy dairy cows. Anim Reprod Sci 2009; 114: 23– 31. Leidl S, 2000: Farbdopplersonographische Untersuchung der uterinen Durchblutung im peripartalen und puerperalen Zeitraum des Rindes. Tierarztliche Fakultat der Ludwig-Maximiliams-Universita¨t Munchen, Germany. Lüttgenau J, Ulbrich SE, Beindorff N, et al. Plasma progesterone concentrations in the mid-luteal phase are dependent on luteal size, but independent of luteal blood flow and gene expression in lactating dairy cows. Anim Reprod Sci 2011; 125: 20– 9. Lüttgenau J et Bollwein H. Evaluation of bovine luteal blood flow by using color Doppler ultrasonography. Reproductive biology 14 (2014) 103– 109. Review Magata F, Hartmann D, Ishii M, et al. Effects of exogenous oxytocin on uterine blood flow in puerperal dairy cows: the impact of days after parturition and retained fetal membranes. Vet J 2013; 196: 76– 80

• • Matsui M, Miyamoto A, 2009: Evaluation of ovarian blood flow by colour Doppler ultrasound: practical use for reproductive management in the cow. Vet J 181, 232– 240. Miura R, Haneda S, Lee HH, et al. Evidence that the dominant follicle of the first wave is more active than that of the second wave in terms of its growth rate, blood flow supply and steroidogenic capacity in cows. Anim Reprod Sci 2014; 145: 114– 22. Miyamoto A, Shirasuna K, Hayashi KG, et al. A potential use of color ultrasound as a tool for reproductive management: new observations using color ultrasound scanning that were not possible with Imaging only in black and white. J Reprod Dev 2006; 52: 153– 60. Miyamoto A, Shirasuna K, Wijayagunawardane MPB, et al. Blood flow: a key regulatory component of corpus luteum function in the cow. Domest Anim Endocrinol 2005; 29: 329– 39. Panarace M, Garnil C, Marfil M, Jauregui G, Lagioia J, Luther E, Medina M, 2006: Transrectal Doppler sonography for evaluation of uterine blood flow throughout pregnancy in 13 cows. Theriogenology 66, 2113– 2119. Pancarci SM, Ari UC, Atakisi O, et al. Nitric oxide concentrations, estradiol-17 beta progesterone ratio in follicular fluid, and COC quality with respect to perifollicular blood flow in cows. Anim Reprod Sci 2012; 130: 9– 15. Pancarci SM, Gu¨ngo¨r O¨ , Atakisi O, et al. Changes in follicular blood flow and nitric oxide levels in follicular fluid during follicular deviation in cows. Anim Reprod Sci 2011; 123: 149– 56.

• • Pinaffi et al. Color-Doppler signals of blood flow in the corpus luteum and vascular perfusion index for ovarian and uterine arteries during expansion of the allantochorion in Bos taurus heifers. Theriogenology 102 (2017) 35 -43. Pugliesi et al. 2014 Conceptus-Induced Changes in the Gene Expression of Blood Immune Cells and the Ultrasound-Accessed Luteal Function in Beef Cattle: How Early Can We Detect Pregnancy? Biology of reproduction (2014) 91(4): 95, 1– 12 Quintela LA, Barrio M, Pen˜a AI, Becerra JJ, Cainzos J, Herrado´n PG Dıaz C. Use of ultrasound in the reproductive management of dairy cattle. Reprod Domest Anim 2012; 47(suppl 3): 34– 44. Review. Rauch A, Kruger L, Miyamoto A, et al. Colour Doppler sonography of cystic ovarian follicles in cows. J Reprod Dev 2008; 54: 447– 53 Scully S, Evans ACO, Duffy P, Crowe MA. Characterization of follicle and CL development in beef heifers using high resolution three-dimensional ultrasonography. Theriogenology 2014; 81: 407– 18. Shirasuna K, Asaoka H, Acosta TJ, Wijayagunawardane MPB, Ohtani M, Hayashi M, et al. Real-time relationships in intraluteal release among prostaglandin F 2 a, endothelin -1, and angiotensin II during spontaneous luteolysis in the cow. Biol Reprod 2004; 71: 1706– 11. Shirasuna K, Watanabe S, Asahi T, Wijayagunawardane MPB, Sasahara K, Jiang C, et al. Prostaglandin F 2 a increases endothelial nitric oxide synthase in the periphery of the bovine corpus luteum: the possible regulation of blood flow at an early stage of luteolysis. Reproduction 2008; 135: 527– 39.

• • Shrestha HK, Ginther OJ. Increase in progesterone and luteal blood flow without a luteolytic response after prostaglandin F 2 a treatment in early luteal-phase heifers. Anim Reprod Sci 2011; 124: 7– 11. Siddiqui MAR, Almamun M, Ginther OJ, 2009: Blood flow in the wall of the preovulatory follicle and its relationship to pregnancy establishment in heifers. Anim Reprod Sci 113, 287– 292. Siqueira LGB, Areas VS, Ghetti AM, et al. Color Doppler flow imaging for the early detection of nonpregnant cattle at 20 days after timed artificial insemination. J Dairy Sci 2013; 96: 6461– 72. Utt MD, Johnson GL III, Beal WE, 2009: The evaluation of corpus luteum blood flow using color-flow Doppler ultrasound Ultrasound in the Reproductive Management for early pregnancy diagnosis in bovine embryo recipients. Theriogenology 71, 707– 715. Vasconcelos JLM, Sartori R, Oliveira HN, et al. Reduction in size of the ovulatory follicle reduces subsequent luteal size and pregnancy rate. Theriogenology 2001; 56: 307– 14. Viana JHM et al. Doppler ultrasonography as a tool for ovarian management. Anim. Reprod. , 2013, 10, 3, 215 -222. Review Wiltbank MC, Dysko RC, Gallagher KP, et al. Relationship between blood-flow and steroidogenesis in the rabbit corpus-luteum. J Reprod Fertil 1988; 84: 513– 20.
773afed2fa4687e0bb80c5257404dd99.ppt