Лекция 3-2017 апикальное тельце и цитоскелет.ppt
- Количество слайдов: 91
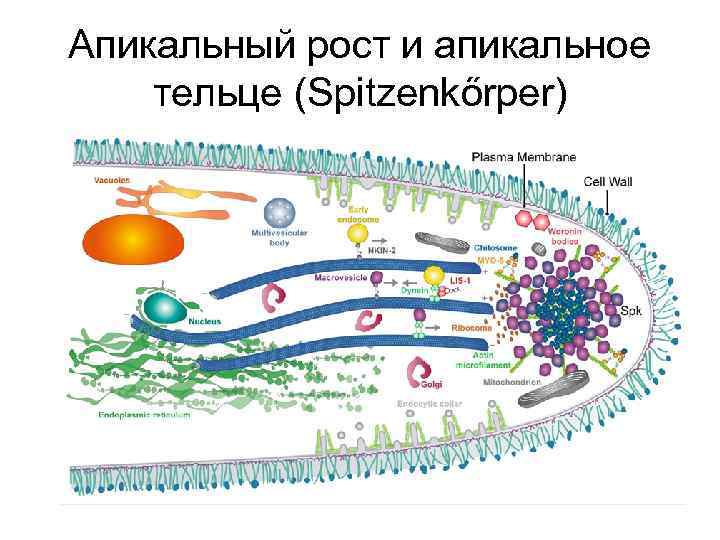 Апикальный рост и апикальное тельце (Spitzenkőrper)
Апикальный рост и апикальное тельце (Spitzenkőrper)

 • Грибы имеют разнообразный клеточный морфогенез для заселения субстрата и адаптации к условиям окружающей среды.
• Грибы имеют разнообразный клеточный морфогенез для заселения субстрата и адаптации к условиям окружающей среды.
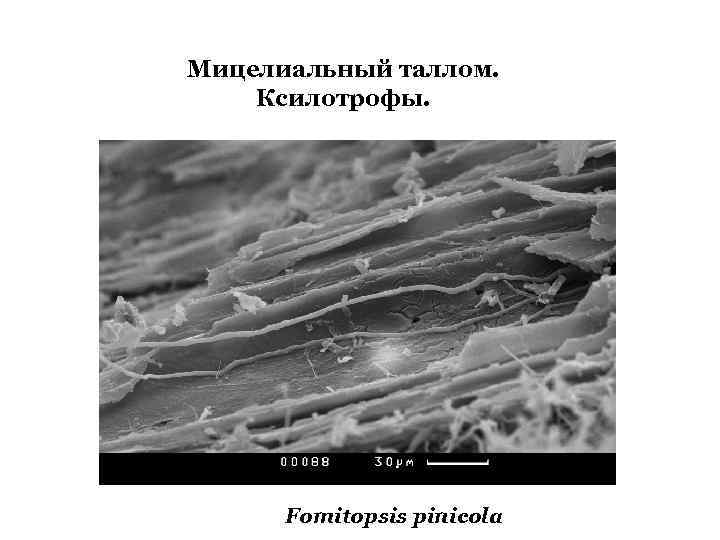 Мицелиальный таллом. Ксилотрофы. Fomitopsis pinicola
Мицелиальный таллом. Ксилотрофы. Fomitopsis pinicola
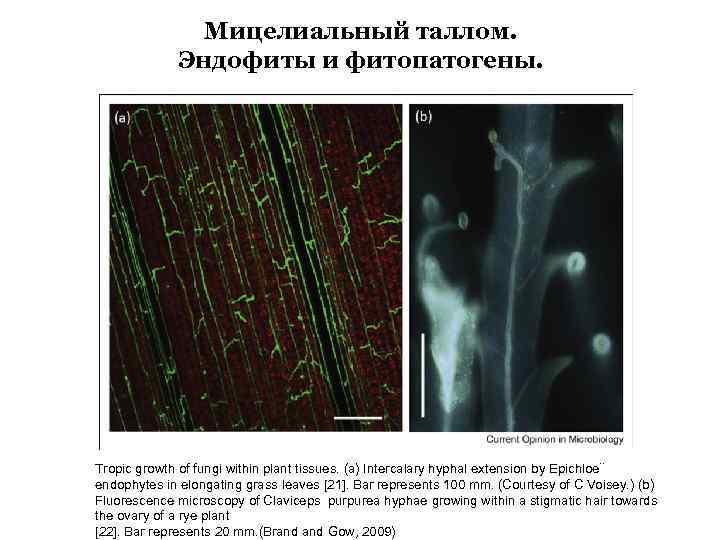 Мицелиальный таллом. Эндофиты и фитопатогены. Tropic growth of fungi within plant tissues. (a) Intercalary hyphal extension by Epichloe¨ endophytes in elongating grass leaves [21]. Bar represents 100 mm. (Courtesy of C Voisey. ) (b) Fluorescence microscopy of Claviceps purpurea hyphae growing within a stigmatic hair towards the ovary of a rye plant [22]. Bar represents 20 mm. (Brand Gow, 2009)
Мицелиальный таллом. Эндофиты и фитопатогены. Tropic growth of fungi within plant tissues. (a) Intercalary hyphal extension by Epichloe¨ endophytes in elongating grass leaves [21]. Bar represents 100 mm. (Courtesy of C Voisey. ) (b) Fluorescence microscopy of Claviceps purpurea hyphae growing within a stigmatic hair towards the ovary of a rye plant [22]. Bar represents 20 mm. (Brand Gow, 2009)
 1. 2. Дрожжевой таллом. 1 - почкующиеся дрожжи, 2 - делящиеся дрожжи
1. 2. Дрожжевой таллом. 1 - почкующиеся дрожжи, 2 - делящиеся дрожжи
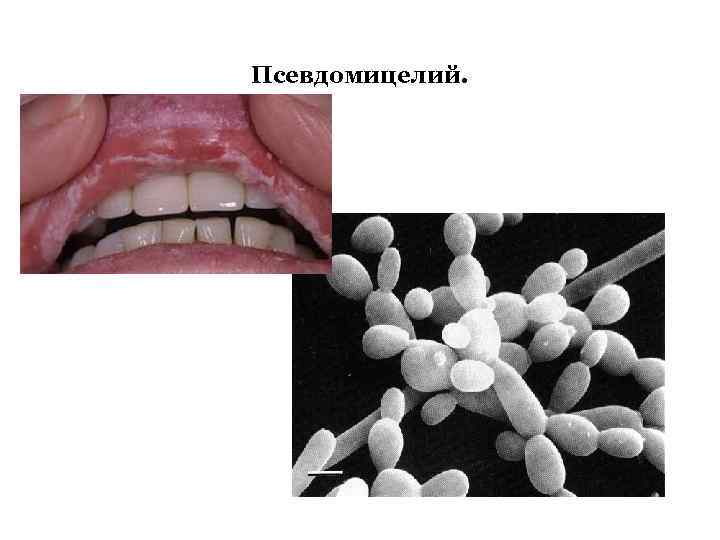 Псевдомицелий.
Псевдомицелий.
 Полярность клеток. Наблюдаемая в разных формах в разных типах и видов клеток клеточная полярность определяется двумя фундаментальными признаками: - асимметричным накоплением мобильных элементов (часто регуляторных молекул) между противоположными полюсами клетки; - ориентированной организацией полярных элементов цитоскелета (в частности актина и микротрубочек) вдоль оси полярности.
Полярность клеток. Наблюдаемая в разных формах в разных типах и видов клеток клеточная полярность определяется двумя фундаментальными признаками: - асимметричным накоплением мобильных элементов (часто регуляторных молекул) между противоположными полюсами клетки; - ориентированной организацией полярных элементов цитоскелета (в частности актина и микротрубочек) вдоль оси полярности.
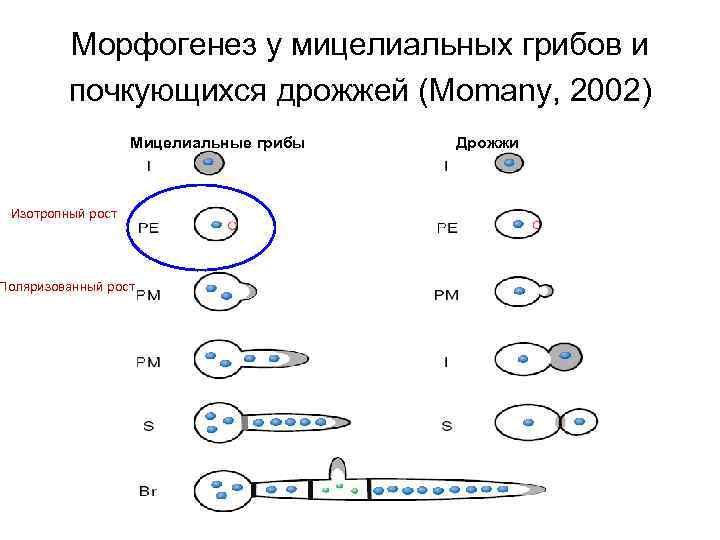 Морфогенез у мицелиальных грибов и почкующихся дрожжей (Momany, 2002) Мицелиальные грибы Изотропный рост Поляризованный рост Дрожжи
Морфогенез у мицелиальных грибов и почкующихся дрожжей (Momany, 2002) Мицелиальные грибы Изотропный рост Поляризованный рост Дрожжи
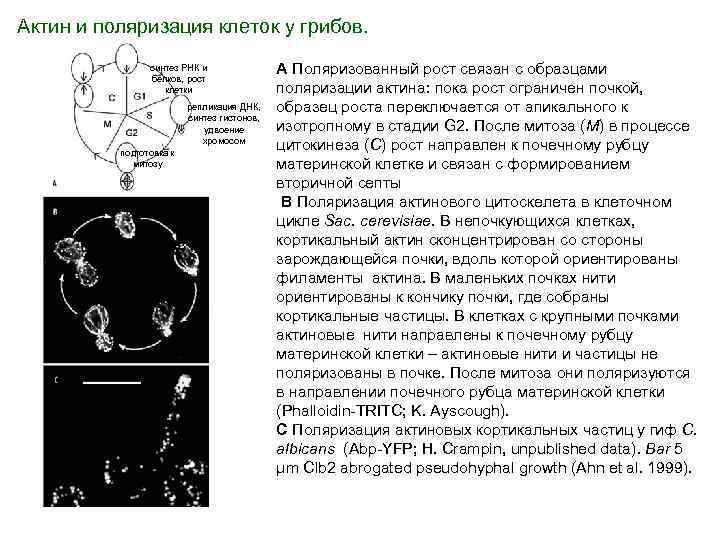 Актин и поляризация клеток у грибов. синтез РНК и белков, рост клетки репликация ДНК, синтез гистонов, удвоение хромосом подготовка к митозу A Поляризованный рост связан с образцами поляризации актина: пока рост ограничен почкой, образец роста переключается от апикального к изотропному в стадии G 2. После митоза (M) в процессе цитокинеза (C) рост направлен к почечному рубцу материнской клетке и связан с формированием вторичной септы B Поляризация актинового цитоскелета в клеточном цикле Sac. cerevisiae. В непочкующихся клетках, кортикальный актин сконцентрирован со стороны зарождающейся почки, вдоль которой ориентированы филаменты актина. В маленьких почках нити ориентированы к кончику почки, где собраны кортикальные частицы. В клетках с крупными почками актиновые нити направлены к почечному рубцу материнской клетки – актиновые нити и частицы не поляризованы в почке. После митоза они поляризуются в направлении почечного рубца материнской клетки (Phalloidin-TRITC; K. Ayscough). C Поляризация актиновых кортикальных частиц у гиф C. albicans (Abp-YFP; H. Crampin, unpublished data). Bar 5 μm Clb 2 abrogated pseudohyphal growth (Ahn et al. 1999).
Актин и поляризация клеток у грибов. синтез РНК и белков, рост клетки репликация ДНК, синтез гистонов, удвоение хромосом подготовка к митозу A Поляризованный рост связан с образцами поляризации актина: пока рост ограничен почкой, образец роста переключается от апикального к изотропному в стадии G 2. После митоза (M) в процессе цитокинеза (C) рост направлен к почечному рубцу материнской клетке и связан с формированием вторичной септы B Поляризация актинового цитоскелета в клеточном цикле Sac. cerevisiae. В непочкующихся клетках, кортикальный актин сконцентрирован со стороны зарождающейся почки, вдоль которой ориентированы филаменты актина. В маленьких почках нити ориентированы к кончику почки, где собраны кортикальные частицы. В клетках с крупными почками актиновые нити направлены к почечному рубцу материнской клетки – актиновые нити и частицы не поляризованы в почке. После митоза они поляризуются в направлении почечного рубца материнской клетки (Phalloidin-TRITC; K. Ayscough). C Поляризация актиновых кортикальных частиц у гиф C. albicans (Abp-YFP; H. Crampin, unpublished data). Bar 5 μm Clb 2 abrogated pseudohyphal growth (Ahn et al. 1999).
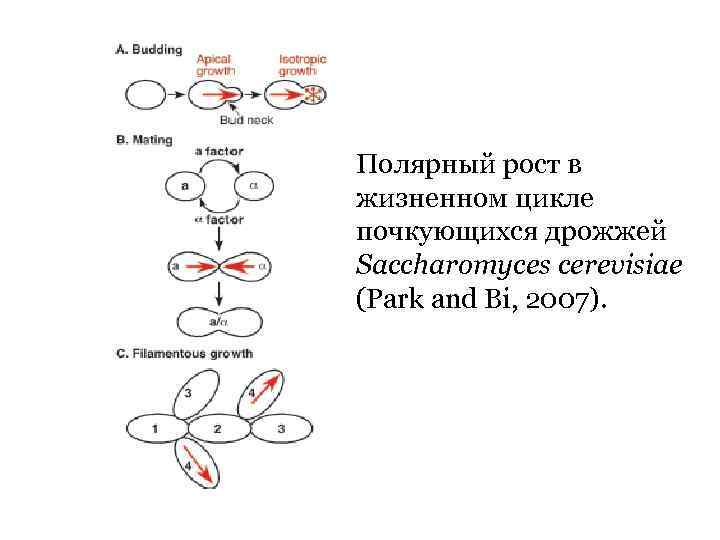 Полярный рост в жизненном цикле почкующихся дрожжей Saccharomyces cerevisiae (Park and Bi, 2007).
Полярный рост в жизненном цикле почкующихся дрожжей Saccharomyces cerevisiae (Park and Bi, 2007).
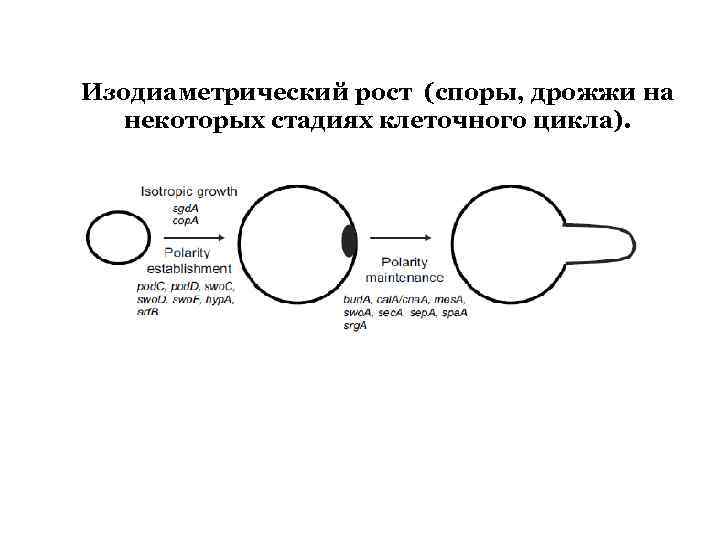 Изодиаметрический рост (споры, дрожжи на некоторых стадиях клеточного цикла).
Изодиаметрический рост (споры, дрожжи на некоторых стадиях клеточного цикла).
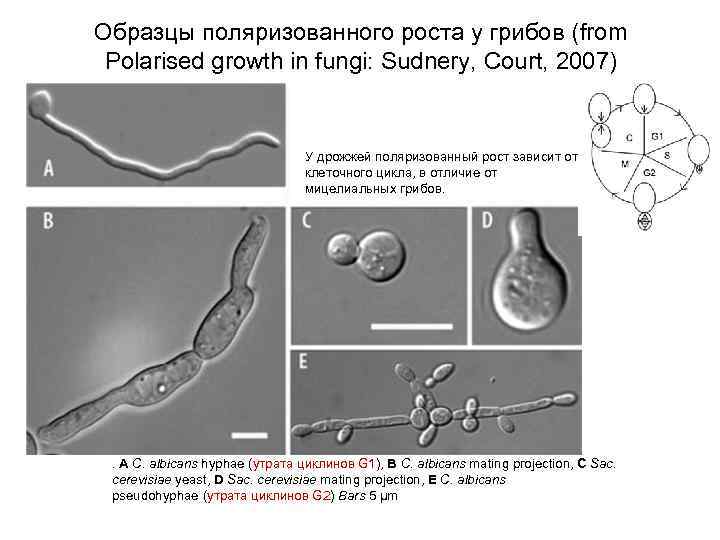 Образцы поляризованного роста у грибов (from Polarised growth in fungi: Sudnery, Court, 2007) У дрожжей поляризованный рост зависит от клеточного цикла, в отличие от мицелиальных грибов. . A C. albicans hyphae (утрата циклинов G 1), B C. albicans mating projection, C Sac. cerevisiae yeast, D Sac. cerevisiae mating projection, E C. albicans pseudohyphae (утрата циклинов G 2) Bars 5 μm
Образцы поляризованного роста у грибов (from Polarised growth in fungi: Sudnery, Court, 2007) У дрожжей поляризованный рост зависит от клеточного цикла, в отличие от мицелиальных грибов. . A C. albicans hyphae (утрата циклинов G 1), B C. albicans mating projection, C Sac. cerevisiae yeast, D Sac. cerevisiae mating projection, E C. albicans pseudohyphae (утрата циклинов G 2) Bars 5 μm
 Поляризованный рост мицелия грибов. • Вегетативное тело большинства грибов представлено мицелием, состоящим из сильно разветвленных гиф, растущих в определенном направлении за счет апикального роста гифы. • Поляризованный рост – фундаментальная черта физиологии грибной клетки.
Поляризованный рост мицелия грибов. • Вегетативное тело большинства грибов представлено мицелием, состоящим из сильно разветвленных гиф, растущих в определенном направлении за счет апикального роста гифы. • Поляризованный рост – фундаментальная черта физиологии грибной клетки.
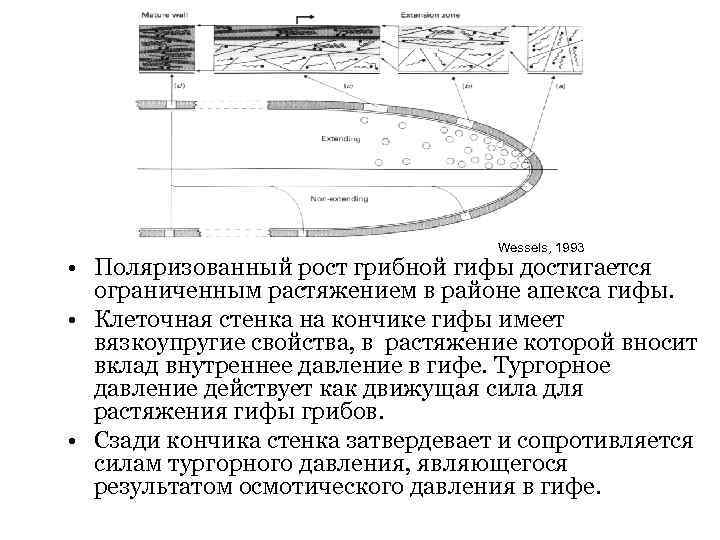 Wessels, 1993 • Поляризованный рост грибной гифы достигается ограниченным растяжением в районе апекса гифы. • Клеточная стенка на кончике гифы имеет вязкоупругие свойства, в растяжение которой вносит вклад внутреннее давление в гифе. Тургорное давление действует как движущая сила для растяжения гифы грибов. • Сзади кончика стенка затвердевает и сопротивляется силам тургорного давления, являющегося результатом осмотического давления в гифе.
Wessels, 1993 • Поляризованный рост грибной гифы достигается ограниченным растяжением в районе апекса гифы. • Клеточная стенка на кончике гифы имеет вязкоупругие свойства, в растяжение которой вносит вклад внутреннее давление в гифе. Тургорное давление действует как движущая сила для растяжения гифы грибов. • Сзади кончика стенка затвердевает и сопротивляется силам тургорного давления, являющегося результатом осмотического давления в гифе.
 • Растяжение гифы на апексе требует синтеза и встраивания нового материала стенки и мембраны таким способом, который не ослабляет кончик. • Этот высоко организованный процесс поддерживается постоянным течением везикул образующихся в цитоплазме и скоординирован с ростом и репликацией всех других цитоплазматических органелл, и их миграцией в сторону апекса.
• Растяжение гифы на апексе требует синтеза и встраивания нового материала стенки и мембраны таким способом, который не ослабляет кончик. • Этот высоко организованный процесс поддерживается постоянным течением везикул образующихся в цитоплазме и скоординирован с ростом и репликацией всех других цитоплазматических органелл, и их миграцией в сторону апекса.
 Модели роста гифы
Модели роста гифы
 . Модель устойчивого состояния роста гифы (Wessels, 1993) Согласно этой модели: Литические ферменты не вовлечены в апикальный рост; Вновь образующаяся стенка на самом кончике гифы – ВЯЗКОЭЛАСТИЧНАЯ; Новые компоненты стенки встраиваются на апексе; Отступя от апекса клеточная стенка затвердевает за счет формирования химических связей.
. Модель устойчивого состояния роста гифы (Wessels, 1993) Согласно этой модели: Литические ферменты не вовлечены в апикальный рост; Вновь образующаяся стенка на самом кончике гифы – ВЯЗКОЭЛАСТИЧНАЯ; Новые компоненты стенки встраиваются на апексе; Отступя от апекса клеточная стенка затвердевает за счет формирования химических связей.
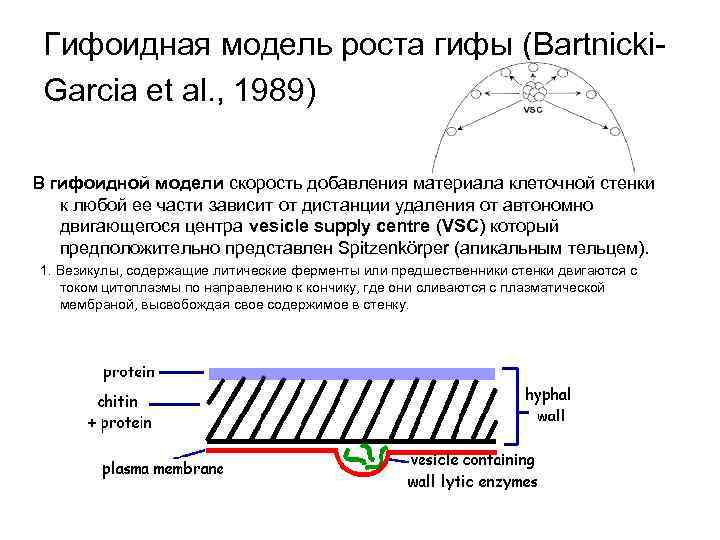 Гифоидная модель роста гифы (Bartnicki. Garcia et al. , 1989) В гифоидной модели скорость добавления материала клеточной стенки к любой ее части зависит от дистанции удаления от автономно двигающегося центра vesicle supply centre (VSC) который предположительно представлен Spitzenkörper (апикальным тельцем). 1. Везикулы, содержащие литические ферменты или предшественники стенки двигаются с током цитоплазмы по направлению к кончику, где они сливаются с плазматической мембраной, высвобождая свое содержимое в стенку.
Гифоидная модель роста гифы (Bartnicki. Garcia et al. , 1989) В гифоидной модели скорость добавления материала клеточной стенки к любой ее части зависит от дистанции удаления от автономно двигающегося центра vesicle supply centre (VSC) который предположительно представлен Spitzenkörper (апикальным тельцем). 1. Везикулы, содержащие литические ферменты или предшественники стенки двигаются с током цитоплазмы по направлению к кончику, где они сливаются с плазматической мембраной, высвобождая свое содержимое в стенку.
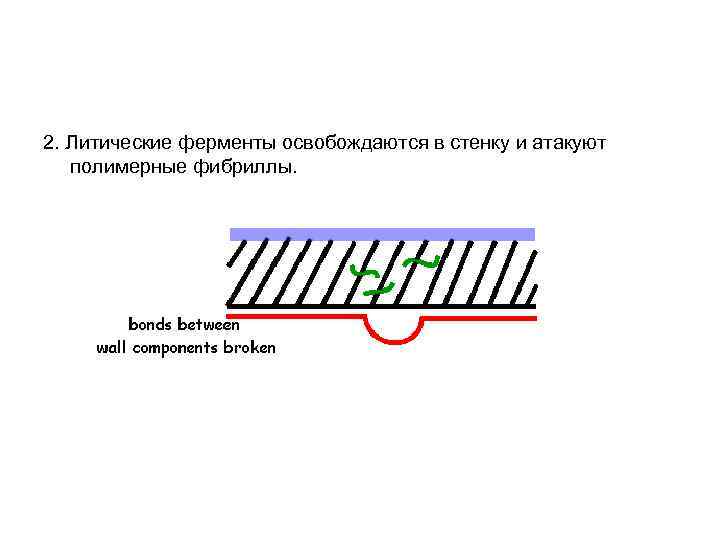 2. Литические ферменты освобождаются в стенку и атакуют полимерные фибриллы.
2. Литические ферменты освобождаются в стенку и атакуют полимерные фибриллы.
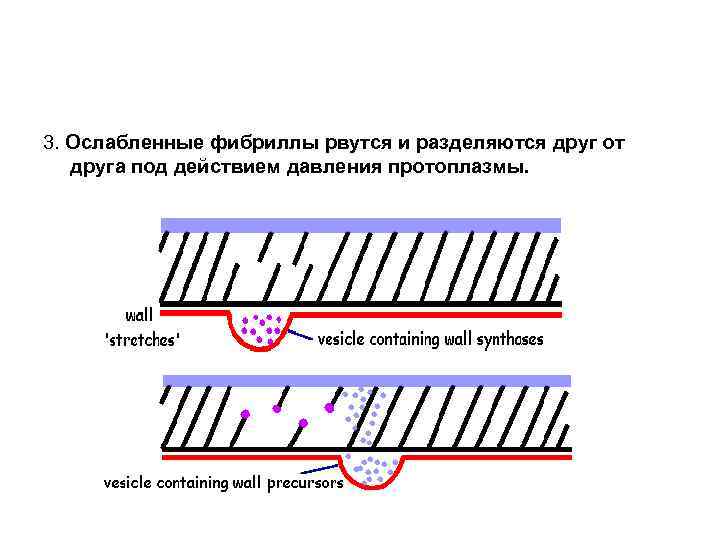 3. Ослабленные фибриллы рвутся и разделяются друг от друга под действием давления протоплазмы.
3. Ослабленные фибриллы рвутся и разделяются друг от друга под действием давления протоплазмы.
 4. Синтазные ферменты стенки строят новые фибриллы и дополнятся аморфными компонентами стенки. В результате поверхность стенки гифы увеличивается. Слияние везикул с плазматической мембраной вносит вклад в увеличение площади поверхности.
4. Синтазные ферменты стенки строят новые фибриллы и дополнятся аморфными компонентами стенки. В результате поверхность стенки гифы увеличивается. Слияние везикул с плазматической мембраной вносит вклад в увеличение площади поверхности.
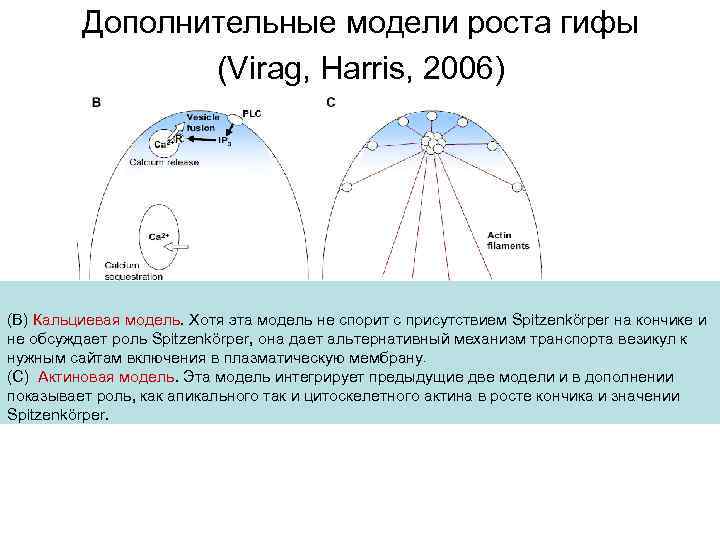 Дополнительные модели роста гифы (Virag, Harris, 2006) (В) Кальциевая модель. Хотя эта модель не спорит с присутствием Spitzenkörper на кончике и не обсуждает роль Spitzenkörper, она дает альтернативный механизм транспорта везикул к нужным сайтам включения в плазматическую мембрану. (С) Актиновая модель. Эта модель интегрирует предыдущие две модели и в дополнении показывает роль, как апикального так и цитоскелетного актина в росте кончика и значении Spitzenkörper.
Дополнительные модели роста гифы (Virag, Harris, 2006) (В) Кальциевая модель. Хотя эта модель не спорит с присутствием Spitzenkörper на кончике и не обсуждает роль Spitzenkörper, она дает альтернативный механизм транспорта везикул к нужным сайтам включения в плазматическую мембрану. (С) Актиновая модель. Эта модель интегрирует предыдущие две модели и в дополнении показывает роль, как апикального так и цитоскелетного актина в росте кончика и значении Spitzenkörper.
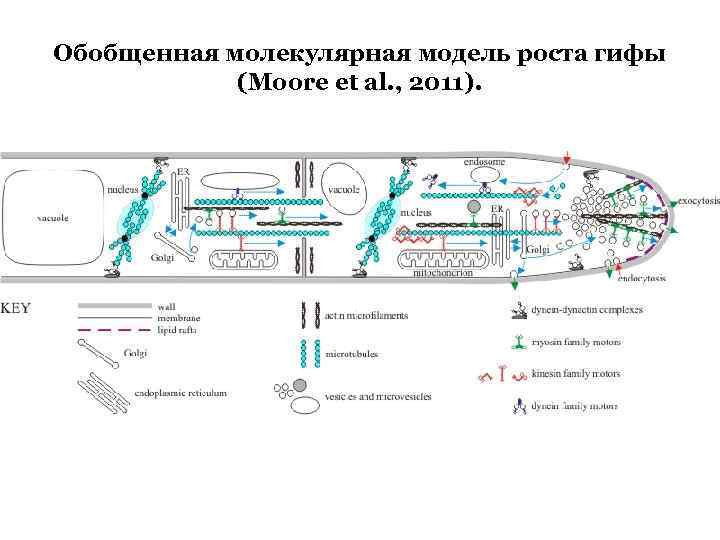 Обобщенная молекулярная модель роста гифы (Moore et al. , 2011).
Обобщенная молекулярная модель роста гифы (Moore et al. , 2011).
 • Поляризованный рост септированного мицелия грибов связан с деятельностью цитоскелета, апикального тельца, полярисомы, экзоцисты, факторов полярности (белковых комплексов: Cdc 42, Arp 2/3 и др. ). • Поляризованный рост дрожжей и псевдомицелия не связан с апикальным тельцем. Скорость роста грибов: Neurospora crassa – 16 мкм/мин, Saccharomyces cerevisiae – 0, 16 мкм/мин.
• Поляризованный рост септированного мицелия грибов связан с деятельностью цитоскелета, апикального тельца, полярисомы, экзоцисты, факторов полярности (белковых комплексов: Cdc 42, Arp 2/3 и др. ). • Поляризованный рост дрожжей и псевдомицелия не связан с апикальным тельцем. Скорость роста грибов: Neurospora crassa – 16 мкм/мин, Saccharomyces cerevisiae – 0, 16 мкм/мин.
 Апикальное тельце (Spitzenkörper) Neurospora crassa (Virag, Harris, 2005).
Апикальное тельце (Spitzenkörper) Neurospora crassa (Virag, Harris, 2005).

 Впервые апикальное тельце было описано у фиксированных и окрашенных клеток двух видов рода Coprinus Brunswik (1924) c помощью световой микроскопии. Пионерской работой положившей начало в исследовании биологии Spitzenkörper (апикального тельца) считается работа Girbardt (1957), проделанная c использованием фазовоконтрастной микроскопии. Girbardt приводит первое описание Spitzenkörper для живой растущей гифы высших грибов, как темная в фазовом контрасте структура, локализованная в грибе Polystictus (Trametes) versicolor. Его тщательное исследование растущей гифы показало, - оно присутствует только в кончике растущей вегетативной гифы, - образуется на месте прорастания споры и боковых ответвлений, - локализовано в том месте гифы, которое коррелирует с направлением роста гифы. Таким образом, функции апикального тельца – обеспечение апикального роста гифы и направленного синтеза клеточной стенки. Далее были проведены детальные исследования ультраструктуры апикального тельца у разных групп грибов в 60 -70 -ые годы (Grove, Braсker), которые показали, что это мультикомпонентный комплекс, в котором доминируют везикулы.
Впервые апикальное тельце было описано у фиксированных и окрашенных клеток двух видов рода Coprinus Brunswik (1924) c помощью световой микроскопии. Пионерской работой положившей начало в исследовании биологии Spitzenkörper (апикального тельца) считается работа Girbardt (1957), проделанная c использованием фазовоконтрастной микроскопии. Girbardt приводит первое описание Spitzenkörper для живой растущей гифы высших грибов, как темная в фазовом контрасте структура, локализованная в грибе Polystictus (Trametes) versicolor. Его тщательное исследование растущей гифы показало, - оно присутствует только в кончике растущей вегетативной гифы, - образуется на месте прорастания споры и боковых ответвлений, - локализовано в том месте гифы, которое коррелирует с направлением роста гифы. Таким образом, функции апикального тельца – обеспечение апикального роста гифы и направленного синтеза клеточной стенки. Далее были проведены детальные исследования ультраструктуры апикального тельца у разных групп грибов в 60 -70 -ые годы (Grove, Braсker), которые показали, что это мультикомпонентный комплекс, в котором доминируют везикулы.
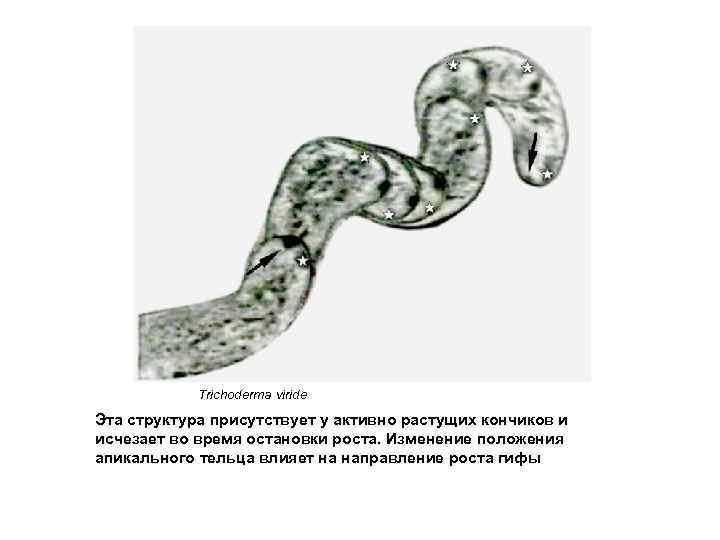 Trichoderma viride Эта структура присутствует у активно растущих кончиков и исчезает во время остановки роста. Изменение положения апикального тельца влияет на направление роста гифы
Trichoderma viride Эта структура присутствует у активно растущих кончиков и исчезает во время остановки роста. Изменение положения апикального тельца влияет на направление роста гифы
 Цитология кончика гифы.
Цитология кончика гифы.
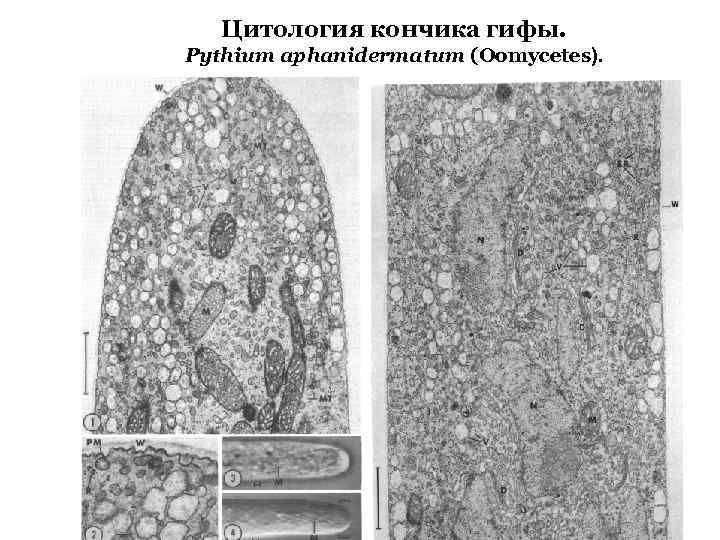 Цитология кончика гифы. Pythium aphanidermatum (Oomycetes).
Цитология кончика гифы. Pythium aphanidermatum (Oomycetes).
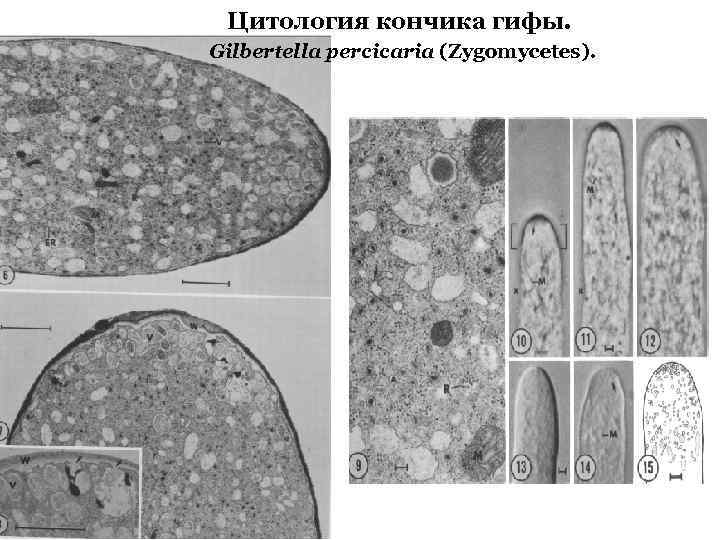 Цитология кончика гифы. Gilbertella percicaria (Zygomycetes).
Цитология кончика гифы. Gilbertella percicaria (Zygomycetes).
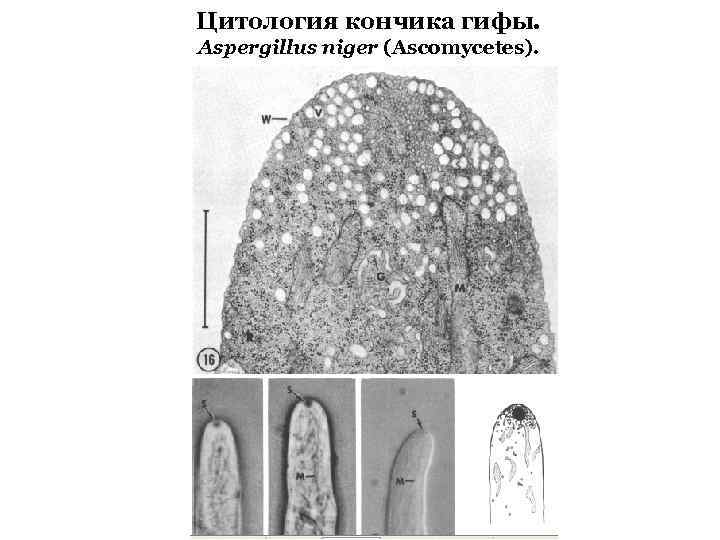 Цитология кончика гифы. Aspergillus niger (Ascomycetes).
Цитология кончика гифы. Aspergillus niger (Ascomycetes).
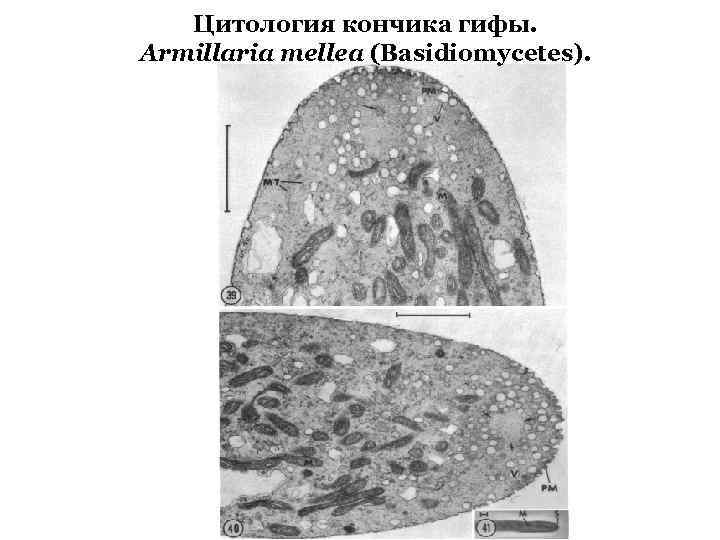 Цитология кончика гифы. Armillaria mellea (Basidiomycetes).
Цитология кончика гифы. Armillaria mellea (Basidiomycetes).
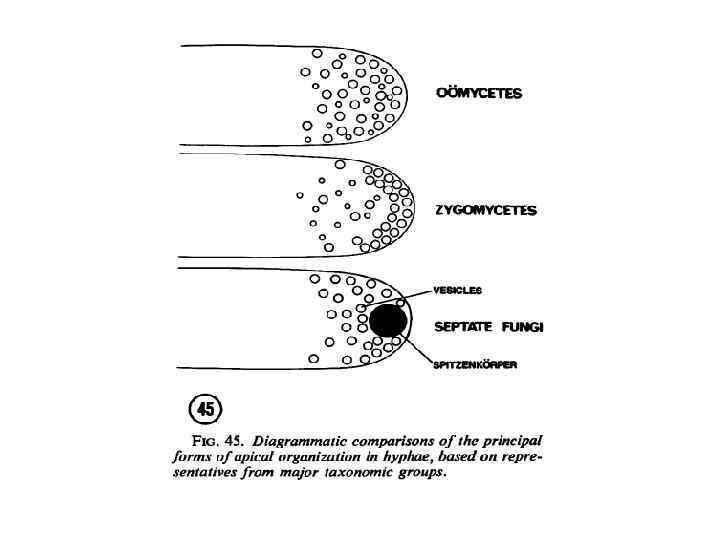
 Цитология кончика гифы.
Цитология кончика гифы.
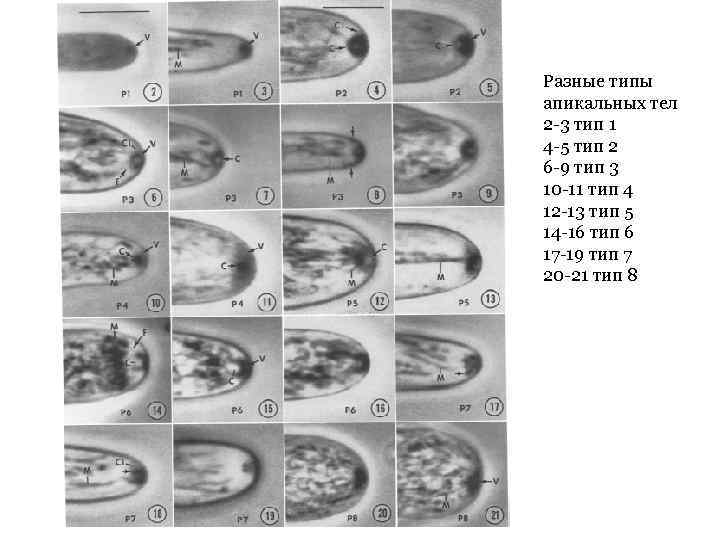 Разные типы апикальных тел 2 -3 тип 1 4 -5 тип 2 6 -9 тип 3 10 -11 тип 4 12 -13 тип 5 14 -16 тип 6 17 -19 тип 7 20 -21 тип 8
Разные типы апикальных тел 2 -3 тип 1 4 -5 тип 2 6 -9 тип 3 10 -11 тип 4 12 -13 тип 5 14 -16 тип 6 17 -19 тип 7 20 -21 тип 8
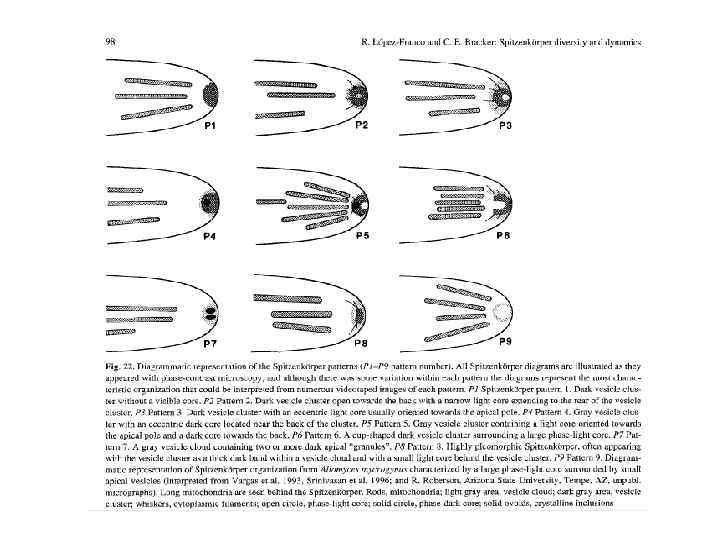
 Исследования апикального центра на уровне светового и электронного микроскопа показало, что апикальное тельце присутствует у септированных грибов и его атрибутами являются (Grove, Bracker, 1970): • Один сферический комплекс. • Он выглядит темным в фазово-контрастном изображении. • У него отсутствует дискретная граница. • Локализовано в апикальном своде апикально растущей гифы. • Требуется для роста гифы. • Состоит из апикальных везикул, микрофиламентов и иногда рибосом. • Имеет полярность и билатеральную симметрию по форме и организации. • Является, по-видимому, источником везикул в процессе экзоцитоза и роста гифы.
Исследования апикального центра на уровне светового и электронного микроскопа показало, что апикальное тельце присутствует у септированных грибов и его атрибутами являются (Grove, Bracker, 1970): • Один сферический комплекс. • Он выглядит темным в фазово-контрастном изображении. • У него отсутствует дискретная граница. • Локализовано в апикальном своде апикально растущей гифы. • Требуется для роста гифы. • Состоит из апикальных везикул, микрофиламентов и иногда рибосом. • Имеет полярность и билатеральную симметрию по форме и организации. • Является, по-видимому, источником везикул в процессе экзоцитоза и роста гифы.
 • Клеточные компоненты, связанные с апикальным тельцем: митохондрии и микрофиламенты. • Показаны изменения размера, формы и положения апикального тельца. • Морфология апикального тельца родоспецифична. • Несептированные грибы из рода Allomyces имеют тип 9 апикального центра, состоящего из кольца мелких везикул. • Действие стрессовых факторов (световой, температурный, электрический) приводит к миграции апикального центра в субапикальную зону или к его исчезновению. В обеих случаях изменяется форма гифы и прекращается рост.
• Клеточные компоненты, связанные с апикальным тельцем: митохондрии и микрофиламенты. • Показаны изменения размера, формы и положения апикального тельца. • Морфология апикального тельца родоспецифична. • Несептированные грибы из рода Allomyces имеют тип 9 апикального центра, состоящего из кольца мелких везикул. • Действие стрессовых факторов (световой, температурный, электрический) приводит к миграции апикального центра в субапикальную зону или к его исчезновению. В обеих случаях изменяется форма гифы и прекращается рост.
 Спутник Spitzenkörper • Спутник Spitzenkörper представляет собой маленькую группы везикул, которые появляются на расстоянии нескольких микрометров позади апикального полюса, быстро мигрируют к апексу гифы и поглощаются основным Spitzenkörper, таким образом, внося вклад в рост гифы. Этот способ поглощения Spitzenkörper спутника было предложено считать принадлежностью пульсирующего роста кончика гифы
Спутник Spitzenkörper • Спутник Spitzenkörper представляет собой маленькую группы везикул, которые появляются на расстоянии нескольких микрометров позади апикального полюса, быстро мигрируют к апексу гифы и поглощаются основным Spitzenkörper, таким образом, внося вклад в рост гифы. Этот способ поглощения Spitzenkörper спутника было предложено считать принадлежностью пульсирующего роста кончика гифы
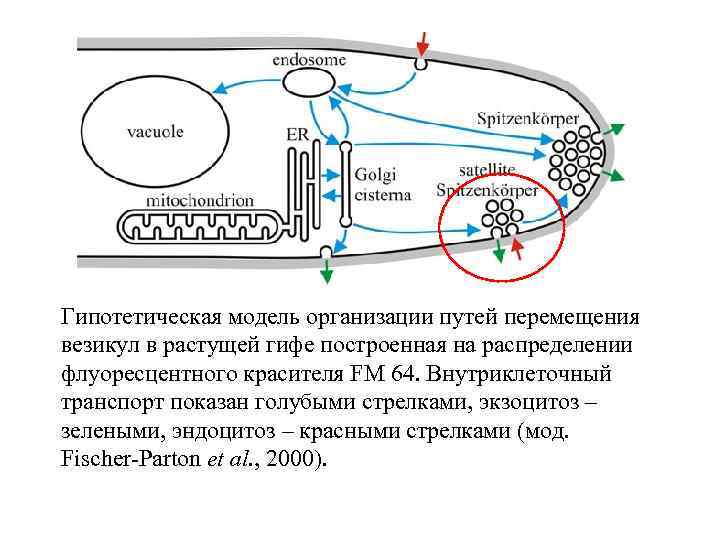 Гипотетическая модель организации путей перемещения везикул в растущей гифе построенная на распределении флуоресцентного красителя FM 64. Внутриклеточный транспорт показан голубыми стрелками, экзоцитоз – зелеными, эндоцитоз – красными стрелками (мод. Fischer-Parton et al. , 2000).
Гипотетическая модель организации путей перемещения везикул в растущей гифе построенная на распределении флуоресцентного красителя FM 64. Внутриклеточный транспорт показан голубыми стрелками, экзоцитоз – зелеными, эндоцитоз – красными стрелками (мод. Fischer-Parton et al. , 2000).
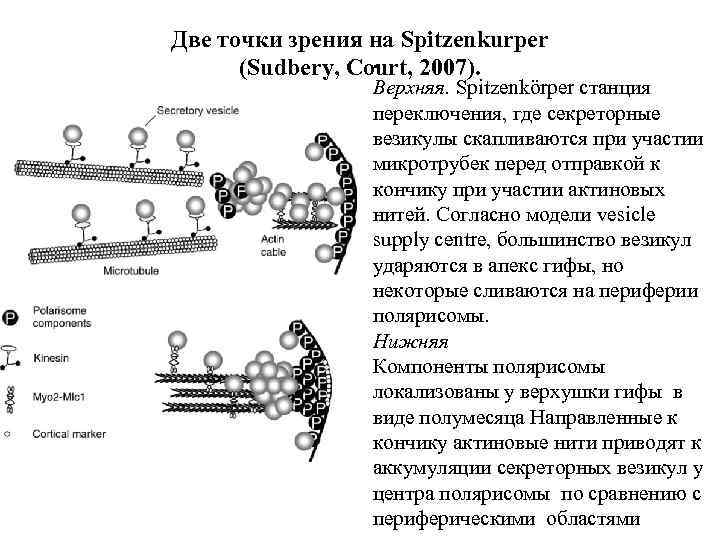 Две точки зрения на Spitzenkurper. (Sudbery, Court, 2007). Верхняя. Spitzenkörper станция переключения, где секреторные везикулы скапливаются при участии микротрубек перед отправкой к кончику при участии актиновых нитей. Согласно модели vesicle supply centre, большинство везикул ударяются в апекс гифы, но некоторые сливаются на периферии полярисомы. Нижняя Компоненты полярисомы локализованы у верхушки гифы в виде полумесяца Направленные к кончику актиновые нити приводят к аккумуляции секреторных везикул у центра полярисомы по сравнению с периферическими областями
Две точки зрения на Spitzenkurper. (Sudbery, Court, 2007). Верхняя. Spitzenkörper станция переключения, где секреторные везикулы скапливаются при участии микротрубек перед отправкой к кончику при участии актиновых нитей. Согласно модели vesicle supply centre, большинство везикул ударяются в апекс гифы, но некоторые сливаются на периферии полярисомы. Нижняя Компоненты полярисомы локализованы у верхушки гифы в виде полумесяца Направленные к кончику актиновые нити приводят к аккумуляции секреторных везикул у центра полярисомы по сравнению с периферическими областями
 Онтогенез апикального тельца • Формирование de novo • Наблюдения дихотомического ветвления у Aspergillus niger мутанта ‘ramosa’ показали, что Spitzenkörper исчезает перед формированием новых дихотомических веточек. Два новых Spitzenkörper образуются после того, как становятся заметными инициали двух новых веточек, по одному у вершины новой веточки (Reynaga-Peña, Bartnicki-García, 1997)
Онтогенез апикального тельца • Формирование de novo • Наблюдения дихотомического ветвления у Aspergillus niger мутанта ‘ramosa’ показали, что Spitzenkörper исчезает перед формированием новых дихотомических веточек. Два новых Spitzenkörper образуются после того, как становятся заметными инициали двух новых веточек, по одному у вершины новой веточки (Reynaga-Peña, Bartnicki-García, 1997)
 • 38 000 везикул сливаются с апикальной мембраной каждую минуту для поддержания роста у Neurospora crassa когда гифа растет с максимальной скоростью !
• 38 000 везикул сливаются с апикальной мембраной каждую минуту для поддержания роста у Neurospora crassa когда гифа растет с максимальной скоростью !
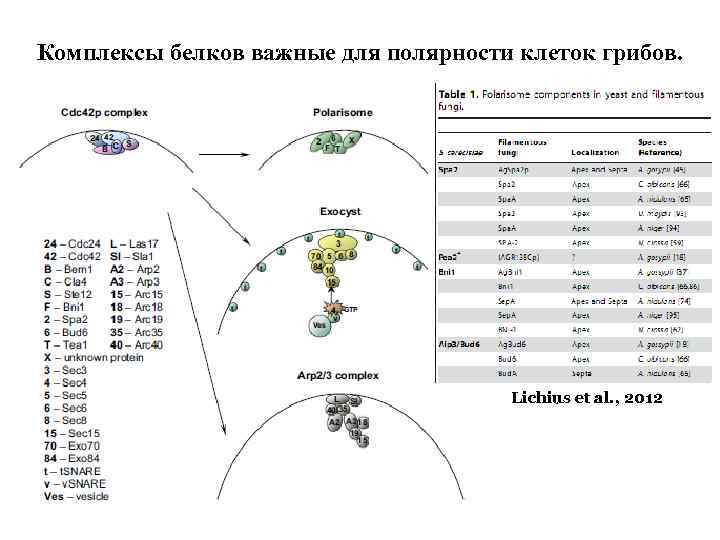 Комплексы белков важные для полярности клеток грибов. Lichius et al. , 2012
Комплексы белков важные для полярности клеток грибов. Lichius et al. , 2012
 Предполагаемые белки, участвующие в создании и поддержании полярности у грибов (Harris et al. , 2009).
Предполагаемые белки, участвующие в создании и поддержании полярности у грибов (Harris et al. , 2009).
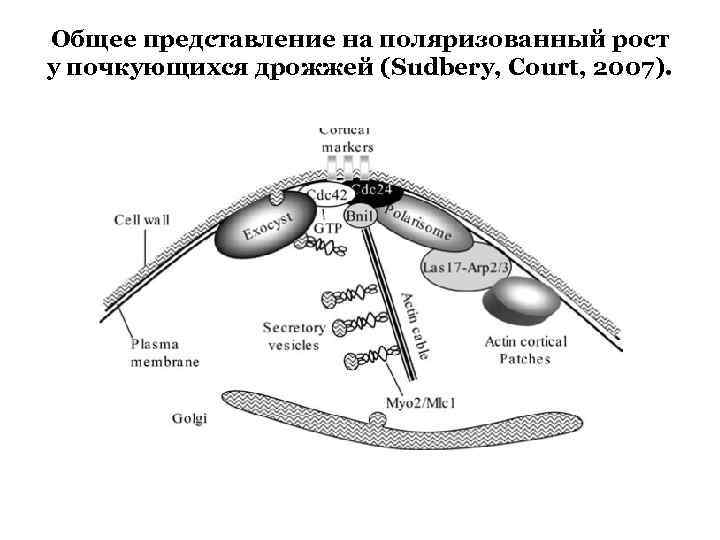 Общее представление на поляризованный рост у почкующихся дрожжей (Sudbery, Court, 2007).
Общее представление на поляризованный рост у почкующихся дрожжей (Sudbery, Court, 2007).
 Полярисома • Полярисома дрожжей состоит из белков Bni 1, Spa 2, Bud 6 и Pea 1, локализованных в виде полумесяца у места зарождающейся почки, и направляет микрофиламенты актина и другие клеточные компоненты к сайтам поляризованного роста • Полярисома мицелиальных грибов состоит из Bni 1, Spa 2 и Bud 6
Полярисома • Полярисома дрожжей состоит из белков Bni 1, Spa 2, Bud 6 и Pea 1, локализованных в виде полумесяца у места зарождающейся почки, и направляет микрофиламенты актина и другие клеточные компоненты к сайтам поляризованного роста • Полярисома мицелиальных грибов состоит из Bni 1, Spa 2 и Bud 6

 Экзоциста • Экзоциста - второй белковый комплекс, который вовлечен в стыковку везикул и с плазматической мембраной • Экзоциста мицелиальных грибов содержит восемь белков: Sec 3, Sec 5, Sec 6, Sec 8, Sec 10, Sec 15, Exo 70, и Exo 84, и взаимодействует с Rho-GTPазой Cdc 42, Rho 1, Rho 3, а также с Sec 4, Rab GTPаза присутствующей на поверхности мембраны везикул
Экзоциста • Экзоциста - второй белковый комплекс, который вовлечен в стыковку везикул и с плазматической мембраной • Экзоциста мицелиальных грибов содержит восемь белков: Sec 3, Sec 5, Sec 6, Sec 8, Sec 10, Sec 15, Exo 70, и Exo 84, и взаимодействует с Rho-GTPазой Cdc 42, Rho 1, Rho 3, а также с Sec 4, Rab GTPаза присутствующей на поверхности мембраны везикул
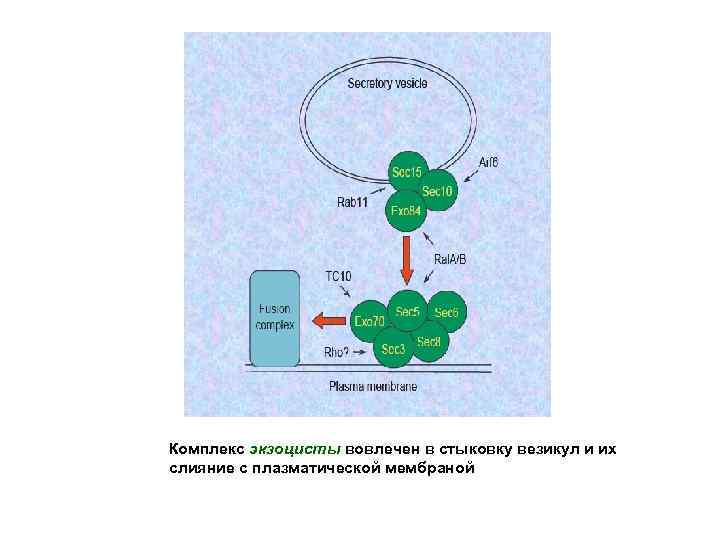 Комплекс экзоцисты вовлечен в стыковку везикул и их слияние с плазматической мембраной
Комплекс экзоцисты вовлечен в стыковку везикул и их слияние с плазматической мембраной
 Комплекс Arp 2/3 • Комплекс Arp 2/3 – белки мицелиальных грибов важных для поддержания полярности и включает Arp 2, Arp 3, Arc 40, Arc 35, Arc 18, Arc 19 и Arc 15. Комплекс Arp 2/3 отвечает за инициацию ветвления актиновых филаментов, образующих кортикальную актиновую сеть, и участвуют в эндоцитозе. Он локализован около актиновых пятен, примыкающих к плазматической мембране в апикальном районе растягивающегося кончика гифы.
Комплекс Arp 2/3 • Комплекс Arp 2/3 – белки мицелиальных грибов важных для поддержания полярности и включает Arp 2, Arp 3, Arc 40, Arc 35, Arc 18, Arc 19 и Arc 15. Комплекс Arp 2/3 отвечает за инициацию ветвления актиновых филаментов, образующих кортикальную актиновую сеть, и участвуют в эндоцитозе. Он локализован около актиновых пятен, примыкающих к плазматической мембране в апикальном районе растягивающегося кончика гифы.
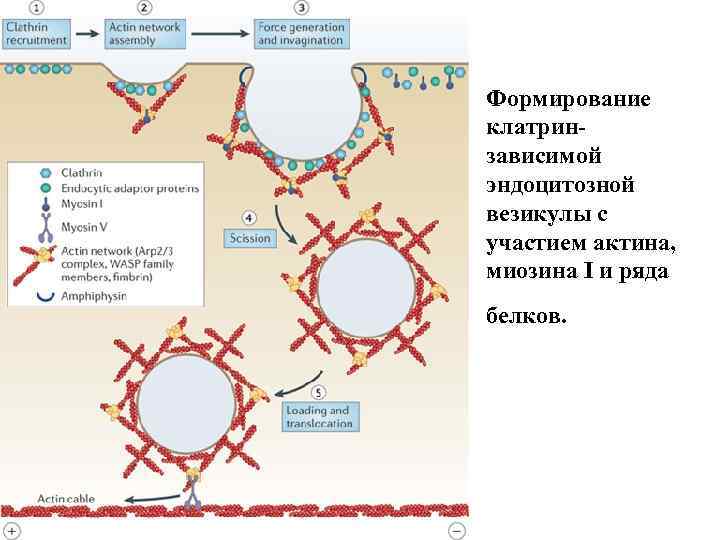 Формирование клатринзависимой эндоцитозной везикулы с участием актина, миозина I и ряда белков.
Формирование клатринзависимой эндоцитозной везикулы с участием актина, миозина I и ряда белков.
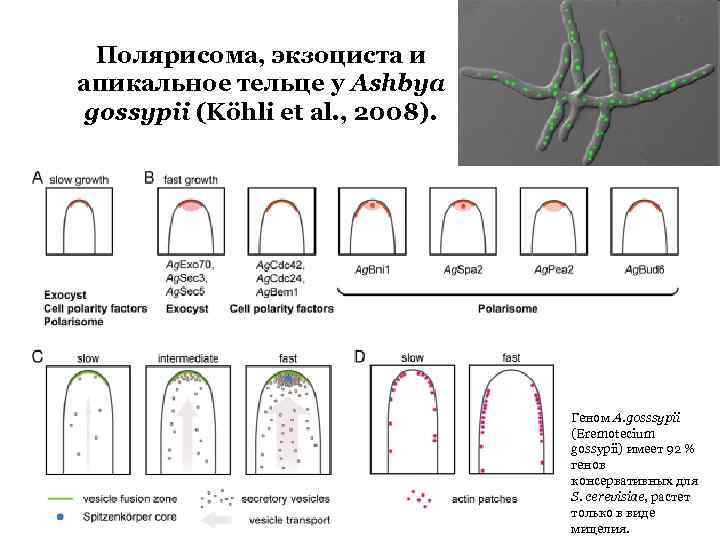 Полярисома, экзоциста и апикальное тельце у Ashbya gossypii (Köhli et al. , 2008). Геном A. gosssypii (Eremotecium gossypii) имеет 92 % генов консервативных для S. cerevisiae, растет только в виде мицелия.
Полярисома, экзоциста и апикальное тельце у Ashbya gossypii (Köhli et al. , 2008). Геном A. gosssypii (Eremotecium gossypii) имеет 92 % генов консервативных для S. cerevisiae, растет только в виде мицелия.
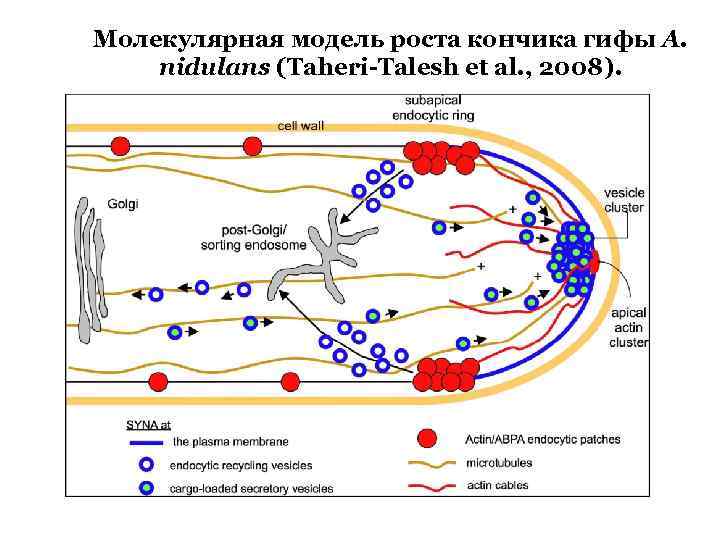 Молекулярная модель роста кончика гифы A. nidulans (Taheri-Talesh et al. , 2008).
Молекулярная модель роста кончика гифы A. nidulans (Taheri-Talesh et al. , 2008).
 Молекулярная модель роста кончика гифы A. nidulans (Brand Gow, 2009).
Молекулярная модель роста кончика гифы A. nidulans (Brand Gow, 2009).
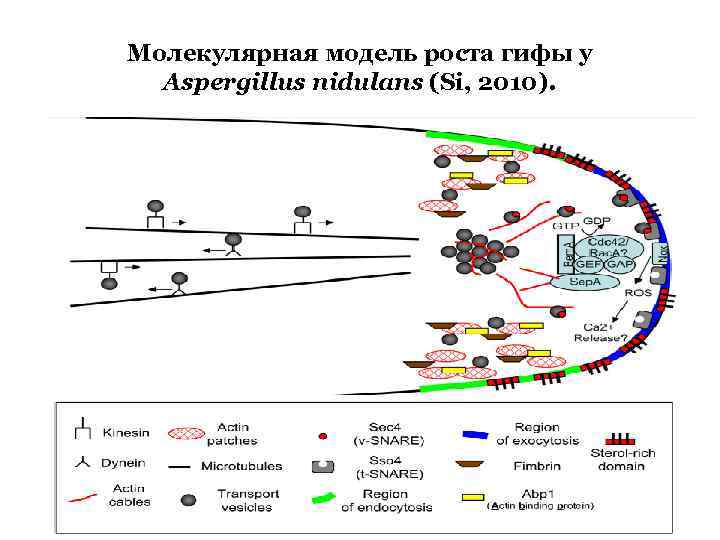 Молекулярная модель роста гифы у Aspergillus nidulans (Si, 2010).
Молекулярная модель роста гифы у Aspergillus nidulans (Si, 2010).
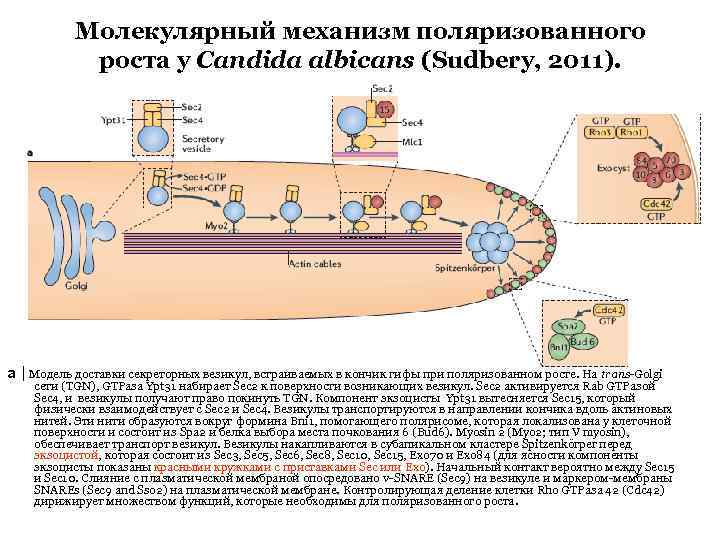 Молекулярный механизм поляризованного роста у Candida albicans (Sudbery, 2011). a | Модель доставки секреторных везикул, встраиваемых в кончик гифы при поляризованном росте. На trans-Golgi сети (TGN), GTPаза Ypt 31 набирает Sec 2 к поверхности возникающих везикул. Sec 2 активируется Rab GTPазой Sec 4, и везикулы получают право покинуть TGN. Компонент экзоцисты Ypt 31 вытесняется Sec 15, который физически взаимодействует с Sec 2 и Sec 4. Везикулы транспортируются в направлении кончика вдоль актиновых нитей. Эти нити образуются вокруг формина Bni 1, помогающего полярисоме, которая локализована у клеточной поверхности и состоит из Spa 2 и белка выбора места почкования 6 (Bud 6). Myosin 2 (Myo 2; тип V myosin), обеспечивает транспорт везикул. Везикулы накапливаются в субапикальном кластере Spitzenkörper перед экзоцистой, которая состоит из Sec 3, Sec 5, Sec 6, Sec 8, Sec 10, Sec 15, Exo 70 и Exo 84 (для ясности компоненты экзоцисты показаны красными кружками с приставками Sec или Exo). Начальный контакт вероятно между Sec 15 и Sec 10. Слияние с плазматической мембраной опосредовано v-SNARE (Sec 9) на везикуле и маркером-мембраны SNAREs (Sec 9 and Sso 2) на плазматической мембране. Контролирующая деление клетки Rho GTPаза 42 (Cdc 42) дирижирует множеством функций, которые необходимы для поляризованного роста.
Молекулярный механизм поляризованного роста у Candida albicans (Sudbery, 2011). a | Модель доставки секреторных везикул, встраиваемых в кончик гифы при поляризованном росте. На trans-Golgi сети (TGN), GTPаза Ypt 31 набирает Sec 2 к поверхности возникающих везикул. Sec 2 активируется Rab GTPазой Sec 4, и везикулы получают право покинуть TGN. Компонент экзоцисты Ypt 31 вытесняется Sec 15, который физически взаимодействует с Sec 2 и Sec 4. Везикулы транспортируются в направлении кончика вдоль актиновых нитей. Эти нити образуются вокруг формина Bni 1, помогающего полярисоме, которая локализована у клеточной поверхности и состоит из Spa 2 и белка выбора места почкования 6 (Bud 6). Myosin 2 (Myo 2; тип V myosin), обеспечивает транспорт везикул. Везикулы накапливаются в субапикальном кластере Spitzenkörper перед экзоцистой, которая состоит из Sec 3, Sec 5, Sec 6, Sec 8, Sec 10, Sec 15, Exo 70 и Exo 84 (для ясности компоненты экзоцисты показаны красными кружками с приставками Sec или Exo). Начальный контакт вероятно между Sec 15 и Sec 10. Слияние с плазматической мембраной опосредовано v-SNARE (Sec 9) на везикуле и маркером-мембраны SNAREs (Sec 9 and Sso 2) на плазматической мембране. Контролирующая деление клетки Rho GTPаза 42 (Cdc 42) дирижирует множеством функций, которые необходимы для поляризованного роста.
 Цитоскелет грибной клетки
Цитоскелет грибной клетки
 • Цитоскелет грибной клетки представлен микротрубочками, филаментами актина в комбинации с моторными белками и промежуточными филаментами септина.
• Цитоскелет грибной клетки представлен микротрубочками, филаментами актина в комбинации с моторными белками и промежуточными филаментами септина.
 Функции • Цитоскелет у грибов играет роль во множестве клеточных функций, таких как регуляция полярности клетки, эндоцитоз и экзоцитоз, митоз и мейоз, септирование и внутриклеточный транспорт органелл.
Функции • Цитоскелет у грибов играет роль во множестве клеточных функций, таких как регуляция полярности клетки, эндоцитоз и экзоцитоз, митоз и мейоз, септирование и внутриклеточный транспорт органелл.
 Микротрубочки • Микротрубочковый цитоскелет Микротрубочки (МТ) это полые цилиндрические структуры диаметром 25 нм, которые собираются из α-тубулина-βтубулина (αβ-тубулин) - гетеродимеров субъединиц глобулярного тубулина при участии ГТФ
Микротрубочки • Микротрубочковый цитоскелет Микротрубочки (МТ) это полые цилиндрические структуры диаметром 25 нм, которые собираются из α-тубулина-βтубулина (αβ-тубулин) - гетеродимеров субъединиц глобулярного тубулина при участии ГТФ
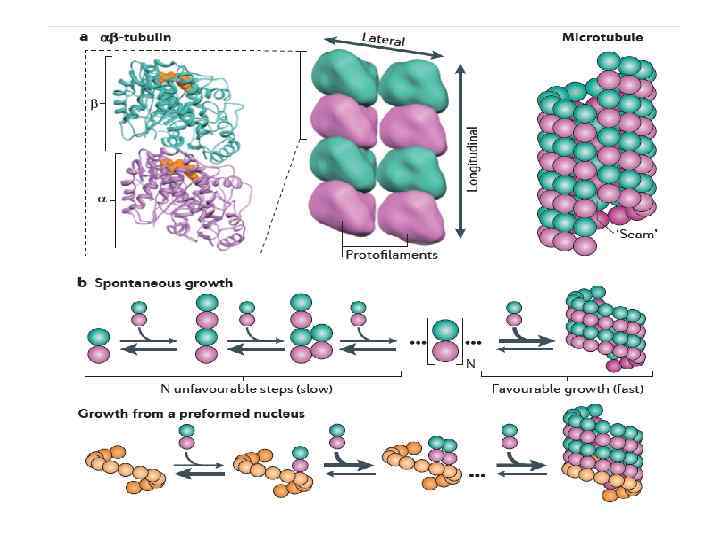
 • Функцию инициации образования микротрубочек у эукариот выполняет центр организации микротрубочек (ЦОМ, англ. МТОС), у грибов эту роль обычно выполняет полярное тельце веретена (ПТВ, англ. spindle pole body, SPB), компонентом которого является γ-тубулин (или γ-tubulin ring complex, γ-Tu. RC), гомолог альфатубулина и бета-тубулина.
• Функцию инициации образования микротрубочек у эукариот выполняет центр организации микротрубочек (ЦОМ, англ. МТОС), у грибов эту роль обычно выполняет полярное тельце веретена (ПТВ, англ. spindle pole body, SPB), компонентом которого является γ-тубулин (или γ-tubulin ring complex, γ-Tu. RC), гомолог альфатубулина и бета-тубулина.
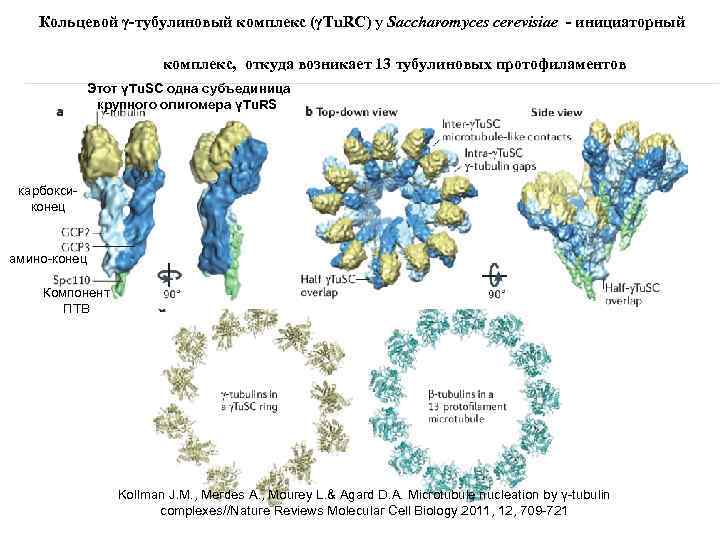 Кольцевой γ‑тубулиновый комплекс (γTu. RC) у Saccharomyces cerevisiae - инициаторный комплекс, откуда возникает 13 тубулиновых протофиламентов Этот γTu. SC одна субъединица крупного олигомера γTu. RS карбоксиконец амино-конец Компонент ПТВ Kollman J. M. , Merdes A. , Mourey L. & Agard D. A. Microtubule nucleation by γ-tubulin complexes//Nature Reviews Molecular Cell Biology 2011, 12, 709 -721
Кольцевой γ‑тубулиновый комплекс (γTu. RC) у Saccharomyces cerevisiae - инициаторный комплекс, откуда возникает 13 тубулиновых протофиламентов Этот γTu. SC одна субъединица крупного олигомера γTu. RS карбоксиконец амино-конец Компонент ПТВ Kollman J. M. , Merdes A. , Mourey L. & Agard D. A. Microtubule nucleation by γ-tubulin complexes//Nature Reviews Molecular Cell Biology 2011, 12, 709 -721
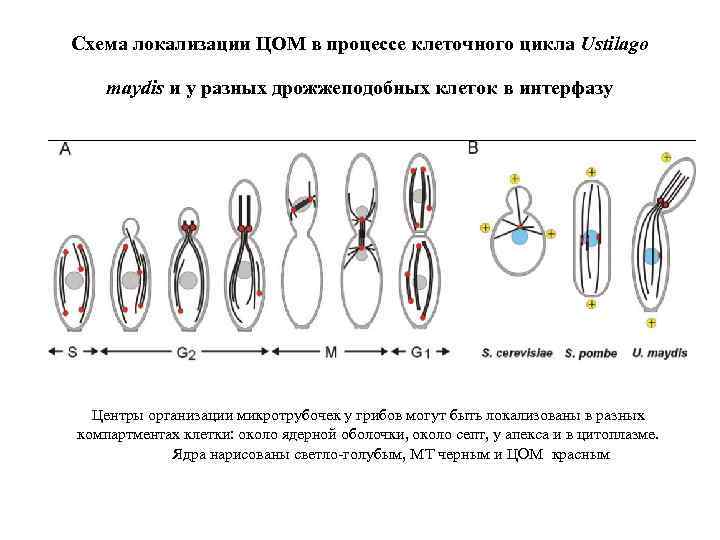 Схема локализации ЦОМ в процессе клеточного цикла Ustilago maydis и у разных дрожжеподобных клеток в интерфазу Центры организации микротрубочек у грибов могут быть локализованы в разных компартментах клетки: около ядерной оболочки, около септ, у апекса и в цитоплазме. Ядра нарисованы светло-голубым, MT черным и ЦОМ красным
Схема локализации ЦОМ в процессе клеточного цикла Ustilago maydis и у разных дрожжеподобных клеток в интерфазу Центры организации микротрубочек у грибов могут быть локализованы в разных компартментах клетки: около ядерной оболочки, около септ, у апекса и в цитоплазме. Ядра нарисованы светло-голубым, MT черным и ЦОМ красным
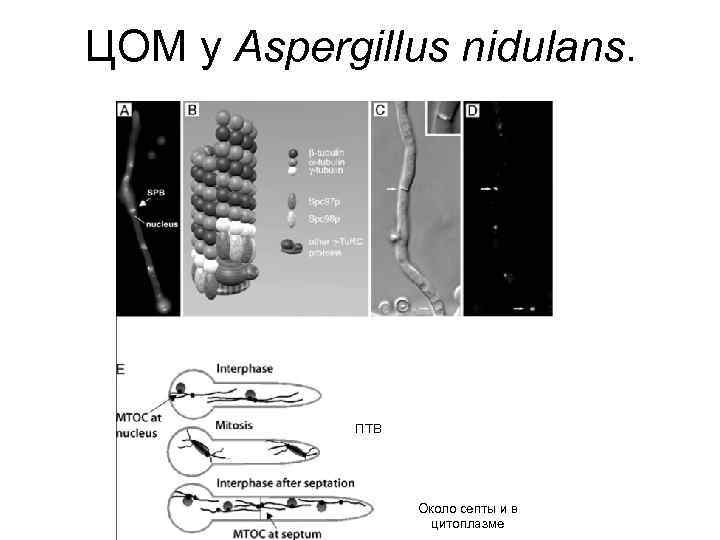 ЦОМ у Aspergillus nidulans. ПТВ Около септы и в цитоплазме
ЦОМ у Aspergillus nidulans. ПТВ Около септы и в цитоплазме
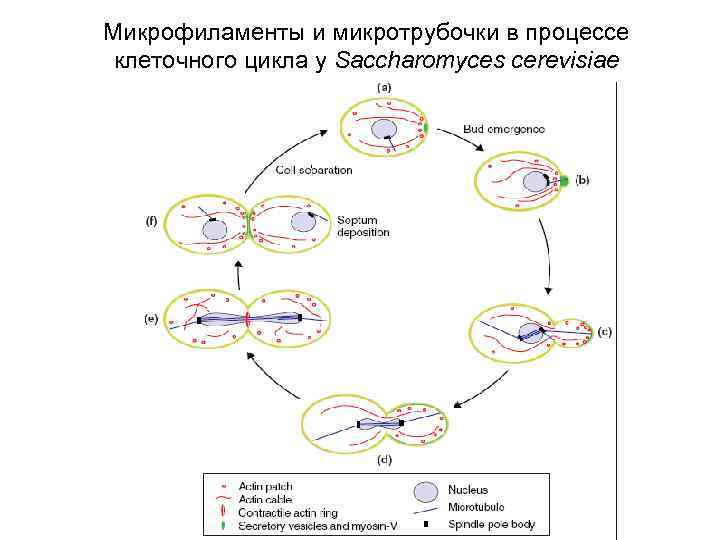 Микрофиламенты и микротрубочки в процессе клеточного цикла у Saccharomyces cerevisiae
Микрофиламенты и микротрубочки в процессе клеточного цикла у Saccharomyces cerevisiae
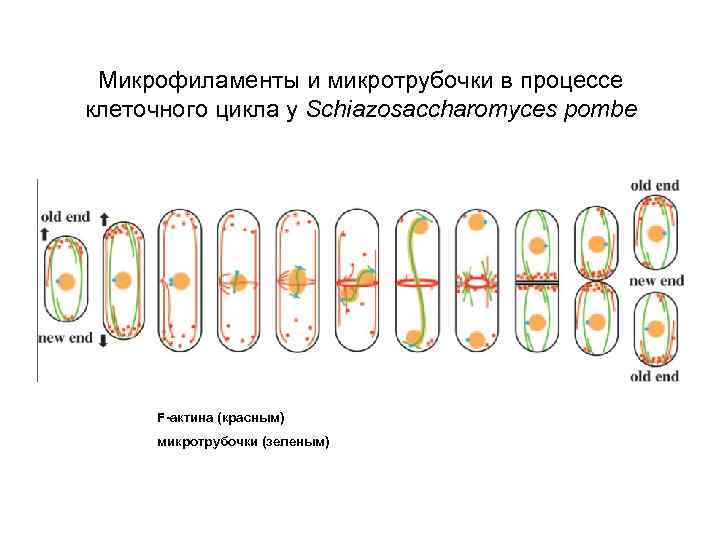 Микрофиламенты и микротрубочки в процессе клеточного цикла у Schiazosaccharomyces pombe F-актина (красным) микротрубочки (зеленым)
Микрофиламенты и микротрубочки в процессе клеточного цикла у Schiazosaccharomyces pombe F-актина (красным) микротрубочки (зеленым)
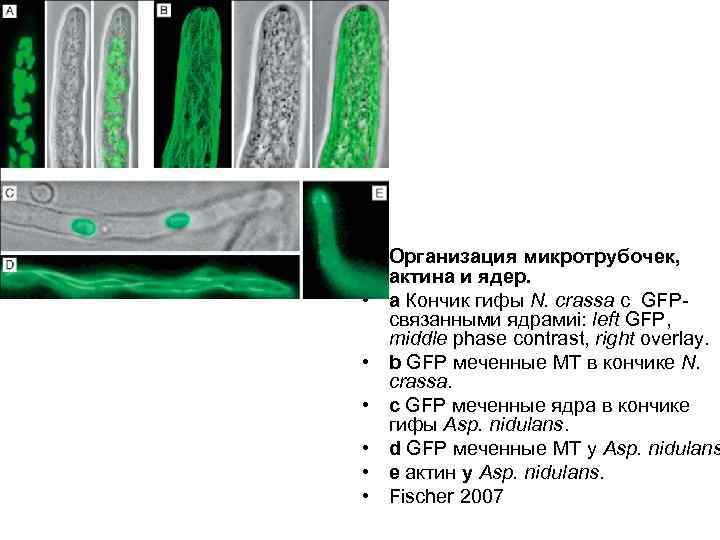 • Организация микротрубочек, актина и ядер. • a Кончик гифы N. crassa с GFPсвязанными ядрамиi: left GFP, middle phase contrast, right overlay. • b GFP меченные MT в кончике N. crassa. • с GFP меченные ядра в кончике гифы Asp. nidulans. • d GFP меченные MT у Asp. nidulans • e актин у Asp. nidulans. • Fischer 2007
• Организация микротрубочек, актина и ядер. • a Кончик гифы N. crassa с GFPсвязанными ядрамиi: left GFP, middle phase contrast, right overlay. • b GFP меченные MT в кончике N. crassa. • с GFP меченные ядра в кончике гифы Asp. nidulans. • d GFP меченные MT у Asp. nidulans • e актин у Asp. nidulans. • Fischer 2007
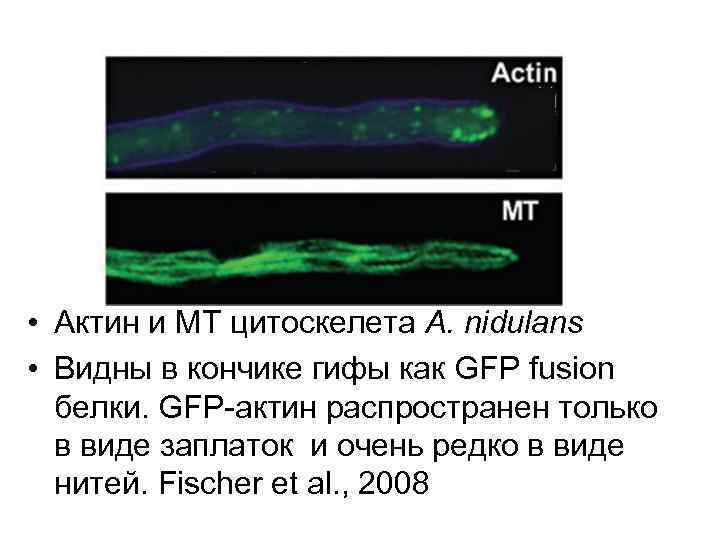 • Актин и MT цитоскелета A. nidulans • Видны в кончике гифы как GFP fusion белки. GFP-актин распространен только в виде заплаток и очень редко в виде нитей. Fischer et al. , 2008
• Актин и MT цитоскелета A. nidulans • Видны в кончике гифы как GFP fusion белки. GFP-актин распространен только в виде заплаток и очень редко в виде нитей. Fischer et al. , 2008
 • АКТИН
• АКТИН
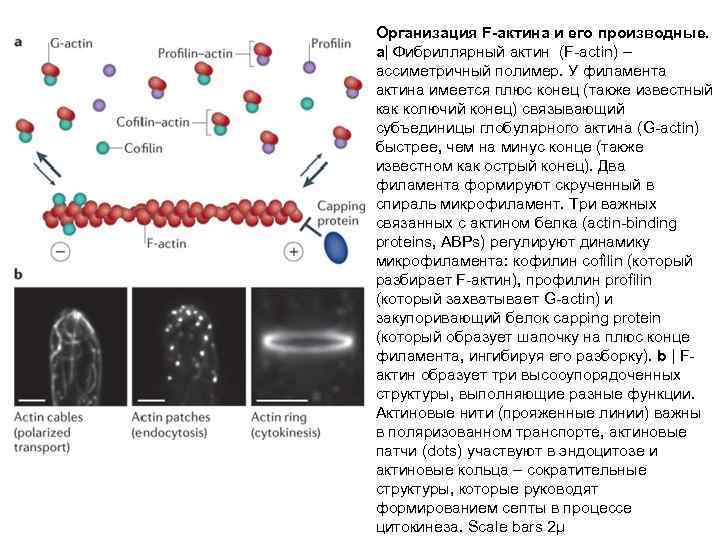 Организация F-актина и его производные. a| Фибриллярный актин (F-actin) – ассиметричный полимер. У филамента актина имеется плюс конец (также известный как колючий конец) связывающий субъединицы глобулярного актина (G-actin) быстрее, чем на минус конце (также известном как острый конец). Два филамента формируют скрученный в спираль микрофиламент. Три важных связанных с актином белка (actin-binding proteins, ABPs) регулируют динамику микрофиламента: кофилин cofilin (который разбирает F-актин), профилин profilin (который захватывает G-actin) и закупоривающий белок capping protein (который образует шапочку на плюс конце филамента, ингибируя его разборку). b | Fактин образует три высооупорядоченных структуры, выполняющие разные функции. Актиновые нити (прояженные линии) важны в поляризованном транспорте, актиновые патчи (dots) участвуют в эндоцитозе и актиновые кольца – сократительные структуры, которые руководят формированием септы в процессе цитокинеза. Scale bars 2μ
Организация F-актина и его производные. a| Фибриллярный актин (F-actin) – ассиметричный полимер. У филамента актина имеется плюс конец (также известный как колючий конец) связывающий субъединицы глобулярного актина (G-actin) быстрее, чем на минус конце (также известном как острый конец). Два филамента формируют скрученный в спираль микрофиламент. Три важных связанных с актином белка (actin-binding proteins, ABPs) регулируют динамику микрофиламента: кофилин cofilin (который разбирает F-актин), профилин profilin (который захватывает G-actin) и закупоривающий белок capping protein (который образует шапочку на плюс конце филамента, ингибируя его разборку). b | Fактин образует три высооупорядоченных структуры, выполняющие разные функции. Актиновые нити (прояженные линии) важны в поляризованном транспорте, актиновые патчи (dots) участвуют в эндоцитозе и актиновые кольца – сократительные структуры, которые руководят формированием септы в процессе цитокинеза. Scale bars 2μ
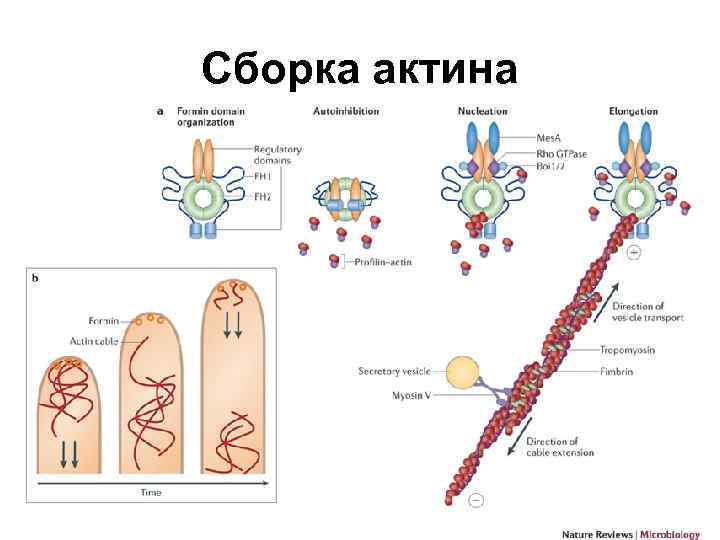 Сборка актина
Сборка актина
 • СЕПТИНЫ • Септины встречаются у клеток грибов и животных и представляют собой пучки неполярных филаментов, они промежуточные по толщине между микротрубочками и филаментами F-актина, в диапазоне 8 -12 нм в диаметре. Они служат опорой для других белков и действуют как диффузный барьер для белков цитоплазмы, локализованных около цитоплазматической мембраны.
• СЕПТИНЫ • Септины встречаются у клеток грибов и животных и представляют собой пучки неполярных филаментов, они промежуточные по толщине между микротрубочками и филаментами F-актина, в диапазоне 8 -12 нм в диаметре. Они служат опорой для других белков и действуют как диффузный барьер для белков цитоплазмы, локализованных около цитоплазматической мембраны.
 Характеристика гетероолигомерного комплекса септинов у дрожжей. Олигомеры состоят из мономеров.
Характеристика гетероолигомерного комплекса септинов у дрожжей. Олигомеры состоят из мономеров.
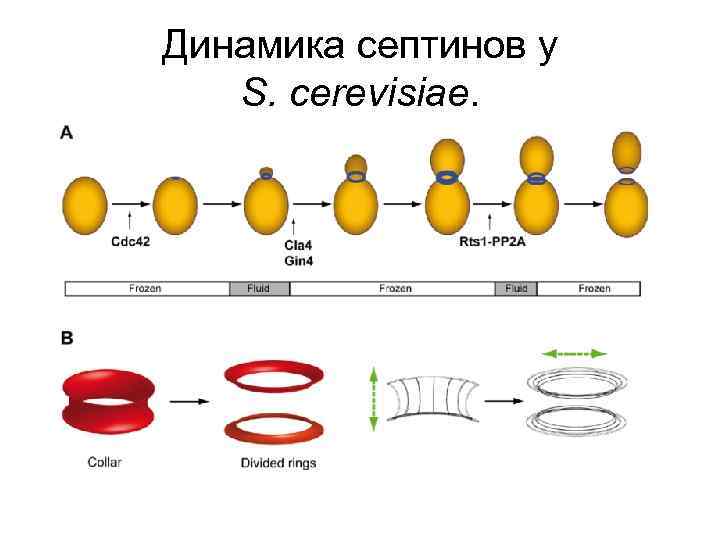 Динамика септинов у S. cerevisiae.
Динамика септинов у S. cerevisiae.
 Моторные белки Имеется три типа молекулярных моторов: ассоциированные с микротрубочками кинезины и динеины, ассоциироанные с актином миозины.
Моторные белки Имеется три типа молекулярных моторов: ассоциированные с микротрубочками кинезины и динеины, ассоциироанные с актином миозины.
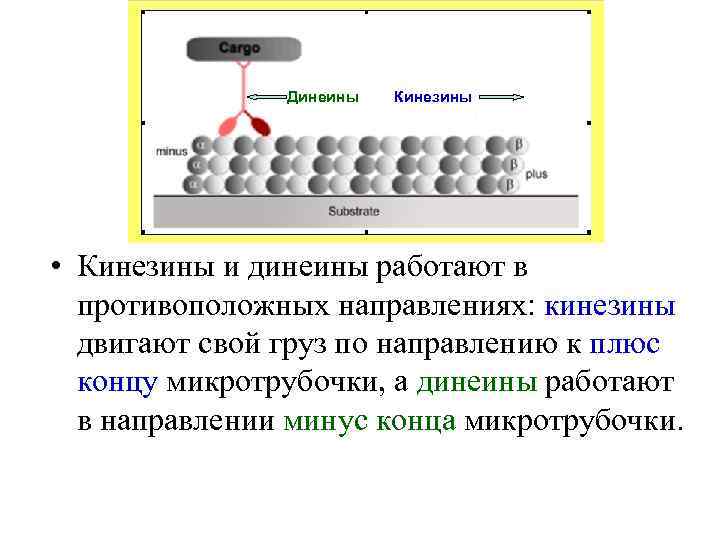 Динеины Кинезины • Кинезины и динеины работают в противоположных направлениях: кинезины двигают свой груз по направлению к плюс концу микротрубочки, а динеины работают в направлении минус конца микротрубочки.
Динеины Кинезины • Кинезины и динеины работают в противоположных направлениях: кинезины двигают свой груз по направлению к плюс концу микротрубочки, а динеины работают в направлении минус конца микротрубочки.
 • В гифах грибов представлены все клеточные транспортные процессы включая апикальное полярное растяжение, септирование и ядерное деление.
• В гифах грибов представлены все клеточные транспортные процессы включая апикальное полярное растяжение, септирование и ядерное деление.
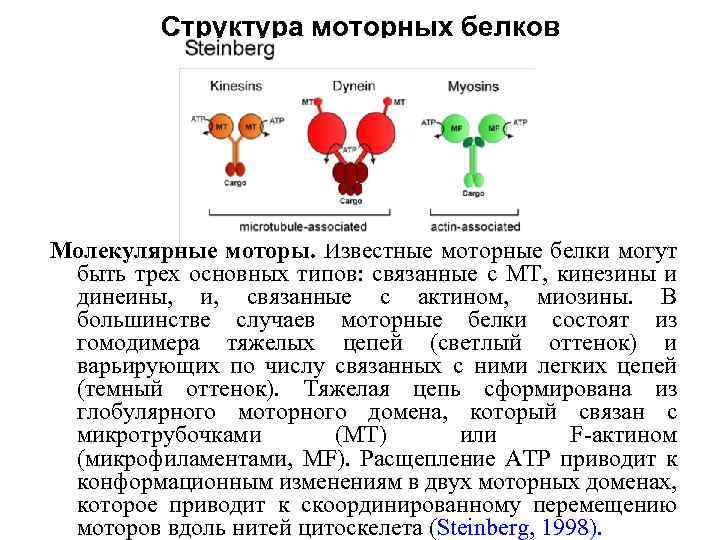 Структура моторных белков Молекулярные моторы. Известные моторные белки могут быть трех основных типов: связанные с MT, кинезины и динеины, и, связанные с актином, миозины. В большинстве случаев моторные белки состоят из гомодимера тяжелых цепей (светлый оттенок) и варьирующих по числу связанных с ними легких цепей (темный оттенок). Тяжелая цепь сформирована из глобулярного моторного домена, который связан с микротрубочками (MT) или F-актином (микрофиламентами, MF). Расщепление ATP приводит к конформационным изменениям в двух моторных доменах, которое приводит к скоординированному перемещению моторов вдоль нитей цитоскелета (Steinberg, 1998).
Структура моторных белков Молекулярные моторы. Известные моторные белки могут быть трех основных типов: связанные с MT, кинезины и динеины, и, связанные с актином, миозины. В большинстве случаев моторные белки состоят из гомодимера тяжелых цепей (светлый оттенок) и варьирующих по числу связанных с ними легких цепей (темный оттенок). Тяжелая цепь сформирована из глобулярного моторного домена, который связан с микротрубочками (MT) или F-актином (микрофиламентами, MF). Расщепление ATP приводит к конформационным изменениям в двух моторных доменах, которое приводит к скоординированному перемещению моторов вдоль нитей цитоскелета (Steinberg, 1998).
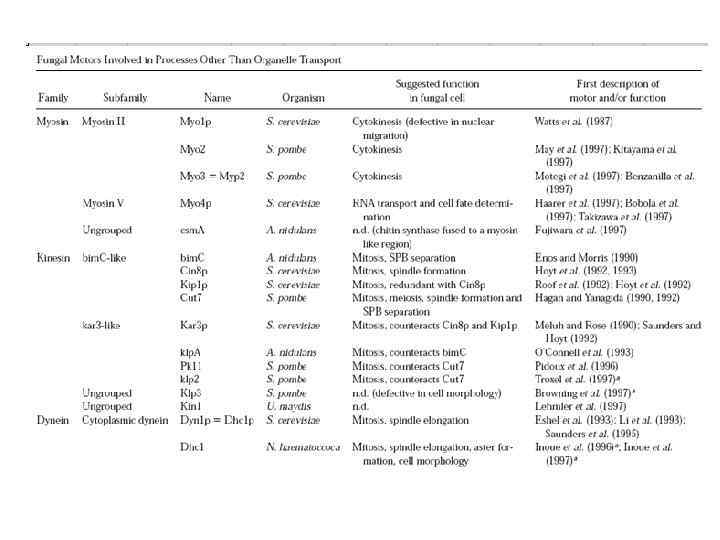
 Грибные моторы вовлечены в следующие процессы: • секреция и эндоцитоз; • цитокинез; • положение и наследование органелл; • митоз; • генетическая рекомбинация; • транспорт РНК.
Грибные моторы вовлечены в следующие процессы: • секреция и эндоцитоз; • цитокинез; • положение и наследование органелл; • митоз; • генетическая рекомбинация; • транспорт РНК.
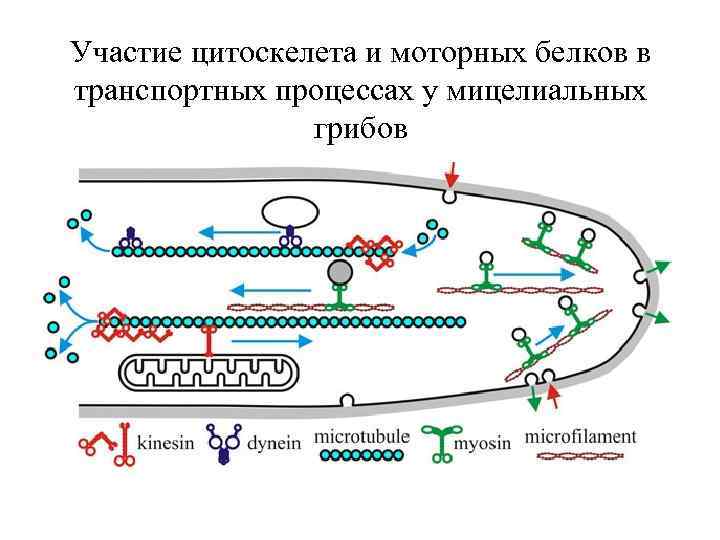 Участие цитоскелета и моторных белков в транспортных процессах у мицелиальных грибов
Участие цитоскелета и моторных белков в транспортных процессах у мицелиальных грибов
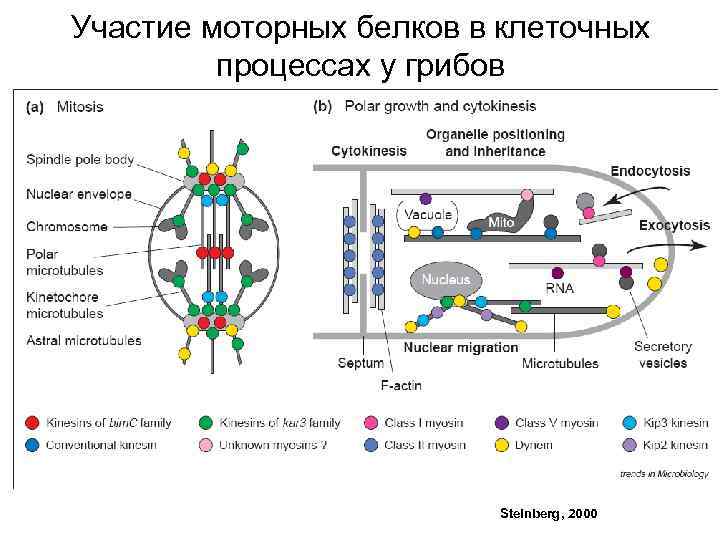 Участие моторных белков в клеточных процессах у грибов Steinberg, 2000
Участие моторных белков в клеточных процессах у грибов Steinberg, 2000
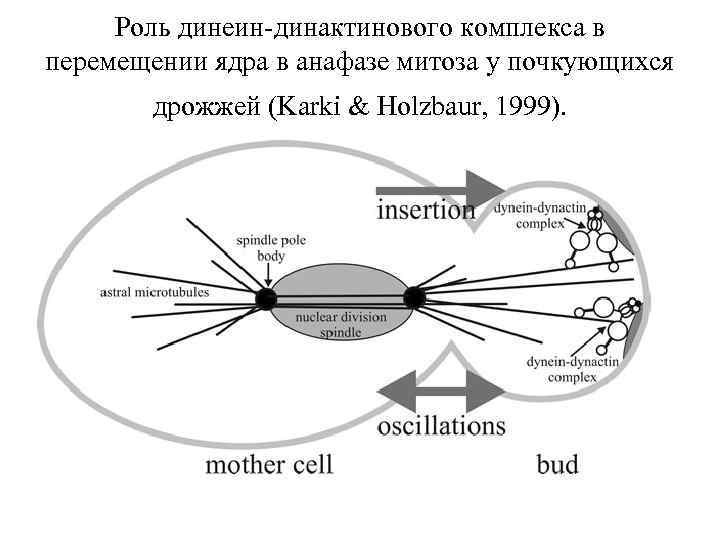 Роль динеин-динактинового комплекса в перемещении ядра в анафазе митоза у почкующихся дрожжей (Karki & Holzbaur, 1999).
Роль динеин-динактинового комплекса в перемещении ядра в анафазе митоза у почкующихся дрожжей (Karki & Holzbaur, 1999).
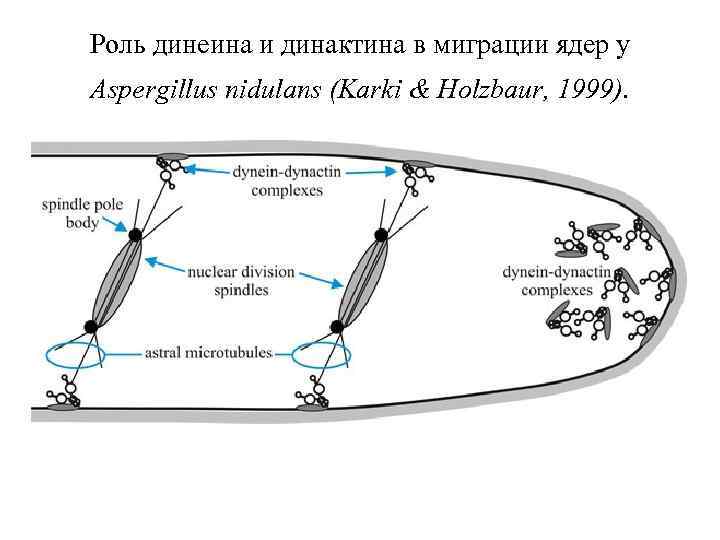 Роль динеина и динактина в миграции ядер у Aspergillus nidulans (Karki & Holzbaur, 1999).
Роль динеина и динактина в миграции ядер у Aspergillus nidulans (Karki & Holzbaur, 1999).
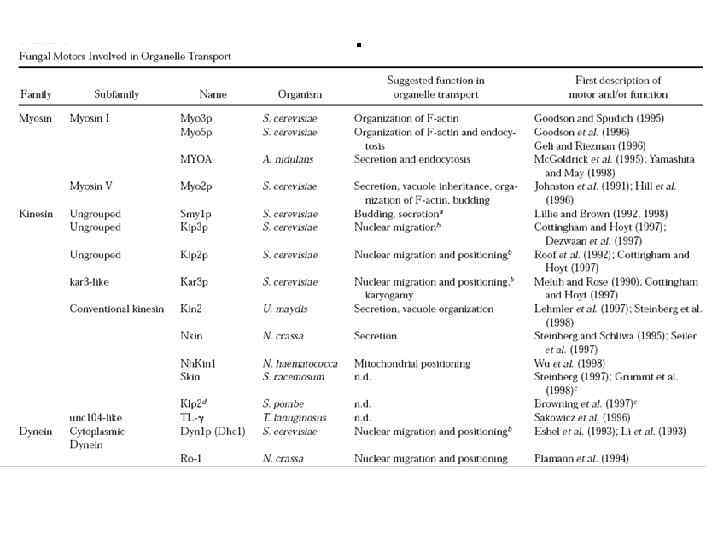
 • Геном Saccharomyces cerevisiae имеет гены, кодирующие пять миозинов, шесть кинезинов и один динеин. • Это небольшое число моторных белков по сравнению с некоторыми системами позвоночных, которые имеют 50 разных клеточных моторов. Что предполагает участие каждого моторного белка в нескольких клеточных процессах.
• Геном Saccharomyces cerevisiae имеет гены, кодирующие пять миозинов, шесть кинезинов и один динеин. • Это небольшое число моторных белков по сравнению с некоторыми системами позвоночных, которые имеют 50 разных клеточных моторов. Что предполагает участие каждого моторного белка в нескольких клеточных процессах.
 Заключение • Молекулярные моторы вносят вклад в огромное количество процессов, которые являются ключевыми для организации и поляризованного роста клеток грибов.
Заключение • Молекулярные моторы вносят вклад в огромное количество процессов, которые являются ключевыми для организации и поляризованного роста клеток грибов.


