Апикальное тельце и цитоскелет Лекция 3 2012.ppt
- Количество слайдов: 91

Апикальное тельце (Spitzenkorper)

• Грибы генерируют разнообразный клеточный морфогенез для заселения субстрата и адаптации к условиям окружающей среды.
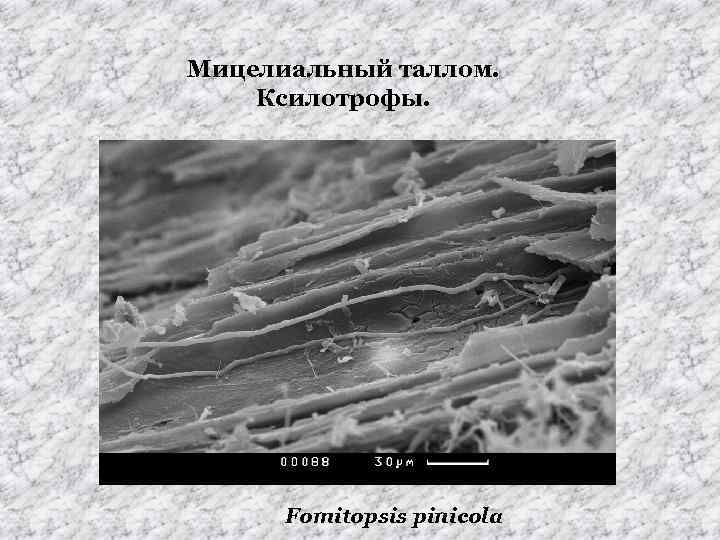
Мицелиальный таллом. Ксилотрофы. Fomitopsis pinicola
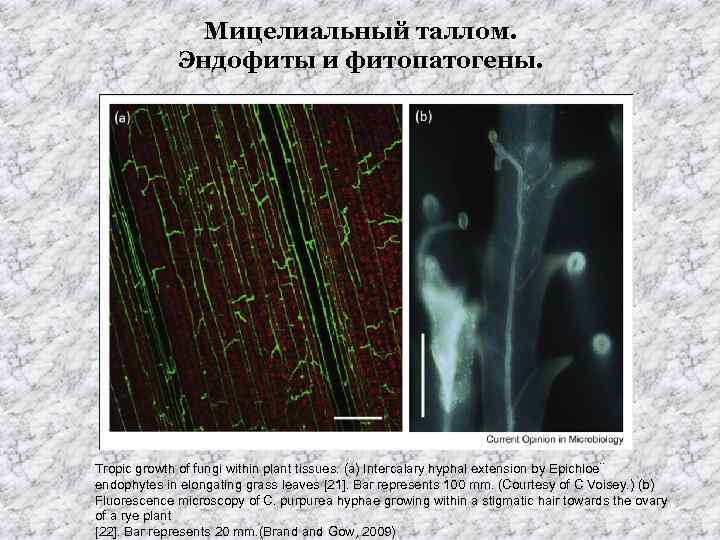
Мицелиальный таллом. Эндофиты и фитопатогены. Tropic growth of fungi within plant tissues. (a) Intercalary hyphal extension by Epichloe¨ endophytes in elongating grass leaves [21]. Bar represents 100 mm. (Courtesy of C Voisey. ) (b) Fluorescence microscopy of C. purpurea hyphae growing within a stigmatic hair towards the ovary of a rye plant [22]. Bar represents 20 mm. (Brand Gow, 2009)

Дрожжевой таллом. 1. 2. 1 - почкующиеся дрожжи, 2 - делящиеся дрожжи

Псевдомицелий.

Полярность клеток. Наблюдаемая в разных формах в разных типах и видов клеток клеточная полярность определяется двумя фундаментальными признаками: - асимметричным накоплением мобильных элементов (часто регуляторных молекул) между противоположными полюсами клетки; - ориентированной организацией полярных элементов цитоскелета (в частности актина и микротрубочек) вдоль оси полярности.

Морфогенез у мицелиальных грибов и почкующихся дрожжей (Momany, 2002) Мицелиальные грибы Изотропный рост Поляризованный рост Дрожжи
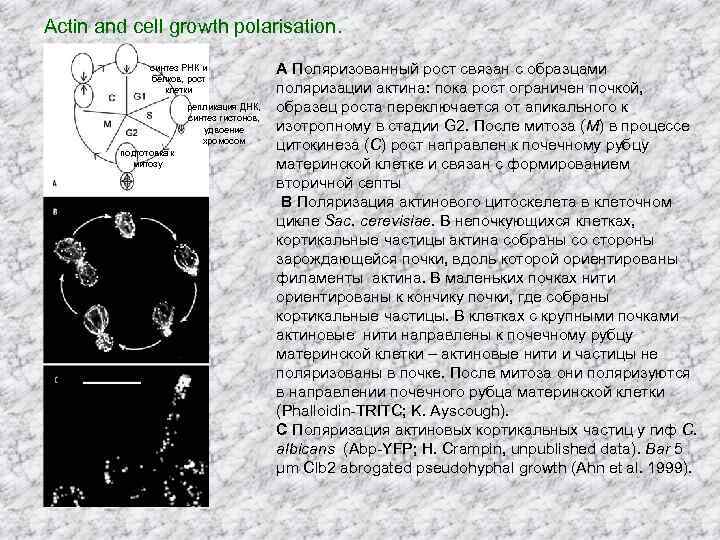
Actin and cell growth polarisation. синтез РНК и белков, рост клетки репликация ДНК, синтез гистонов, удвоение хромосом подготовка к митозу A Поляризованный рост связан с образцами поляризации актина: пока рост ограничен почкой, образец роста переключается от апикального к изотропному в стадии G 2. После митоза (M) в процессе цитокинеза (C) рост направлен к почечному рубцу материнской клетке и связан с формированием вторичной септы B Поляризация актинового цитоскелета в клеточном цикле Sac. cerevisiae. В непочкующихся клетках, кортикальные частицы актина собраны со стороны зарождающейся почки, вдоль которой ориентированы филаменты актина. В маленьких почках нити ориентированы к кончику почки, где собраны кортикальные частицы. В клетках с крупными почками актиновые нити направлены к почечному рубцу материнской клетки – актиновые нити и частицы не поляризованы в почке. После митоза они поляризуются в направлении почечного рубца материнской клетки (Phalloidin-TRITC; K. Ayscough). C Поляризация актиновых кортикальных частиц у гиф C. albicans (Abp-YFP; H. Crampin, unpublished data). Bar 5 μm Clb 2 abrogated pseudohyphal growth (Ahn et al. 1999).
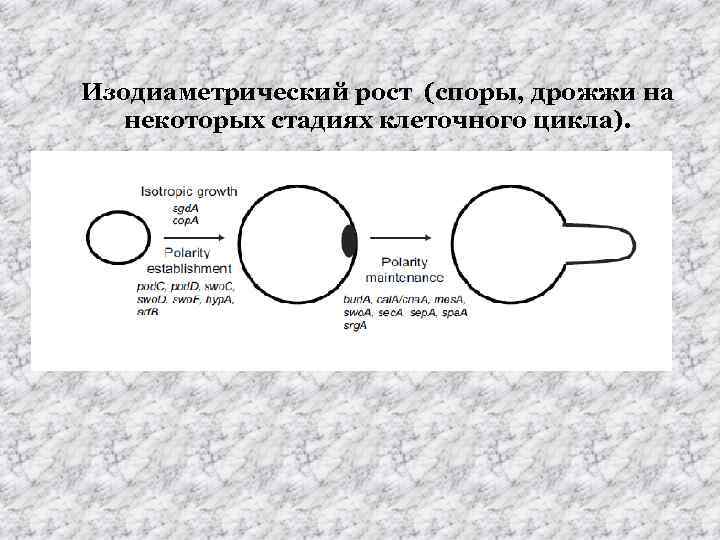
Изодиаметрический рост (споры, дрожжи на некоторых стадиях клеточного цикла).

Полярный рост в жизненном цикле почкующихся дрожжей Saccharomyces cerevisiae (Park and Bi, 2007).
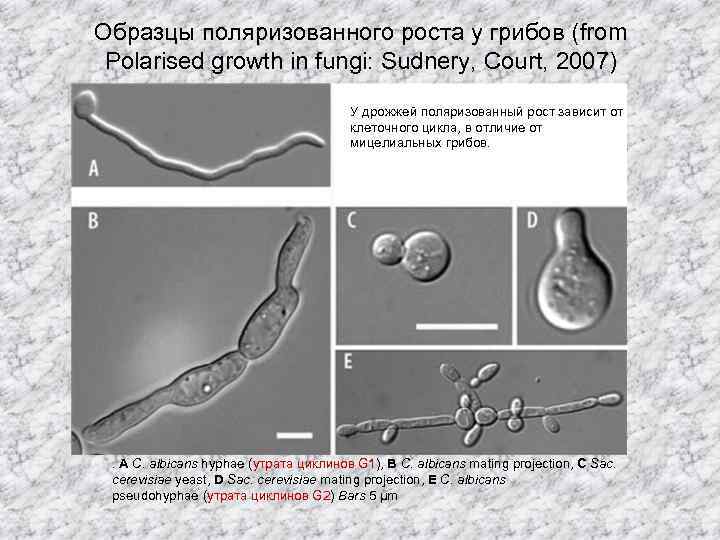
Образцы поляризованного роста у грибов (from Polarised growth in fungi: Sudnery, Court, 2007) У дрожжей поляризованный рост зависит от клеточного цикла, в отличие от мицелиальных грибов. . A C. albicans hyphae (утрата циклинов G 1), B C. albicans mating projection, C Sac. cerevisiae yeast, D Sac. cerevisiae mating projection, E C. albicans pseudohyphae (утрата циклинов G 2) Bars 5 μm

Поляризованный рост мицелия грибов. • Вегетативное тело большинства грибов представлено мицелием, состоящим из сильно разветвленных гиф, растущих в определенном направлении за счет апикального роста гифы. • Поляризованный рост – фундаментальная черта физиологии грибной клетки.

Wessels, 1993 • Поляризованный рост грибной гифы достигается ограниченным растяжением в районе апекса гифы. • Клеточная стенка на кончике гифы имеет вязкоупругие свойства, в растяжение которой вносит вклад внутреннее давление в гифе. Тургорное давление действует как движущая сила для растяжения гифы грибов. • Сзади кончика стенка затвердевает и сопротивляется силам тургорного давления, являющегося результатом осмотического давления в гифе.

• Растяжение гифы на апексе требует синтеза и встраивания нового материала стенки и новых мембран способом, который не ослабляет кончик. • Этот высоко организованный процесс поддерживается постоянным течением везикул образующихся в цитоплазме и скоординирован с ростом и репликацией всех других цитоплазматических органелл, и их миграцией в сторону апекса.

• Модели роста гифы

. Модель устойчивого состояния роста гифы (Wessels, 1993) Согласно этой модели: Литические ферменты не вовлечены в апикальный рост; Вновь образующаяся стенка на самом кончике гифы – ВЯЗКОЭЛАСТИЧНАЯ; Новые компоненты стенки встраиваются на апексе; Отступя от апекса клеточная стенка затвердевает за счет формирования химических связей.
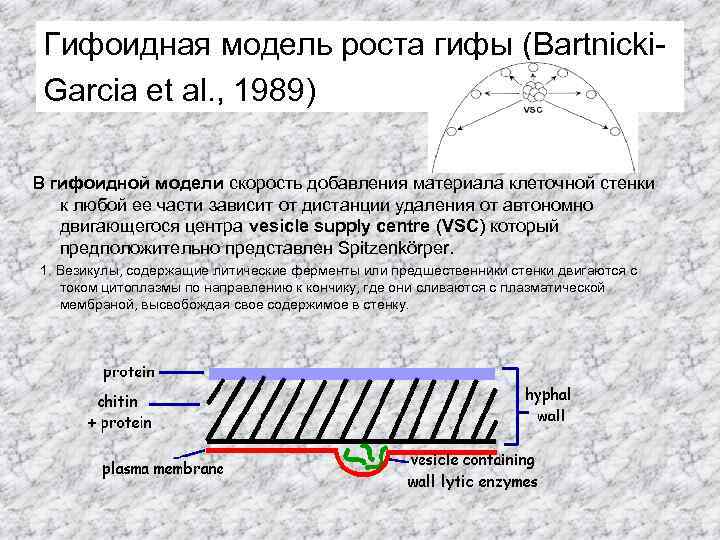
Гифоидная модель роста гифы (Bartnicki. Garcia et al. , 1989) В гифоидной модели скорость добавления материала клеточной стенки к любой ее части зависит от дистанции удаления от автономно двигающегося центра vesicle supply centre (VSC) который предположительно представлен Spitzenkörper. 1. Везикулы, содержащие литические ферменты или предшественники стенки двигаются с током цитоплазмы по направлению к кончику, где они сливаются с плазматической мембраной, высвобождая свое содержимое в стенку.
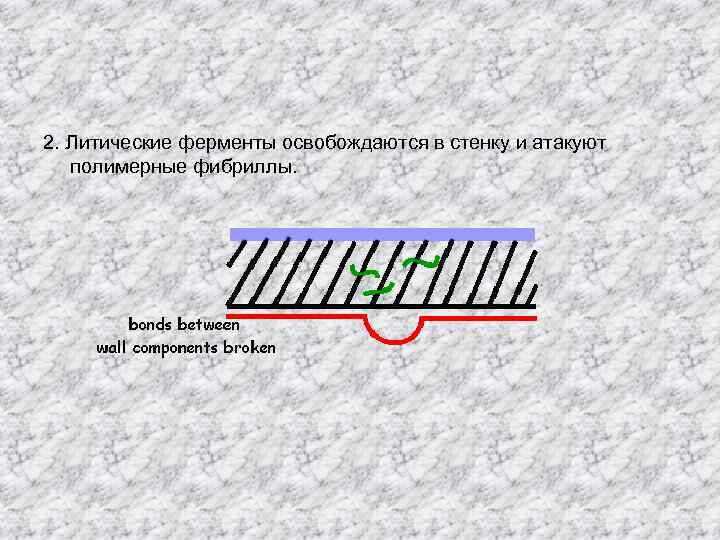
2. Литические ферменты освобождаются в стенку и атакуют полимерные фибриллы.
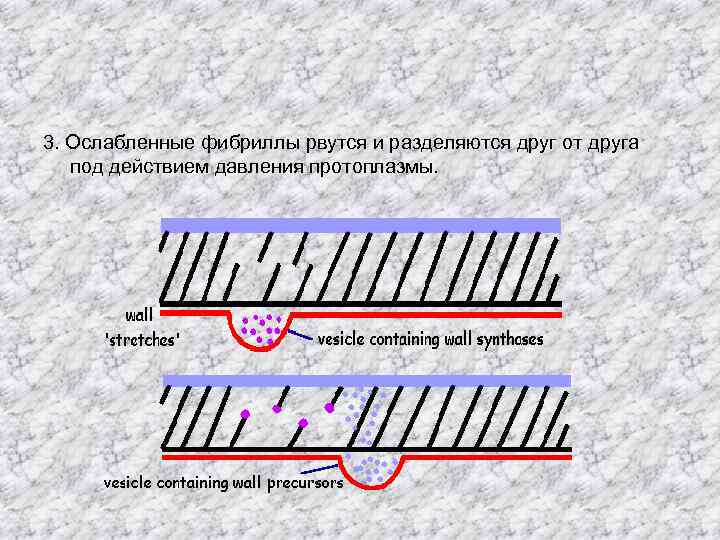
3. Ослабленные фибриллы рвутся и разделяются друг от друга под действием давления протоплазмы.

4. Синтазные ферменты стенки строят новые фибриллы и дополнятся аморфными компонентами стенки. В результате поверхность стенки гифы увеличивается. Слияние везикул с плазматической мембраной вносит вклад в увеличение площади поверхности.

Дополнительные модели роста гифы (Virag, Harris, 2006) (В) Кальциевая модель. Хотя эта модель не спорит с присутствием Spitzenkörper на кончике и не обсуждает роль Spitzenkörper, она дает альтернативный механизм транспорта везикул к нужным сайтам включения в плазматическую мембрану. (С) Актиновая модель. Эта модель интегрирует предыдущие две модели и в дополнении показывает роль, как апикального так и цитоскелетного актина в росте кончика и значении Spitzenkörper.

Обобщенная молекулярная модель роста гифы (Moore et al. , 2011).

• Поляризованный рост септированного мицелия грибов связан с деятельностью цитоскелета, апикального тельца, полярисомы, экзоцисты, факторов полярности (белковых комплексов: Cdc 42, Arp 2/3 и др. ). • Поляризованный рост дрожжей и псевдомицелия не связан с апикальным тельцем. Скорость роста грибов: Neurospora crassa – 16 мкм/мин, Saccharomyces cerevisiae – 0, 16 мкм/мин.

Апикальное тельце (Spitzenkörper) Neurospora crassa (Virag, Harris, 2005).

Впервые апикальное тельце было описано у фиксированных и окрашенных клеток двух видов рода Coprinus Brunswik (1924) c помощью световой микроскопии. Пионерской работой положившей начало в исследовании биологии Spitzenkörper (апикальное тельце) считается работа Girbar (1957), проделанная c использованием фазово-контрастной микроскопии. Girbardt приводит первое описание Spitzenkörper для живой растущей гифы высших грибов, как темная в фазовом изображении структура, локализованная в грибе Polystictus versicolor. Его тщательное исследование растущей гифы показало, - оно присутствует только в кончике растущей вегетативной гифы, - образуется на месте прорастания споры и боковых ответвлений, - локализовано в том месте гифы, которое коррелирует с направлением роста гифы. Таким образом, функции апикального тельца – обеспечение апикального роста гифы и направленного синтеза клеточной стенки. Далее были проведены детальные исследования ультраструктуры апикального тельца у разных групп грибо в 60 -70 -ые годы (Grove, Braсker), которые показали, что эт мультикомпонентный комплекс, в котором доминируют везикулы.
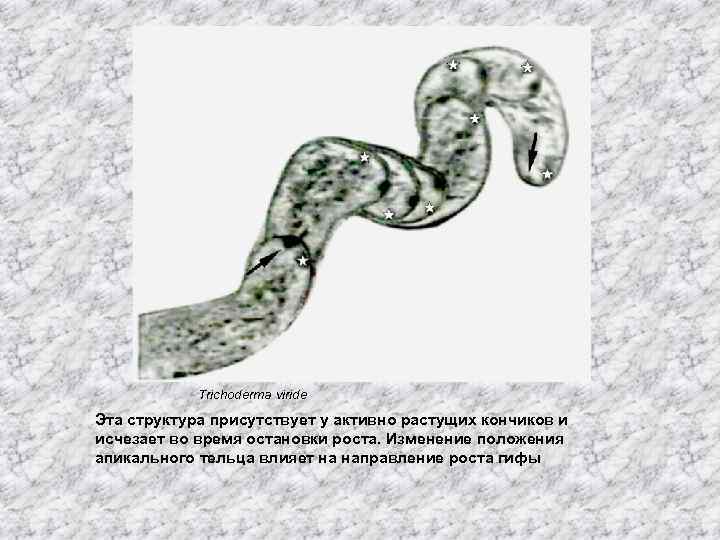
Trichoderma viride Эта структура присутствует у активно растущих кончиков и исчезает во время остановки роста. Изменение положения апикального тельца влияет на направление роста гифы

Цитология кончика гифы.
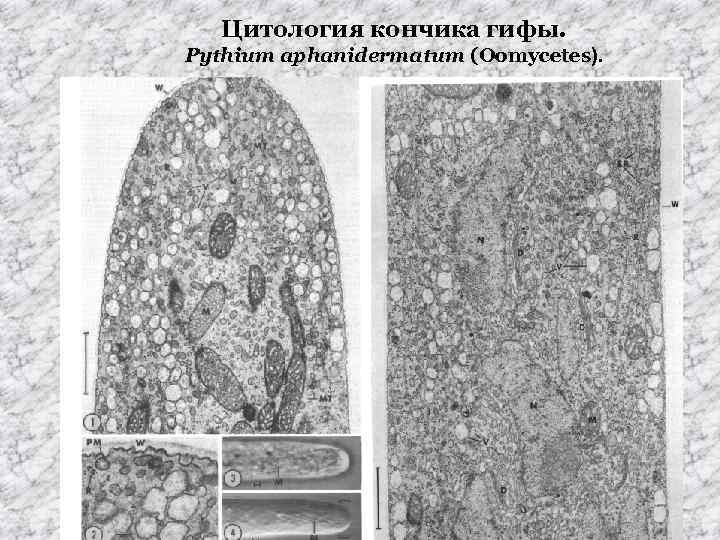
Цитология кончика гифы. Pythium aphanidermatum (Oomycetes).

Цитология кончика гифы. Gilbertella percicaria (Zygomycetes).
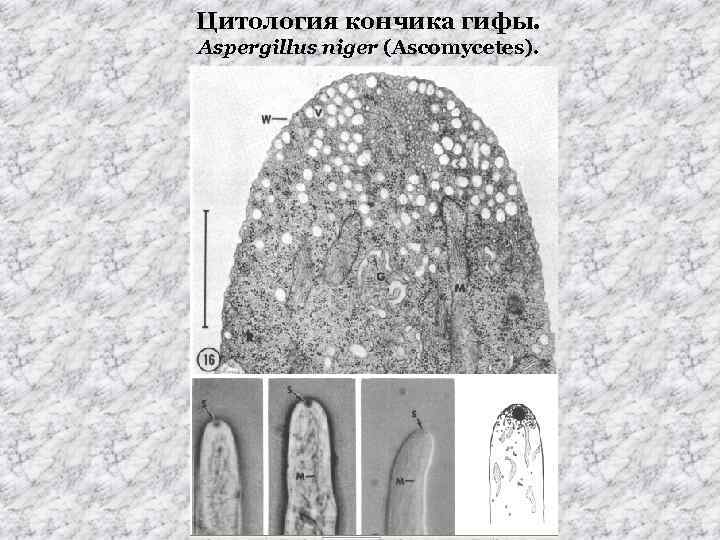
Цитология кончика гифы. Aspergillus niger (Ascomycetes).
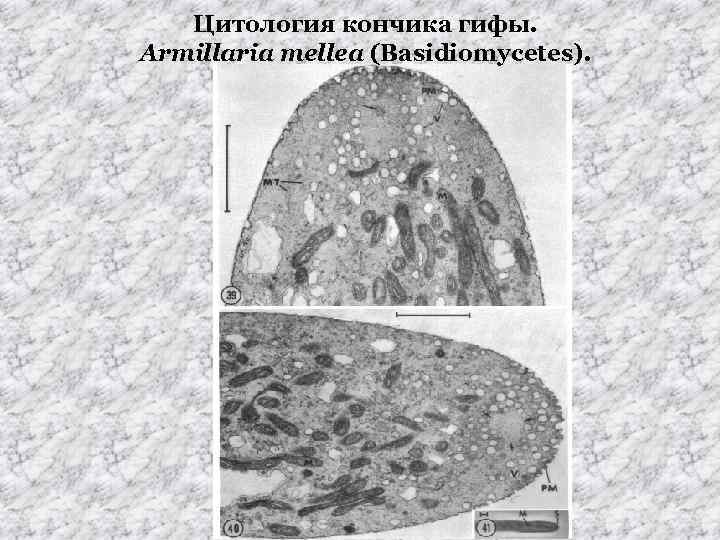
Цитология кончика гифы. Armillaria mellea (Basidiomycetes).


Цитология кончика гифы.

Разные типы апикальных тел 2 -3 тип 1 4 -5 тип 2 6 -9 тип 3 10 -11 тип 4 12 -13 тип 5 14 -16 тип 6 17 -19 тип 7 20 -21 тип 8


Исследования апикального центра на уровне светового и электронного микроскопа показало, что апикальное тельце присутствует у септированных грибов и его атрибутами являются (Grove, Bracker, 1970): • Один сферический комплекс. • Он выглядит темным в фазово-контрастном изображении. • У него отсутствует дискретная граница. • Локализовано в апикальном своде апикально растущей гифы. • Требуется для роста гифы. • Состоит из апикальных везикул, микровезикул, микрофиламентов и иногда рибосом. • Имеет полярность и билатеральную симметрию по форме и организации. • Является, по-видимому, источником везикул в процессе экзоцитоза и роста гифы.

• Клеточные компоненты, связанные с апикальным тельцем: митохондрии и микрофиламенты. • Показаны изменения размера, формы и положения апикального тельца. • Морфология апикального тельца родоспецифична. • Несептированные грибы из рода Allomyces имеют тип 9 апикального центра, состоящего из кольца мелких везикул. • Действие стрессовых факторов (световой, температурный, электрический) приводит к миграции апикального центра в субапикальную зону или к его исчезновению. В обеих случаях изменяется форма гифы и прекращается рост.

Спутник Spitzenkörper • Спутник Spitzenkörper представляет собой маленькую группы везикул, которые появляются на расстоянии нескольких микрометров позади апикального полюса, быстро мигрируют к апексу гифы и поглощаются основным Spitzenkörper, таким образом, внося вклад в рост гифы. Этот способ поглощения Spitzenkörper спутника было предложено считать принадлежностью пульсирующего роста кончика гифы
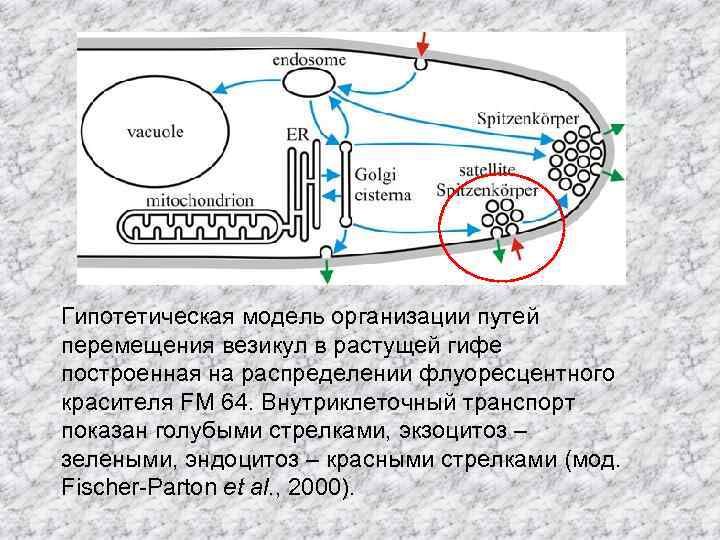
Гипотетическая модель организации путей перемещения везикул в растущей гифе построенная на распределении флуоресцентного красителя FM 64. Внутриклеточный транспорт показан голубыми стрелками, экзоцитоз – зелеными, эндоцитоз – красными стрелками (мод. Fischer-Parton et al. , 2000).
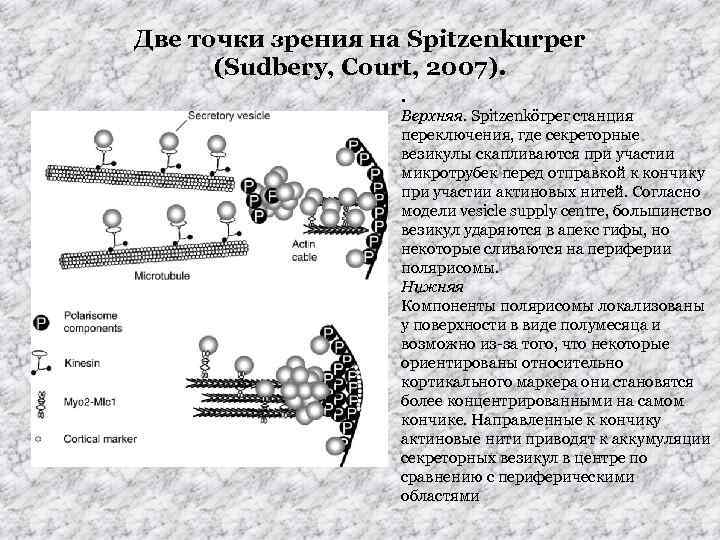
Две точки зрения на Spitzenkurper (Sudbery, Court, 2007). . Верхняя. Spitzenkörper станция переключения, где секреторные везикулы скапливаются при участии микротрубек перед отправкой к кончику при участии актиновых нитей. Согласно модели vesicle supply centre, большинство везикул ударяются в апекс гифы, но некоторые сливаются на периферии полярисомы. Нижняя Компоненты полярисомы локализованы у поверхности в виде полумесяца и возможно из-за того, что некоторые ориентированы относительно кортикального маркера они становятся более концентрированными на самом кончике. Направленные к кончику актиновые нити приводят к аккумуляции секреторных везикул в центре по сравнению с периферическими областями

Онтогенез апикального тельца • По-видимому, формирование de novo • Наблюдения дихотомического ветвления у Aspergillus niger мутанта ‘ramosa’ показали, что Spitzenkörper исчезает перед формированием новых дихотомических веточек. Два новых Spitzenkörper образуются после того, как становятся заметными инициали двух новых веточек, по одному у вершины новой веточки (Reynaga-Peña, Bartnicki-García, 1997)

• 38 000 везикул сливаются с апикальной мембраной каждую минуту для поддержания роста у Neurospora crassa когда гифа растет с максимальной скоростью !
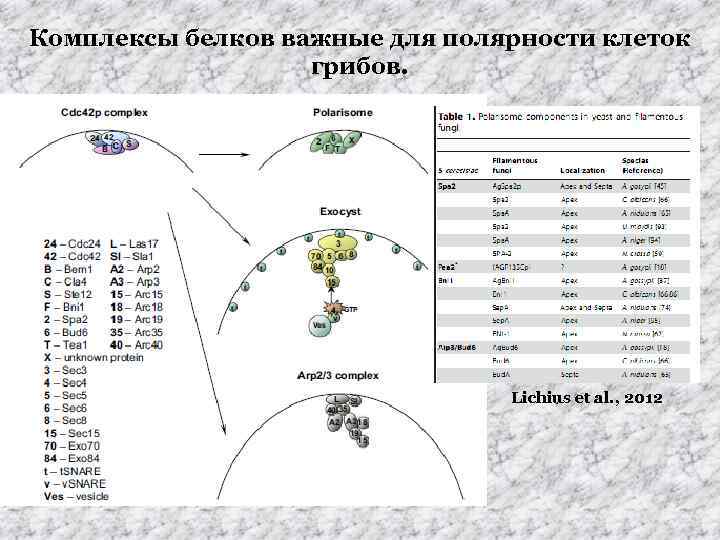
Комплексы белков важные для полярности клеток грибов. Lichius et al. , 2012

Предполагаемые белки, участвующие в создании и поддержании полярности у грибов (Harris et al. , 2009).

Общее представление на поляризованный рост у почкующихся дрожжей (Sudbery, Court, 2007).

Полярисома • Полярисома дрожжей состоит из белков Bni 1, Spa 2, Bud 6 и Pea 1, локализованных в виде полумесяца у места зарождающейся почки, и направляет микрофиламенты и другие клеточные компоненты к сайтам поляризованного роста • Полярисома мицелиальных грибов состоит из Bni 1, Spa 2 и Bud 6

Экзоциста • Экзоциста - второй белковый комплекс, который вовлечен в стыковку везикул и с плазматической мембраной • Экзоциста мицелиальных грибов содержит восемь белков: Sec 3, Sec 5, Sec 6, Sec 8, Sec 10, Sec 15, Exo 70, и Exo 84, и взаимодействует с Rho-GTPазой Cdc 42, Rho 1, Rho 3, а также с Sec 4, Rab GTPаза присутствующей на поверхности мембраны везикул
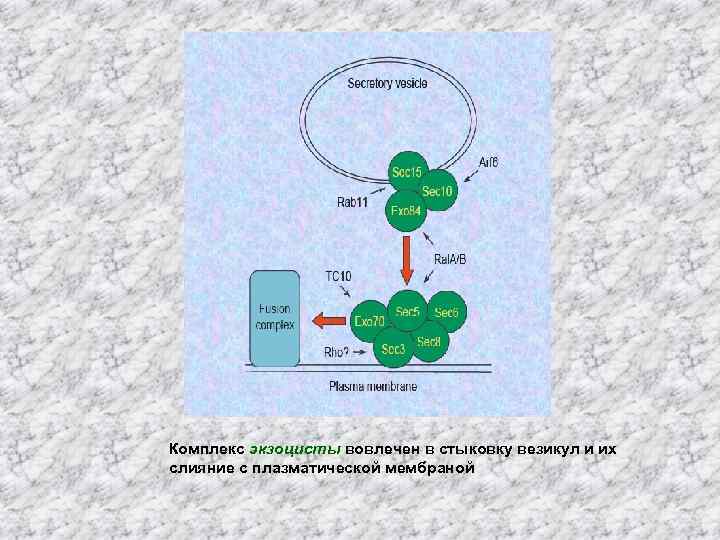
Комплекс экзоцисты вовлечен в стыковку везикул и их слияние с плазматической мембраной

Комплекс Arp 2/3 • Комплекс Arp 2/3 – другая серия белков мицелиальных грибов важных для поддержания полярности и включает Arp 2, Arp 3, Arc 40, Arc 35, Arc 18, Arc 19, и Arc 15. Комплекс Arp 2/3 отвечает за инициацию ветвления актиновых филаментов, образующих кортикальную актиновую сеть, и эндоцитоз. Он локализован около актиновых пятен, примыкающих к плазматической мембране в апикальном районе растягивающегося кончика гифы.

Полярисома, экзоциста и апикальное тельце у Ashbya gossypii (Köhli et al. , 2008). Геном A. gosssypii (Eremotecium gossypii) имеет 92 % генов консервативных для S. cerevisiae, растет только в виде мицелия.
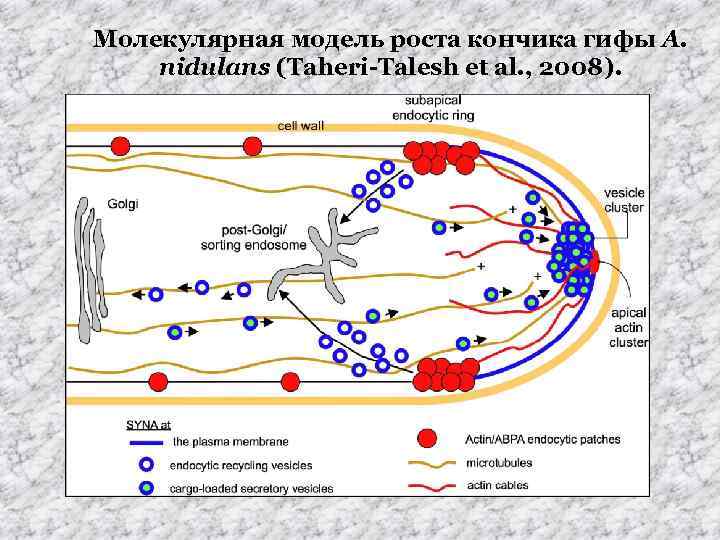
Молекулярная модель роста кончика гифы A. nidulans (Taheri-Talesh et al. , 2008).
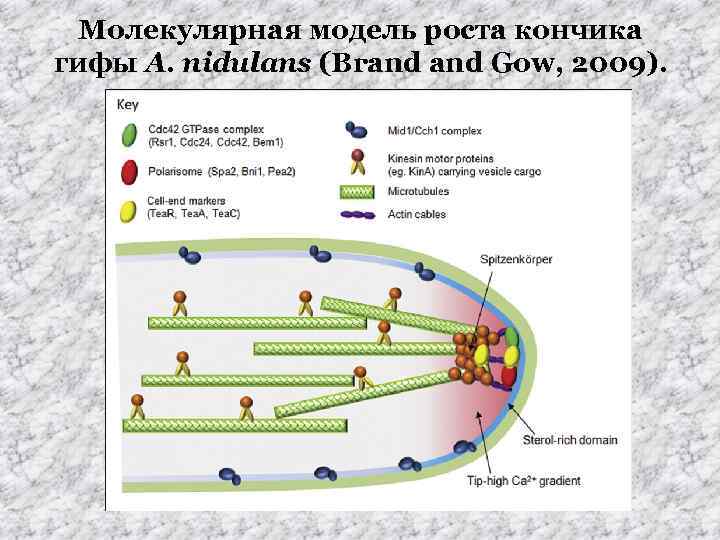
Молекулярная модель роста кончика гифы A. nidulans (Brand Gow, 2009).

Молекулярная модель роста гифы у Aspergillus nidulans (Si, 2010).

Молекулярный механизм поляризованного роста у Candida albicans (Sudbery, 2011). a | Модель доставки секреторных везикул, встраиваемых в кончик гифы при поляризованном росте. На trans-Golgi сети (TGN), GTPаза Ypt 31 набирает Sec 2 к поверхности возникающих везикул. Sec 2 активируется Rab GTPазой Sec 4, и везикулы получают право покинуть TGN. Компонент экзоцисты Ypt 31 вытесняется Sec 15, который физически взаимодействует с Sec 2 и Sec 4. Везикулы транспортируются в направлении кончика вдоль актиновых нитей. Эти нити образуются вокруг формина Bni 1, помогающего полярисоме, которая локализована у клеточной поверхности и состоит из Spa 2 и белка выбора места почкования 6 (Bud 6). Myosin 2 (Myo 2; тип V myosin), обеспечивает транспорт везикул. Везикулы накапливаются в субапикальном кластере Spitzenkörper перед экзоцистой, которая состоит из Sec 3, Sec 5, Sec 6, Sec 8, Sec 10, Sec 15, Exo 70 и Exo 84 (для ясности компоненты экзоцисты показаны красными кружками с приставками Sec или Exo). Начальный контакт вероятно между Sec 15 и Sec 10. Слияние с плазматической мембраной опосредовано v-SNARE (Sec 9) на везикуле и маркером-мембраны SNAREs (Sec 9 and Sso 2) на плазматической мембране. Контролирующая деление клетки Rho GTPаза 42 (Cdc 42) дирижирует множеством функций, которые необходимы для поляризованного роста.

Цитоскелет грибной клетки

• Функции цитоскелета - обеспечение внутриклеточного транспорта везикул и органелл, сегрегации хромосом в процессе ядерного деления, а также секреции и поляризованном росте у клеток грибов.

Состав цитоскелета Имеется три главных компонента составляющих цитоскелет эукариот: филаменты актина или микрофиламенты, промежуточные филаменты и микротрубочки: • филаменты актина или микрофиламенты твердые палочки около 7 nm в диаметре, состоящие из двух цепей глобулярного белка названного актином (один из самых распростарненных белков в природе). Эти филаменты сократимы и вносят вклад в изменение формы, связи клетка-с -клетой или клетка-со-стенкой, сигнальную трансдукию, цитокинез и течение цитоплазмы. • Промежуточные филаменты это очень обширный класс фиброзных белков формирующих структурные фибриллы в диапазоне от 8 до 12 nm в диаметре. Они также принимают участие в межклеточных связях и контактах с окружающей средой, но в большинстве своем функционируют как элементы-выдерживающие напряжение для поддержания формы и жесткости клетки животных, и структуры мембранных структур подобных ядерной оболочки. Первый ген промежуточных фибрилл у грибов был охарактеризован у мицелиальног гриба A. nidulans mbm. B продукт гена, колокализован с митохондриями, и делеция mdm. B влияет на морфологию и распределение митохондрий; • микротрубочки это прямые, полые цилиндры около 25 nm в диаметре, обычно состоящие из 13 профиламентов, которые являются полимером α- и β-тубулина. Они имеют очень динамичное поведение и выполняют азные функции от транспорта до структурной поддержки.

Функции микрофиламентов • Микрофиламенты актина требуются у грибов для движения органелл, • Поляризованного роста • Септирования (цитокинеза). • Он необходим для секреции везикул и растяжении клеточной стенки. • И, возможно, вместе с микротрубочками цитоскелета - для локализации маркерных белков на кончике клетки, которые контролируют непосредственно направление роста.

Актин у дрожжей Важность актина у почкующихся дрожжей показана на примере фенотипических изменений при мутации гена, который кодирует актин, они включают: • крупные морфологические дефекты, • аномальное отложение хитина, • дефектный выбор сайта почкования, • аномальная сегрегация ядер, • аномальный цитокинез, • аномальное распределение внутриклеточных органелл, • аномальная секреция, • изменена чувствительность к окружающим факторам (температуре, концентрации осмотика и ионов).

Структура актина • Белок актин имеет молекулярный вес порядка 42 k. Da (375 аминокислот), который существует как мономер (глобулярный или G-actin) или как линейный полимер, состоящий из мономера известен как филаменты или F-актин. Эти филаменты, которые так важны в морфогенезе, движении органелл и цитокинезе; микрофиламенты чрезвычайно динамичные структуры, которые могут быть быстро модифицированы при взаимодействии с набором актин связанных белков actin binding proteins (ABPs) (Sutherland & Witke, 1999; Walker & Garrill, 2006).

Схема организации микротрубочек и актиновых филаментов у эукариотических организмов

Образование микрофиламентов • Факторами полимеризации актина у эукариотических клеток являются формины. У Saccharomyces cerevisiae присутствует два разных формина, у Schizosaccharomyces pombe актин кодируется тремя форминами, а A. nidulans и N. crassa имеют один формин. Формин A. nidulans, SEPA, локализован в обеих сайтах: септирования и кончике гифы, что указывает на использование мицелиальными грибами сайт-специфических регуляторных механизмов для контроля опосредованной формином полимеризации актина (Xiang & Plamann, 2003).

Микротрубочки • Микротрубочки состоят из димера α- and βтубулина который собран в цилиндрическую трубки с диаметром около 25 nm но сильно варьируют по длине. • Динамика полимеризации микротрубочек является центральной для биологических функций. • Даже in vitro, очищенные тубулиновые димеры беспрерывно самособираются и разбираются; полимеризация микротрубочек и удлинение происходит до случайного переключения на деполимеризацию.
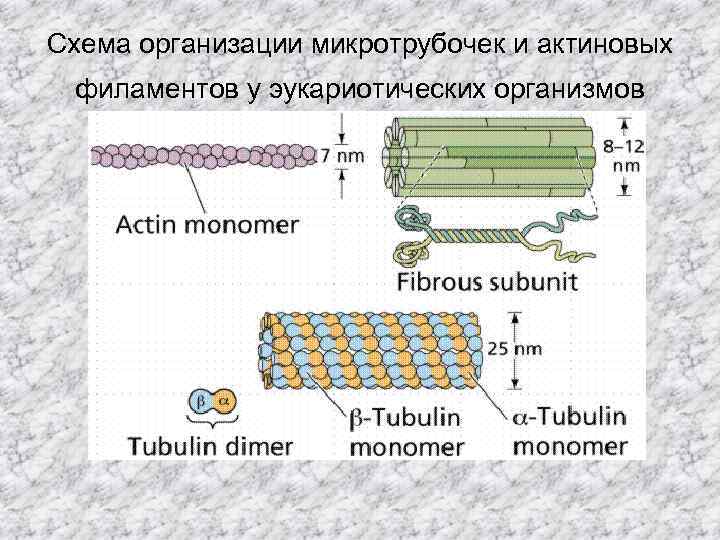
Схема организации микротрубочек и актиновых филаментов у эукариотических организмов

Функции микротрубочек • Микротрубочки и ассоциированные с ними белки вовлечены в широкий круг внутриклеточных функций, как и актиновые микрофиламенты (действительно, они работают вместе в большинстве случаев), частично транспорт и положение органелл, везикул и ядер. • Имеется видоспецифическая вариация в механизмах транспорта органелл, таких как митохондрии, они транспортируются по актиновым путям у почкующихся дрожжей и некоторых мицелиальных грибов, но у N. crassa, их движение зависит от микротрубочек.

• Деполимеризация приводит к быстрому укорочению микротрубочек, приводящее либо к полному исчезновению, либо к обратному переключению на удлинение (которое называют термином. • Эта динамичная нестабильность является особым свойством микротрубочек, так как это дает возможность им выполнять механическую работу. • Удлинение микротрубочек поляризовано, быстро растущий plus конец, и медленно или не-растущий minus конец (в клетках, минус конец обычно якорная точка).

Происхождение микротрубочек • MTs не могут эффективно собираться de novo в эукариотической клетке, но требуют точки инициации. Эту функцию у эукариот и грибов в том числе выполняет центр организации микротрубочек (MTOCs), который является протеиновым комплексом, характерным компонентом которого является γ-тубулин Известно, что γ-тубулин высших эукариот формирует 2. 2 -MDa комплексное кольцо, состоящее из 12 или 13 (разное число по литературным данным) γ-тубулиновых субъединиц связанных с другими белками, так называемый γtubulin ring complex (γ-Tu. RC; Aldaz et al. 2005). γ-Tu. RC действует как инициаторный комплекс, откуда и исходит 13 тубулиновых протофиламентов.

MTOCs (центры организации микротрубочек) у Aspergillus nidulans.

MTOCs у грибов могут быть локализованы в разных компартментах клетки. -У дрожжей и мицелиальных грибов главным/единственным центром организации микротрубочек является встроенное в мембрану ядра полярное тело веретена, ПТВ -дисперсные MTOCs, локализованные в цитоплазме -полярные MTOCs
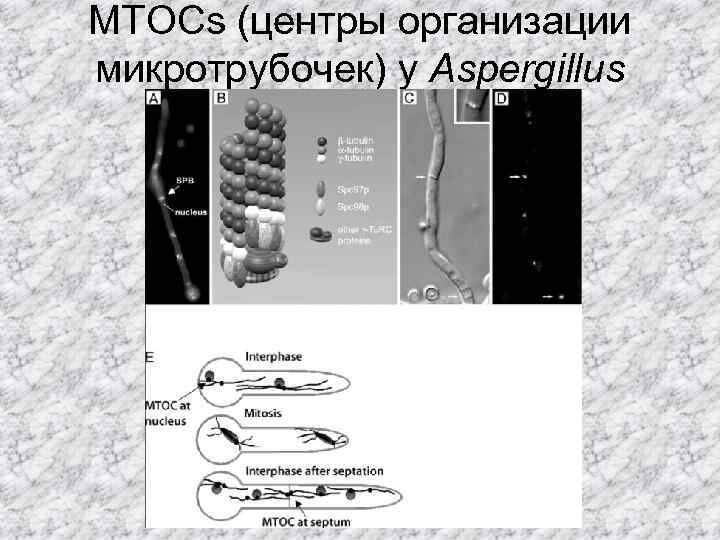
MTOCs (центры организации микротрубочек) у Aspergillus nidulans.
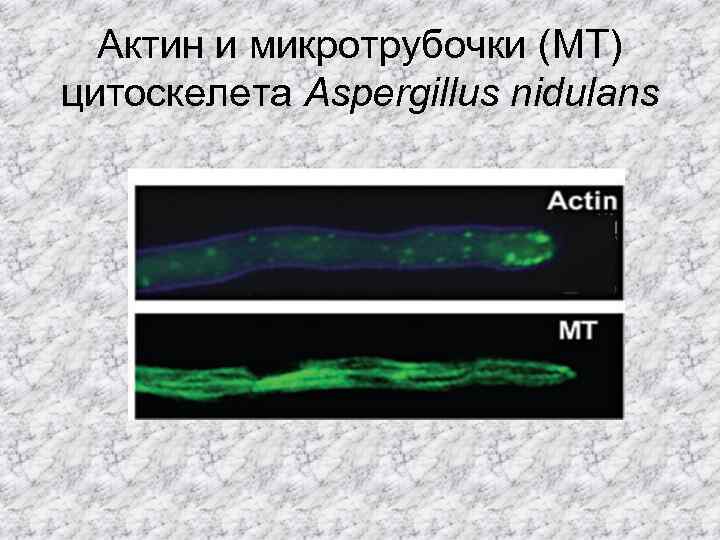
Актин и микротрубочки (MT) цитоскелета Aspergillus nidulans
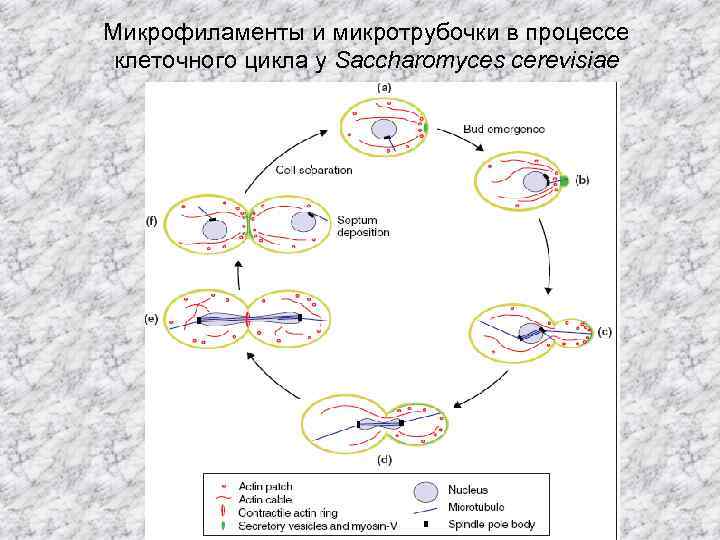
Микрофиламенты и микротрубочки в процессе клеточного цикла у Saccharomyces cerevisiae
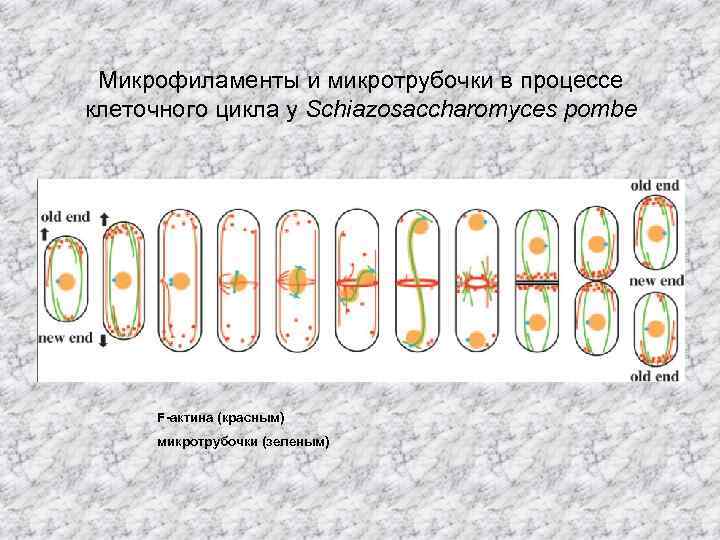
Микрофиламенты и микротрубочки в процессе клеточного цикла у Schiazosaccharomyces pombe F-актина (красным) микротрубочки (зеленым)
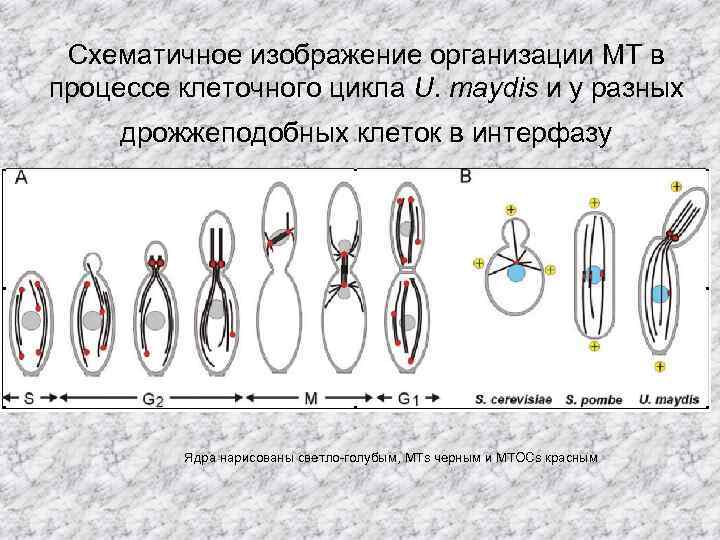
Схематичное изображение организации MT в процессе клеточного цикла U. maydis и у разных дрожжеподобных клеток в интерфазу Ядра нарисованы светло-голубым, MTs черным и MTOCs красным

Схема MT и актина цитоскелета у S. cerevisiae, (A) S. pombe (B) и A. nidulans ( C)

Моторные белки Имеется три типа молекулярных моторов: асоциированные с микротрубочками кинезины и динеины, и ассоциироанные с актином миозины.
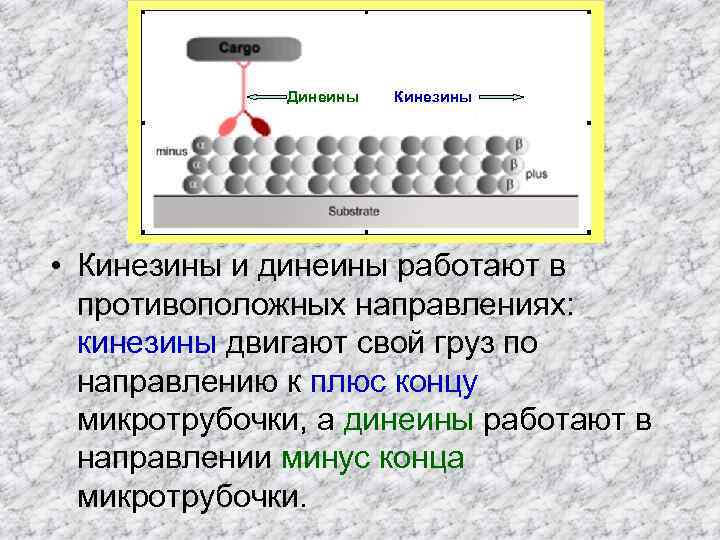
Динеины Кинезины • Кинезины и динеины работают в противоположных направлениях: кинезины двигают свой груз по направлению к плюс концу микротрубочки, а динеины работают в направлении минус конца микротрубочки.

• В гифах грибов представлены все клеточные транспортные процессы включая апикальное полярное растяжение, септирование и ядерное деление.
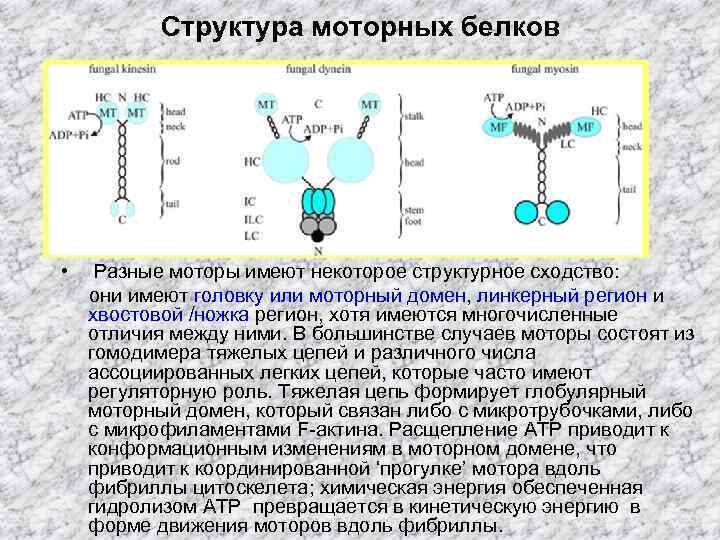
Структура моторных белков • Разные моторы имеют некоторое структурное сходство: они имеют головку или моторный домен, линкерный регион и хвостовой /ножка регион, хотя имеются многочисленные отличия между ними. В большинстве случаев моторы состоят из гомодимера тяжелых цепей и различного числа ассоциированных легких цепей, которые часто имеют регуляторную роль. Тяжелая цепь формирует глобулярный моторный домен, который связан либо с микротрубочками, либо с микрофиламентами F-актина. Расщепление ATP приводит к конформационным изменениям в моторном домене, что приводит к координированной ‘прогулке’ мотора вдоль фибриллы цитоскелета; химическая энергия обеспеченная гидролизом ATP превращается в кинетическую энергию в форме движения моторов вдоль фибриллы.

(a) Актин Schizosaccharomyces japonicus var. versatilis. (b) Ядра у Schizosaccharomyces japonicus var. versatilis. (c) Актин у Saccharomyces cerevisiae. (d) Ядра Saccharomyces cerevisiae. (e–h, j) Актин в гифе Aureobasidium pullulans.

• Имеется тесная связь между актиновым и микротрубочковым цитоскелетными системами и одни и те же органеллы передвигаются на обоих типах филаментов. • Например, мутации в каждом из этих моторов могут приводить к сходным дефектам в септировании, миграции ядер и распределению органелл у грибов. • С другой стороны имеется также доказательство, что движение некоторых органелл специфично к индивидуальным моторам, и эти моторы различны у разных грибов. • Например, у Saccharomyces cerevisiae, транспорт митохондрий, секреторных везикул и вакуолей основан главным образом на F -актине и он ассоциирован с миозиновыми моторами, в тоже время у делящихся дрожжей Schizosaccharomyces pombe в этот тип передвижения вовлечена микротрубочковая система.

Грибные моторы вовлечены в следующие процессы: • секреция и эндоцитоз; • цитокинез; • положение и наследование органелл; • митоз; • генетическая рекомбинация; • RNA транспорт.
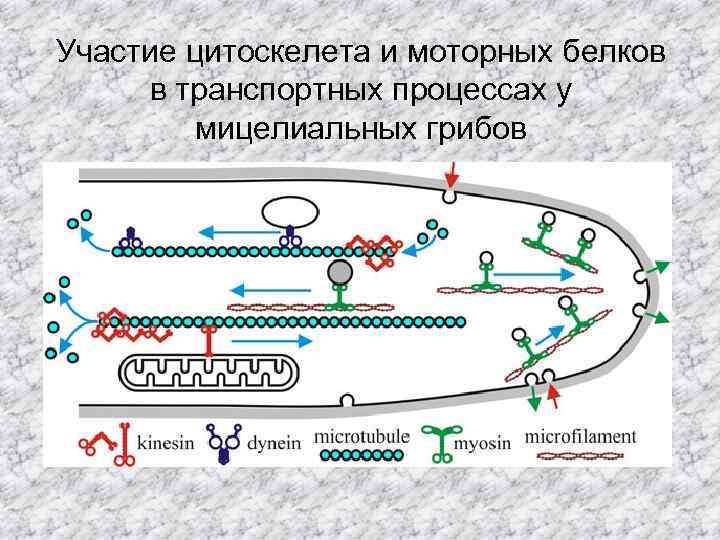
Участие цитоскелета и моторных белков в транспортных процессах у мицелиальных грибов
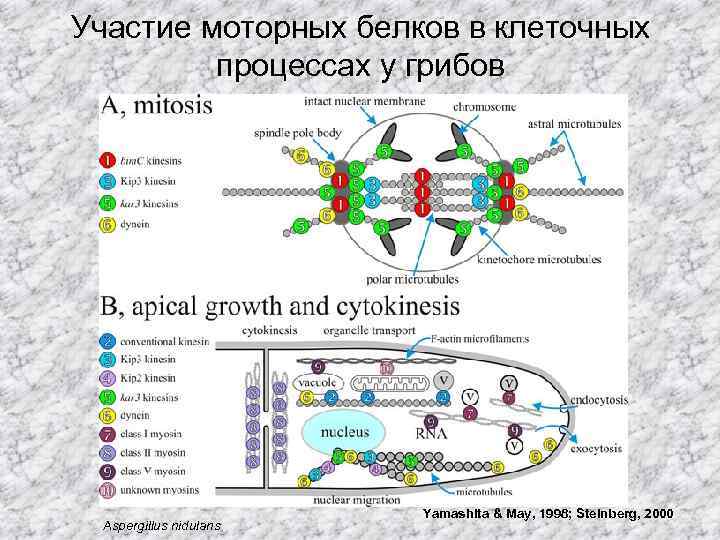
Участие моторных белков в клеточных процессах у грибов Aspergillus nidulans Yamashita & May, 1998; Steinberg, 2000

Роль динеин-динактинового комплекса в перемещении ядра в анафазе митоза у почкующихся дрожжей (Karki & Holzbaur, 1999).

Роль динеина и динактина в миграции ядер у Aspergillus nidulans (Karki & Holzbaur, 1999).

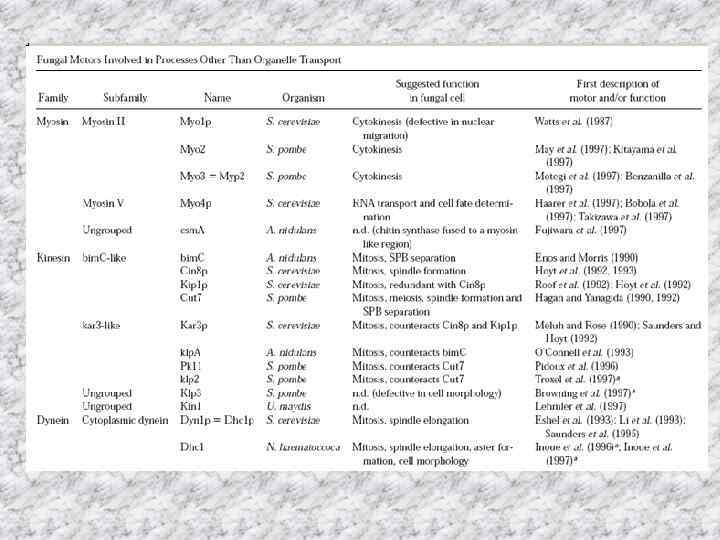

• Геном Saccharomyces cerevisiae имеет гены, кодирующие пять миозинов, шесть кинезинов и один динеин. • Это небольшое число моторных белков по сравнению с некоторыми системами позвоночных, которые имеют 50 разных клеточных моторов. Что предполагает участие каждого моторного белка в нескольких клеточных процессах.

Заключение • Молекулярные моторы вносят вклад в огромное количество процессов, которые являются ключевыми для организации и поляризации растяжения клеток грибов у дрожжей и мицелиальных грибов.
Апикальное тельце и цитоскелет Лекция 3 2012.ppt