психофармакогенетика2.pptx
- Количество слайдов: 35
 АО «МЕДИЦИНСКИЙ УНИВЕРСИТЕТ АСТАНА» СРС Натему: Выполнила: интерн гр. 690 «ВБ» Бекбалтаева Ж. П. Проверила: преподаватель Иванов Д. А. Астана 2017 год.
АО «МЕДИЦИНСКИЙ УНИВЕРСИТЕТ АСТАНА» СРС Натему: Выполнила: интерн гр. 690 «ВБ» Бекбалтаева Ж. П. Проверила: преподаватель Иванов Д. А. Астана 2017 год.

 В 1957 году A. Motulsky обобщил все доступные на тот момент данные проведённых генетических исследований лекарственных препаратов [13], в 1959 году F. Vogel ввёл термин «фармакогенетика» . Наконец, в 1962 году W. Kalow была опубликована первая книга по фармакогенетике.
В 1957 году A. Motulsky обобщил все доступные на тот момент данные проведённых генетических исследований лекарственных препаратов [13], в 1959 году F. Vogel ввёл термин «фармакогенетика» . Наконец, в 1962 году W. Kalow была опубликована первая книга по фармакогенетике.
 Понятие генетического полиморфизма В основе большинства генетических изменений, приводящих к изменению функциональности гена, лежат точечные нуклеотидные изменения в ДНК — однонуклеотидные. Несмотря на минимальное изменение структуры ДНК, они могут приводить к существенным изменениям свойств кодируемых генами пептидов.
Понятие генетического полиморфизма В основе большинства генетических изменений, приводящих к изменению функциональности гена, лежат точечные нуклеотидные изменения в ДНК — однонуклеотидные. Несмотря на минимальное изменение структуры ДНК, они могут приводить к существенным изменениям свойств кодируемых генами пептидов.
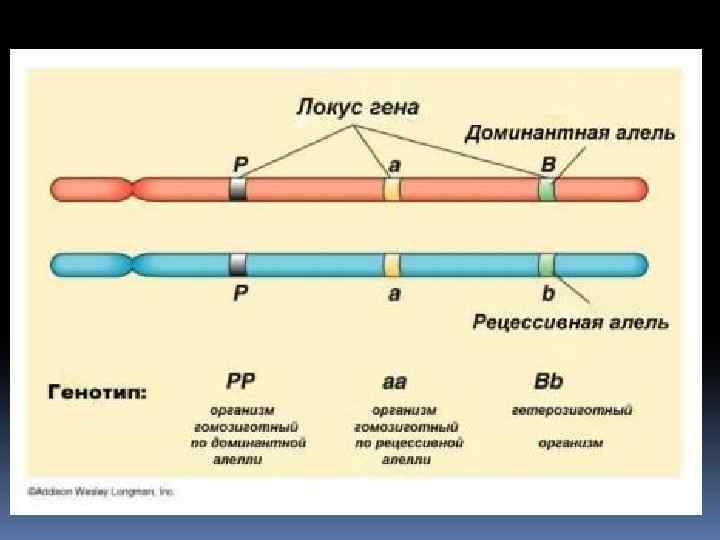
 В среднем однонуклеотидные различия между геномами двух людей обнаруживаются в количестве 1 на 1000 оснований, при этом во всём человеческом геноме приблизительно 3 миллиарда пар нуклеотидов.
В среднем однонуклеотидные различия между геномами двух людей обнаруживаются в количестве 1 на 1000 оснований, при этом во всём человеческом геноме приблизительно 3 миллиарда пар нуклеотидов.
 Было показано, что нуклеотидные полиморфизмы влияют не только на фенотип, но и на устойчивость организмов к различным заболеваниям и внешним воздействиям, на скорость синтеза и распада различных веществ в организме, действие фармпрепаратов.
Было показано, что нуклеотидные полиморфизмы влияют не только на фенотип, но и на устойчивость организмов к различным заболеваниям и внешним воздействиям, на скорость синтеза и распада различных веществ в организме, действие фармпрепаратов.
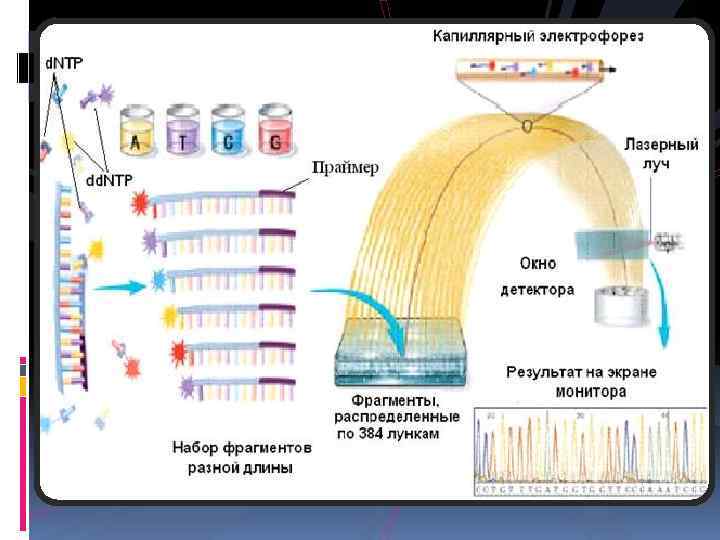
 Минимальность структурных изменений, которую обусловливают нуклеотидные полиморфизмы, диктует необходимость использования особо точных методов, которые позволяют регистрировать такие изменения. Традиционно использующийся метод анализа длин рестрикционных фрагментов (п. ЦР-п. ДРФ), минисеквенирование ДНк.
Минимальность структурных изменений, которую обусловливают нуклеотидные полиморфизмы, диктует необходимость использования особо точных методов, которые позволяют регистрировать такие изменения. Традиционно использующийся метод анализа длин рестрикционных фрагментов (п. ЦР-п. ДРФ), минисеквенирование ДНк.
 Результатом существования ОНП у пациентов является: • изменение (повышение/снижение) активности белка (фермента, транспортёра, ионного канала, сопряжённых белков и т. д. ), если имеет место однонуклеотидный полиморфизм в структурной части гена (кодирует аминокислотную последовательность белка); • изменение количества (повышение/снижение) белка (фермента, транспортёра, ионного канала, сопряжённых белков и т. д. ).
Результатом существования ОНП у пациентов является: • изменение (повышение/снижение) активности белка (фермента, транспортёра, ионного канала, сопряжённых белков и т. д. ), если имеет место однонуклеотидный полиморфизм в структурной части гена (кодирует аминокислотную последовательность белка); • изменение количества (повышение/снижение) белка (фермента, транспортёра, ионного канала, сопряжённых белков и т. д. ).
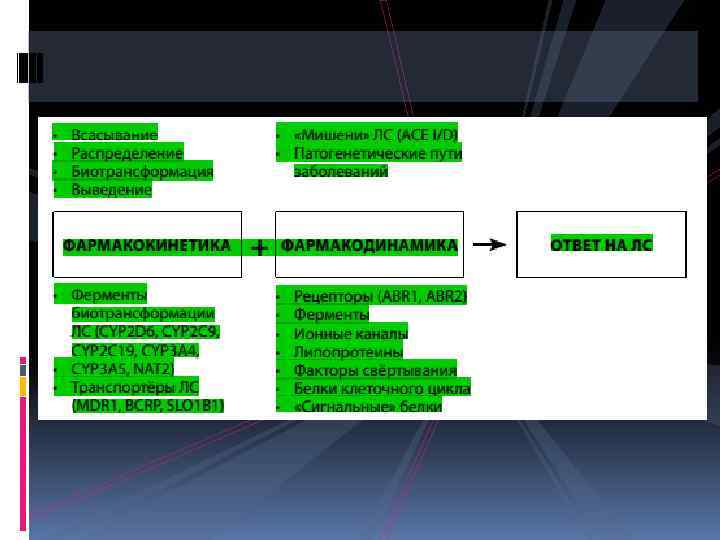
 Именно существование ОНп в том или ином гене, передаваемые из поколения в поколения, могут определять генетически обусловленный вклад в индивидуальный фармакологический ответ: • развитие неблагоприятной побочной реакции, • резистентность (низкая эффективность или вообще её отсутствие) применении ЛС.
Именно существование ОНп в том или ином гене, передаваемые из поколения в поколения, могут определять генетически обусловленный вклад в индивидуальный фармакологический ответ: • развитие неблагоприятной побочной реакции, • резистентность (низкая эффективность или вообще её отсутствие) применении ЛС.

 CYP 2 C 9*3 —это однонуклеотидный полиморфизм гена, который представляет замену аденилового (а) нуклеотида на тимидиловый (т) в нуклеотидной последовательности ДНк гена в положении 1075. Носительство данного ОНп у пациента приводит к тому, что синтезируется фермент CYP 2 C 9, в аминокислотной последовательности которого изолейцин в 359 положении заменен на лейцин, который обладает низкой активностью. Следовательно, метаболизм ЛС-субстратов CYP 2 C 9 (непрямые антикоагулянты, Нп. ВС, пероральные гипогликемические препараты) будте замедлен.
CYP 2 C 9*3 —это однонуклеотидный полиморфизм гена, который представляет замену аденилового (а) нуклеотида на тимидиловый (т) в нуклеотидной последовательности ДНк гена в положении 1075. Носительство данного ОНп у пациента приводит к тому, что синтезируется фермент CYP 2 C 9, в аминокислотной последовательности которого изолейцин в 359 положении заменен на лейцин, который обладает низкой активностью. Следовательно, метаболизм ЛС-субстратов CYP 2 C 9 (непрямые антикоагулянты, Нп. ВС, пероральные гипогликемические препараты) будте замедлен.
 Например, транспортёр органических анионов SLCO 1 B 1 осуществляет «захват» (т. н. инфлюкс) ряда гиполипидемических ЛС из группы статинов из крови. Гетерозиготное, а особенно гомозиготное носительство однонуклеотидного полиморфизма SLCO 1 B 1*5 приводит к синтезу транспортёра со сниженной активностью, при этом статины хуже захватываются в гепатоцитах, «задерживаются» в системном кровотоке, вызывая неблагоприятные побочные реакции, и, прежде всего миопатию, вплоть до рабдомиолиза.
Например, транспортёр органических анионов SLCO 1 B 1 осуществляет «захват» (т. н. инфлюкс) ряда гиполипидемических ЛС из группы статинов из крови. Гетерозиготное, а особенно гомозиготное носительство однонуклеотидного полиморфизма SLCO 1 B 1*5 приводит к синтезу транспортёра со сниженной активностью, при этом статины хуже захватываются в гепатоцитах, «задерживаются» в системном кровотоке, вызывая неблагоприятные побочные реакции, и, прежде всего миопатию, вплоть до рабдомиолиза.
 Для снижения риска поражения поперечнополосатой мускулатуры, при выявлении гетерозиготного носительства (генотип SLCO 1 B 1*1/*5) максимальная доза симвастатина и аторвастатина не должна превышать 40 мг/сутки, а при выявлении гомозиготного носительства (SLCO 1 B 1*1/*5) — 20 мг/сутки.
Для снижения риска поражения поперечнополосатой мускулатуры, при выявлении гетерозиготного носительства (генотип SLCO 1 B 1*1/*5) максимальная доза симвастатина и аторвастатина не должна превышать 40 мг/сутки, а при выявлении гомозиготного носительства (SLCO 1 B 1*1/*5) — 20 мг/сутки.
 «Фармакодинамические» полиморфизмы генов Например, молекулой-мишенью для непрямых антикоагулянтов (варфарин, аценокумарол, фениндион) является 1 субъединица фермент витамин К эпоксидредуктазы (VKORC 1). У носителей генотипа аа по однонуклеотидному полиморфизму G 1639 A гена VKORC 1 отмечается высокая чувствительность к непрямым антикоагулянтам, поэтому поддерживающая доза варфарина необходима менее 2, 5 мг/сутки (средняя поддерживающая доза варфарина — 5 мг/сутки).
«Фармакодинамические» полиморфизмы генов Например, молекулой-мишенью для непрямых антикоагулянтов (варфарин, аценокумарол, фениндион) является 1 субъединица фермент витамин К эпоксидредуктазы (VKORC 1). У носителей генотипа аа по однонуклеотидному полиморфизму G 1639 A гена VKORC 1 отмечается высокая чувствительность к непрямым антикоагулянтам, поэтому поддерживающая доза варфарина необходима менее 2, 5 мг/сутки (средняя поддерживающая доза варфарина — 5 мг/сутки).
 У носителей однонуклеотидного полиморфизма одного из генов главного комплекса гистосовместимости HLA-B*5701 (как у гетерозигот, так и у гомозигот) в 50% случаях развивается опасная для жизни аллергическиая реакция по типу гиперчувствительности замедленного типа применении противовирусного препарата из группы ингибиторов ВИч-протеиназы абакавира у пациентов с ВИчинфекцией. при выявлении у пациента однонуклеотидного полиморфизма HLAB*5701 следует отказаться от применения абакавира.
У носителей однонуклеотидного полиморфизма одного из генов главного комплекса гистосовместимости HLA-B*5701 (как у гетерозигот, так и у гомозигот) в 50% случаях развивается опасная для жизни аллергическиая реакция по типу гиперчувствительности замедленного типа применении противовирусного препарата из группы ингибиторов ВИч-протеиназы абакавира у пациентов с ВИчинфекцией. при выявлении у пациента однонуклеотидного полиморфизма HLAB*5701 следует отказаться от применения абакавира.
 Национальный Институт Исследования человеческого генома в СШа собирает информацию о GWAS из разных публикаций в одну общую базу данных, которая доступна всем по адресу http: //www. genome. gov/gwastudies/
Национальный Институт Исследования человеческого генома в СШа собирает информацию о GWAS из разных публикаций в одну общую базу данных, которая доступна всем по адресу http: //www. genome. gov/gwastudies/
 Психофармакогенетика Психические расстройства являются, как известно, достаточно распространённой и тяжёлой патологией. Не менее драматичной является ситуация и в области лекарственного лечения этих расстройств, поскольку определённая часть больных эффективно не реагируют на психотропные препараты и/или испытывают серьёзные побочные осложнения при их применении.
Психофармакогенетика Психические расстройства являются, как известно, достаточно распространённой и тяжёлой патологией. Не менее драматичной является ситуация и в области лекарственного лечения этих расстройств, поскольку определённая часть больных эффективно не реагируют на психотропные препараты и/или испытывают серьёзные побочные осложнения при их применении.
 Наиболее существенной вехой в изучении фармакогенетических показателей при лечении психических расстройств стало открытие полиморфизма гена фермента цитохрома P 450, а именно 2 D 6 — CYP 2 D 6, метаболизирующего, как известно, большинство психотропных препаратов.
Наиболее существенной вехой в изучении фармакогенетических показателей при лечении психических расстройств стало открытие полиморфизма гена фермента цитохрома P 450, а именно 2 D 6 — CYP 2 D 6, метаболизирующего, как известно, большинство психотропных препаратов.
 Влияние генетически детерминированного типа метаболизма CYP 2 D 6 на фармакокинетику психотропных препаратов активно изучалось с 80 -х годов (хотя имеются и более ранние публикации по фармакогенетике в психиатрии [18, 19]). так, одними из первых были опубликованы исследования галоперидола [20], имипрамина [21], клозапина [22]
Влияние генетически детерминированного типа метаболизма CYP 2 D 6 на фармакокинетику психотропных препаратов активно изучалось с 80 -х годов (хотя имеются и более ранние публикации по фармакогенетике в психиатрии [18, 19]). так, одними из первых были опубликованы исследования галоперидола [20], имипрамина [21], клозапина [22]
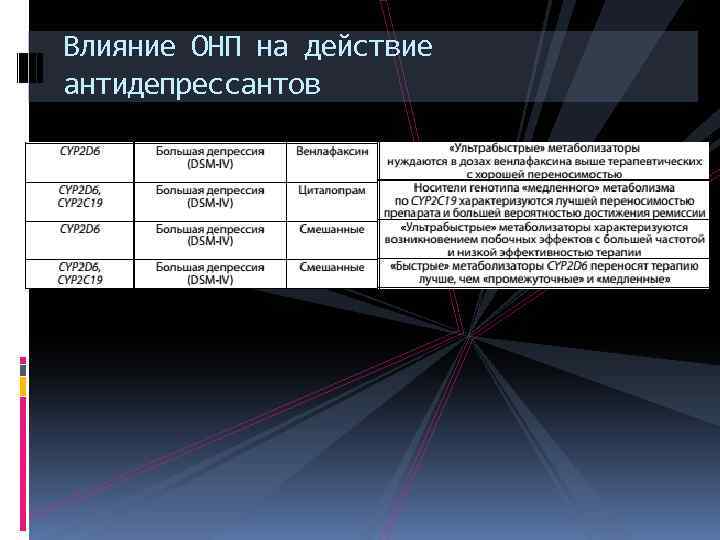 Влияние ОНП на действие антидепрессантов
Влияние ОНП на действие антидепрессантов
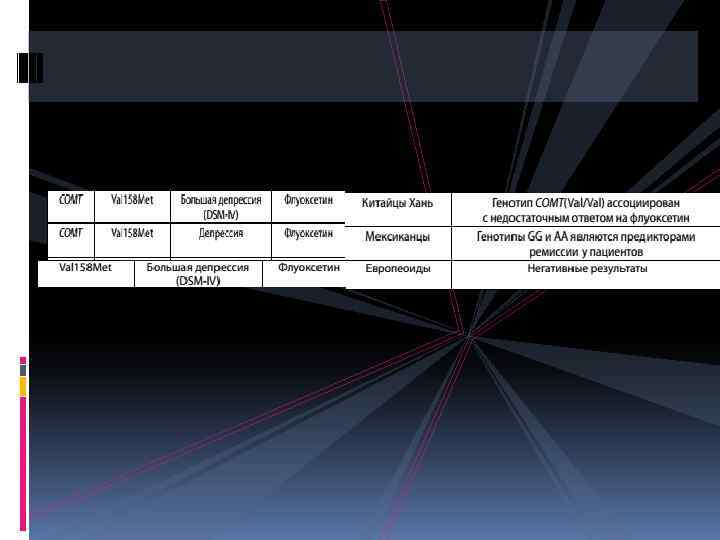
 как известно, основной мишенью типичных антипсихотиков являются рецепторы дофамина 2 типа (D 2). Уже самые первые работы выявили, что наличие мутаций генов, кодирующих рецепторы дофамина, влияет на аффинность препарата к молекулам-мишеням и посредством этого существенно изменяет механизм действия.
как известно, основной мишенью типичных антипсихотиков являются рецепторы дофамина 2 типа (D 2). Уже самые первые работы выявили, что наличие мутаций генов, кодирующих рецепторы дофамина, влияет на аффинность препарата к молекулам-мишеням и посредством этого существенно изменяет механизм действия.
 Наиболее известным алгоритмом подбора психотропных препаратов является тест-система Ampli. Chip P 450 test (Roche Molecular Systems, Inc. ), разработанная в 2004 году группой учёных во главе с J. de Leon [33– 35]. алгоритм учитывал гены, кодирующие ферменты цитохрома P 450, не только ранее упомянутый CYP 2 D 6.
Наиболее известным алгоритмом подбора психотропных препаратов является тест-система Ampli. Chip P 450 test (Roche Molecular Systems, Inc. ), разработанная в 2004 году группой учёных во главе с J. de Leon [33– 35]. алгоритм учитывал гены, кодирующие ферменты цитохрома P 450, не только ранее упомянутый CYP 2 D 6.
 На основе расширенного генетического теста пациент получал рекомендации, какой психотропный препарат (как правило, тест применялся для подбора антипсихотиков) будет наиболее эффективен и безопасен при имеющемся у пациента типе метаболизма.
На основе расширенного генетического теста пациент получал рекомендации, какой психотропный препарат (как правило, тест применялся для подбора антипсихотиков) будет наиболее эффективен и безопасен при имеющемся у пациента типе метаболизма.
 В последние 4 года активно разрабатывается и внедряется алгоритм для подбора антидепрессантов и антипсихотиков Gene. Sight. Данная тест-система включает в себя интерпретацию комплексного генетического тестирования пациента по полиморфизмам нескольких генов, связанных как с фармакокинетикой, так и с фармакодинамикой психотропных препаратов.
В последние 4 года активно разрабатывается и внедряется алгоритм для подбора антидепрессантов и антипсихотиков Gene. Sight. Данная тест-система включает в себя интерпретацию комплексного генетического тестирования пациента по полиморфизмам нескольких генов, связанных как с фармакокинетикой, так и с фармакодинамикой психотропных препаратов.
 Gene. Sight обладает очень удобным интерфейсом интерпретации: для каждого пациента, согласно результатам тестирования, он создаёт три группы препаратов — «применять без предостережений» , «применять с осторожностью» , «применять с частым мониторингом состояния» , —в которые наглядно распределяет антидепрессанты и антипсихотики.
Gene. Sight обладает очень удобным интерфейсом интерпретации: для каждого пациента, согласно результатам тестирования, он создаёт три группы препаратов — «применять без предостережений» , «применять с осторожностью» , «применять с частым мониторингом состояния» , —в которые наглядно распределяет антидепрессанты и антипсихотики.
 Наиболее популярным подходом на данный момент остаётся фармакогенетическое тестирование единичных полиморфизмов, показавших наиболее высокий уровень доказательности в многоцентровых исследованиях и значимо ассоциированных с эффективностью и безопасностью психотропных препаратов.
Наиболее популярным подходом на данный момент остаётся фармакогенетическое тестирование единичных полиморфизмов, показавших наиболее высокий уровень доказательности в многоцентровых исследованиях и значимо ассоциированных с эффективностью и безопасностью психотропных препаратов.
 в 2013 году вышло в свет руководство J. K. Hicks et al. по подбору дозы трициклических антидепрессантов на основании носительства определённых аллелей CYP 2 D 6 и CYP 2 C 19 [49]. В том же году опубликовано руководство по назначению карбамазепина в зависимости от наличия у пациента аллеля HLA-B*1502 (многочисленные исследования показали, что данный аллель увеличивает риск развития кожных реакций гиперчувствительности — синдрома Стивенса–Джонса, токсического эпидермального некролиза)
в 2013 году вышло в свет руководство J. K. Hicks et al. по подбору дозы трициклических антидепрессантов на основании носительства определённых аллелей CYP 2 D 6 и CYP 2 C 19 [49]. В том же году опубликовано руководство по назначению карбамазепина в зависимости от наличия у пациента аллеля HLA-B*1502 (многочисленные исследования показали, что данный аллель увеличивает риск развития кожных реакций гиперчувствительности — синдрома Стивенса–Джонса, токсического эпидермального некролиза)
 В 1973 году на базе 2 -го МОЛГМИ им. Н. И. пирогова была создана лаборатория фармакологической генетики, в которой начали проводить исследования по фармакогенетике психотропных препаратов.
В 1973 году на базе 2 -го МОЛГМИ им. Н. И. пирогова была создана лаборатория фармакологической генетики, в которой начали проводить исследования по фармакогенетике психотропных препаратов.
 С 1986 года данная лаборатория существует в составе НИИ Фармакологии им. В. В. закусова Ра. МН [66]. к 1979 году под руководством академика а. В. Вальдмана разработаны положения об индивидуальных реакциях на бромдигидрохлорфенил бензодиазепин и мезокарб; кроме того, активно развивалось изучение эффектов психотропных средств на эмоциональную сферу пациентов
С 1986 года данная лаборатория существует в составе НИИ Фармакологии им. В. В. закусова Ра. МН [66]. к 1979 году под руководством академика а. В. Вальдмана разработаны положения об индивидуальных реакциях на бромдигидрохлорфенил бензодиазепин и мезокарб; кроме того, активно развивалось изучение эффектов психотропных средств на эмоциональную сферу пациентов
 Дальнейшие разработки в области психофармакогенетики привели к пониманию анксиогенеза на уровне Га. Мк-а-бензодиазепинового рецепторного комплекса; эти данные позволили учёным во главе с акад. Ра. МН С. Б. Середениным разработать новый противотревожный препарат —афобазол
Дальнейшие разработки в области психофармакогенетики привели к пониманию анксиогенеза на уровне Га. Мк-а-бензодиазепинового рецепторного комплекса; эти данные позволили учёным во главе с акад. Ра. МН С. Б. Середениным разработать новый противотревожный препарат —афобазол


