Антибиотики инте.ppt
- Количество слайдов: 64

Антибиотики. Химиотерапия.

Краткая историческая справка. Эвристический период. Проблема лечения инфекционных болезней имеет такую же долгую историю, как и изучение самих болезней. С точки зрения современного человека, первые попытки в этом направлении были наивны и примитивны, хотя некоторые из них не были лишены здравого смысла (например прижигание ран или изоляция больных). Изготовление настоев и отваров из растительного сырья было широко распространено в античном мире, их пропагандировал Клавдий Гален (отсюда и «галеновы» ). В средневековье репутацию препаратов из лекарственного сырья значительно «подмочили» всевозможные зелья, «изыскания» алхимиков.

Основателем химиотерапии с полным правом должен считаться Парацельс, названный А. И. Герценом «первым профессором химии от сотворения мира» . Парацельс не без успеха применял для лечения инфекций человека и животных различные неорганические вещества (например соли ртути и мышьяка).

После открытия Нового Света стало известно свойствах коры дерева «кина» , использовавшейся индейцами для лечения малярии. Популярности этого средства способствовало чудесное излечение жены вице-короля Америки, графини Цинхон, и в Европу кора прибыла уже под названием «порошок графини» , а позднее ее имя присвоили и самому хинному дереву. Такую же славу снискало другое заокеанское средство – ипекакуана, применявшееся индейцами для лечения «кровавых» поносов.

u u u История современных антимикробных средств началась с открытия Паулем Эрлихом способности анилиновых красителей убивать трипаносомы. Роберт Кох применил атоксил (органическое производное мышьяка) для лечения сонной болезни. Но через несколько месяцев выяснилось, что этот препарат вызывает дегенерацию зрительного нерва. Пауль Эрлих получил препарат сальварсан (спасающий), который спас жизнь тысячам больных различными спирохетозами (сифилис, фрамбезия и др. ).

П. Ерлих

Антибиотики. При изучении сибирской язвы Л. Пастер заметил, что заражение животного смесью возбудителя и других бактерий часто мешает развитию заболевания, что позволило ему предположить, что конкуренция между микробами может блокировать патогенные свойства возбудителя. Впервые идею о возможности применения существующего антагонизма между микробами для лечебных целей высказал М. М. Мечников.

Л. Пастер

Эти находки положили начало развитию двух направлений в подходе к лечению инфекций: применение стерилизованных микробных культур (чему особый толчок дало открытие и применение туберкулина Кохом) и особых ингибирующих агентов, продуцируемых микробами. В последующем было установлено, что отдельные почвенные спорообразующие бактерии выделяют вещества, убивающие бактерии других видов.

В 70 -х годах ХІХ века русские врачи В. А. Маннасеин и А. Г. Полотебнов установили бактерицидные свойства плесневых грибов (Penicillium glaucum) и эффективность экстрактов их культур при лечении инфицированных язв и ран. Для этого направления ведущее значение имело открытие А. Флемингом пенициллинов (1928). Следствием этой знаменитой «случайности» (в открытую чашку со стафилококками нечаянно попала плесень Р. notatum, образовавшая зону задержки роста) являлось получение чистого пенициллина (Хоуард Флори и Эрнст Чейн, 1940) и начало новой эры в химиотерапии.

А. Флеминг

Е. Чейни

Г. Флори

u Первый отечественный пенициллин (крустозин) был получен З. В. Ермольевой из P. Crustosum в 1942 году. Безусловно, без предшествующих многолетних исследований, в том числе и отечественных ученых, эта «случайность» вряд ли могла стать плодотворной. Более того, в 1985 г. в архивах Лионского университета была найдена диссертация рано скончавшегося студента-медика, за сорок лет до А. Флеминга подробно характеризующая открытый им препарат из плесени P. notatum, активный против многих патогенных бактерий.

З. В. Ермольева

Основные принципы химиотерапии инфекционных болезней. Эффективность любого препарата опосредует сумма слагаемых, обеспечивающих его терапевтическое действие: сохранение стабильности структуры при введении в организм либо образование активного метаболита, скорость абсорбции и элиминации, способность к проникновению в ткани и биологические жидкости, избирательность действия, чувствительность микроорганизмов.

Критерии эффективности. При оценке эффективности антимикробных препаратов к основным критериям относят терапевтический индекс, достижимую концентрацию в сыворотке крови, спектр активности. Терапевтический индекс – частное от деления максимального переносимой (токсичной) дозы препарата на минимальную дозу, проявляющую антимикробную активность. (Dosis tolerantia / Dosis curativa). Терапевтический индекс должен быть не меньше 3. Более высокое значение терапевтического индекса соответствует большей эффективности препарата.

Спектр активности антимикробных средств. Антимикробные агенты действуют только на вегетирующие клетки, но не на споры или цисты. Для реализации своей биологической активности антимикробное средство должно: - проникнуть в микробную клетку; - связаться с соответствующей мишенью и модифицировать ее; - сохранить при этом свою структуру или образовать активный метаболит.

Эффекты антимикробных препаратов: Антибактериальные противогрибковые и антипротозойные препараты тормозят рост либо вызывают гибель микроорганизмов. Противовирусные препараты ингибируют репликацию вирусов, блокируя их адсорбцию на чувствительных клетках, высвобождение вирусного генома либо подавляя вирусспецифические синтезы. Активность химиотерапевтических препаратов выражают в единицах действия (ЕД) или в микрограммах (мкг).

Антибактериальные препараты К антибактериальным химиотерапевтическим средствам относят антибиотики, сульфаниламидные средства различного химического строения, противосифилитические и противотуберкулёзные средства.

Антибиотики – (греч. Anti – против + biosis, жизнь) – химические вещества биологического происхождения и их полусинтетические производные, избирательно тормозящие рост и размножение или убивающие микроорганизмы, вирусы, простейшие, грибы, а также задерживают рост злокачественных опухолей.

З. Ваксман

Биологическая активность антибиотиков оценивается в международных единицах, которые содержаться в 1 мл раствора или в 1 мг препарата (ЕД/мл, ЕД/мг). За 1 ЕД антибиотика принимают наименьшее его количество в мкг, которое угнетает рост эталонного штамма микроорганизма в определенном объеме. Например, за 1 ЕД пенициллина принимают минимальное количество препарата, способное задерживать рост штамма Staf. aureus 209 5 50 мл питательного бульона; для стрептомицина – минимальное количество антибиотика, которое ингибирует рост E. Coli в 1 мл питательного бульона.

Классификация Антибиотики классифицируют и характеризуют по их происхождению, химической структуре, механизму действия, спектру активности, частоте развития лекарственной устойчивости и т. д. Тип продуцента: В соответствии с типом продуцента выделяют антибиотики, синтезируемые:

1. Грибами: (бензилпенициллин, гризеофульвин, цефалоспорины). 2. Актиномицетами (аминогликозиды – стрептомицин, мономицин, тетрациклины, левомицетин, макролиды – олеандомицин, эритромицин, линкомицин, рифампицин, полиеновые антибиотики – нистатин, леворин, амфотерицин – В; ингибиторы В-лактамаз – клавулановая, тиенамицин).

3. Бактериями (например, полимиксины (B. polymyxa), бацитрацин, лихенгифармин (B licheniformis ), грамицидин С (B. brevis), субтилин (B. subtilis), продигиозин (Serratia marcescens), колиформин (E. coli) и др. 4. Растениями: хлоремен (хлорелла), аренарин (бессмертник), иманин (зверобой), гордецин (зерна ячменя), хинин (кора хинного дерева), хлорофиллипт (листья евкалипта), амицин (чеснок), рафпанин (редис) и др. 5. Животными: интерфероны, лизоцим, эритрин.

Способы получения антибиотиков: - биосинтетические (природные), их продуцентами выступают специальные штаммы микроорганизмов; - полусинтетические, получаемые химическим соединением природного антибиотика, точнее его «ядра» , с различными химическими радикалами (при этом возможно направленное создание препаратов с заданными свойствами); - синтетические антибиотики, источник их получения – химический синтез, возможный после определения структуры природных препаратов (например, левомицетин)

По спектру биологического действия выделяют антибиотики узкого спектра, активные преимущественно против грамположительных микроорганизмов и широкого спектра, эффективные против многих Гр (+) и Гр (-) бактерий; По типу противомикробной активности их делят на бактерицидные (пенициллины, стрептомицины, цефалоспорины, полимиксины) и бактериостатические (тетрациклины, левомицетин, макролиды).

Механизм действия. Антибиотики подавляют различные процессы: синтез компонентов клеточной стенки, функции ЦПД, синтез белка, транскрипцию и синтез нуклеиновых кислот микроорганизмов. - Ингибиторы синтеза компонентов клеточной стенки (В-лактамные антибиотики, бацитрацины, ванкомицин, циклосерин); все В-лактамные антибиотики оказывают бактерицидное действие.

- Ингибиторы функции цитоплазматических мембран- ЦПМ служит селективно проницаемым барьером, нарушение ее функций приводит к выходу из клетки белков, пуриновых и пиримидиновых нуклеотидов, ионов с последующей ее гибелью. К препаратам этой группы относят полимиксины, полиеновые антибиотики, и грамицидины. Полимиксины – нарушают осмотическую резистентность ЦПМ; Полиеновые антибиотики (нистатин, леворин, амфотерицин В) продуцируют виды Streptomyces. Эти антибиотики применяю как противомикробные препараты, так как они связывают эргостерол ЦПМ клетки гриба, что приводит к потере клеткой низкомолекулярных соединений.

- Ингибиторы синтеза белка – антибиотики которые нарушают функциональные свойства рибосом. К этой группе отнесены аминогликозиды, тетрациклины, хлорамфеникол (левомицетин), макролиды, азалиды, линкозамиды (линкомицин). Практически все эти антибиотики продуценты Streptomyces разных видов.

- Ингибиторы транскрипции и синтеза нуклеиновых кислот. Среди большого числа антибиотиков, подавляющих транскрипцию, на практике применяют лишь рифамицины – продукты жизнедеятельности Streptomyces mediterranei. Наиболее известен полусинтетический препарат рифампицин. Его бактерицидная активность опосредована ингибированием ДНКзависимой РНК-полимеразы, что приводит к торможению синтеза любых видов бактериальной РНК.

Сульфаниламиды – первые антибактериальные средства широкого спектра действия, нашедшие применение в медицине как системные бактериостатики. Сульфаниламиды относят к структурным аналогам р-аминобензойной кислоты – предшественника фолиевой кислоты. Препараты проявляют бактериостатическое действие , конкурентно угнетая дегидроптероат синтетазу, что препятствует образованию дегидрофолиевой кислоты и соответственно тетрагидрофолиевой кислоты, необходимой для синтеза пуриновых и пиримидиновых оснований. В результате подавляется рост и размножение микроорганизмов. Спектр активности сульфаниламидов: грамположительные бактерии (стрептококки, актиномицеты, палочка сибирской язвы), грибы, и простейшие.

По характеру действия и клинической значимости препараты, применяемые для лечения вирусных инфекций, подразделяют на четыре основные группы: 1. этиотропные; 2. иммуномодулирующие (корригирующие дефекты иммунного реагирования, развивающиеся при заболевании);

3. патогенетические (направленные на борьбу с интоксикацией, обезвоживанием, сосудистыми и органными поражениями, аллергическими реакциями а также на профилактику бактериальных суперинфекций); 4. симптоматические (купирующие сопутствующую симптоматику, например кашель, головную боль и т. д. )

Ингибиторы адсорбции, проникновения и депротеинизации вирусов. Производные адамантома: ремантадин и амантадин увеличивают значение р. Н эндосом, тем самым предупреждая слияние (т. к. слияние клеточных мембран с вирусными суперкапсидами происходит при низких значениях р. Н). Дизоксарил взаимодействует с суперкапсидом, препятствуя высвобождению вирусных нуклеокапсидов.

Ингибиторы синтеза ранних белков. Основными белками, синтезируемыми на ранней стадии репродукции, выступают РНК-полимеразы и неструктурные белки. Их синтез in vitro ингибирует гуанидин, 2 бензимидазол и аналогичные соединения. Однако этот эффект практически не воспроизводится in vivo, что связано с быстрым развитием химиорезистентности. Поэтому в арсенал противовирусных средств препараты, эффективно подавляющие синтез ранних белков, отсутствуют.

Ингибиторы синтеза нуклеиновых кислот. Эти ЛС действуют как антиметаболиты, что обусловлено их структурным сходством с пуриновыми и пиримидиновыми основаниями. Основные механизмы антивирусного действия препаратов связаны с подавлением активности вирусных полимераз. В форме нуклеотидных аналогов препараты ингибируют вирусные ДНК-полимеразы и/или выступают субстратами для вирусных ферментов; в результате ЛС встраиваются в вирусные нуклеиновые кислоты, образуя дефектные полинуклеотиды или обрывая их дальнейший рост.

Ингибиторы обратной транскриптазы избирательно взаимодействуют с ферментом ретровирусов, включая ВИЧ. Азидотимидин (зидовудин) известно два механизма действия этого ЛС: 1) препарат обладает большим аффинитетом к обратной транскриптазе по сравнению с природными субстратами, тем самым блокируя взаимодействие фермента с последними; 2) встраивание аналога в нуклеотидную цепь вместо тимидина блокирует ее дальнейшую сборку. Ламивидин, ставудин, залцитабин (применяются при развитии резистентности к азидотимидину).

Ингибиторы ДНК-полимераз ДНКсодержащих вирусов: эффективное средство лечения герпетических энцефалитов, существенно снижающее смертность больных. Ацикловир – не влияет на синтез ДНК в незараженных клетках, так как в них он не превращается в активную форму.

Нуклеотидные аналоги широкого спектра. Препараты этой группы ингибируют активность как РНК- так и ДНКполимераз вирусов. Среди большой группы соединений клиническое применение нашел рибавирин. Основные механизмы антивирусной активности: 1) конкуренция с гуанозином за связь с ферментами, обеспечивающими образование гуанизинтрифосфата; 2) ингибирование полимераз нуклеиновых кислот вирусов; 3) нарушение копирования м. РНК встраиванием метилированного гуанина в 5’ –окончание молекулы РНК.

Ингибиторы протеаз: саквинавир, ритонавир, индинавир. Механизм действия связан с конкурентным ингибированием протеаз ВИЧ, что ведет к подавлению дезинтеграции молекул полипротеинов. В результате в ВИЧ-инфицированных клетках накапливаются проявляющие цитотоксическое действие нерасщепленные предшественники дадполипротеина.

Ингибиторы сборки дочерных популяций: производные тиосемикарбазонов – метисазон Антивирусное действие обусловлено подавлением синтеза поздних белков (точнее синтеза поздних м. РНК или поздних полисом) что нарушает сборку дочерных популяций.

Устойчивость микроорганизмов к действию антимикробных средств: Известно два типа устойчивости микроорганизмов к антимикробным средствам – естественная (природная) и приобретенная. Естественная резистентность относится к видовым признакам микроба. К основным механизмам резистентности к действию антибактериальных средств относят:

1) способность к синтезу инактивирующих ферментов (βлактамазы разрушают βлактамное кольцо в молекулах антибиотиков) 2) модификация мишеней, с которыми взаимодействуют лекарственные препараты.

Устойчивость не связанная с наследственными свойствами: 1) изменение метаболической активности клеток-мишеней (большинство антибактериальных средств эффективно подавляет жизнедеятельность лишь активно растущих клеток; 2) уменьшение количества мишеней для ЛС (проводимая химиотерапия способна уменьшать количество мишеней для действия препарата; например, под действием пенициллина отдельные бактерии способны трансформироваться в L-формы, лишенные клеточной стенки и поэтому резистентные к действию антибиотиков с подобным механизмом действия).

Устойчивость, обусловленная изменениями генома. Мутации приводят к изменениям структурных белков (например, в структуре 30 S субъединиц рибосом) и ферментов (например ДНК-зависимых РНКполимераз). Также возможны мутации в локусе гена, кодирующего чувствительность к ЛС.

Селекция штаммов. На фоне применения антибактериального средства часто происходит селекция штаммов, способствующая выживанию и последующему доминированию в популяции бактерий с резистентностью к ЛС. Подобным путем ряд штаммов золотистого стафилококка вырабатывает устойчивость к метициллину.

Плазмиды резистентности обычно представлены внехромосомными молекулами ДНК. Плазмиды могут включать один или более генов, кодирующих синтез ферментов, осуществляющих инактивацию или модификацию ЛС, а также опосредующих быструю элиминацию ЛС из клетки. Гены множественной устойчивости могут также кодировать транспозоны, интегрированные в плазмиды. R-факторы могут придать устойчивость к одному или нескольким ЛС одновременно. Плазмиды способны вызывать состояние резистентности передачей соответствующих дочерних популяций плазмид посредством бактериальной конъюгации или трансдукции.

Выделяют два основных пути преодоления устойчивости к химиопрепаратам: комбинированное применение препаратов с различными механизмами действия и использование ЛС, воздействующих на ранние этапы репродукции, что резко снижает вероятность проявления резистентности.

Побочные эффекты антибиотикотерапии: 1. Токсические реакции: поражение печени (тетрациклин, левомицетин, рифампицин), почек (аминогликозиды, линкомицин), нарушение функций костного мозга (анемия, лейкотромбоцитопения, вплоть до апластического криза) – поражение органов кровотворения; поражение центральной и периферической нервной системы. 2. Эндотоксикоз.

3. Дисбактериозы - развиваются после приема антибиотиков широкого спектра действия, подавляющих жизнь многих бактерий, в том числе и непатогенных. В результате конкурентный баланс в микробных ценозах резко нарушается, что дает устойчивым видам возможность колонизировать свободные участки. 4. Аллергизирующее действие анафилактический шок, астматический бронхит, ринит, конъюнктивит и др.

5. Тератогенное действие на плод. 6. Иммунодепрессивные эффекты: цитостатический эффект препаратов на иммунокомпетентные клетки (левомицетин, циклоспорин).

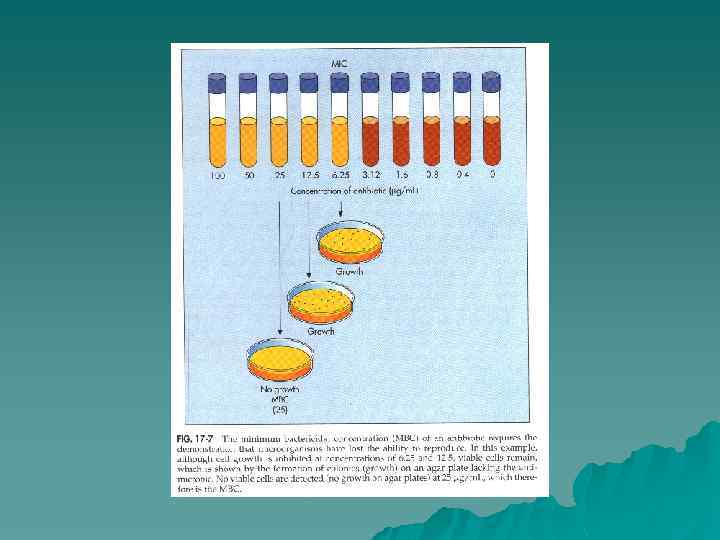
Методы определения чувствительности к антимикробным средствам. u Критериями активности того или иного препарата выступает минимальная ингибирующая (подавляющая) концентрация (МИК – МПК) – наименьшая концентрация препарата, тормозящая рост тест-культуры и минимальная бактерицидная концентрация (МБК) – наименьшая концентрация препарата, вызывающая бактерицидный эффект. u

Методы определения чувствительности к антимикробным средствам. 1) серийные разведения в жидких средах; 2) серийные разведения в плотных средах; 3) диффузные методы; 4) новые методы определения чувствительности бактерий к химиопрепаратам.
Разведение в плотных питательных средах



Ускорены методы определения чувствительности микроорганизмов к антибиотикам · определение изменений ферментативной активности микроорганизмов под воздействием антибиотиков; · определение цвета редокс-индикаторов при изменении окислительно-восстановительного потенциала во время роста бактерий в питательной среде; цитологичная оценка изменений морфологии бактериальных клеток под воздействием антибиотиков; автоматизированное.

К первой группе принадлежит метод Роджерса, который ориентируется на способность антибиотиков подавлять ферментативную активность чувствительных микроорганизмов, которая сопровождается изменением цвета соответствующего индикатора. Суть его заключается в дифференцированном изменении красного цвета фенолового красного на желтый или фиолетовый в зависимости от чувствительности исследуемого штамма. В случае чувствительности к действию антибиотика не происходит разложение глюкозы при культивировании в среде, которое содержит ее и определены концентрации препарата.

Вторая группа методов регистрирует изменения окислительно- восстановительного потенциала среды в процессе роста микроорганизмов, о чем свидетельствует изменение цвета резазурина, 1, 3, 5 -трифенилтетразолия хлорида, 2, 6 -дихлорфенолиндофенола и других, которые добавляются к среде. Этот метод технически простой, а результаты могут быть получены через 2 -6 часа.

Третья группа методов. Образование инволюционных форм бактерий под воздействием антибиотиков исследуют под фазово-контрастным или антоптральным микроскопом в специальных микрокапсулах. Они образуются в результате действия бактериостатических концентраций препарата. Под воздействием суббактериостатических концентраций, а также при резистентности исследуемого штамма на поверхности агара вырастают нормальные микроколонии.

Автоматизированное определение антибиотикочувствительности
Антибиотики инте.ppt