ANTIBIOTIKI.pptx
- Количество слайдов: 55

АНТИБІОТИКИ використання в медичній практиці Підготував доцент, к. мед. н. СТАРОДУБЦЕВ С. Г. ВДНЗУ УМСА. Полтава 2013.

Классификация антибиотиков Антибиотики – это химиотерапевтические средства, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов и развитие злокачественных новообразований.

Термин «антибиотики» появился в 1942 году и происходит от слова «антибиоз» (от греч. anti – против, bios - жизнь), означающего антогонизм между организмами. Антибиоз впервые был описан французским ученым Л. Пастером, наблюдавшим подавления развития бацилл сибирской язвы микроорганизмами других видов. Русский ученый И. И. Мечников предложил препарат из живых молочно-кислых бактерий для подавления развития патогенных бактерий в желудочно-кишечном тракте.

А. Г. Полотебнов и В. А. Манассеин показали в эксперименте и клинике угнетающее действие зеленой плесени на рост и размножение некоторых бактерий. В 1929 году английский микробиолог А. Флеминг опубликовал сообщение, что зеленая плесень подавляет рост стафилококков. Культурная жидкость этой плесени, содержащая антибактериальное вещество, была названа А. Флемингом «пенициллин» . В 1940 году Х. Флори и Э. Чейн получили пенициллин в чистом виде

. В 1942 году под руководством З. В. Ермольевой был синтезирован первый отечественный пенициллин (крустозин). В настоящее время имеются около 3000 антибиотических веществ, однако, в практической медицине используются лишь несколько десятков, остальные оказались слишком токсичными или малоактивными.

Существуют несколько классификаций антибиотиков: химическая классификация: β-лактамные антибиотики, включают группу пенициллинов, цефалоспоринов, карбопенемов и монобактамов; группа тетрациклинов, группа макролидов и другие; по спектру действия:

а) препараты узкого спектра действия: - действуют преимущественно на граммположительные бактерии – пенициллины, линкомицин; - действуют преимущественно на граммотрицательные бактерии – полимиксины монобактамы; б) препараты широкого спектра действия: цефалоспорины 3 -го поколения, тетрациклины, аминогликозиды, амоксициллин, ампициллин;

по механизму действия: - ингибиторы синтеза клеточной стенки микроорганизмов – пенициллины, цефалоспорины, карбопинемы; - ингибиторы синтеза белка на рибосомах аминогликозиды, тетрациклины, группа левомицетина; - нарушающие молекулярную организацию и функцию одноклеточных мембран – полимиксины, полиеновые антибиотики (нистатин, леворин, амфотерицин); - нарушающие синтез нуклеиновых кислот (ингибиторы РНК) – полимеразы – рифампицин.

Механизм и характер антимикробного действия антибиотиков. Механизм действия Антибиотики Преимущественный характер антимикробного действия Нарушение синтеза клеточной стенки β-локтамиды Бактерицидный Гликопептидные антибиотики - Циклосерин Бацитрацин
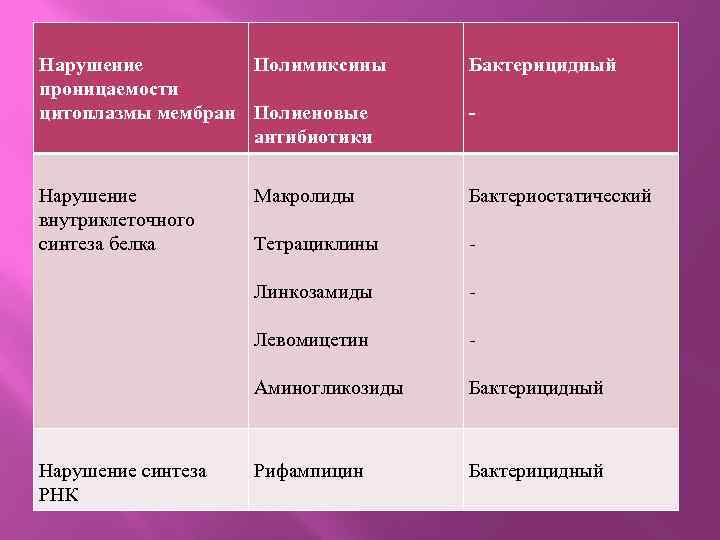
Нарушение Полимиксины проницаемости цитоплазмы мембран Полиеновые антибиотики Бактерицидный Нарушение внутриклеточного синтеза белка Макролиды Бактериостатический Тетрациклины - Линкозамиды - Левомицетин - Аминогликозиды Бактерицидный Рифампицин Бактерицидный Нарушение синтеза РНК -

Из таблицы видно, что бактерицидный эффект оказывают преимущественно те антибиотики, которые нарушают синтез клеточной стенки, изменяют проницаемость цитоплазмы мембран или нарушают синтез РНК в микроорганизмах. Бактериостатическое действие характерно для антибиотиков, нарушающих внутриклеточный синтез белка. Наиболее часто используют смешанную классификацию антибиотиков, основанную на спектре и механизме действия с учетом химического строения.

По химическому строению выделяют следующие группы антибиотиков: 1. β-лактамные антибиотики (пенициллины, цефалоспорины, карбопенемы, монобактамы). 2. Макролиды и близкие к ним антибиотики. 3. Аминогликозиды. 4. Тетрациклины.

5. Полимиксины. 6. Полиены (противогрибковые антибиотики). 7. Препараты хлорамфениколя (левомицетина). 8. Гликопептидные антибиотики. 9. Антибиотики разных химических групп.

Принципы антибиотикотерапии 1. Идентификация возбудителя и изучение его антибиотикограммы. Все биологические пробы должны поступить в лабораторию до начала лечения. Методы выявления возбудителей инфекции подразделяются на прямые и непрямые. · Прямые: прямое микроскопическое исследование нативных препаратов (мазков - отпечатков): электронная микроскопия: культуральное исследование. · Непрямые: иммуноферментное исследование: хромотография: серологические тесты.

2. Выбор оптимального препарата с учетом: а) фармакокенетики и фармакодинамики препарата: б) особенностей макроорганизма Необходимо учитывать фармакокинетический аспект: способность препарта достичь очага инфекции и создать эффективный уровень концентрации. Необходимо знать способность проникновения препарата через тканевые барьеры, выходить в брюшную полость и полость плевры, накапливаться в костной или мышечной ткани, подкожно-жировой клетчатке.

В ряде случаев для достижения эффективного уровня активности препарата в очагах микробного воспаления необходимо использовать нетрадиционные пути введения: эндолимфатическое введение, введение препарата с клеточной взвесью во время плазмафереза, либо новые лекарственные формы химиотерапевтических препаратов – липосомальные формы или антибиотики, ассоциированные с наночастицами

Для выбора препарата с учетом фармакодинамики необходимо знать спектр действия антибиотика и выбирать препарат с учетом предполагаемого возбудителя. 3. Введение оптимальных доз препарата с оптимальной частотой. Средняя терапевтическая концентрация (СТК), как правило, в 2 -5 раз должна превышать минимально подавляющую концетрацию (МПК). МПК – это та концентрация антибиотика, которая in vitro подавляет рост выделенного штамма возбудителя. МПК должна быть в пределах 0, 0 Х – 0, 00 Х мкг/л и ниже. СТК зависит от вида возбудителя, его локализации, тяжести заболевания.

Поддержание СТК на определенном уровне обеспечивается кратностью введения антибиотика в течение суток с учетом периода полувыведения. Путь введения определяется биодоступностью антибиотика, тяжестью заболевания, локализацией патологического процесса. Для большинства противобактериальных препаратов эффект зависит от уровня концентрации и времени поддерживания стабильной концентрации в крови. Уровень препарата в крови не должен существенно колебаться в течении суток.

Поддержание СТК на определенном уровне обеспечивается кратностью введения антибиотика в течение суток с учетом периода полувыведения. Для ряда препаратов (аминогликозидов) существует постантибиотический период. Их эффект зависит не от уровня стабильной концентрации, а пиковой. Поэтому суточную дозу нужно вводить в один прием, что повышает терапевтический эффект и снижает нефротоксичность.

4. Устранение причин, препятствующих эффективной антибиотикотерапии (дренирование локального очага инфекции, удаление инородного тела). 5. Продолжительность лечения до достижения очевидного выздоровления, и еще 3 суток во избежание рецидива инфекции. 6. Проведение фармакокинетического мониторинга за уровнем концентрации препарата в крови или в очаге микробного воспаления, что позволяет проводить коррекцию схем лечения, увеличить эффект и снизить вероятность побочных эффектов.

Это особенно важно в условиях нарушения распределения антибиотиков в организме, например при почечной или печеночной недостаточности. 7. Проведение микробиологического контроля за излечением (ранний контроль – 3 -4 день антибиотикотерапии; поздний контроль – на 3 -7 день окончания антибактериальной терапии). 8. Антибиотикотерапию проводить предпочтительно одним препаратом (монотерапия).

Основные группы антибиотиков · пенициллин (натриевая и калиевая соль бензилпенициллина), полусинтетические: оксациллин, метициллин, ампициллин, амоксициллин, пролонгированные: бициллин, бициллин-3, бициллин-5, комбинированные: ампиокс (ампициллин + оксациллин), аугментин (амоксициллин + калиевая соль клавулоновой кислоты), уназин (ампициллин + сульбактам). Клавулонат калия и сульбактам - ингибиторы пенициллиназы, вырабатываемой микроорганизмами.

Стрептомицииы (подавляют функцию рибосом МО, широкий спектр, ото-, нефро-, гепатотоксичны, угнетают гемопоэз): стрептомицин. Тетрациклииы (подавляют функцию рибосом МО, широкий спектр): тетрациклин · полусинтетические: метациклин, доксициклин. Макролиды (нарушают синтез белка в МО, гепатотоксичны, возможно нарушение функции ЖКТ):

эритромицин, олеандомицин, рокситромицин, азитромицин, кларитромицин. Амииогликозиды (нарушают синтез клеточной стенки МО, широкий спектр, ото- и нефротоксичны): · канамицин, гентамицин, тобрамицин, сизомицин, полусинтетические: амикацин, нетромицин. Левомицетины (нарушают синтез белка в МО, широкий спектр, угнетают гемопоэз): левомицетин. Рифампицины (нарушают синтез белка в МО, широкий спектр, вызывают гиперкоагуляцию, гепатотоксичны): рифампицин.

Противогрибковые антибиотики: · леворин, нистатин. Полимиксин В (воздействует на грам-отрицательные МО, в том числе на палочку сине-зеленого гноя). Линкозамины (нарушают синтез белка в МО): · линкомицин, клиндамицин. Цефалоспорины (нарушают синтез клеточной стенки МО, широкий спектр, нефротоксичны в высоких дозах):

· 1 -е поколение: цепорин, цефалексин, цефазолин, цефамезин, кефзол. · 2 -е поколение: цефамандол, цефметазол, цефокситин, цефаклор, цефуроксим, цефотетан. · 3 -е поколение: цефтриаксон, цефотаксим, цефиксим, цефтибутен, цефпирамид, цефтазидим. · 4 -е поколение: цефпиром (кейтен).

Фторхинолоны (подавляют ДНК-гидразу МО, широкий спектр): 3 -е поколение: офлоксацин, ципрофлоксацин, 4 -е поколение: левофлоксацин, флероксацин, тосуфлоксацин. Карбопенемы (нарушают синтез клеточной стенки МО, широкий спектр): имипенем, меропенем, комбинированный: тиенам (имипенем-f целастатин натрия)

Группы антибиотиков Левомицетин эффективен в отношении многих грамотрицательных и грамположительных бактерий, риккетсий и спирохет, поэтому относится к группе антибиотиков широкого спектра действия, широко используется в инфекционной практике, а в лечении больных брюшным тифом остается препаратом выбора.

Тетрациклины (тетрациклин, окситетрациклин, доксациклина гидрохлорид, или вибрамицин, метациклина гидрохлорид, или рондомицин) и рифампицин также обладают широким антибактериальным спектром действия, подавляют рост большинства грамположительных и грамотрицательных бактерий, риккетсий, хламидий.

Аминогликозиды — антибиотики неомициновой группы (неомицина сульфат, мономицин, канамицин, гентамицина сульфат) – действуют на большинство грамположительных и грамотрицательных бактерий; они активны в отношении микроорганизмов, устойчивых к пенициллину, левомицетину, тетрациклинам.

Антибиотики-макролиды (эритромицин, олеандомицина фосфат) эффективны в отношении большой группы бактерий, но преимущественно грамположительных. Их применение ограничено главным образом тяжелыми формами заболевания; в первую очередь их назначают больным стафилококковыми инфекциями. С этой же целью используют и другие антибиотики (цепорин, кефзол, ристомицин). Полимиксины оказывают губительное действие на грамотрицательные бактерии (шигеллы, сальмонеллы, эшерихии, синегнойная палочка).

Широкое применение в клинической практике находят антибиотики и других групп, в частности линкомицина гидрохлорид. Он активен главным образом в отношении грамположительных кокков, микоплазм и, следовательно, особенно показан для терапии осложненного гриппа, пневмоний, рожи, гнойных поражений костной и мышечной тканей, Фузидин-натрий обладает узким спектром действия (стафилококки, менингококк, гонококк); полимиксина В сульфат (аэроспорин) используется почти исключительно при инфекциях, вызванных синегнойной палочкой.

Противогрибковые антибиотики и другие препараты для лечения грибковых заболеваний (нистатин, леворин, монистат, клотримазол, микосептин, микозолон, нитрофунгин и др. ) эффективны в отношении многих грибов – возбудителей микозов. Некоторые из них применяются не только с целью лечения, но и для профилактики кандидозов у иммуноскомпрометированных лиц и у больных, получивших длительные курсы массивной антибиотикотерапии с использованием препаратов широкого спектра действия.

В последние годы на смену многим традиционным, природным антибиотикам приходят препараты третьего и четвертого поколений, представленные главным образом полусинтетическими пенициллинами, такими как: ампициллин, оксациллин, амоксициллин, тикарциллин, циклоциллин, карбенициллин),

цефалоспоринами (цефалотин, цефалоридин), аминогликозидами (амикацин, нетилмецин, дибекацин, тобрамицин), тетрациклинами (метациклин, доксициклин, моноциклин), рифампицинами (рифампицин, рифадин). По сравнению с природными антибиотиками они обладают многими преимуществами: кислотно– и ферментоустойчивостью, расширенным спектром действия, улучшенным распределением в тканях и жидкостях организма, измененным механизмом действия на бактериальную клетку, меньшим числом побочных эффектов.

Для воздействия на возбудителя болезни наряду с антибиотиками используют и другие химиотерапевтические препараты. Высокой антимикробной активностью обладают производные нитрофурана (фуразолидон, фурадонин, фурагин, фурацилин и др. ). Они эффективны в отношении многих грамотрицательных и грамположительных бактерий, в том числе резистентных к антибиотикам и сульфаниламидным препаратам, а также некоторых простейших (трихомонады, лямблии).

В последние годы широкое распространение получили препараты широкого спектра действия – производные хинолона (офлоксацин, или таривид, ципрофлоксацин, или ципробай, ципрофлюксазин и др. ). Они остаются препаратами резерва и применяются при особо тяжелых формах инфекций, вызванных кишечными бактериями, а также хламидиями, микоплазмами.

Сульфаниламидные препараты Не утратили своего значения и сульфаниламидные препараты. Отмечаемое в последнее время снижение интереса к ним со стороны практических врачей надо признать неоправданным.

При лечении больных с острыми кишечными инфекциями можно с успехом использовать препараты, отличающиеся медленным всасыванием из кишечника (сульгин, фталазол), что позволяет поддерживать их высокую концентрацию в кишечнике при пероральном применении. Терапевтический интерес представляют сульфаниламидные препараты пролонгированного действия (сульфапиридазин, сульфадиметоксин, или мадрибон), применяемые самостоятельно и в сочетании с салициловой кислотой (салазосульфапиридин) и триметопримом (бактрим, или бисептол, сульфатен, гросептол).

Эти препараты используют для лечения широкого круга заболеваний, вызываемых грамположительными и грамотрицательными бактериями – от ангин и пневмоний до кишечных инфекций. К побочным явлениям, вызываемым сульфаниламидами, относятся раздражающее действие на слизистую оболочку желудка, образование камней в мочевыводящей системе и др.

Обильное щелочное питье отчасти предотвращает эти побочные эффекты, особенно нарушение функции почек. Комбинированное использование различных антибактериальных препаратов нередко ведет к повышению терапевтической эффективности. Однако следует учитывать возможность не только синергизма, но и антагонизма комбинируемых средств, а также кумуляцию побочных эффектов каждого из компонентов сочетания (подавление нормальной микрофлоры, нарастание риска вторичной инфекции, увеличение частоты и тяжести побочных реакций).

Весьма широк спектр противопаразитарных (противопротозойных) средств: § противомалярийные – хингамин, § хлоридин, § хинин, § примахин; § противотрихомонадные, § противоамебные – метронидазол, § тинидазол, § эметина гидрохлорид и др.

Из этого ряда (далеко не полного) следует выделить производные нитроимидазолов: § метронидазол (трихопол, клион, флагил), § тинидазол (фасижин) и т. д. , которые обладают одновременно определенной антибактериальной активностью, в том числе в отношении анаэробных бактерий. Применяющиеся в клинической практике противовирусные препараты оказывают избирательное действие на ограниченное число видов вирусов; в большинстве случаев их эффективность недостаточно высока.

Химиотерапия играет в большинстве случаев решающую роль в общем комплексе лечебно -профилактических мероприятий в инфекционной практике. Нельзя не согласиться с тем, что достигнутые успехи в борьбе с массовыми инфекционными болезнями были во многом связаны с использованием химиотерапевтических препаратов, в частности антибиотиков.

Именно благодаря их применению стали возможными случаи выздоровления больных легочной чумой, резко снизилась летальность при таких заболеваниях, как брюшной тиф, сыпной тиф, менингококковая инфекция и др. Число известных химиотерапевтических средств, включая антибиотики, нарастает с каждым годом. Описано более 2000 антибиотиков, у 200 из них детально изучен механизм действия. В повседневной практике врачи общей практики и врачи стационаров применяют не более 50 препаратов с антибактериальным действием.

Уросептики и препараты от мочевых инфекций Инфекция мочевых путей - весьма частая патология. И не только в структуре нефроурологических заболеваний, а в структуре всей заболеваемости в целом. Антибактериальные препараты, предназначенные для борьбы с мочевой инфекцией, называются уросептиками. Они должны отвечать определенным требованиям. Во-первых, эти лекарства должны выделяться преимущественно почками и выводиться с мочой.

С этой точки зрения подходящими могут быть почти все существующие антибиотики, так как все равно значительная их часть фильтруется почками и проходит через мочевыделительную систему. Но есть и второе условие - эти препараты должны сохранить к моменту выведения свою антибактериальную активность, то есть метаболизм их в организме должен быть минимальным. И вот это условие уже серьезно сокращает количество антибактериальных средств, претендующих на звание уросептиков. Многие годы наиболее часто и традиционно применяемыми уросептиками были лекарственные средства из трех групп: нитрофураны, оксихинолины и хинолоны. Значение их велико и сегодня.

Нитрофураны Наиболее известны из этой группы фурадонин (нитрофурантоин), фурагин (фуразидин), эрцефурил, фурацилин и фуразолидон. Но эффективными уросептиками являются лишь фурадонин и фурагин. Они в крайне малом количестве накапливаются в крови и тканях, зато в исключительно высокой концентрации и в активном состоянии накапливаются в моче.

Что касается других нитрофуранов, то эрцефурил практически не всасывается из кишки и в мочу не попадает (используется при кишечных инфекциях), фурацилин применяется наружно, а фуразолидон подвержен значительному метаболизму, так что в активном состоянии в моче его не более 5% от принятой дозы. Не только пациенты, но даже многие медики стали относиться к фурадонину и фурагину весьма скептически: дескать, препараты старые, есть новые и помощнее. Но это не так. Антибактериальный спектр у нитрофуранов широк и включает почти всех известных виновников мочевой инфекции.

Оксихинолины Из множества представителей этой группы (энтеросептол, интвстопан, хинозол и т. д. ) уросептиком стал лишь один - нитроксолин. Известен он под названиями 5 -НОК, нибиол, никопет. Он остается и на сегодня одним из важнейших уросептиков, обладает широким антимикробным спектром (и противогрибковым в том числе), быстро всасывается в кишечном тракте и в высокой концентрации оказывается в моче. Устойчивость к препарату развивается редко.

Хинолоны и фторхинолоны Третья группа уросептиков - хинолоны. Здесь следует выделить хинолоны первого поколения - налидиксовая кислота (неграм, невиграмон) и пипемидовая кислота (папин, пимидель), и хинолоны второго поколения (фторхинолоны) - норфлоксацин (нолицин).

Ко второму поколению относятся и другие фторхинолоны - офлоксацин, ломефлоксацин, ципрофлоксацин, а есть еще и третье поколение (левофлоксацин, спарфлоксацин) и даже четвертое (моксифлоксацин), но уросептиком стал лишь нолицин. Это связано с тем, что в тканях и крови он накапливается мало, зато в высокой концентрации накапливается в моче.

Все другие фторхинолоны имеют обратное свойство. И еще один немаловажный момент - это быстрый период полувыведения, который составляет у норфлоксацина 3 -4 часа, а вот у остальных фторхинолонов в лучшем случае -12 -14, а то и 18 -20 часов. На сегодняшний день нолицин (норфлоксацин) можно считать препаратом выбора при любой мочевой инфекции.

Кроме высокой концентрации в моче и низкой способности к метаболизму есть и еще один важный момент, касающийся любых антибиотиков, а не только уросептиков: это индивидуальная чувствительность микрофлоры. Пока что мы говорили о традиционных уросептиках и эмпирической терапии. Но если проводился посев мочи на микрофлору и чувствительность ее к антибиотикам, то результаты этого анализа должны быть положены в основу терапии, даже если другие параметры лекарственного средства (например, концентрация в моче) оставляют желать лучшего.

ANTIBIOTIKI.pptx