18-Антибиотики.ppt
- Количество слайдов: 24

Антибиотики Специфические продукты обмена (вторичные метаболиты) либо их химические модификации Синтезируются разными организмами (чаще – грибами и актиномицетами) Обладают высокой физиологической активностью по отношению к м-мам или злокачественным опухолям (1 -100 мкг/мл) Характеризуются специфичностью действия по отношению к организмам и клеточным мишеням (большинство направлено против бактерий) Различаются химической структурой, типу воздействия, мишенями, активностью, продуцентами.

Ваксман З. А. Американский микробиолог и биохимик, родился в России. Выделил и очистил актиномицин (1940), стрептотрицин (1942), открыл стрептомицин (1944), неомицин (1948) и др. АБ. Лауреат Нобелевской премии по физиологии и медицине (1952).
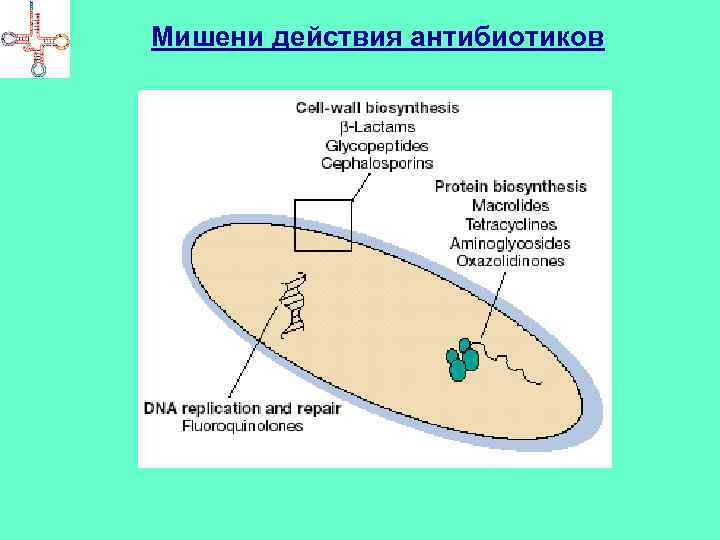
Мишени действия антибиотиков

Ингибиторы синтеза КС Пенициллины, цефалоспорины, нокардицин А, сульфазецин и др. Имеют в составе молекулы -лактамное кольцо Мишень – бактериальный фермент – гликопептидтранспептидаза (формирование сшивок в муреине) Бацитрацин А – связывает в комплекс с ионами Ме молекулу фосфорилированного липидного переносчика → не происходит дефосфорилирование → не синтезируется муреин Циклосерин – подавляет активность аланинрацемазы и Dаланинсинтетазы → не синтезируется муреин Ванкомицин (гликопептид) – связывается с концевыми D-ala → препятствует транспептидированию
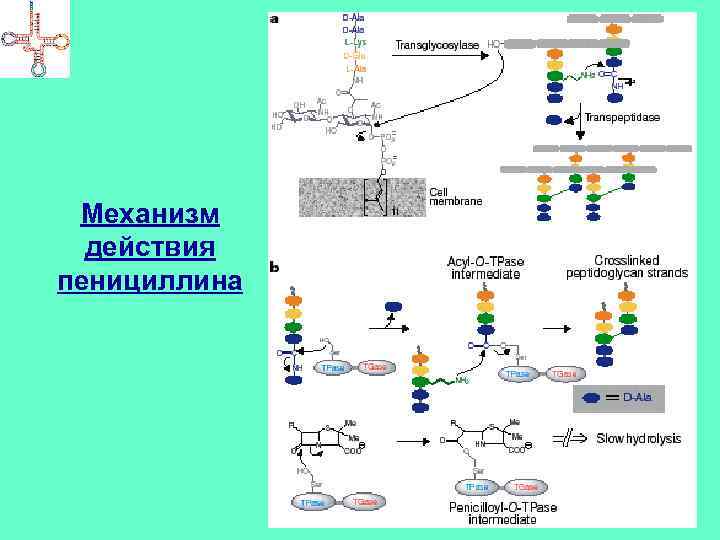
Механизм действия пенициллина
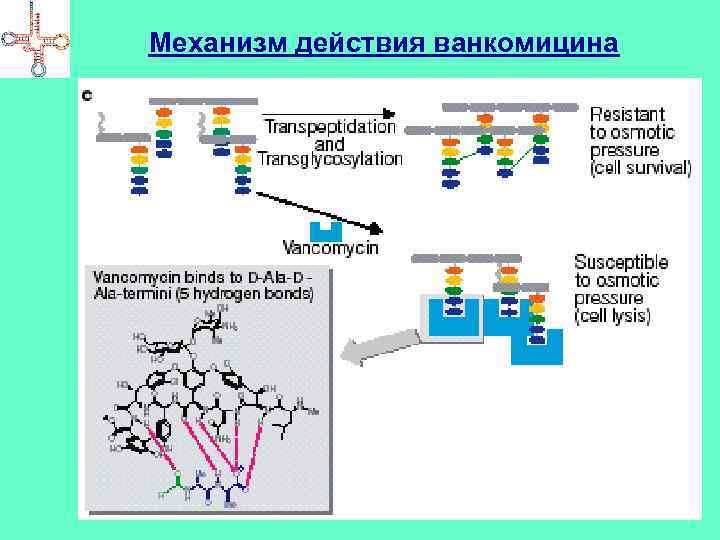
Механизм действия ванкомицина

Мембрано-активные антибиотики • Полипептидные (полимиксины), полиеновые (амфотерицин В, нистатин, леворин, трихомицин) АБ, ионофоры. • Мишень – плазматическая мембрана. Полимиксины – связываются с фосфатами кислых липидов в бислое → нарушается проницаемость ПМ; активируют фосфолипазы наружной мембраны → разрушение липидного бислоя. Полиеновые АБ – связываются со стеролами в мембранах грибов → в ПМ образуются поры → нарушается проницаемость. Ионофоры (низкомолекулярные в-ва пептидной природы) – транспортируют ионы через ПМ → нарушают ионный градиент на ПМ → нарушают связанные с ионным градиентом процессы

Ингибиторы трансляции • Тетрациклины, аминогликозидные АБ ( Sm, Km, Nm, Gm), хлорамфеникол, макролидные АБ (эритромицин, тилозин и др. ). • Способны связываться с рибосомами ( чаще – 70 S), блокируя трансляцию. Тетрациклины – препятствуют взаимодействию с рибосомами аминоацилтранспортных РНК. Стрептомицин – ингибирует инициацию трансляции. Хлорамфеникол – ингибирует активность пептидилтрансферазы. Эритромицины – нарушают процесс транслокации рибосомы. Пуромицин (структурно сходен с А-ветвью т. РНК) – связывается с А -участком рибосом, после пептидилтрансферазной реакции комплекс отщепляется от рибосомы (т. к. нет кодонантикодонового взаимодействия)
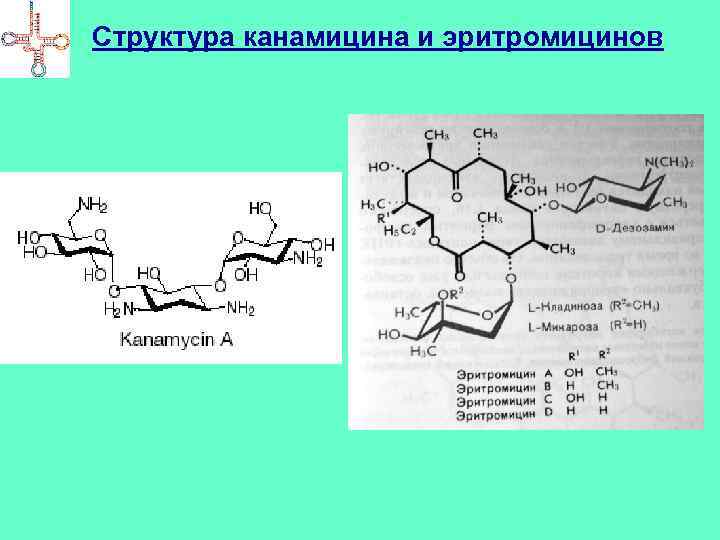
Структура канамицина и эритромицинов
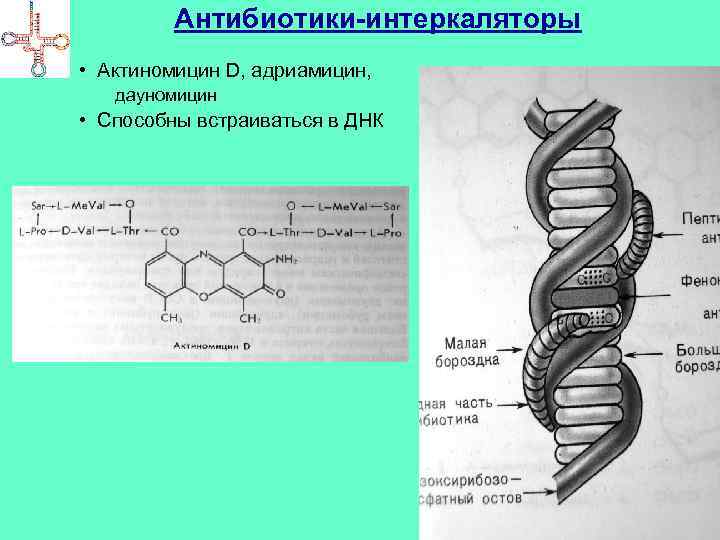
Антибиотики-интеркаляторы • Актиномицин D, адриамицин, дауномицин • Способны встраиваться в ДНК

ДНК-тропные антибиотики • Митомицины, порфиромицин • модифицируют пуриновые АО, формируют поперечные сшивки между цепями ДНК → подавляется репликация, возникают ошибки репликации, имеют место разрывы ДНК • Блеомицины вызывают одно- и двухнитевые разрывы в ДНК

Ингибиторы транскрипции • Интеркаляторы, рифамицины прочно связываются с ДНК-зависимыми РНК-полимеразами ( -субъединицей минифермента) прокариот → нарушается процесс транскрипции

Ингибиторы ферментативных процессов • Пенициллины, цефалоспорины, циклосерин, хлорамфеникол и др. • Антимицин – подавляет процесс транспорта электронов между цитохромами в дыхательной цепи • Олигомицин – связывается с ферментами, сопрягающими окисление субстратов с фосфорилированием • Новобиоцин – ингибитор ДНК-гиразы (нарушает репликацию ДНК) • Актиномицин А – ингибирует цитохром С-редуктазу
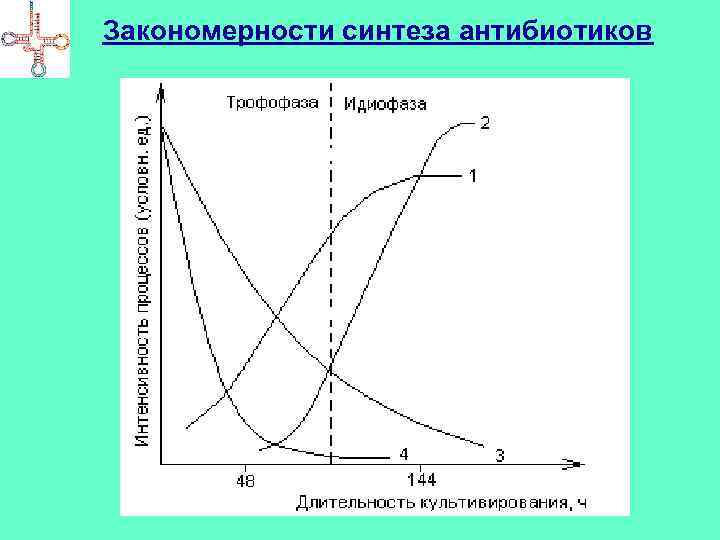
Закономерности синтеза антибиотиков

АБ-продуктивность • АБ-продуктивность организма: количество АБ (мкг или единиц), образованное единицей массы (обычно 1 мг) сухих клеток продуцента в единицу времени (обычно за 1 час) зависит от вида м-ма, фазы роста, состава среды, условий • Активность АБ выражается в единицах (ЕД) минимальное количество чистого в-ва АБ, способное подавить развитие определенного числа клеток тест-м-ма в единице объема КЖ 1 ЕД Sm – 1 мкг чистого основания вещества (тест-микроб – E. coli); 1 ЕД Pn 0, 6 мкг натриевой соли бензилпенициллина (тест-микроб – S. aureus)

Механизмы устойчивости к антибиотикам • Превращение активных форм АБ в неактивные под действием специфических ферментов • Модификация чувствительной к данному АБ мишени • Снижение проницаемости мембран и КС к АБ • Использование альтернативного фермента или метаболического пути взамен инактивированного • Увеличение содержание фермента, подверженного ингибированию антибиотиком • Повышение концентрации метаболита, способного противодействовать АБ • Снижение потребности в продукте, образование которого находится под контролем АБ
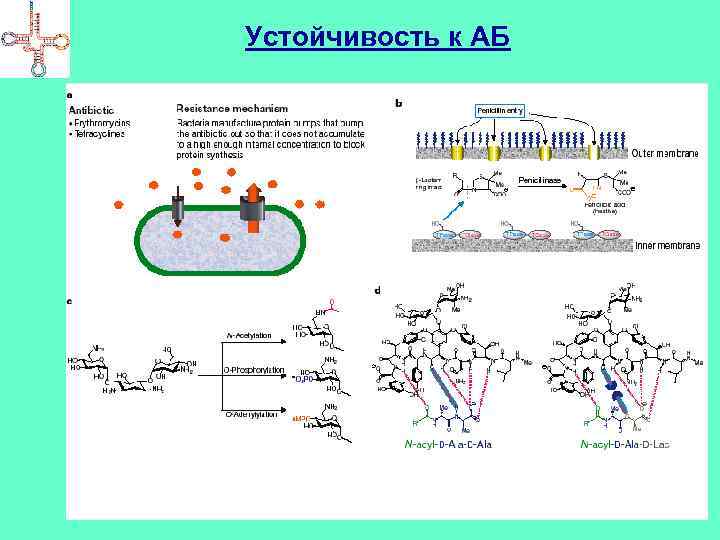
Устойчивость к АБ
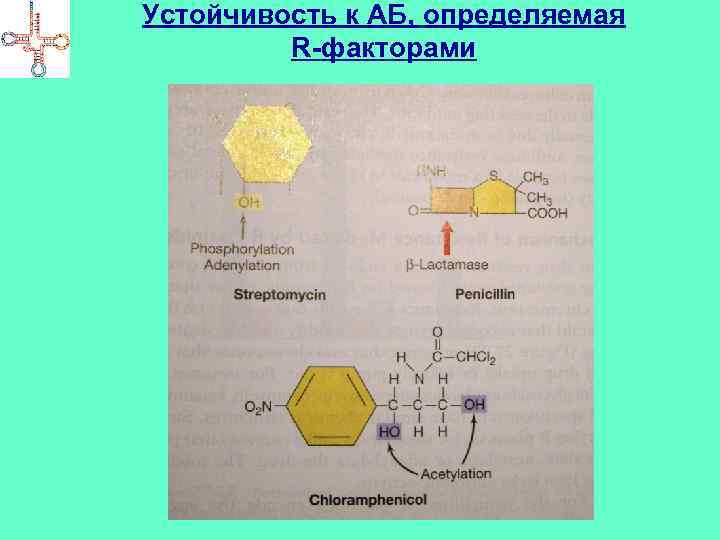
Устойчивость к АБ, определяемая R-факторами

Появление патогенов человека - отдельные штаммы вида устойчивы ко всем известным АБ

Получение аналогов АБ Самый продуктивный подход – поиск аналогов АБ Осуществляется с использованием «комбинаторной химии» Автоматизированный метод химического синтеза, предполагающий систематизированные замены нескольких радикалов в базовой молекуле При использовании только 5 -ти реагентов удалось произвести замены для 4 -х групп Tc. Получено 5 5 = 625 производных Tc за несколько часов
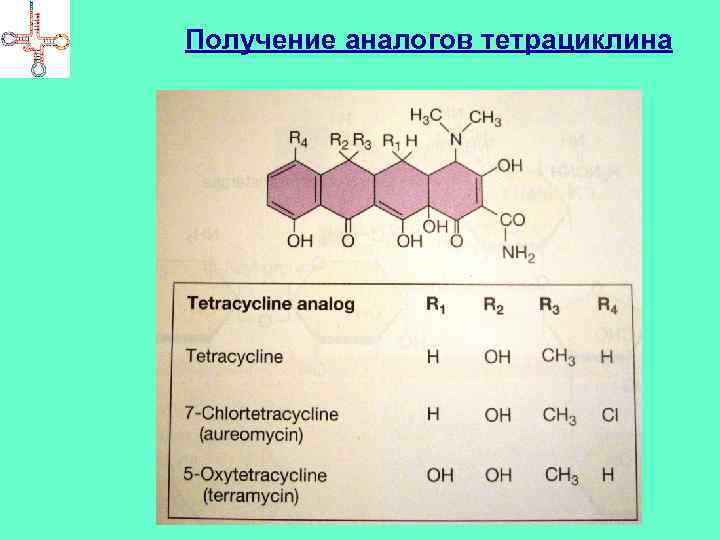
Получение аналогов тетрациклина

Разработка лекарств В настоящее время методом «комбинаторной химии» создано ~ 7 млн. соединений – кандидатов в лекарственные препараты q Их исследуют в лабораторных тестах по степени активности к патогенным микроорганизмам q Активные препараты исследуют на лаб. животных (активность, токсичность, безопасность), испытания длятся сериями несколько лет (статистика) q Активные препараты испытывают в клиниках тоже несколько лет для определения эффективности, побочных явлений, безопасности Ежегодно на исследование новых препаратов фарминдустрия расходует до $4 млр.

Разработка лекарств Чтобы найти и разработать фарм-препарат обычно требуется 10 -25 лет Поиск и разработка одного фарм-препарата обходится в среднем в $500 млн Новый, более дешевый, подход – компьютерный дизайн препаратов: Знание трехмерной структуры субстрат-ферментного комплекса протеазы, кодируемой ВИЧ, позволило сконструировать аналог субстрата протеазы (препарат саквинавир), который связывается с ее активным центром и ингибирует белок-предшественник ВИЧ не образуется

Ключевые вопросы 1. 2. 3. 4. 5. 6. 7. 8. Назовите отличительные особенности антибиотиков. Чем антибиотики отличаются от бактериоцинов, ферментов, токсинов, ядов, строительных блоков, витаминов, антисептиков, химиотерапевтических препаратов? Назовите клеточные мишени для антибиотиков, приведите примеры соответствующих антибиотиков. Каковы механизмы действия разных антибиотиков? Каковы механизмы устойчивости микроорганизмов к антибиотикам? Благодаря чему распространяются в окружающей среде антибиотикорезистентные микроорганизмы? Как возникает множественная резистентность к антибиотикам? Что понимают под активностью антибиотиков, как ее выражают? В чем состоят закономерности биосинтеза антибиотиков и чем определяется антибиотическая продуктивность организма? Кем и зачем синтезируются антибиотики?
18-Антибиотики.ppt