Антибиот.3 2013.ppt
- Количество слайдов: 49

АНТИБИОТИКИ Лекция 6, 2013 Лекарственный препарат Карбенициллина динатриевая соль полусинтетический пенициллин. Карбенициллин представляет собой белый порошок, легко растворимый в воде, медленно растворяется в спирте. По НД подлинность карбенициллина устанавливают по реакции на ионы натрия и по ИК спектру, который должен совпадать с ИК спектром стандартного образца. Удельное вращение карбенициллина должно быть в пределах от +182 до +1960 (1% водный раствор). Карбенициллин даёт и другие реакции, характерные для пенициллинов.
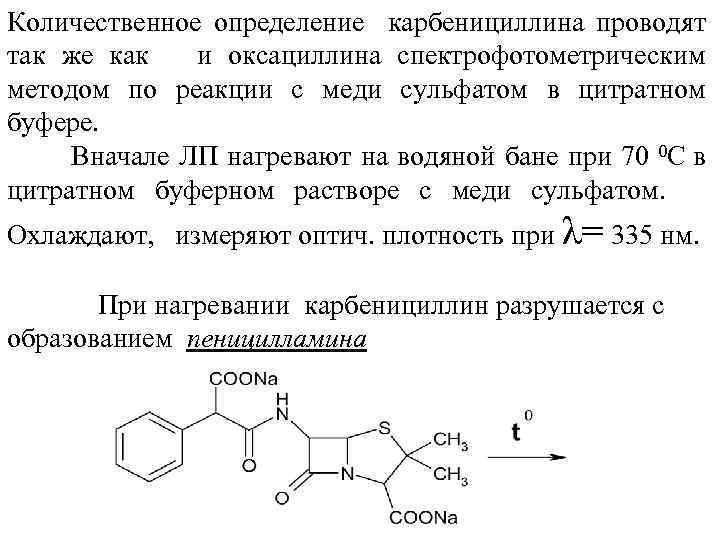
Количественное определение карбенициллина проводят так же как и оксациллина спектрофотометрическим методом по реакции с меди сульфатом в цитратном буфере. Вначале ЛП нагревают на водяной бане при 70 0 С в цитратном буферном растворе с меди сульфатом. Охлаждают, измеряют оптич. плотность при λ= 335 нм. При нагревании карбенициллин разрушается с образованием пеницилламина
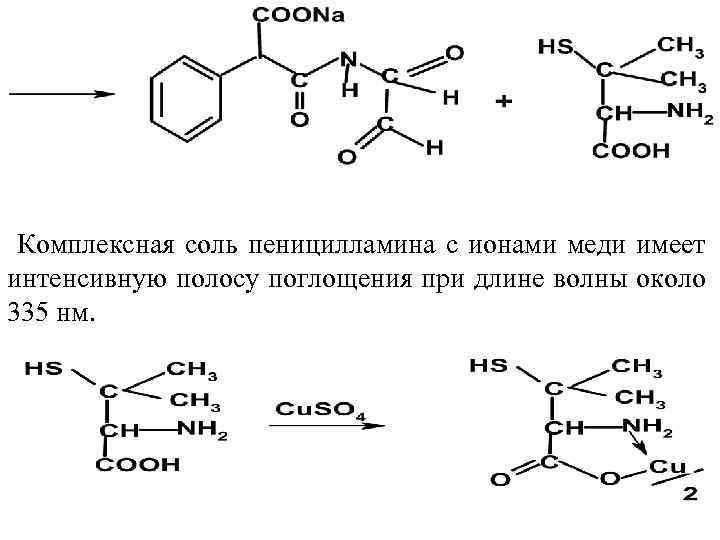
Комплексная соль пеницилламина с ионами меди имеет интенсивную полосу поглощения при длине волны около 335 нм.

Карбенициллин обладает широким спектром антимикробной активнoсти в отношении грамотрицатель ных и грамположительных микроорганизмов, активен в отношении синегнойной палочки. Неустойчив по отношению к кислотам и пенициллиназе. Все карбоксипенициллины, в том числе и карбеницил лин, разрушаются под действием β лактамаз и постепенно теряют своё значение. Применяют внутримышечно до 20 30 г в сутки при инфекции мочеполовых органов, мочевыводящих и желче выводящих путей, при перитоните, абсцессе мозга, менингите и др. Дозы зависят от тяжести заболеваний. Выпускается в порошке для инъекций во флаконах по 1, 0 г.
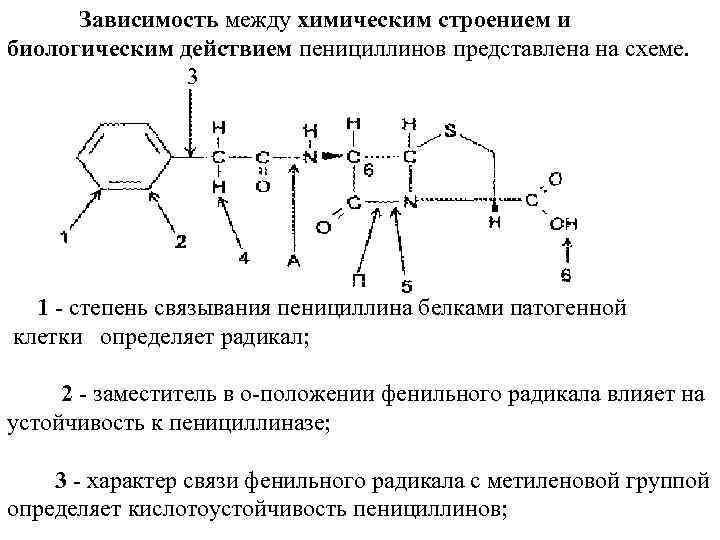
Зависимость между химическим строением и биологическим действием пенициллинов представлена на схеме. 3 1 степень связывания пенициллина белками патогенной клетки определяет радикал; 2 заместитель в о положении фенильного радикала влияет на устойчивость к пенициллиназе; 3 характер связи фенильного радикала с метиленовой группой определяет кислотоустойчивость пенициллинов;

4 заместитель атома водорода в метиленовой группе определяет спектр действия пенициллина; 5 расщепление β~лактамной связи приводит к исчезновению свойств антибиотика и появлению аллергического действия; 6 заместитель в карбоксильной группе дает возможность получения солевых форм пенициллинов; П пенициллиназа расщепляет беталактамное ядро; А амилаза расщепляет амидную связь. К антибиотикам, и в частности к пенициллинам, предъявляют высокие требования по чистоте

В НД регламентируется количество посторонних пенициллинов в каждом из препаратов (их присутствие обусловлено микробиологическим процессом получения). Так, содержание бензилпенициллина в калиевой и натриевой солях должно быть не менее 90, 0%, а сумма пенициллинов — не менее 96, 0%. Таким образом, в препаратах допускается содержание 6, 0% других пенициллинов. Содержание посторонних пенициллинов определяют методом УФ спектрофотометрии при λ=280 нм. Оптическая плотность 0, 18% р ров ЛС в кювете спектрофотометра при λ 280 нм д. б. не более 0, 18. Разность между оптическими плотностями при длине волн 263 и 280 нм не менее 0, 72.

В ампициллине натриевой соли Уф спектрофотометри чески опр ют светопоглощающие примеси (оптич. плотн водного р ра ЛП при 325 нм должна быть не более 0, 3). Значения отношений оптических плотностей феноксиметилпенициллина при двух максимумах поглощения (268 и 274 нм), обусловленными фенокси группой также используют для определения чистоты ЛП (A 268/A 274 д. б. не менее 1, 21 и не более 1, 24). По МФ III УФ спектрофотометрию используют для опр я подлинности феноксиметилпенициллина (оптич. плотн. ЛП в 0, 1 М Na. OH д. б. от 0, 56 и до 0, 60) и чистоты феноксиметилпенициллина (примесь n оксифеноксиметилпенициллина так же опр ют в р ре , 1 0 М Na. OH; при длине волны 306 нм оптич. плотн. д. б. не более 0, 36).

Определение йодсорбирующих примесей в ЛП основано на том, что сами пенициллины йодом не окисляются. Окисление йодом пенициллинов проводится только после щелочного гидролиза и добавления ацетатного буфера при p. H 4, 5. Если окисление йодом проводить в тех же условиях, но без предварительного щелочного гидролиза, то окисляться будут только возможные продукты расщепления (йодсорбирующие примеси). Методика определения йодсорбирующих примесей Точную навеску испытуемого ЛП р ют в 1/15 М р-ре фосфатного буфера (p. H 7, 0) в мерной колбе вместим. 100 мл (раствор А).

К 10 мл р ра А в конической колбе с притертой пробкой прибавляют 20 мл 0, 8 М р ра ацетатного буфера (p. H 4, 7 + 0, 05). Точно отмеривают 25 мл 0, 005 М р ра йода, калия йодид, перемешивают, оставляют на 20 мин в темном месте. Избыток йода оттитровывают 0, 01 М р ром натрия тиосульфата в присутствии крахмала (до обесцвечивания). Параллельно проводят контрольный опыт. Содержание йодсорбирующих примесей в процентах (X), в пересчете на сухое вещество, вычисляют но формуле обратного титрования с учётом контрольного

Все препараты пенициллина испытываются на токсичность биологическим методом. Возможность наличия токсичных примесей обусловлена методом получения пенициллинов: 1)микробиологический синтез природных пенициллинов; 2) микробиологический синтез 6 АПК; 3) ферментативный гидролиз бензилпенициллина амилазой для получения 6 АПК — исходного вещества для полусинтетических пенициллинов. Препараты пенициллина введения испытываются стерильность. для парентерального на пирогенность и

Все пенициллины в щелочной среде гидролизуются, а в кислой гидролизуются и подвергаются изомеризации с потерей активности. В препаратах пенициллина регламентируется содержание воды. Определение проводится различными способами: 1. путем высушивания (феноксиметилпенициллин); в сушильном шкафу 2. для некоторых ЛП в вакуум сушильном шкафу; 3. Титрованием по методу К. Фишера. Допустимое содержание воды колеблется от 1 до 10%.

ЛП пенициллинов отличаются друг от друга по продолжительности действия и по эффективности при различных путях введения. Натриевую и калиевую соли бензилпенициллина вводят главным образом внутримышечно и подкожно по 200 000– 1 500 000 ЕД в сутки в 3– 6 приемов. Новокаиновая соль бензилпенициллина при внутримышечном введении обеспечивает пролонгированное действие в течение 12– 18 ч, а бензатинбензилпенициллин — 1 2 недели.

Устойчивость феноксиметилпенициллина, ампициллина, оксациллина и амоксициллина в кислой среде желудочного сока позволяет применять их перорально. Феноксиметилпенициллин назначают внутрь по 0, 2 г, Ампициллин — по 0, 25– 0, 5 г 4– 6 раз в сутки, Амоксициллин по 0, 5 1, 0 г 3 раза в сутки. Оксациллина натриевую соль вводят внутрь по 0, 25– 0, 5 г (суточная доза 3, 0 г) или внутримышечно до 2, 0– 4, 0 г в сутки. Карбенициллина динатриевую соль вводят внутримышечно по 4, 0– 8, 0 г, а внутривенно (капельно) до 20– 30 г в сутки.

Побочные разнообразны: эффекты антибиотиков весьма наиболее часто наблюдаемая побочная реакция диарея, связанная с антимикробной терапией (от легких до очень тяжелых случаев); антибиотики могут нарушать всасывание витаминов, поступающих с пищей, подавлять рост микроорганизмов, синтезирующих витамины в кишечнике человека (развивать дисбактериоз); назначение антибиотиков широкого спектра действия, особенно перорально, может привести к развитию кандидоза или инфекций, вызванных грамотрицательными бактериями;

часто у больных развивается аллергия и гиперчувствительность к антибиотикам; для антибиотиков аминогликозидов ототоксичность (гентамицин), нефротоксичность (левомицетин); характерна неблагоприятные эффекты возможны со стороны печени, почек, органов кроветворения, слуха, вестибулярного аппарата и другие.
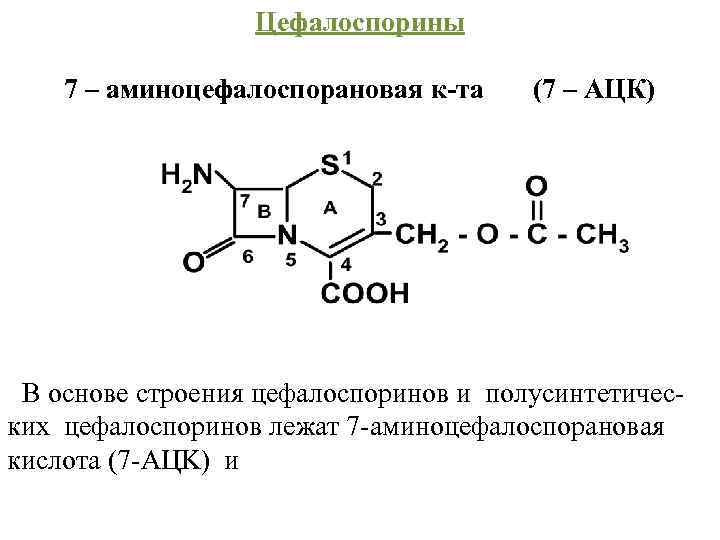
Цефалоспорины 7 – аминоцефалоспорановая к-та (7 – АЦК) В основе строения цефалоспоринов и полусинтетичес ких цефалоспоринов лежат 7 аминоцефалоспорановая кислота (7 AЦK) и
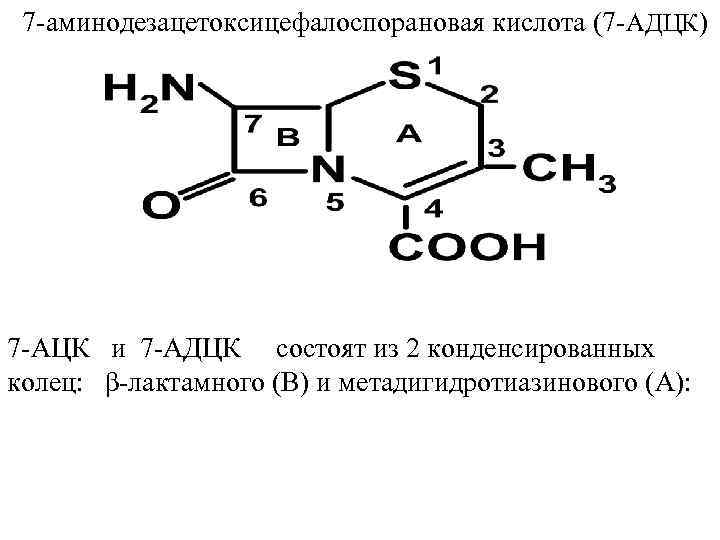
7 аминодезацетоксицефалоспорановая кислота (7 АДЦК) 7 АЦК и 7 АДЦК состоят из 2 конденсированных колец: β лактамного (В) и метадигидротиазинового (А):

Цефалоспорины являются ацильными производными 7 АЦК или 7 АДЦК. Первые сведения о цефалоспоринах относятся к 1945 г Итальянский микробиолог Brotzu при исследовании флоры морской воды близ берегов Сардинии обнаружил микроорганизмы с выраженной антибактериальной активностью. Развиваясь в питательной среде, эти организмы продуцируют вещество, ингибирующее развитие многих бактерий. В 1948 г, было установлено, что изолированная Brotzu культура продуцирует 7 различных антибиотиков, одним из которых является цефалоспорин С.
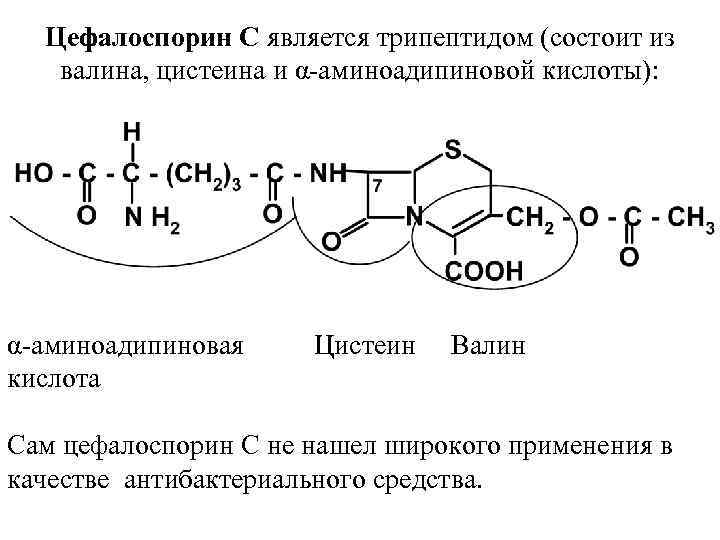
Цефалоспорин С является трипептидом (состоит из валина, цистеина и α аминоадипиновой кислоты): α аминоадипиновая Цистеин Валин кислота Сам цефалоспорин С нe нашел широкого применения в качестве антибактериального средства.
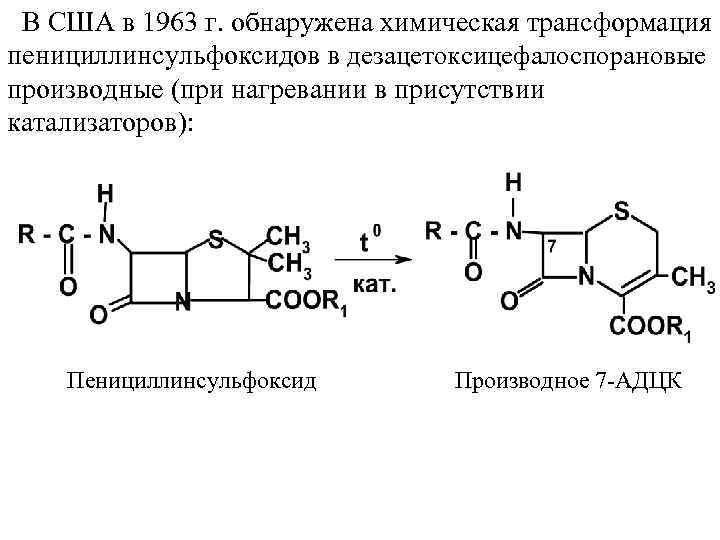
В США в 1963 г. обнаружена химическая трансформация пенициллинсульфоксидов в дезацетоксицефалоспорановые производные (при нагревании в присутствии катализаторов): Пенициллинсульфоксид Производное 7 АДЦК

Рентгеноструктурный анализ позволил установить идентичность пространственной структуры β-лактамных колец в пенициллинах и цефалоспоринах, а также геометрии конденсированных циклических систем. Кроме того, микробиологическая активность отдельных цефалоспориновых антибиотиков, полученных путем химической модификации природной молекулы, определяется типом дополнительно введенных заместителей.

Структура ядра цефалоспорина С сходна с таковой пенициллинов. Как оказалось, биогенез ядер этих типов антибиотиков идентичен. Единственное исключение составляет способ замыкания серосодержащего кольца. У цефалоспорина С атом углерода, соответствующий одной из 2 х метильных групп у С 2 молекулы пенициллина, входит в состав шестичленного дигидротиазинового кольца. Однако его можно подвергнуть тем же модификациям, что и пенициллин.

В медицинскую практику цефалоспорины стали входить в начале 60 х годов и уже в 1990 е годы занимали ведущее место на мировом фармацевтическом рынке. В настоящее время в зависимости от особенностей антимикробного спектра выделяют 5 групп цефалоспо ринов, которые по хронологии их создания называют поколениями. Цефалоспорины I поколения (Цефалоспорины I) обладают преимущесмтвенной активностью в отношении грамм положительных стафилококков и стрептококков. Грам отрицательные бактерии устойчивы к цефалоспоринам I, за исключением Eschericiha coli и Proteus mirabilis.

Цефалоспорины II обладают сходной активностью с цефалоспоринами I по отношению к грамм положитель ным коккам, но превосходят их по действию на грамм отрицательные бактерии. Цефалоспорины III проявляют выраженную активность в отношении грамм отрицательных бактерий. Цефалоспорины IY показывают высокую активность в отношении грамм отрицательных бактерий и обладают более высокой активностью в отношении грамм положи тельных бактерий по сравнению с цефалоспоринами III. К цефалоспоринам Y относят в настоящее время пока один препарат цефтобипрол. В отличие от других цефалоспоринов он проявляет активность в отношении метициллинрезистентного золотистого стафилококка.
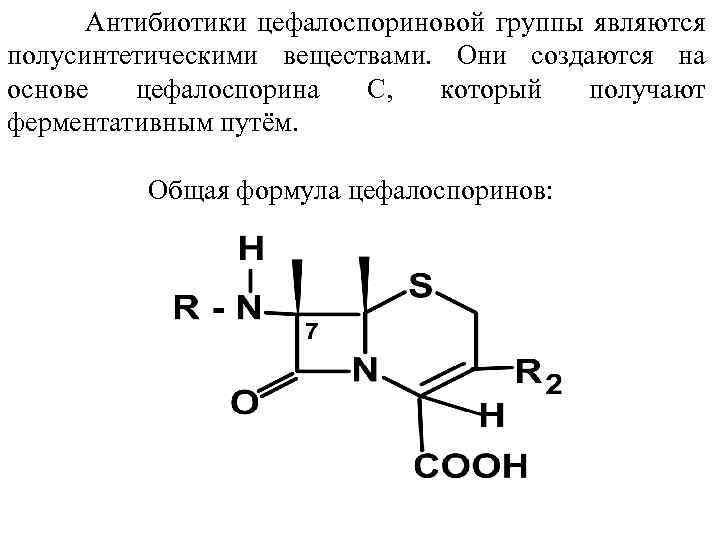
Антибиотики цефалоспориновой группы являются полусинтетическими веществами. Они создаются на основе цефалоспорина С, который получают ферментативным путём. Общая формула цефалоспоринов:
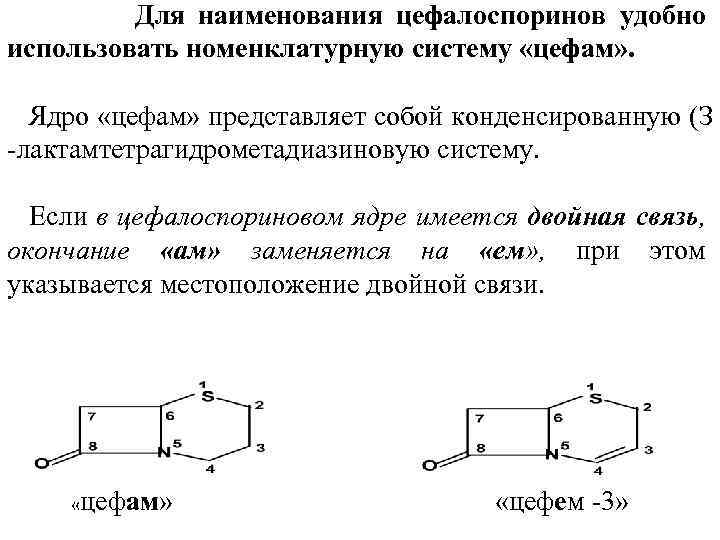
Для наименования цефалоспоринов удобно использовать номенклатурную систему «цефам» . Ядро «цефам» представляет собой конденсированную (З лактамтетрагидрометадиазиновую систему. Если в цефалоспориновом ядре имеется двойная связь, окончание «ам» заменяется на «ем» , при этом указывается местоположение двойной связи. «цефам» «цефем 3»
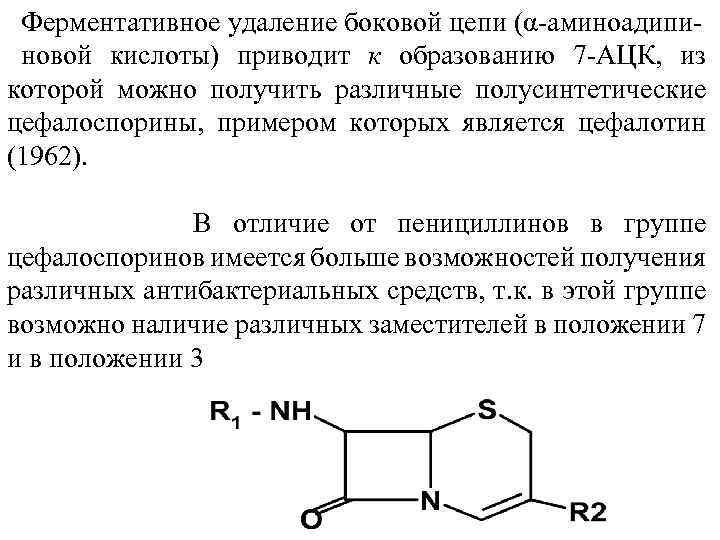
Ферментативное удаление боковой цепи (α аминоадипи новой кислоты) приводит к образованию 7 АЦК, из которой можно получить различные полусинтетические цефалоспорины, примером которых является цефалотин (1962). В отличие от пенициллинов в группе цефалоспоринов имеется больше возможностей получения различных антибактериальных средств, т. к. в этой группе возможно наличие различных заместителей в положении 7 и в положении 3

Цефалоспорины I Цефазолин Cefazolin (Цефазолина натриевая соль) Цефазолин белая лиофилизированная масса или белый порошок, легкорастворимый в воде, малорастворимый в спирте.
![Подлинность цефазолина устанавливают по реакции на ионы натрия с р ром K[Sb(OH) 6] белый Подлинность цефазолина устанавливают по реакции на ионы натрия с р ром K[Sb(OH) 6] белый](https://present5.com/presentation/186886774_230169650/image-30.jpg)
Подлинность цефазолина устанавливают по реакции на ионы натрия с р ром K[Sb(OH) 6] белый осадок. С раствором формальдегида в концентрированной серной кислоте цефазолин даёт бледно жёлтое окрашивание, которое при нагревании становится более интенсивным. Водные растворы цефалоспоринов дают в УФ области характерную полосу поглощения с максимумом при длине волны около 260 нм, что обусловлено колебанием связи при возможном участии серы ядра. УФ спектр цефазолина в водном растворе в присутствии натрия гидрокарбоната имеет максимум светопоглощения при 272 нм, в 0, 1 М растворе кислоты хлористоводородной – при 266 нм.

ИК спектр цефазолина должен иметь полосы поглощения, совпадающие с полосами поглощения спектра стандартного образца. Фефалоспорины оптически активны. Так удельное вращение цефазолина (5% водный р р) должно быть в пределах от 15 до – 240. Для идентификации цефазолина используют также метод ТСХ. Колич. опр. цефазолина проводят методом ВЭЖХ. Цефазолин применяется при инфекциях дыхательных путей, остеомиэлите, перитоните, инфекциях мочевыводящих путей и др.

Обычно назначают цефазолин в дозах по 0, 25 0, 5 г. Выпускается во флаконах по 0, 25; 0, 5; 1, 0; 2, 0 и 4, 0 г. Цефалексин Cefalexinum

Цефалексин белый или желтовато белый порошок, р рим в воде 1: 100, нер римый в спирте и эфире. химические свойства обусловлены наличием в составе молекул атома серы в дитидротиазиновом кольце (способность к окислению) и β лактамного кольца. Окисление серы проводят 80% р ром серной к ты (H 2 S 04), содержащей 1% азотной кислоты образуется желтое окрашивание. Гидроксамовая реакция на β лактамное кольцо проводится по методике для пенициллинов.

Применяется цефалексин внутрь при циститах, пиелонефрите, простатите, при инфекциях дыхательных путей, при ангине, пневмонии. Назначают цефалексин до 1 2 г в сутки. Выпускают цефалексин в капсулах по 0, 25 г, в таблетках по 0, 5 г, и в порошке для суспензий по 0, 25 г во флаконах. К цефалоспоринам I относятся также цефалоридин, цефалотин, цефадроксил, цефрадин и др. Они применяются в основном при кокковых инфекциях.
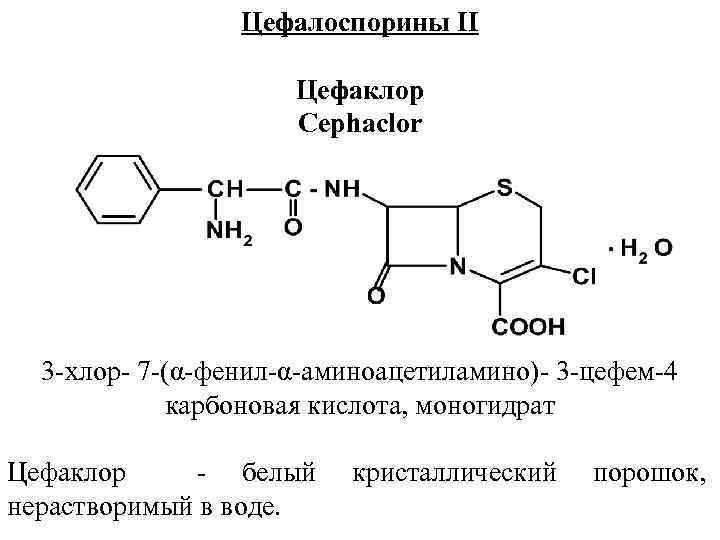
Цефалоспорины II Цефаклор Cephaclor 3 хлор 7 (α фенил α аминоацетиламино) 3 цефем 4 карбоновая кислота, моногидрат Цефаклор белый нерастворимый в воде. кристаллический порошок,

Подлинность цефаклора устанавливают методом ВЭЖХ, сравнивая время удерживания испытуемого и стандартного образцов. Как и для других β лактамидов для цефаклора можно использовать гидроксамовую пробу. УФ спектр цефаклора должен иметь максимум поглощения при 265 нм. Колич. опр. цефаклора проводят методом ВЭЖХ или спектрофотометрическим методом. Применяется: пневмонии, бронхите, пиелонефрите и др. Обычные дозы цефаклора для взрослых составляют 0, 25 г 3 раза в день. Выпускается в капсулах по 0, 25 и 0, 5 г или в порошке для суспензий во флаконах по 1, 5 и 3, 0 г .
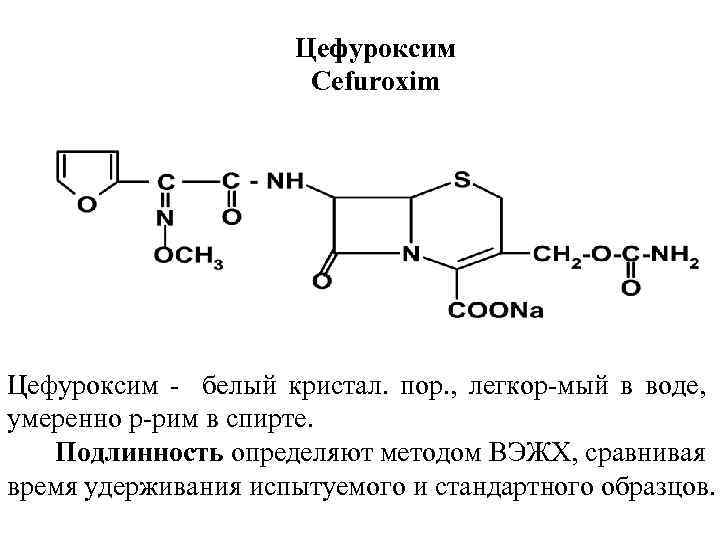
Цефуроксим Cefuroxim Цефуроксим белый кристал. пор. , легкор мый в воде, умеренно р рим в спирте. Подлинность определяют методом ВЭЖХ, сравнивая время удерживания испытуемого и стандартного образцов.

ИК спектр цефуроксима должен иметь полосы поглощения, совпадающие с полосами поглощения СО. Цефуроксим должен давать положительную реакцию на ионы натрия. Колич. опр. - метод ВЭЖХ. Применяется цефуроксим при пневмонии, бронхите, отитах, пиелонефритах и др. Обычные дозы для взрослых 0, 25 г 2 раза в день. Выпускают цефуроксим в таблетках, покрытых оболочкой по 0, 125 г; 0, 25; 0, 5 г и в гранулах для приготовления суспензии.


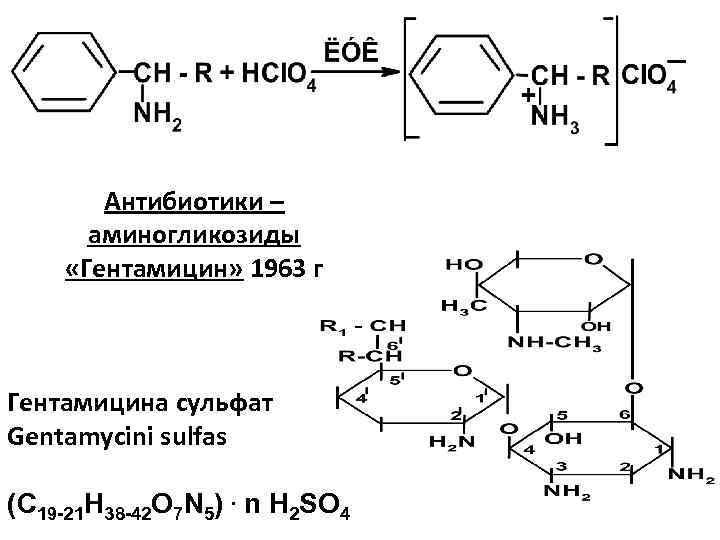
Антибиотики – аминогликозиды «Гентамицин» 1963 г Гентамицина сульфат Gentamycini sulfas (C 19 -21 H 38 -42 O 7 N 5). n H 2 SO 4
![Подлинность: -ИК – спектр; -ТСХ; - величина удельного вращения [ ]; • реакции на Подлинность: -ИК – спектр; -ТСХ; - величина удельного вращения [ ]; • реакции на](https://present5.com/presentation/186886774_230169650/image-42.jpg)
Подлинность: -ИК – спектр; -ТСХ; - величина удельного вращения [ ]; • реакции на SO 42 -; • на алифатическую аминогруппу - с нингидрином; • реакция на аминосахара - реакция с орцином зелён. окр.
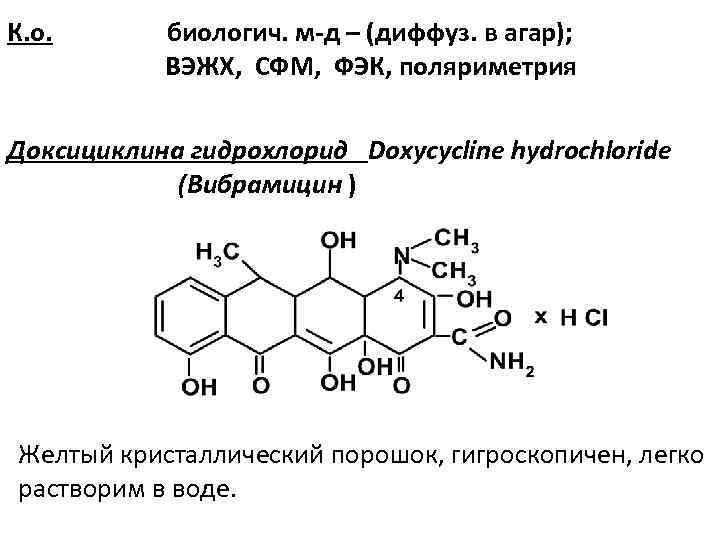
К. о. биологич. м-д – (диффуз. в агар); ВЭЖХ, СФМ, ФЭК, поляриметрия Доксициклина гидрохлорид Doxycycline hydrochloride (Вибрамицин ) Желтый кристаллический порошок, гигроскопичен, легко растворим в воде.
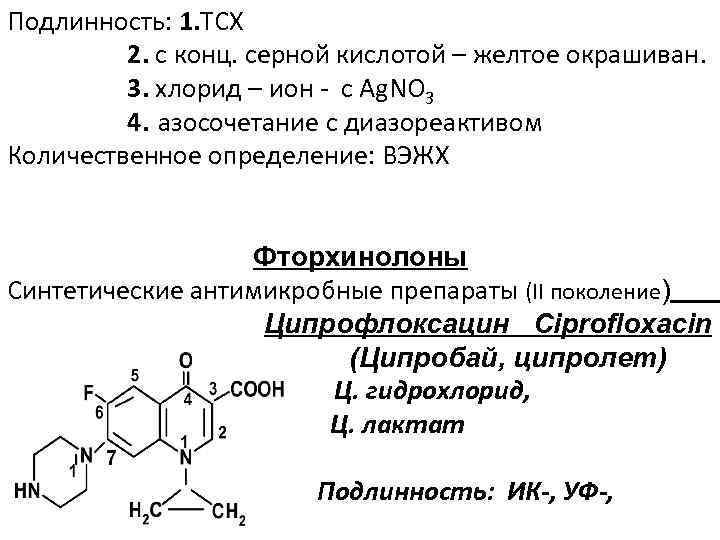
Подлинность: 1. ТСХ 2. с конц. серной кислотой – желтое окрашиван. 3. хлорид – ион - c Ag. NO 3 4. азосочетание с диазореактивом Количественное определение: ВЭЖХ Фторхинолоны Синтетические антимикробные препараты (II поколение) Ципрофлоксацин Ciprofloxacin (Ципробай, ципролет) Ц. гидрохлорид, Ц. лактат Подлинность: ИК-, УФ-,
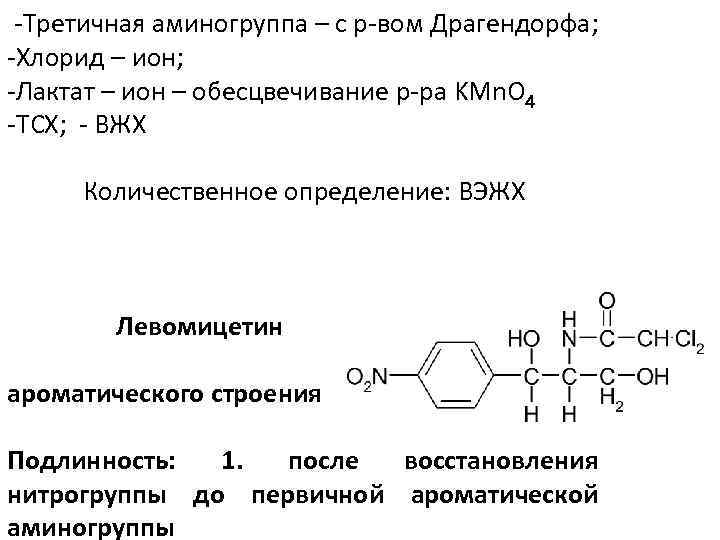
-Третичная аминогруппа – с р-вом Драгендорфа; -Хлорид – ион; -Лактат – ион – обесцвечивание р-ра KMn. O 4 -ТСХ; - ВЖХ Количественное определение: ВЭЖХ Левомицетин ароматического строения Подлинность: 1. после восстановления нитрогруппы до первичной ароматической аминогруппы
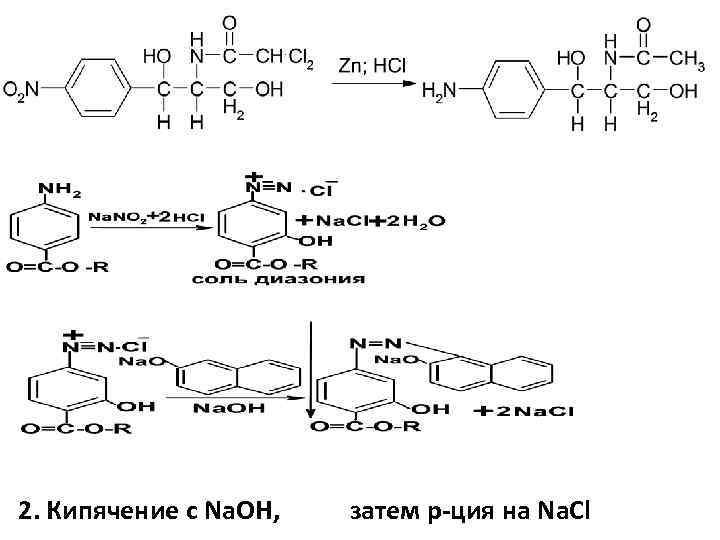
2. Кипячение с Na. OH, затем р-ция на Na. Cl

3. С р-ром Na. OH – красное окрашивание; 4. С Cu. SO 4 - комплексная соль синего цвета (ОН) группы; 5. ИК-, УФ- СФМ Количественный анализ 1. УФ- СФМ; 2. Нитритометрия после восстановления ЛС


Поэтому антибиотикотерапия должна проводиться под контролем врача. В процессе использования антибиотиков к ним может развиться устойчивость микроорганизмов (резистентность). Резистентными считают бактерии, которые нельзя обезвредить введением в инфицированный организм фармакологических доз лекарств. Поистине пророческими оказались слова И. П. Павлова о том, что, действуя на микробы, следует помнить об их интересах. А главный интерес бактерий, как и всего живого, - выживание.
Антибиот.3 2013.ppt