6_Voda.ppt
- Количество слайдов: 27

Аномалии воды строение и свойства свободная и связанная вода значение для живых организмов © Шкляр Т. Ф. 2011

Вода – важнейшая составляющая среды нашего организма. Cодержание в различных органах составляет 70 – 90%. Вода присутствует во всех тканях нашего организма, хотя распределена неравномерно: Содержание воды в органах и тканях: Системы организма объемная доля, % 70% воды организма находится внутри клеток в составе клеточной протоплазмы. 30% воды приходится на внеклеточную жидкость, из которой: межклеточная жидкость составляет 20%, вода плазмы крови – 8%, вода лимфы - 2%. Кровь 92 Почки до 82 Мозг до 85 Печень до 69 Мышцах 75 Жировые ткани 25 Кости до 28 Соединительная ткань 80 Кожа 72 Зубная эмаль 0, 2

«Мир чарующий и фантастический» лауреат Нобелевской премии в области биоэнергетики Альберт Сент-Дьердьи Биология забыла роль воды или вообще не думала о ней

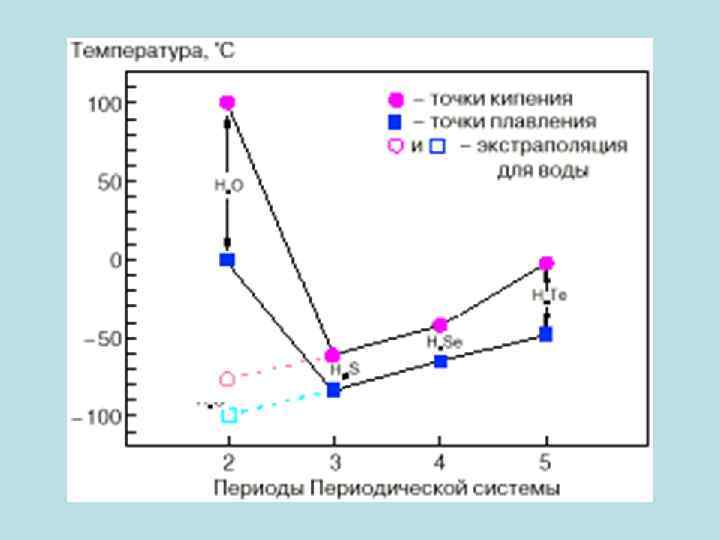
Элементы VI группы, соединяясь с двумя атомами водорода образуют гидриты: Н 2 О, Н 2 Se, Н 2 Te. Эти соединения являются жидкостями

Строение молекулы воды а – угол между связями O-H; б – расположение полюсов заряда; в – внешний вид электронного облака молекулы воды. Атомы водорода связаны с атомом кислорода посредством Ковалентной связи К. с. - химическая связь, осуществляемая за счет образования общих для взаимодействующих атомов электронных пар.

Типы ковалентной связи Неполярная ковалентная связь Возникает между двумя одноименными атомами или очень близкими по значениям электроотрицательности атомами. Центр тяжести облака спаренных электронов располагается симметрично между центрами тяжести положительных зарядов обоих ядер. Полярная ковалентная связь Возникает между двумя различными атомами. Электронное облако обобществленных электронов неравномерно. Электроны тяготеют к одному их атомов. Центры тяжести электрических зарядов в молекуле не совпадают. В таких случаях концентрация электронов с одного конца выше и он приобретает частичный отрицательный заряд. С другого конца появляется частичный положительный заряд. Такая молекула – Диполь.

Dipole

Прочность связи Мерой прочности связи является ЭНЕРГИЯ СВЯЗИ, определяемая затратой энергии, необходимой для разрушения связи. Энергия связи — это работа, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Энергия связи H-H в молекуле H 2 равна 435 к. Дж/моль. N-N в молекуле N 2 равна 940 к. Дж/моль. H-O в молекуле H 2 O равна 428 х2 к. Дж/моль. КОВАЛЕНТНЫЕ СВЯЗИ ОЧЕНЬ ПРОЧНЫЕ
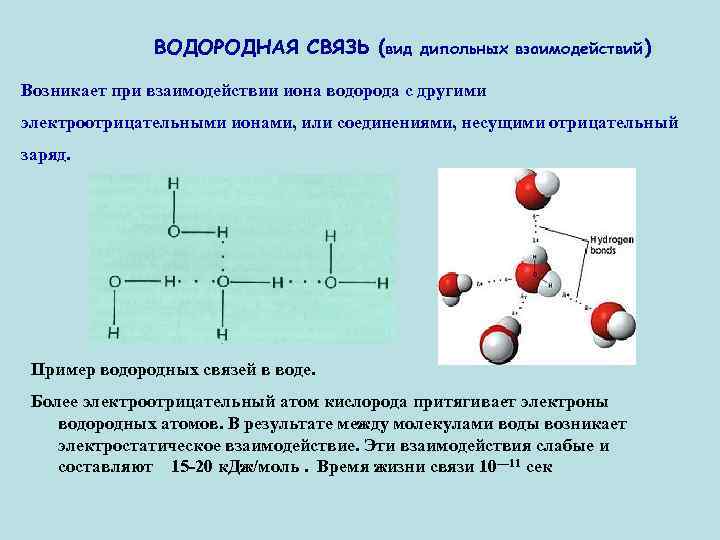
ВОДОРОДНАЯ СВЯЗЬ (вид дипольных взаимодействий) Возникает при взаимодействии иона водорода с другими электроотрицательными ионами, или соединениями, несущими отрицательный заряд. Пример водородных связей в воде. Более электроотрицательный атом кислорода притягивает электроны водородных атомов. В результате между молекулами воды возникает электростатическое взаимодействие. Эти взаимодействия слабые и составляют 15 -20 к. Дж/моль. Время жизни связи 10— 11 сек
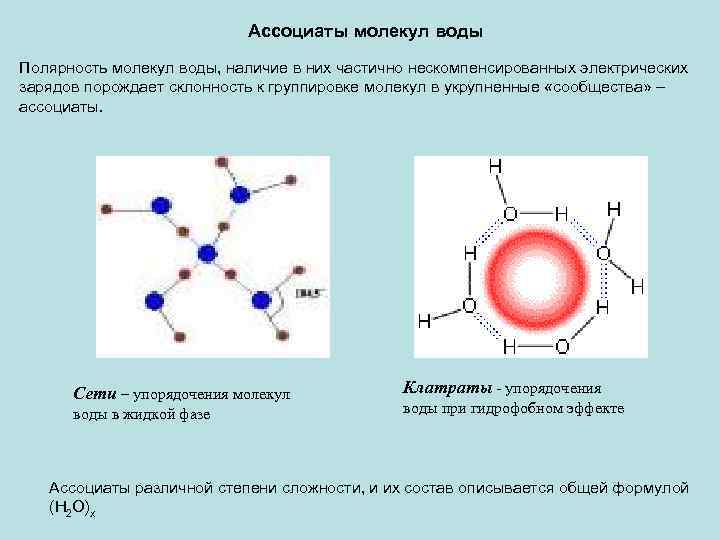
Ассоциаты молекул воды Полярность молекул воды, наличие в них частично нескомпенсированных электрических зарядов порождает склонность к группировке молекул в укрупненные «сообщества» – ассоциаты. Сети – упорядочения молекул воды в жидкой фазе Клатраты - упорядочения воды при гидрофобном эффекте Ассоциаты различной степени сложности, и их состав описывается общей формулой (H 2 O)x
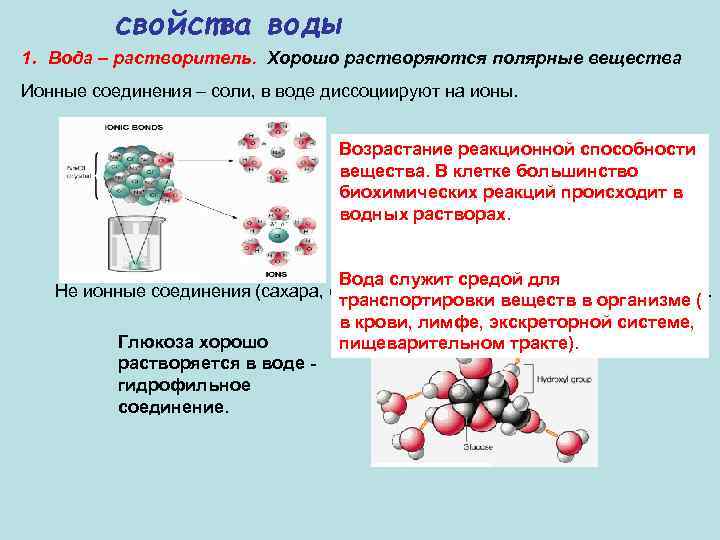
свойства воды 1. Вода – растворитель. Хорошо растворяются полярные вещества Ионные соединения – соли, в воде диссоциируют на ионы. Возрастание реакционной способности Хлорид натрия растворяется с вещества. В клетке большинство образованием ионов натрия и биохимических реакций происходит в хлора водных растворах. Вода служит средой для Не ионные соединения (сахара, спирты), имеющие заряженные группы (ОН-). транспортировки веществ в организме ( в крови, лимфе, экскреторной системе, Глюкоза хорошо пищеварительном тракте). растворяется в воде - гидрофильное соединение.

свойства воды: 1. Вода – растворитель. Неполярные молекулы гидрофобны, т. е. отталкиваются водой, возникают гидрофобные взаимодействия. Гидрофобные взаимодействия между неполярными (гидрофобными) группами радикалов аминокислот Играют роль в стабилизации многих белков, нуклеиновых кислот, мембран и субклеточных структур.

свойства воды: 1. Вода – растворитель. Неполярные соединения в воде не растворяются. Перестройка водородных связей в воде при помещении в нее неполярных веществ идет таким образом, что вода сжимает эти молекулы друг с другом, так, чтобы площадь соприкосновения возникающего гидрофобного пространства с полярным раствором была минимальной. Молекулы гидрофобных веществ агрегируют в полярных растворителях и образуют поверхности раздела с водой. Многие биохимические реакции происходят на поверхностях раздела

Свойства воды как растворителя имеет значение для жизни: • В клетке большинство биохимических реакций происходит в водных растворах. • При растворении возрастает реакционная способность вещества. • Стабилизирует многие белки, нуклеиновые кислоты, мембраны и субклеточные структуры. • Способствует образованию поверхностей раздела, на которых происходят многие биохимические реакции. • Вода служит средой для транспортировки веществ в организме (в крови, лимфе, экскреторной системе, пищеварительном тракте).

липопротеид

свойства воды: 2. Теплоемкость – количество теплоты(Дж), которое необходимо для поднятия температуры 1 кг вещества на 1 градус. Для подавляющего числа веществ теплоемкость жидкости после плавления кристалла увеличивается незначительно, не более 10%. 4, 2 к. Дж/(кг*К) Значение: обеспечивается минимальное изменение внутренней температуры организма. Биохимические процессы идут в узком диапазоне температур (скорости их стабильны).

свойства воды: 3. Теплопроводность – мера способности теплоты распространяться по веществу Вода 0, 6 - 0, 7 Вт/(м×К) (Железо - 92, воздух – 0, 026, дерево – 0, 15) Значения коэффициентов теплопроводности тканей организма человека (Вт/м*К) Жировая клетчатка 0, 17 - 0, 21 Эпидермис кожи 0, 15 - 0, 25 Мышечная ткань 0, 45 - 0, 58 Значение: Кости черепа 0, 38 Серое вещество мозга 0, 51 - 0, 56 В организме имеют место процессы, идущие с Кровь 0, 70 выделением тепла. Это тепло равномерно Кожа 0, 314 распределяется по всей воде организма. Таким образом, устраняется опасность возникновения локальных очагов с повышенной температурой и сопутствующих повреждений.

свойства воды: 4. Теплота испарения Удельная теплота испарения количество теплоты, которое необходимо сообщить 1 кг вещества, чтобы перевести его из жидкого состояния в газообразное. Теплота испаpения воды - пpи 25 гpадyсов около 2400 к. Дж/кг При испарении с поверхности кожи 1 мл воды организм теряет 0, 58 ккал тепла Значение: Испарение сопровождается охлаждением: потоотделение, одышка у собак, вентиляция пасти крокодилов и т. д. Большая теплота испарения означает, что отдача организмом даже больших количеств тепла сопровождается минимальными потерями воды, т. е. не обязательно ведет к его обезвоживанию.

Благодаря • большой теплоемкости, • высокой теплопроводности, • большой теплоте испарения ВОДА УЧАСТВУЕТ В ТЕРМОРЕГУЛЯЦИИ

свойства воды: 5. Поведение вблизи точки замерзания Скол, полученный методом замораживания-скалывания, дает представление о трехмерной организации внутренних структур. Микрофотография со сканирующего электронного микроскопа. Дрожжи. http: //molbiol. ru/pictures/80851. html
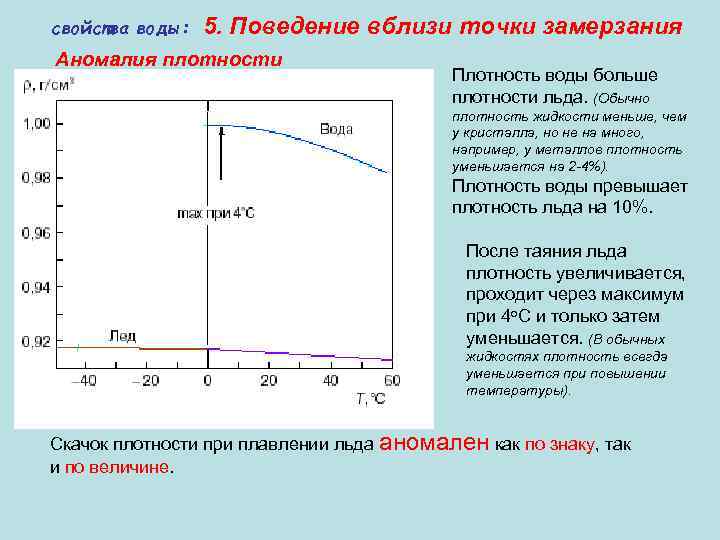
свойства воды: 5. Поведение вблизи точки замерзания Аномалия плотности Плотность воды больше плотности льда. (Обычно плотность жидкости меньше, чем у кристалла, но не на много, например, у металлов плотность уменьшается на 2 -4%). Плотность воды превышает плотность льда на 10%. После таяния льда плотность увеличивается, проходит через максимум при 4 о. С и только затем уменьшается. (В обычных жидкостях плотность всегда уменьшается при повышении температуры). Скачок плотности при плавлении льда аномален как по знаку, так и по величине.

Организмы выработали способы защиты клеток от замерзания: • Соль понижает температуру замерзания. Для клетки максимальное понижение температуры, которое может быть достигнуто таким путем, составляет лишь 2 о. С. • Клетки организмов, подвергающихся низким температурам, вырабатывают антифризы.

свойства воды: 6. Вода как реагент Вода является необходимым метаболитом многих биохимических реакций: 1. Как источник водорода реакция ГИДРАТАЦИИ (окисление жирных кислот в митохондриях) 2. Участие в реакциях гидролиза. ГИДРОЛИЗ – (от греч. Hydro – вода, Lysis – распад, разложение) это реакция обменного разложения вещества водой С 12 H 22 O 11 + H 2 O Сахароза = C 6 H 12 O 6 + C 6 H 12 O 6 глюкоза фруктоза
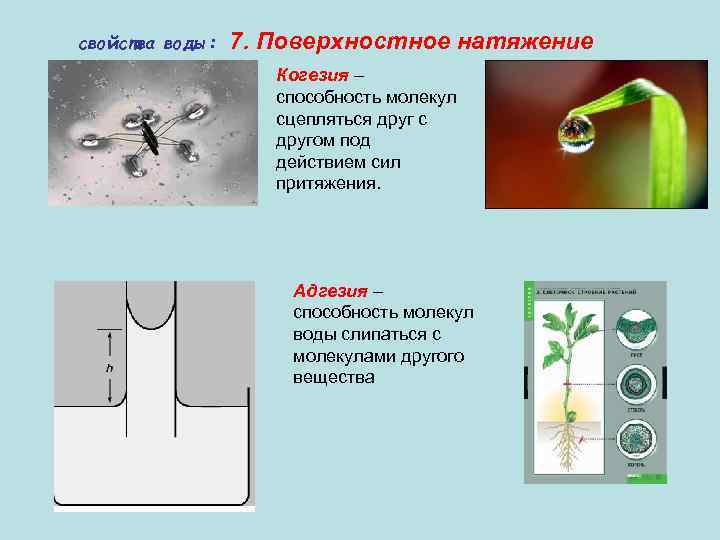
свойства воды: 7. Поверхностное натяжение Когезия – способность молекул сцепляться друг с другом под действием сил притяжения. Адгезия – способность молекул воды слипаться с молекулами другого вещества

Значение воды для животных организмов • Служит растворителем и средой для диффузии веществ • Участвует в реакциях гидролиза • Участвует в терморегуляции организма Обеспечивает поддержание структуры А - эритроцит в нормотоническом растворе Б – эритроцит в гипертоническом растворе Выполняет защитную функцию (содержится в слезной жидкости, в слизях) Служит компонентом смазки (суставы) Служит средой, в которой происходит оплодотворение

6_Voda.ppt