 Анодное растворение металлов
Анодное растворение металлов
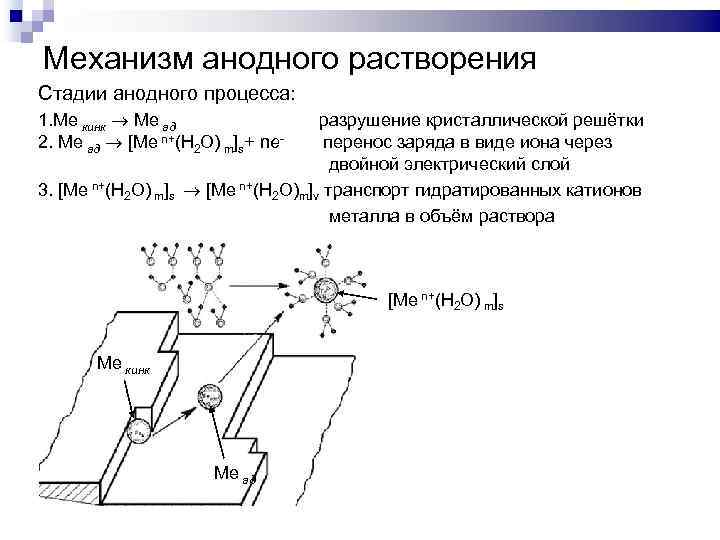 Механизм анодного растворения Стадии анодного процесса: 1. Ме кинк Ме ад 2. Ме ад [Ме n+(Н 2 О) m]s+ ne- разрушение кристаллической решётки перенос заряда в виде иона через двойной электрический слой 3. [Ме n+(Н 2 О) m]s [Ме n+(Н 2 О)m]v транспорт гидратированных катионов металла в объём раствора [Ме n+(Н 2 О) m]s Ме кинк Ме ад
Механизм анодного растворения Стадии анодного процесса: 1. Ме кинк Ме ад 2. Ме ад [Ме n+(Н 2 О) m]s+ ne- разрушение кристаллической решётки перенос заряда в виде иона через двойной электрический слой 3. [Ме n+(Н 2 О) m]s [Ме n+(Н 2 О)m]v транспорт гидратированных катионов металла в объём раствора [Ме n+(Н 2 О) m]s Ме кинк Ме ад
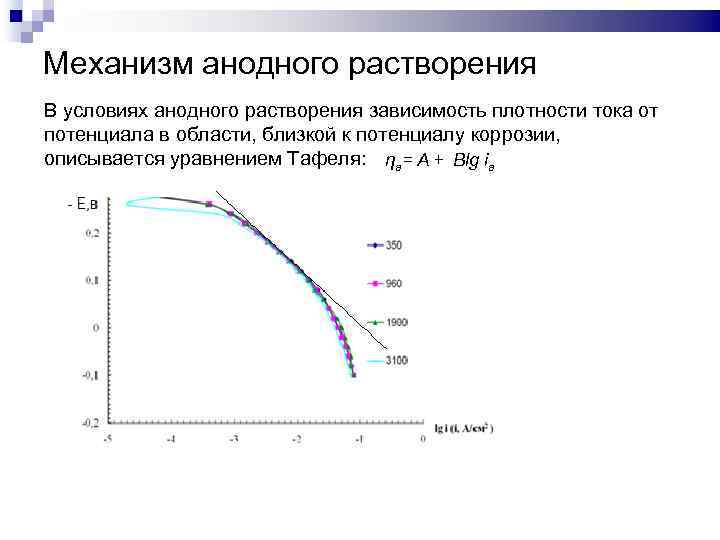 Механизм анодного растворения В условиях анодного растворения зависимость плотности тока от потенциала в области, близкой к потенциалу коррозии, описывается уравнением Тафеля: ηа= А + Вlg iа
Механизм анодного растворения В условиях анодного растворения зависимость плотности тока от потенциала в области, близкой к потенциалу коррозии, описывается уравнением Тафеля: ηа= А + Вlg iа
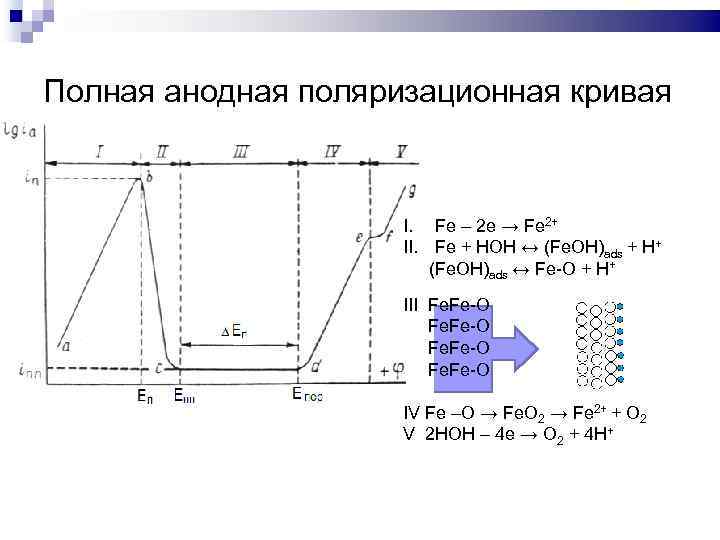 Полная анодная поляризационная кривая I. Fe – 2 e → Fe 2+ II. Fe + HOH ↔ (Fe. OH)ads + H+ (Fe. OH)ads ↔ Fe-O + H+ III Fe. Fe-O IV Fe –O → Fe. O 2 → Fe 2+ + O 2 V 2 HOH – 4 e → O 2 + 4 H+
Полная анодная поляризационная кривая I. Fe – 2 e → Fe 2+ II. Fe + HOH ↔ (Fe. OH)ads + H+ (Fe. OH)ads ↔ Fe-O + H+ III Fe. Fe-O IV Fe –O → Fe. O 2 → Fe 2+ + O 2 V 2 HOH – 4 e → O 2 + 4 H+
 Способы пассивации Пассиваторами являются: 1. Окислители, например HNO 3, Na. NO 2, K 2 Cr 2 O 7, O 2. 2. Пассивация достигается при анодной поляризации металла 3. Пассивация реализуется при образовании на поверхности металла нерастворимых соединений: оксидов (Al 2 O 3, Cr 2 O 3, Ti. O 2), гидроксидов (Zn(OH)2), солей ( Fe. SO 4, Pb. SO 4, Fe. PO 4) Депассиваторами являются - анионы неорганических и органических кислот: Cl-, Br-, SO 42 -, HS-, CH 3 COO- и т. д. ; -восстановители: Na 2 SO 3, Na 2 S 2 O 3 и т. д.
Способы пассивации Пассиваторами являются: 1. Окислители, например HNO 3, Na. NO 2, K 2 Cr 2 O 7, O 2. 2. Пассивация достигается при анодной поляризации металла 3. Пассивация реализуется при образовании на поверхности металла нерастворимых соединений: оксидов (Al 2 O 3, Cr 2 O 3, Ti. O 2), гидроксидов (Zn(OH)2), солей ( Fe. SO 4, Pb. SO 4, Fe. PO 4) Депассиваторами являются - анионы неорганических и органических кислот: Cl-, Br-, SO 42 -, HS-, CH 3 COO- и т. д. ; -восстановители: Na 2 SO 3, Na 2 S 2 O 3 и т. д.
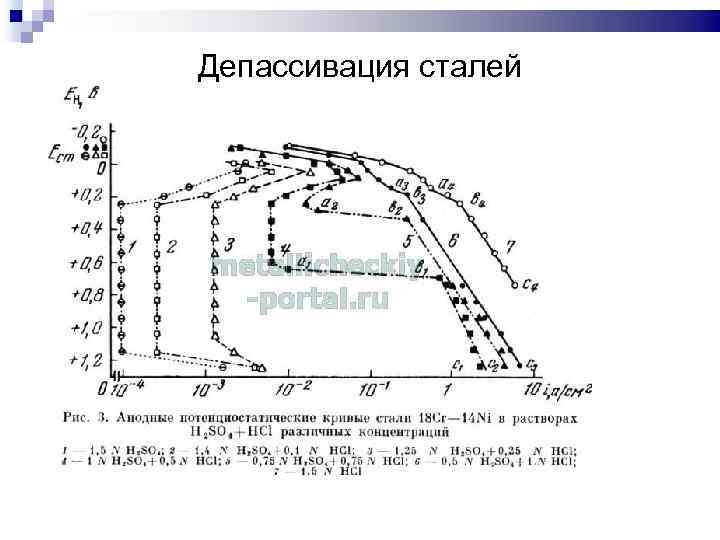 Депассивация сталей
Депассивация сталей
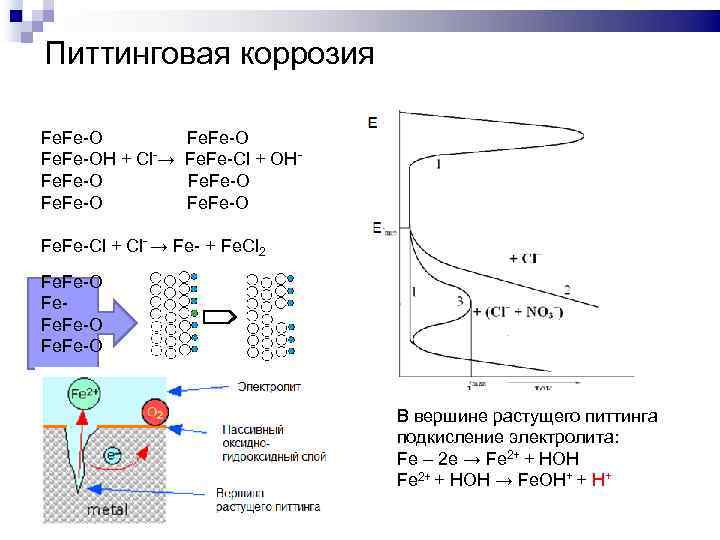 Питтинговая коррозия Fe. Fe-OH + Cl-→ Fe. Fe-O Fe. Fe-Cl + OHFe. Fe-O Fe. Fe-Cl + Cl- → Fe- + Fe. Cl 2 Fe. Fe-O В вершине растущего питтинга подкисление электролита: Fe – 2 e → Fe 2+ + HOH → Fe. OH+ + H+
Питтинговая коррозия Fe. Fe-OH + Cl-→ Fe. Fe-O Fe. Fe-Cl + OHFe. Fe-O Fe. Fe-Cl + Cl- → Fe- + Fe. Cl 2 Fe. Fe-O В вершине растущего питтинга подкисление электролита: Fe – 2 e → Fe 2+ + HOH → Fe. OH+ + H+
 Питтинговая коррозия Питтингообразование активируется анионами неорганических и органических кислот: Cl-, Br-, SO 42 -, HS-, CH 3 COO- и т. д. ;
Питтинговая коррозия Питтингообразование активируется анионами неорганических и органических кислот: Cl-, Br-, SO 42 -, HS-, CH 3 COO- и т. д. ;
 Вторичные процессы при коррозии А│ Fe + m. H 2 O →Fe 2+⋅m. H 2 O + 2 e К │ O 2 + 2 H 2 O + 4 e → 4 OH- Первичные процессы при коррозии стали в нейтральных средах Вторичные процессы: Fe 2+ + 2 OH- → Fe(OH)2 ↓. 2 Fe(OH)2 +½О 2 → Fe 2 O 3 + 2 H 2 O Fe 2+ + SH- → Fe. S↓+ H+ При кислотной коррозии свинца в серной кислоте образуется сульфат свинца: Pb 2+ + SO 42 - → Pb. SO 4 ↓. При коррозии цинка в атмосферных условиях на поверхности металла образуется пассивный слой гидроксида: Zn 2+ + 2 OH- → Zn(OH)2 ↓; При коррозии магния и железа в плавиковой кислоте образуются нерастворимые фториды этих металлов: Mg 2+ + 2 F- → Mg. F 2 ↓; Fe 2+ + 2 F- → Fe. F 2 ↓
Вторичные процессы при коррозии А│ Fe + m. H 2 O →Fe 2+⋅m. H 2 O + 2 e К │ O 2 + 2 H 2 O + 4 e → 4 OH- Первичные процессы при коррозии стали в нейтральных средах Вторичные процессы: Fe 2+ + 2 OH- → Fe(OH)2 ↓. 2 Fe(OH)2 +½О 2 → Fe 2 O 3 + 2 H 2 O Fe 2+ + SH- → Fe. S↓+ H+ При кислотной коррозии свинца в серной кислоте образуется сульфат свинца: Pb 2+ + SO 42 - → Pb. SO 4 ↓. При коррозии цинка в атмосферных условиях на поверхности металла образуется пассивный слой гидроксида: Zn 2+ + 2 OH- → Zn(OH)2 ↓; При коррозии магния и железа в плавиковой кислоте образуются нерастворимые фториды этих металлов: Mg 2+ + 2 F- → Mg. F 2 ↓; Fe 2+ + 2 F- → Fe. F 2 ↓