Анестезия и ИТ при высоко-рисковой абдоминальной хирургии Поленцов


Анестезия и ИТ при высоко-рисковой абдоминальной хирургии Поленцов Ю.О., к.мед.н., НИР Николаев 2016

Чем обусловлена актуальность темы Нарастание сложности и агрессивности вмешательств: Комбинированные в одной полости: ПРПК + резекция печени; НЭ+ПДР+резекция сосудов (читай – ишемия органов). В двух полостях: резекция печени + резекция легкого Увеличение возраста пациентов Увеличение сложности и тяжести сопутствующей патологии, требующей периоперационного лечения Развитие тяжелых послеоперационных осложнений: СД после ПДР, ОПП, ОППН, тромбозы сосудов, кровотечения, хирургическая инфекция, внутригоспитальная пневмония, сепсис.

План презентации Что такое высоко-рисковая хирургия (некардиальная)? Какие риски (у некардиохирургических больных) и каково их влияние на летальность? Влияние на летальность послеоперационных осложнений Смена парадигмы анестезиологии и ИТ в связи с развитием высоко-рисковой хирургии (публикуется впервые) Наиболее значимые интра- и пост-операционные факторы, влияющие на частоту осложнений и летальность у некардиохирургических больных Наиболее важные методы уменьшения частоты развития осложнений и летальности у некардиохирургических пациентов после высоко-рисковой хирургии. Влияние «Triple Low» Критерии и алгоритмы для проведения ИТ и оценки ее эффективности, включая GDT и трансфузионную терапию. «Невидимое» ОПП. Критерии диагностики и ее влияние на летальность в ОРИТ Протоколы ведущих ассоциаций в области анестезии и ИТ, как основа для работы «Откровения» об альбумине (не нужен более, чем в 50% случаев)
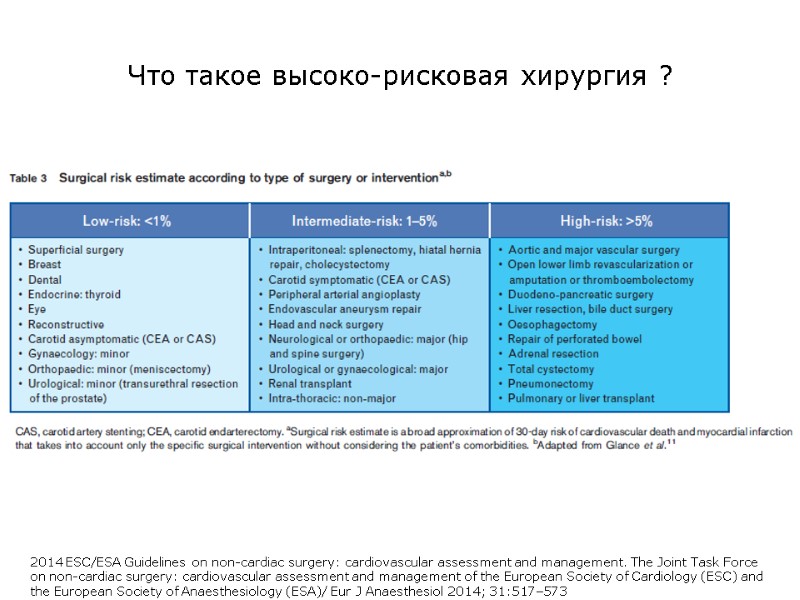
Что такое высоко-рисковая хирургия ? 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA)/ Eur J Anaesthesiol 2014; 31:517–573

Высоко-рисковая хирургия – хирургия с летальностью 5% и выше; таких пациентов 12,5% среди всех оперированных, но на них приходится более 80% of deaths. Откуда данные: - 94 госпиталя National Health Service, 1999 – 2004 гг., - Intensive Care National Audit & Research Centre database, - 4.117.727 хирургических операций, из которых 2.893.432 плановых (12.704 deaths; 0.44%) и 1.224.295 ургентных (65,674 deaths; 5.4%) Identification and characterisation of the high-risk surgical population in the United Kingdom/Rupert M Pearse et al.,/Critical Care 2006, 10:R81 (doi:10.1186/cc4928 В ОРИТ идут только тяжелые и летальность среди высоко-рисковых в среднем до 20%
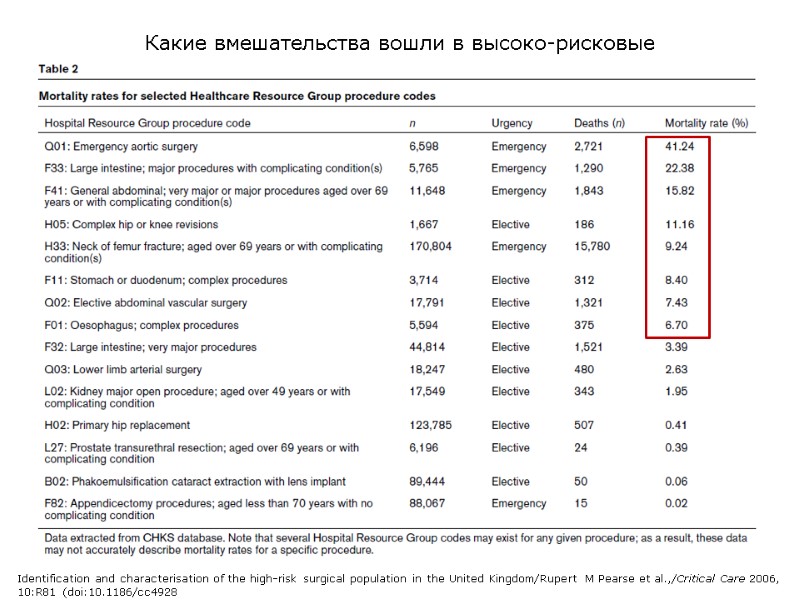
Какие вмешательства вошли в высоко-рисковые Identification and characterisation of the high-risk surgical population in the United Kingdom/Rupert M Pearse et al.,/Critical Care 2006, 10:R81 (doi:10.1186/cc4928

С чем связаны риски? Состояние пациента Сложность вмешательства Осложнения в послеоперационном периоде Значимость не только периода операции, но и ИТ в послеоперационном периоде

Состояние пациента. В первую очередь и в основном это – риски осложнений со стороны системы кровообращения. Насколько опасно? Каковы факторы, определяющие риск возникновения?
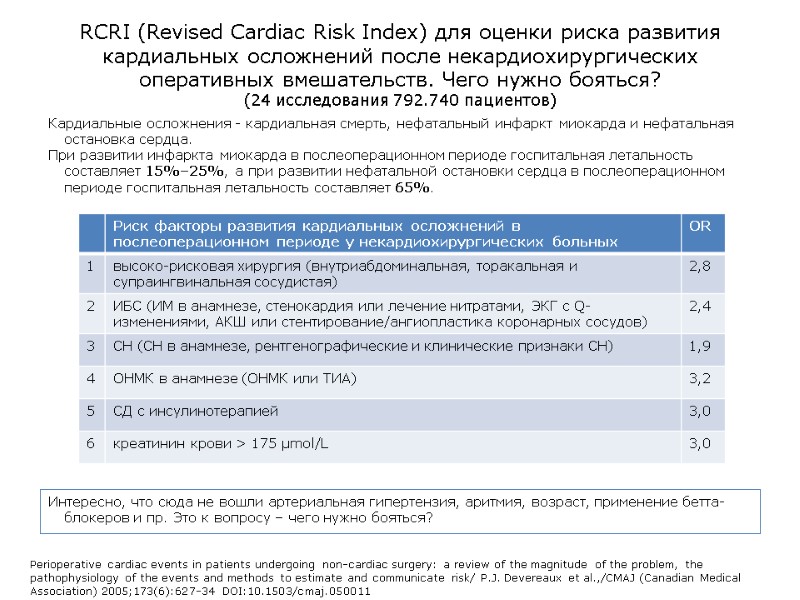
RCRI (Revised Cardiac Risk Index) для оценки риска развития кардиальных осложнений после некардиохирургических оперативных вмешательств. Чего нужно бояться? (24 исследования 792.740 пациентов) Кардиальные осложнения - кардиальная смерть, нефатальный инфаркт миокарда и нефатальная остановка сердца. При развитии инфаркта миокарда в послеоперационном периоде госпитальная летальность составляет 15%–25%, а при развитии нефатальной остановки сердца в послеоперационном периоде госпитальная летальность составляет 65%. Perioperative cardiac events in patients undergoing non-cardiac surgery: a review of the magnitude of the problem, the pathophysiology of the events and methods to estimate and communicate risk/ P.J. Devereaux et al.,/CMAJ (Canadian Medical Association) 2005;173(6):627-34 DOI:10.1503/cmaj.050011 Интересно, что сюда не вошли артериальная гипертензия, аритмия, возраст, применение бетта-блокеров и пр. Это к вопросу – чего нужно бояться?

MICA-index и on-line калькулятор (MI-myocardial Infarction; CA-cardiac Arrest) 2007 год, 180 госпиталей, более 200.000 пациентов Выявили 5 факторов риска развития инфаркта миокарда и остановки сердца в послеоперационном периоде при некардиохирургических вмешательствах: Вид оперативного вмешательства Функциональный класс (МЕТ, 6 минутный тест, CPET VO2) Креатинин крови >130mmol/L or >1.5 mg/dL Класс по ASA (ASA I - здоров; ASA II – легкие системные заболевания; ASA III – тяжелые системные заболевания, но контролируемые и не выводят пациента из строя; ASA IV – тяжелые заболевания, выводящие пациента из строя, и даже жизнеугрожающие; ASA V – тяжелое состояние с угрозой гибели в течение 24 часов без вмешательства) Возраст This model is presented as an interactive risk calculator (http://www.surgicalriskcalculator.com/miorcardiacarrest) so that the risk could be calculated at the bedside or clinic in a simple and accurate way.

Кроме факторов состояния пациента и сложности вмешательства существуют и послеоперационные осложнения. А что сильнее влияет на послеоперационную летальность? Факторы состояния пациента и сложности вмешательства или послеоперационные осложнения?

Оценили 30-дневную летальность и выживание в течение до 8 лет после 8 наиболее часто выполняемых операций. Использовали базу данных The National Surgical Quality Improvement Program (NSQIP), в которой сведения об 1,2 млн оперированных пациентов. Исследование проспективное. С использованием базы данных NSQIP собрали данные о 105.951 пациентов, оперированных между 1991 и 1999 годами, и отслеживали их состояние в течение 8 лет. С помощью логистического и Cox-regression анализов идентифицировали предикторы 30-дневной летальности и долгосрочного выживания. Оценивалось влияние 22 видов осложнений, имевшихся в базе данных. Наиболее важным фактором, снижающим выживание пациентов в послеоперационном периоде, было появление в течение 30 дней любого из 22 осложнений, фиксирующихся в базе данных. Медиана выживаемости при этом сокращалась на 69%. Негативное влияние осложнений на выживание пациентов зависело также и от типа оперативного вмешательства и сохранялось даже тогда, когда пациенты, не выжившие в течение 30 дней, были исключены из исследования. Determinants of Long-Term Survival After Major Surgery and the Adverse Effect of Postoperative Complications\Shukri F. Khuri, MD, William G. Henderson, PhD, Ralph G. DePalma, MD, Cecilia Mosca, MSPH, Nancy A. Healey, BS, Dharam J. Kumbhani, MD, SM, and the Participants in the VA National Surgical Quality Improvement Program\Ann Surg 2005;242:326–343 Появление осложнений в течение 30 дней после оперативного вмешательства более опасно в отношении выживания после большой хирургии, чем факторы дооперациооного риска и интраоперационные факторы риска.
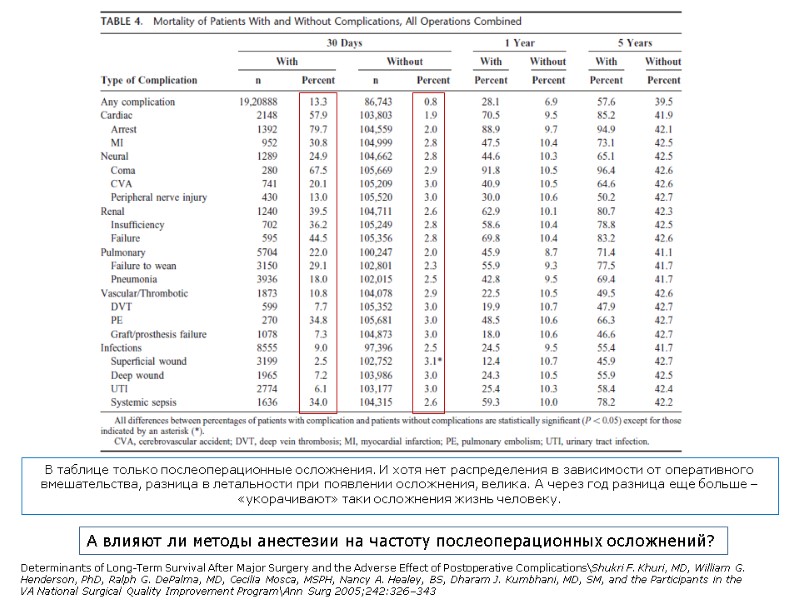
В таблице только послеоперационные осложнения. И хотя нет распределения в зависимости от оперативного вмешательства, разница в летальности при появлении осложнения, велика. А через год разница еще больше – «укорачивают» таки осложнения жизнь человеку. Determinants of Long-Term Survival After Major Surgery and the Adverse Effect of Postoperative Complications\Shukri F. Khuri, MD, William G. Henderson, PhD, Ralph G. DePalma, MD, Cecilia Mosca, MSPH, Nancy A. Healey, BS, Dharam J. Kumbhani, MD, SM, and the Participants in the VA National Surgical Quality Improvement Program\Ann Surg 2005;242:326–343 А влияют ли методы анестезии на частоту послеоперационных осложнений?
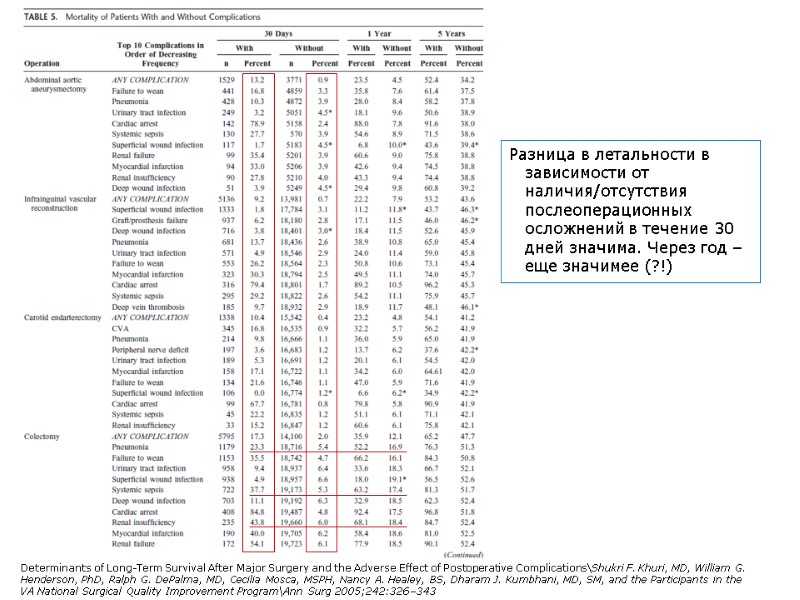
Разница в летальности в зависимости от наличия/отсутствия послеоперационных осложнений в течение 30 дней значима. Через год – еще значимее (?!) Determinants of Long-Term Survival After Major Surgery and the Adverse Effect of Postoperative Complications\Shukri F. Khuri, MD, William G. Henderson, PhD, Ralph G. DePalma, MD, Cecilia Mosca, MSPH, Nancy A. Healey, BS, Dharam J. Kumbhani, MD, SM, and the Participants in the VA National Surgical Quality Improvement Program\Ann Surg 2005;242:326–343
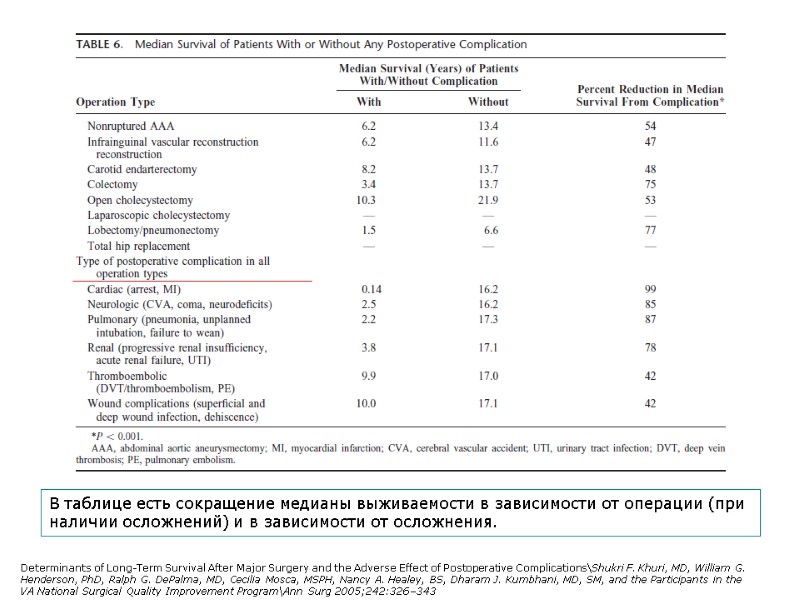
В таблице есть сокращение медианы выживаемости в зависимости от операции (при наличии осложнений) и в зависимости от осложнения. Determinants of Long-Term Survival After Major Surgery and the Adverse Effect of Postoperative Complications\Shukri F. Khuri, MD, William G. Henderson, PhD, Ralph G. DePalma, MD, Cecilia Mosca, MSPH, Nancy A. Healey, BS, Dharam J. Kumbhani, MD, SM, and the Participants in the VA National Surgical Quality Improvement Program\Ann Surg 2005;242:326–343

Смена парадигмы: «Старая» (основана на среднестатистическом опыте, передаваемом от поколения к поколению): плановых сложных отменять основная задача в отношении тех, кого взяли – снять со стола/доставить в ОРИТ живым Одна из «задач» в ОРИТе - «наполнение» листа ИТ хорошими препаратами (альбумин, плазма, современные антибиотики, метаболиты ; не дай Бог симпатомиметики Для «подстраховки» в отношении сложных пациентов – «мнение старших товарищей» Обновленная (основана на доказательной медицине – цифры, протоколы, алгоритмы): сложных готовим, причем не для «пережить на столе», но для «снизить риски гибели в послеоперационном периоде» Основная задача – не только снять со стола, но снизить риски послеоперационных осложнений и гибели в послеоперационном периоде Основная задача в ОРИТе – поддержание жизненно важных показателей на необходимых протокольных уровнях применением только доказанных методов лечения. Никаких «модных» препаратов без доказательной базы. Никаких мнений – только цифры и протоколы, основанные на доказательной медицины. Но – мультидисциплинарный подход (примеры: вторичный СД после ПДР, ГБ с тяжелой гипертензией, ИБС со стенозом коронарных артерий, тяжелая аритмия и пр.) Используемые критерии для ИТ – далее в презентации

Взгляд на методы анестезии и ИТ с позиции послеоперационного выживания пациента (хотя бы 30 дней), а не только с позиции «выживания» на столе. No opinions, guidelines only. Никаких мнений. Только протоколы. Class I – IIа, Grade A. Класс рекомендаций I – IIа, степень доказательств А

Интраоперационные факторы риска (хирургической и анестезиологической агрессии) Тяжесть травмы (летальность при травме/операции без анестезии и ИТ ?) Вид вмешательства (высоко-рисковые) Длительность вмешательства Гипотермия Длительность специфических процедур (Прингл, One-lung Vent, пережатие полой вены, пережатие аорты, артерий конечностей/внутренних органов) Кровопотеря Величина потери функции органа (легкое, печень, почка и пр.) Нежелательные эффекты анестетиков (кардиодепрессия) Глубокая/поверхностная анестезия Артериальная гипотензия Трансфузия (TRALI) Гипоксия при одно-легочной вентиляции Сниженная доставка кислорода (DO2<600 мл/мин/м2 ?) “Tripple low”

Наиболее важные методы снижения рисков, используемые нами В операционной Согревание. Влияние на частоту осложнений. А частота послеоперационных осложнений ? Нейроаксиальная блокада (ЭА/паравертебральный блок). Протоколы ERAS – снижение частоты послеоперационных осложнений (дыхание, кровообращение, тромбообразование) и даже риска рецидива ? Инвазивный контроль АД и ЦВД «Triple low» (МАК, БИС и АД среднее) Протективная ИВЛ (протокол РДСВ) Аутогемотрансфузия с помощью аппарата Cell-saver One Lung Vent Предоперационная подготовка: malnutrition Венозный доступ: яремная или подключичная Мониторинг адекватности инфузии: SvO2, BE, lactate Предупреждение TRALI: трансфузия по показаниям После операции: Нейроаксиальный блок (ЭА, паравертебральный блок) Раннее энтеральное питание Парентеральное питание по протоколу Контроль гликемии с инсулинотерапией Полоскание ротоглотки антисептиком – профилактика пневмонии А/б профилактика (приказ МОЗ 502) вместо неоправданного лечения – снижение а/б резистентности Трансфузия по показаниям Альбумин – контроль тяжести состояния и эффективности терапии; коррекция при уровне ниже 20 г/л
Предупреждение наведенной гипотермии
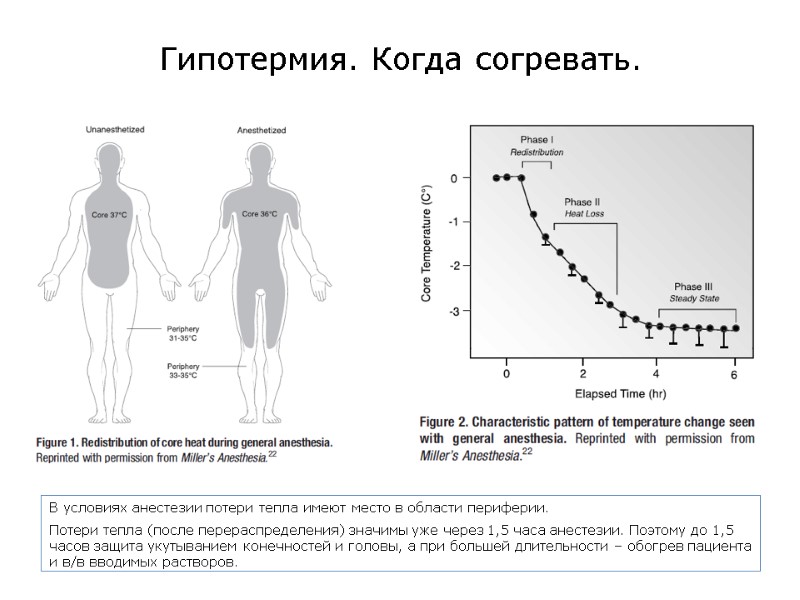
Гипотермия. Когда согревать. В условиях анестезии потери тепла имеют место в области периферии. Потери тепла (после перераспределения) значимы уже через 1,5 часа анестезии. Поэтому до 1,5 часов защита укутыванием конечностей и головы, а при большей длительности – обогрев пациента и в/в вводимых растворов.

Наиболее значимые негативные эффекты наведенной гипотермии Хирургическая инфекция области вмешательства (угнетение клеточного иммунитета, активности снижение гуморального иммунитете в зоне вмешательства из-за вазоконстрикции и ухудшения перфузии зоны вмешательства. Частота хирургической инфекции после резекции кишечника при гипотермии увеличивается в 3 раза. Ишемия миокарда. Пациенты с исходной патологией системы кровообращения при гипотермии (ниже 35,5°С) имеют увеличенную частоту нежелательных кардиальных событий (ишемия миокарда, нарушение ритма, остановка сердца, ИМ). Этому способствуют сдвиг кривой диссоциации гемоглобина влево (связь Нв и О2 укрепляется) и дрожание после анестезии с ув. потреблением О2. Коагулопатия. Понижение температуры тела на 1,6ºС увеличивает кровопотерю при артропластике на 500 мл. Уменьшается активность тромбоцитов и факторов свертывания – ферментов, максимально активных при 37ºС. Предупреждение наведенной гипотермии – во всех протоколах. При травме входит в «летальную триаду».
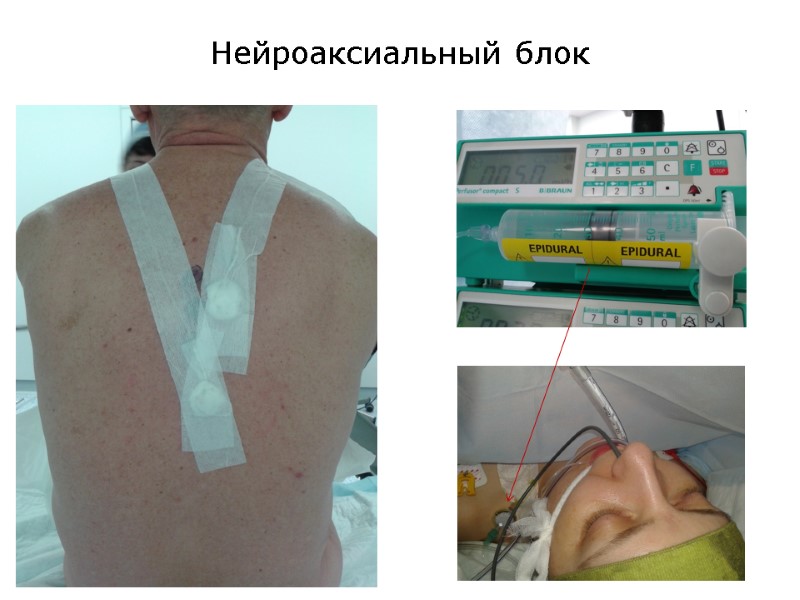
Нейроаксиальный блок
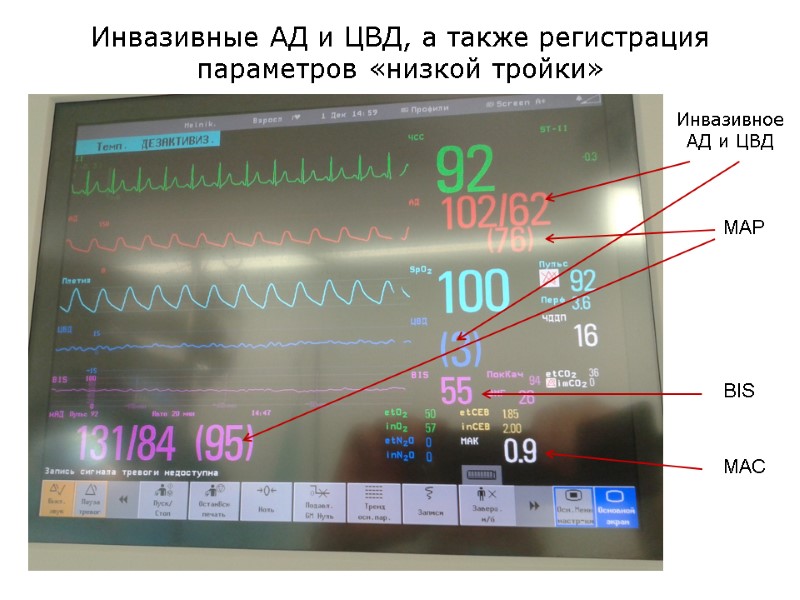
MAC BIS MAP Инвазивное АД и ЦВД Инвазивные АД и ЦВД, а также регистрация параметров «низкой тройки»
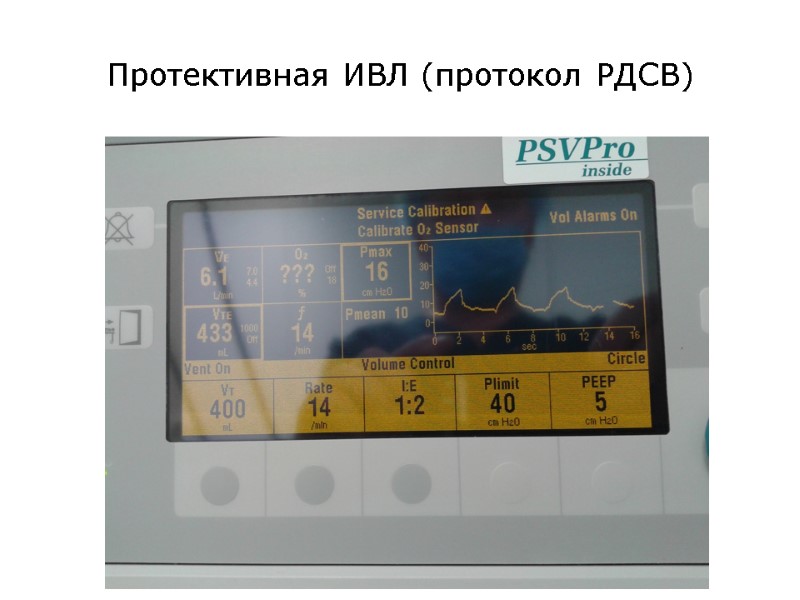
Протективная ИВЛ (протокол РДСВ)
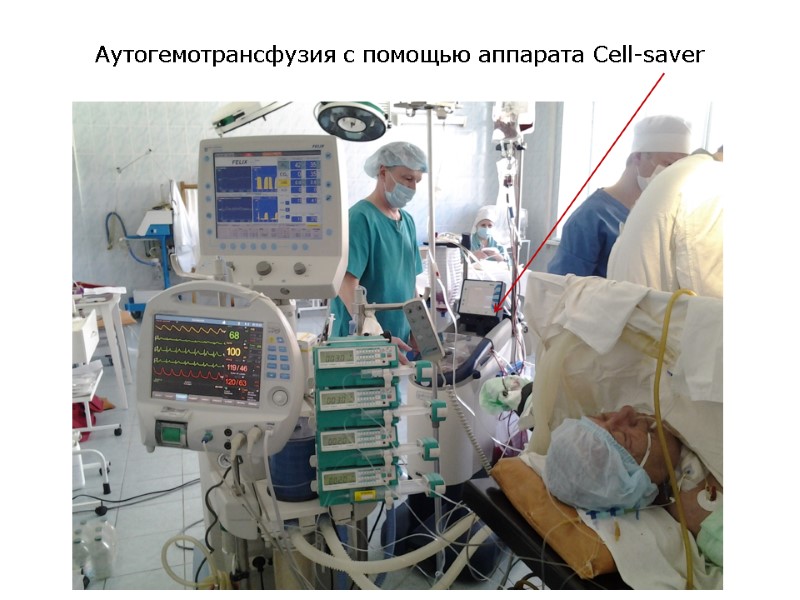
Аутогемотрансфузия с помощью аппарата Cell-saver
Аутогемотрансфузия с помощью аппарата Cell-saver
Анестезия в условиях одно-легочной вентиляции

Основные положения касательно анестезии в условиях одно-легочной вентиляции Влияние общих анестетиков на внутрилегочный шунт при однолегочной вентиляции легких (ОВЛ) связано с их воздействием на феномен гипоксической легочной вазоконстрикции (ГЛВ). Феномен ГЛВ возникает в невентилируемом легком при ОВЛ (или в пораженном легком при ателектазировании легочной ткани) и проявляется ГЛВ уменьшением кровотока в невентилируемых участках легкого, в результате чего величина внутрилегочного шунта уменьшается. Т.е. ГЛВ имеет протективный эффект. Ингибирование феномена ГЛВ увеличивает внутирлегочное шунтирование крови и обусловливает развитие гипоксемии. Ингаляционные анестетики ингибируют феномен ГЛВ в дозо-зависимой форме, что может увеличивать внутрилегочное шунтирование крови и способствовать гипоксемии при ОВЛ. Поэтому при ОВЛ ингаляционные анестетики если и использовать, то желательно использовать в «пониженной» дозе (≤ 1 МАК и BIS не ниже 45). Пропофол не ингибируют феномен ГЛВ при ОВЛ. Поэтому пропофол часто является анестетиком предпочтения в торакальной хирургии, где возникает необходимость в ОВЛ, по данным научной литературы.

«Triple Low» или «Тройка низких показателей»
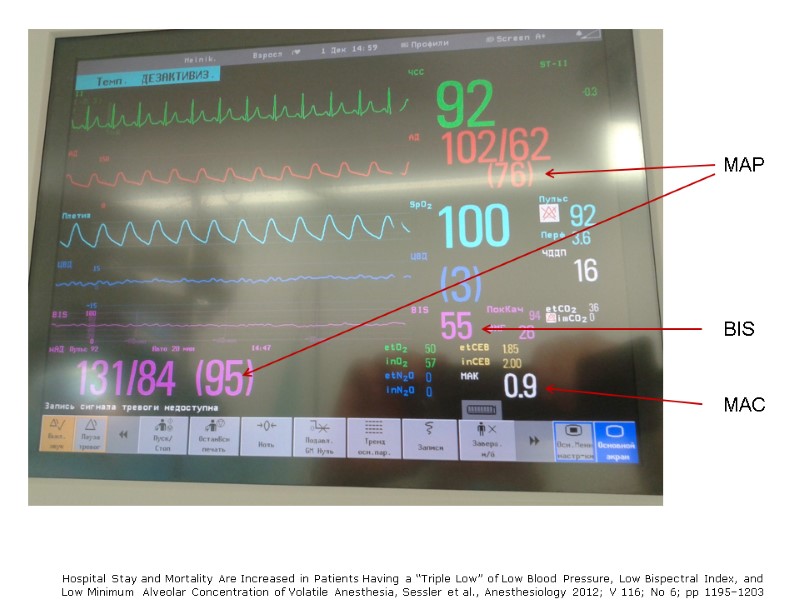
Hospital Stay and Mortality Are Increased in Patients Having a “Triple Low” of Low Blood Pressure, Low Bispectral Index, and Low Minimum Alveolar Concentration of Volatile Anesthesia, Sessler et al., Anesthesiology 2012; V 116; No 6; pp 1195–1203 MAC BIS MAP

Значение «Triple Low» 24,120 пациентов с некардиохирургическими вмешательствами в Cleveland Clinic, Cleveland, Ohio Показатели, которые оказались пограничными: 87±5 mmHg (MAP), 46±4 (BIS), and 0.56±0.11 (MAC). Каждый фактор из «Triple low» ассоциировался с удлинением сроков пребывания в госпитале (hazard ratio 1.5, 95% CI 1.3–1.7). 30-дневная летальность удваивалась при сочетании 2-х факторов из «Triple low» и увеличивалась в 4 раза при наличии всех 3-х факторов. Triple low в течении 60 min увеличивал 30-дневную летальность в 4 раза в сравнении с периодом в 15 min. Увеличение сроков пребывания в госпитале прогрессивно нарастало по мере увеличения длительности «Triple low» от 15 до 60 min. Заключение: низкое АДср во время низкого МАК являлось сильным и очень значимым предиктором летальности. Когда низкие АДср и низкий МАК сочетались с низким BIS, риск летальности еще увеличивался. Значения, которые показатели имели в ситуации «Triple lows» анестезиологи воспринимали, как рутинные. Hospital Stay and Mortality Are Increased in Patients Having a “Triple Low” of Low Blood Pressure, Low Bispectral Index, and Low Minimum Alveolar Concentration of Volatile Anesthesia, Sessler et al., Anesthesiology 2012; V 116; No 6; pp 1195–1203
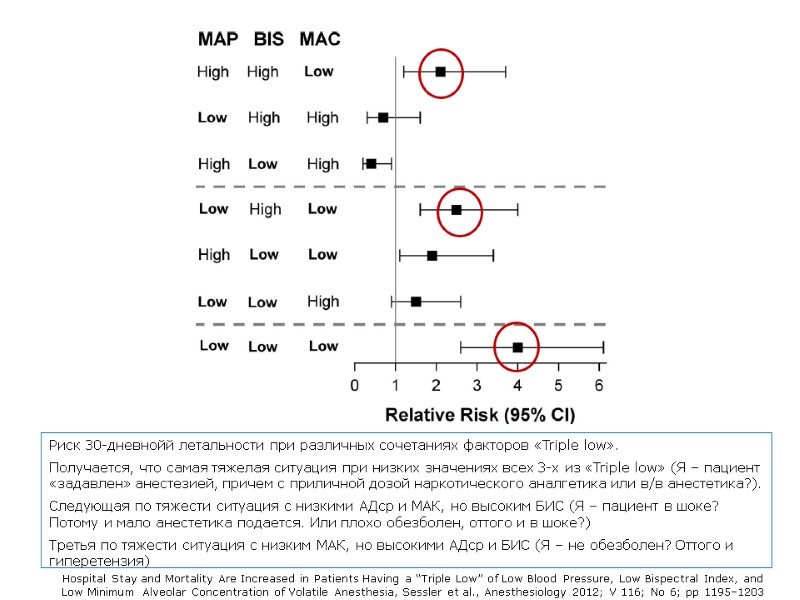
Риск 30-дневнойй летальности при различных сочетаниях факторов «Triple low». Получается, что самая тяжелая ситуация при низких значениях всех 3-х из «Triple low» (Я – пациент «задавлен» анестезией, причем с приличной дозой наркотического аналгетика или в/в анестетика?). Следующая по тяжести ситуация с низкими АДср и МАК, но высоким БИС (Я – пациент в шоке? Потому и мало анестетика подается. Или плохо обезболен, оттого и в шоке?) Третья по тяжести ситуация с низким МАК, но высокими АДср и БИС (Я – не обезболен? Оттого и гиперетензия) Hospital Stay and Mortality Are Increased in Patients Having a “Triple Low” of Low Blood Pressure, Low Bispectral Index, and Low Minimum Alveolar Concentration of Volatile Anesthesia, Sessler et al., Anesthesiology 2012; V 116; No 6; pp 1195–1203
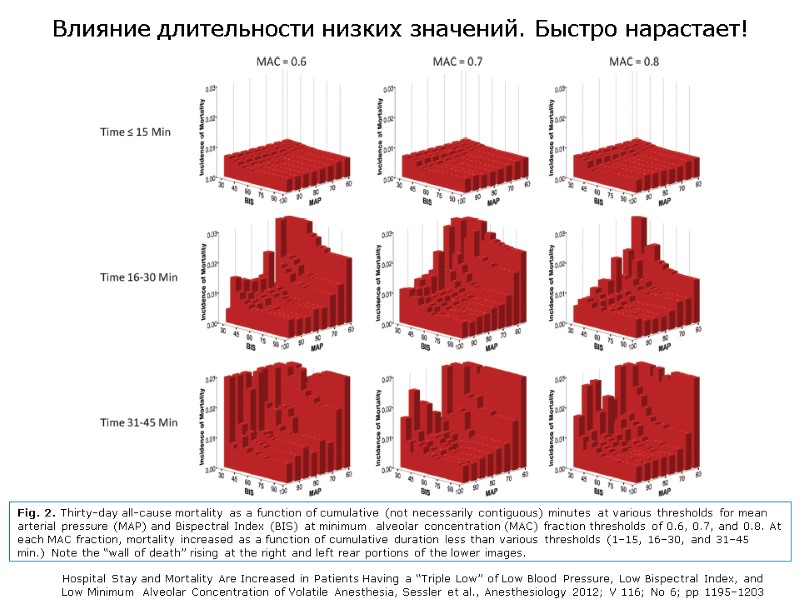
Влияние длительности низких значений. Быстро нарастает! Fig. 2. Thirty-day all-cause mortality as a function of cumulative (not necessarily contiguous) minutes at various thresholds for mean arterial pressure (MAP) and Bispectral Index (BIS) at minimum alveolar concentration (MAC) fraction thresholds of 0.6, 0.7, and 0.8. At each MAC fraction, mortality increased as a function of cumulative duration less than various thresholds (1–15, 16–30, and 31–45 min.) Note the “wall of death” rising at the right and left rear portions of the lower images. Hospital Stay and Mortality Are Increased in Patients Having a “Triple Low” of Low Blood Pressure, Low Bispectral Index, and Low Minimum Alveolar Concentration of Volatile Anesthesia, Sessler et al., Anesthesiology 2012; V 116; No 6; pp 1195–1203
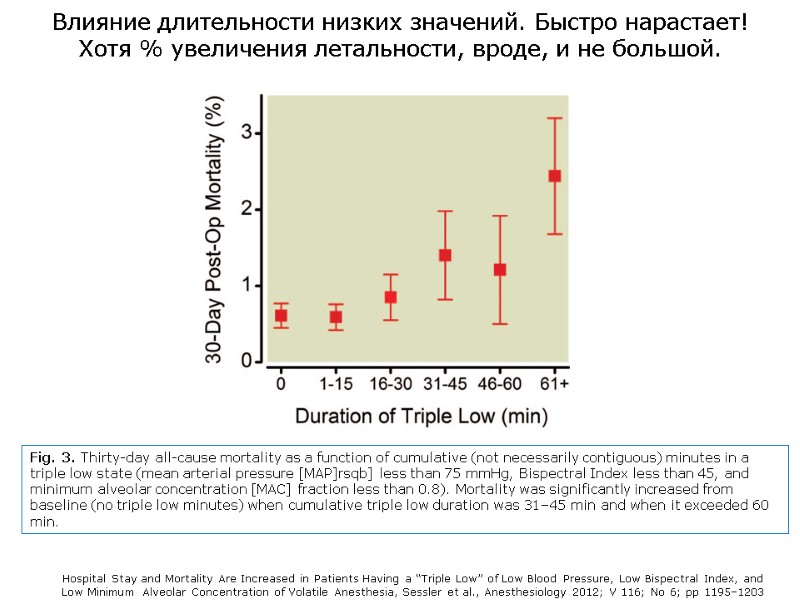
Fig. 3. Thirty-day all-cause mortality as a function of cumulative (not necessarily contiguous) minutes in a triple low state (mean arterial pressure [MAP]rsqb] less than 75 mmHg, Bispectral Index less than 45, and minimum alveolar concentration [MAC] fraction less than 0.8). Mortality was significantly increased from baseline (no triple low minutes) when cumulative triple low duration was 31–45 min and when it exceeded 60 min. Hospital Stay and Mortality Are Increased in Patients Having a “Triple Low” of Low Blood Pressure, Low Bispectral Index, and Low Minimum Alveolar Concentration of Volatile Anesthesia, Sessler et al., Anesthesiology 2012; V 116; No 6; pp 1195–1203 Влияние длительности низких значений. Быстро нарастает! Хотя % увеличения летальности, вроде, и не большой.
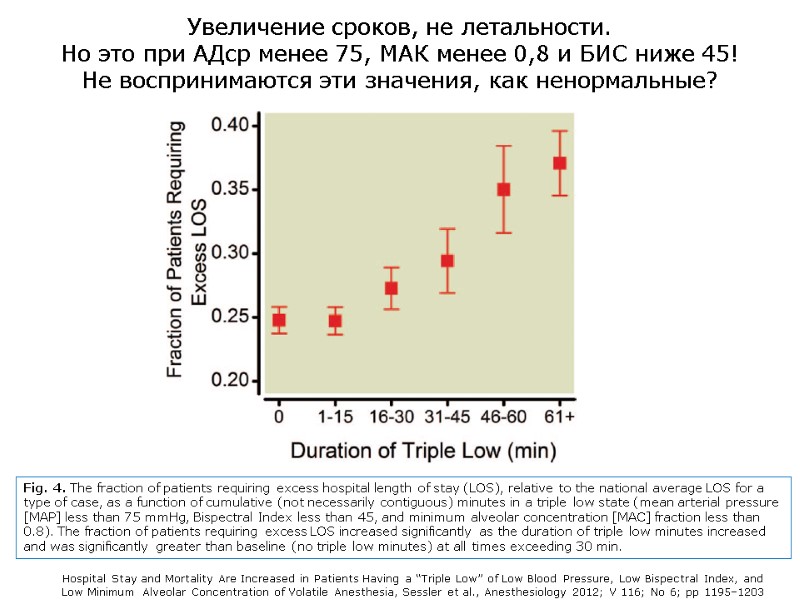
Увеличение сроков, не летальности. Но это при АДср менее 75, МАК менее 0,8 и БИС ниже 45! Не воспринимаются эти значения, как ненормальные? Fig. 4. The fraction of patients requiring excess hospital length of stay (LOS), relative to the national average LOS for a type of case, as a function of cumulative (not necessarily contiguous) minutes in a triple low state (mean arterial pressure [MAP] less than 75 mmHg, Bispectral Index less than 45, and minimum alveolar concentration [MAC] fraction less than 0.8). The fraction of patients requiring excess LOS increased significantly as the duration of triple low minutes increased and was significantly greater than baseline (no triple low minutes) at all times exceeding 30 min. Hospital Stay and Mortality Are Increased in Patients Having a “Triple Low” of Low Blood Pressure, Low Bispectral Index, and Low Minimum Alveolar Concentration of Volatile Anesthesia, Sessler et al., Anesthesiology 2012; V 116; No 6; pp 1195–1203

Критерии в анестезиологии и ИТ. No opinions, guidelines only. Никаких мнений. Только протоколы. Class I – IIа, Grade A. Класс рекомендаций I – IIа, степень доказательств А Поленцов Ю.О., к.м.н

Критерии адекватности для гемодинамики АД ср 70 mmHg (Я - сист/диаст выше 100/70) АД ср 60 mmHg (30 мин. суммарно) – риск осложнений (Я – сист/диаст 90/40 или 80/50 и ниже) ЦВД не менее 8 mmHg (≈ 10 смН2О) при лечении септ. шока и 4 mmHg (≈ 5,5 смН2О) при РДСВ. В целом ЦВД - суррогатный показатель (не стандарт) SvO2 ≥ 70% / 65% (верхняя полая вена / смешанная венозная кровь) Лактат крови < 2 ммоль/л
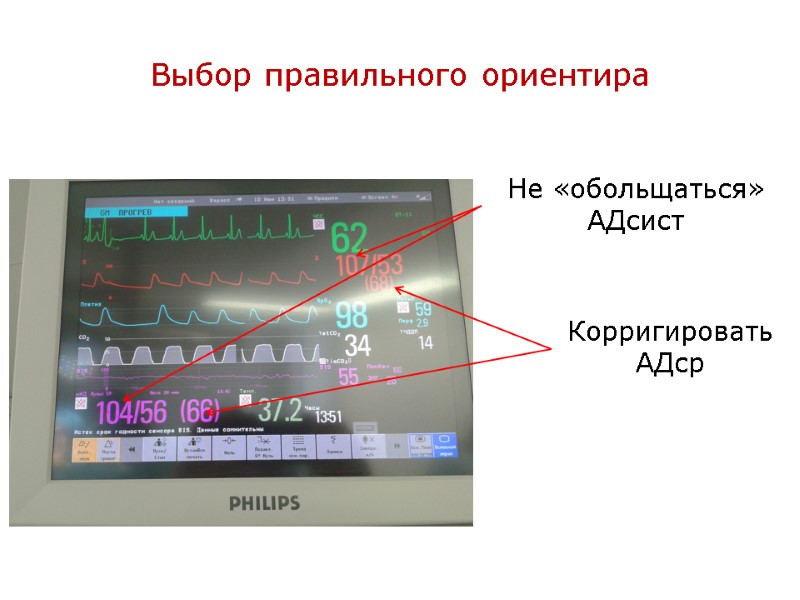
Выбор правильного ориентира Корригировать АДср Не «обольщаться» АДсист

Критерии адекватности для газообмена SpO2 95% для возраста 60, SpO2 90% для возраста > 60, SpO2 88% для «Low-volume strategy» при лечении (ИВЛ) РДСВ, PaCO2 ≥ 35 ≤ 45 mmHg PaCO2 пермиссивная при лечении РДСВ до 60 mmHg и даже выше при условии PH>7,2 РДСВ диагностируется при PaO2/FiO2 < 200 + Rő- картина ОПЛ диагностируется при PaO2/FiO2 <300 >200

Алгоритм выбора уровня FiO2 и PEEP для устранения гипоксемии NB! При подаче в дыхательной смеси, например, 70% О2 ПДКВ не может составлять менее 10 смН2О

Критерии адекватности инфузии Адекватность инфузии: АД, чсс, диурез, SvO2, лактат, ВЕ NB! ЦВД не указано. Это суррогатный показатель. NB! ЦВД обязательно в протоколе при септ шоке

GDT (Goal Directed Therapy) – – новый взгляд на адекватность инфузии Смысл GDT – коррекция функции ССС с целью обеспечения нормальной и даже сверх-нормальной доставки О2 к тканям (DO2>600 мл\мин\м2) за счет оптимизации как преднагрузки ЛЖ, так и его инотропной функции путем достижения заданных целевых значений основных гемодинамических показателей. DO2 = CaO2 x CO, где CaO2 = Hb х SaO2 x 1,34; CO = SV х HR Влияние GDT на летальность наиболее значимо у пациентов с высоким риском гибели (20%). Что такое 20% - на предыдущих слайдах. Влияние GDT на частоту осложнений значимо у всех высоко-рисковых пациентов в большой хирургии. Влияние GDT на частоту осложнений у пациентов с патологией ССС: снижает частоту больших осложнений, и не влияет на частоту нежелательных кардио-васкулярных событий. Уровень доказательности IIA, т.е. GDT in high-risk pts should be considered
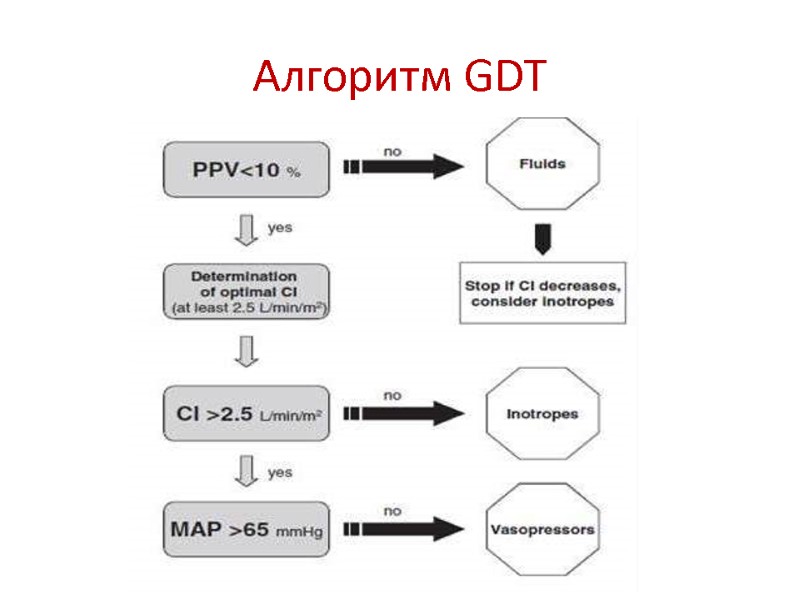
Алгоритм GDT
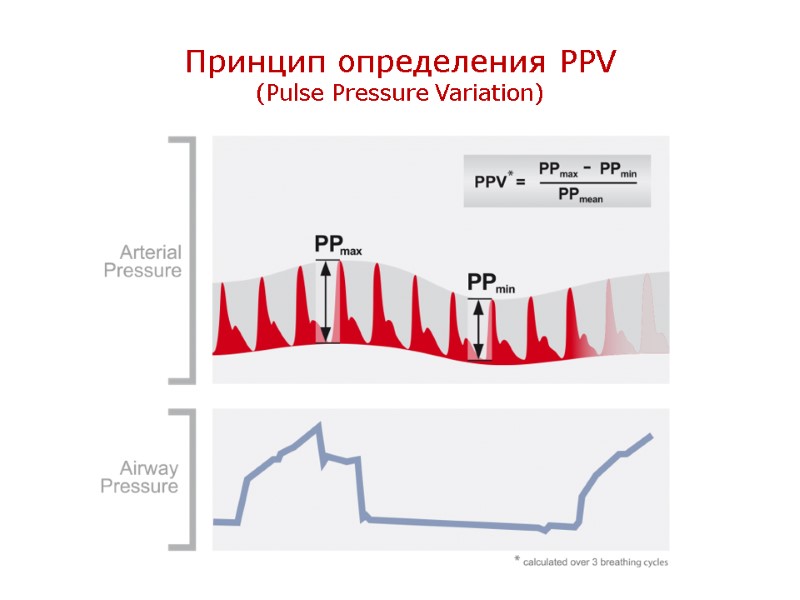
Принцип определения PPV (Pulse Pressure Variation)
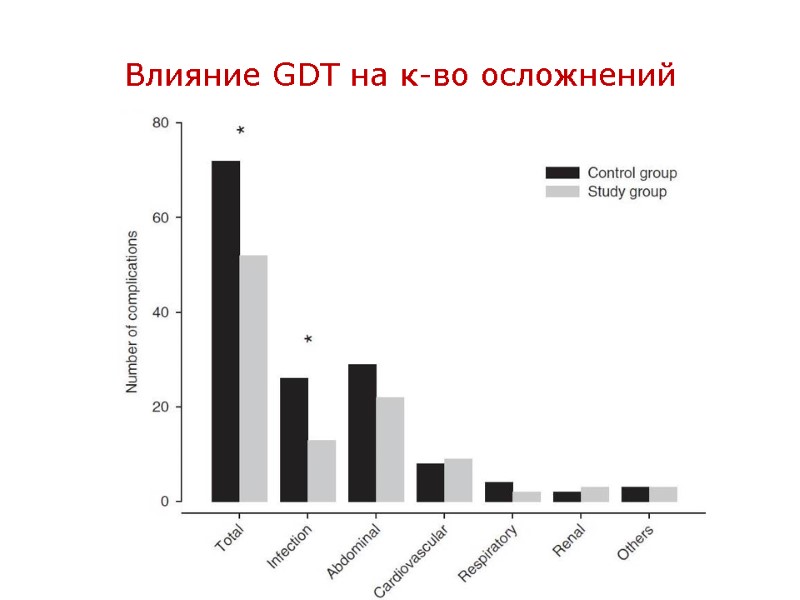
Влияние GDT на к-во осложнений
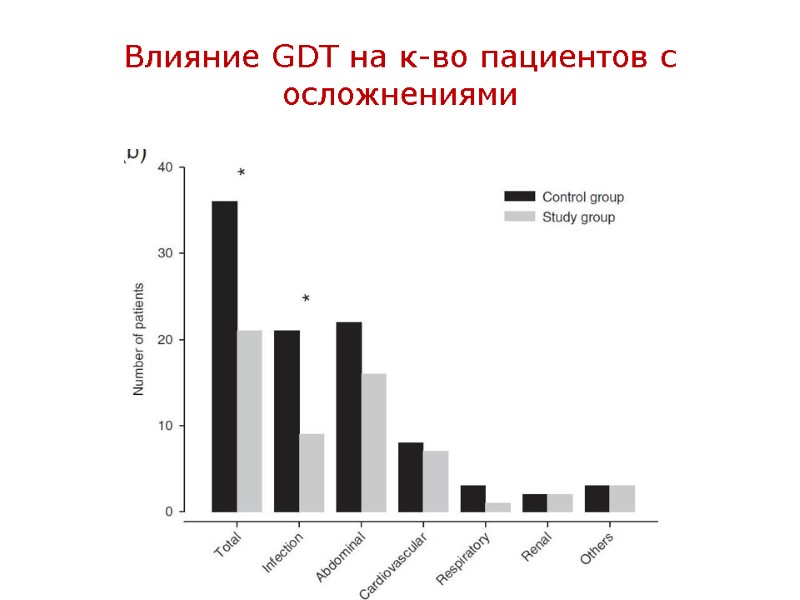
Влияние GDT на к-во пациентов с осложнениями

GDT при сепсисе ≠ GDT при хирургии NB!

Критерии адекватности инфузионной терапии при септическом шоке Early Goal-directed therapy (EGDT) для септ шока: In septic shock (initial resuscitation of sepsis-induced hypoperfusion) (grade 1C): a) CVP 8–12 mm Hg b) MAP ≥ 65 mm Hg c) Urine output ≥ 0.5 mL/kg/hr d) Superior vena cava oxygenation saturation (ScvО2) or mixed venous oxygen saturation (SvO2) 70% or 65%,respectively Inotropic Therapy: Рекомендуется не использовать стратегию увеличения сердечного индекса до супранормального уровня (grade 1B). В отношении пациентов ОРИТ с тяжелым сепсисом не удалось доказать пользу увеличения доставки кислорода с использованием добутамина Рекомендуется пробовать использовать добутамин в дозе до 20 μg/kg/min или добавлять его к вазопрессорам (если таковые используются) в случае: a) миокардиальной дисфункции, определяемой по увеличенному давлению наполнения и низкому сердечному выбросу, или b) признаков гипоперфузии, сохраняющихся, несмотря на достигнутую нормоволемию и АДср (grade 1C).
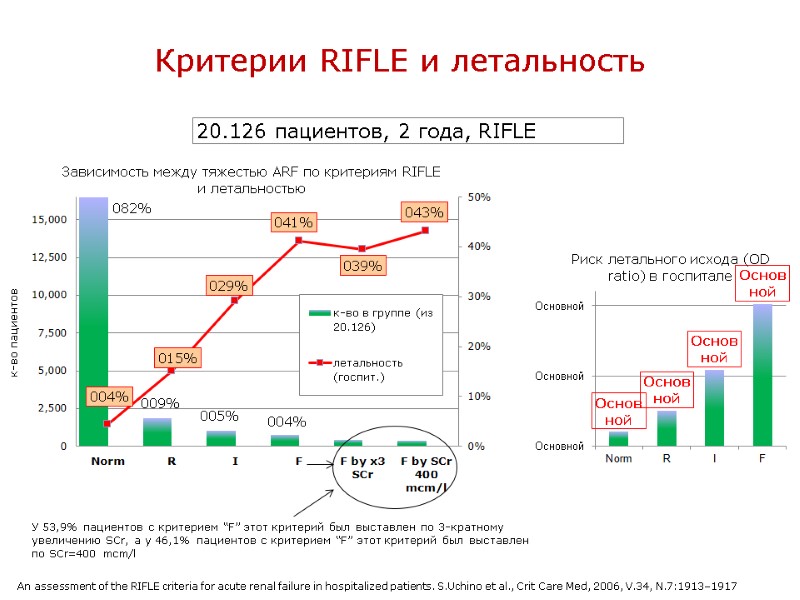
Критерии RIFLE и летальность 20.126 пациентов, 2 года, RIFLE An assessment of the RIFLE criteria for acute renal failure in hospitalized patients. S.Uchino et al., Crit Care Med, 2006, V.34, N.7:1913–1917 У 53,9% пациентов с критерием “F” этот критерий был выставлен по 3-кратному увеличению SCr, а у 46,1% пациентов с критерием “F” этот критерий был выставлен по SCr=400 mcm/l
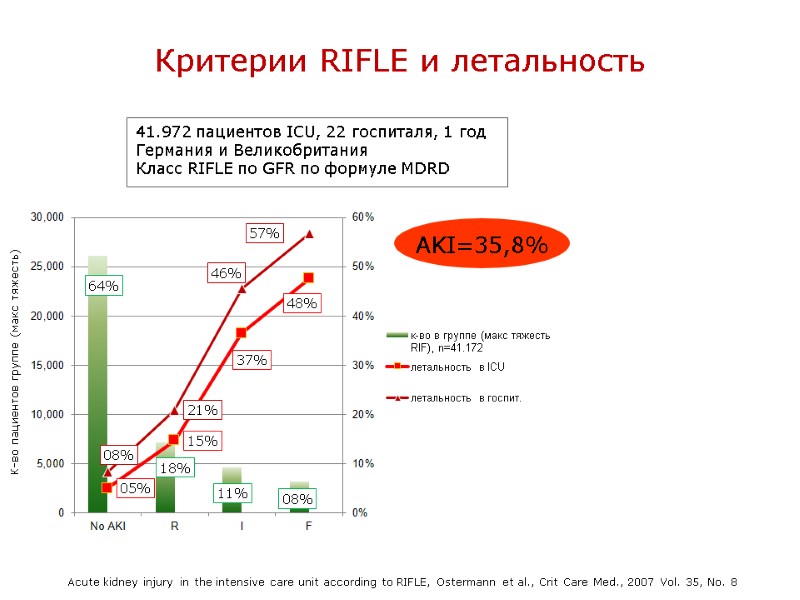
Критерии RIFLE и летальность 41.972 пациентов ICU, 22 госпиталя, 1 год Германия и Великобритания Класс RIFLE по GFR по формуле MDRD AKI=35,8% Acute kidney injury in the intensive care unit according to RIFLE, Ostermann et al., Crit Care Med., 2007 Vol. 35, No. 8
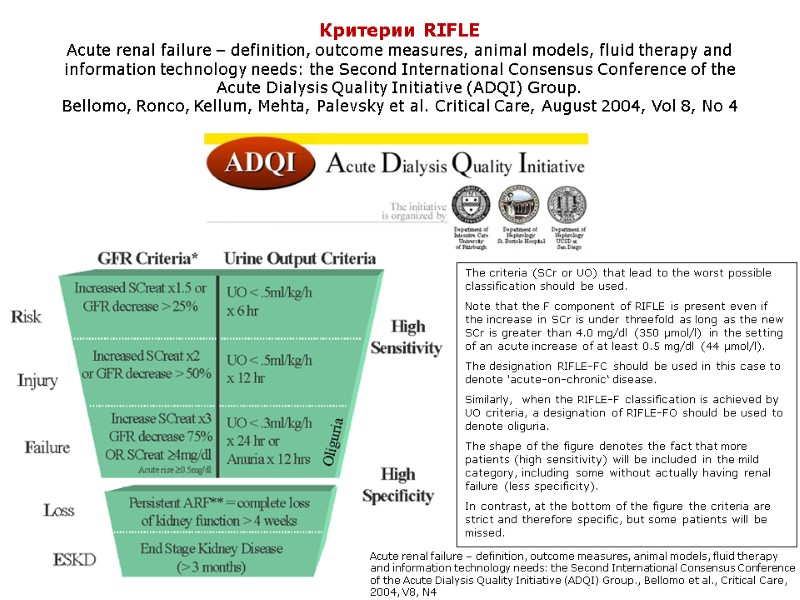
Критерии RIFLE Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Bellomo, Ronco, Kellum, Mehta, Palevsky et al. Critical Care, August 2004, Vol 8, No 4 Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group., Bellomo et al., Critical Care, 2004, V8, N4 The criteria (SCr or UO) that lead to the worst possible classification should be used. Note that the F component of RIFLE is present even if the increase in SCr is under threefold as long as the new SCr is greater than 4.0 mg/dl (350 μmol/l) in the setting of an acute increase of at least 0.5 mg/dl (44 μmol/l). The designation RIFLE-FC should be used in this case to denote 'acute-on-chronic‘ disease. Similarly, when the RIFLE-F classification is achieved by UO criteria, a designation of RIFLE-FO should be used to denote oliguria. The shape of the figure denotes the fact that more patients (high sensitivity) will be included in the mild category, including some without actually having renal failure (less specificity). In contrast, at the bottom of the figure the criteria are strict and therefore specific, but some patients will be missed.

Трансфузиология по протоколам Эр. массу – при Hb ≤ 70 г/л (клиника ИБС и тканевая гипоксия - 90 г/л) 1С Плазму – при кровотечении на фоне ПТИ ≤ 60% и уровне фибриногена ≤ 0,8 г/л Тромбоконцентрат – при ≤ 50 х 109/л в случае операции и при ≤ 20 х 109/л в случае геморрагических проявлений вне операций; до уровня 20 – 40 х 109/л Рестриктивная стратегия инфузии и трансфузии Оценка эффективности по ВЕ и уровню лактата

Гемо-, плазмо-, альбумино- и тромбоцито- трансфузия никакой большой хирургии без согревания больного 1В никакой гемотрансфузии без определения уровня Нв (исключение для «без определения Нв» – профузное и гемодинамически значимое кровотечение) никакой плазмотрансфузии без кровотечения, причем кровотечения либо с коагулопатией (ПТИ < 60% и уровень фибриногена < 1 г/л либо), либо с объемом кровопотери 25% ОЦК и более никаких ГЭКов никакого альбумина без подтверждения альбумина крови ≤ 20 г/л (25 г/л) Обязательный набор обследований при поступлении пациента в ОРИТ: - Нв, ПТИ, фибриноген, альбумин, КОС, Т° ≥ 36 °С


Смотрим год выхода рекомендаций, к-во и тему
Смотрим год выхода рекомендаций, к-во и тему

Осторожнее с протоколами и критериями

Для тех, кто верит в Альбумин

Для тех, кто верит в Альбумин
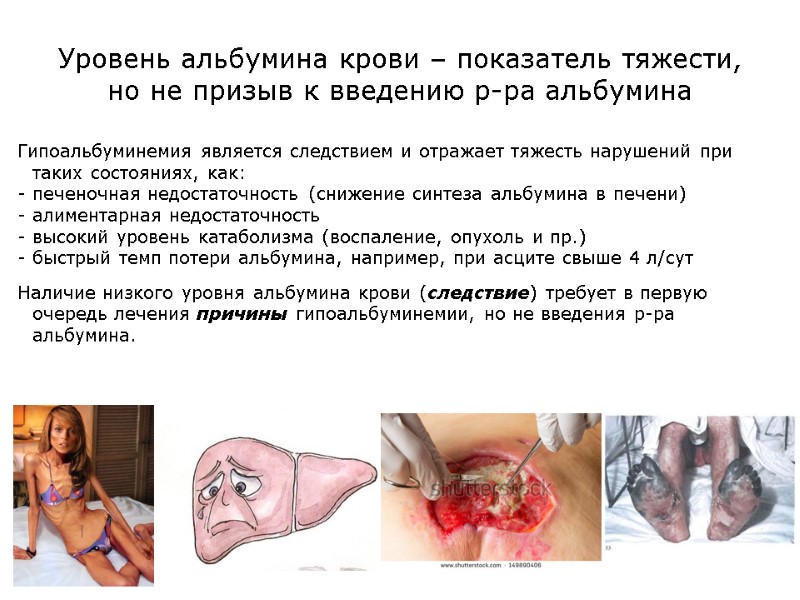
Уровень альбумина крови – показатель тяжести, но не призыв к введению р-ра альбумина Гипоальбуминемия является следствием и отражает тяжесть нарушений при таких состояниях, как: печеночная недостаточность (снижение синтеза альбумина в печени) алиментарная недостаточность высокий уровень катаболизма (воспаление, опухоль и пр.) быстрый темп потери альбумина, например, при асците свыше 4 л/сут Наличие низкого уровня альбумина крови (следствие) требует в первую очередь лечения причины гипоальбуминемии, но не введения р-ра альбумина.

Когда нужно/не нужно вводить р-р альбумина Введение р-ра альбумина повышает уровень альбумина крови. При этом введение р-ра альбумина маскирует тяжесть процесса, вызвавшего гипоальбуминемию, но не улучшает выживаемость пациентов (доказано исследованиями). Уровень альбумина крови выше 20–25 г/л не имеет смысла повышать введением р-ра альбумина (доказано исследованиями). Но имеет смысл лечить причину гипоальбуминемии: улучшать функцию печени, нутритивный статус и уменьшать активность патологического процесса, вызвавшего тяжелый катаболизм. Уровень альбумина крови ниже 20 г/л стоит повышать введением р-ра экзогенного альбумина. Интересное исключение: вводить р-р экзогенного альбумина, независимо от уровня альбумина крови, необходимо при развитии гепато-ренального синдрома 1-го типа. Причем вводить в дозе 1 г/кг в сутки, в сочетании с вазопрессорами и до момента ухода от вазопрессоров.

Recent large RCT trials on Albumin use Saline versus Albumin Fluid Evaluation study (SAFE) – 6.997 pts (Australia & NZ) The Albumin Italian Outcome Sepsis study (ALBIOS) – 1.818 pts (Italia) Early Albumin Resuscitation during Septic Shock study (EARSS) – 798 pts (France)

Об исследовании SAFE в 2-х словах Рандомизированное исследование. 6.997 пациентов в 16 ОРИТах. Группа с применением альбумина (3.497) и группа только с кристаллоидом (3.500). В альбуминовую группу 1,5 года вместо всех жидкостей вливали только 4% р-р альбумина! Не было разницы между группами ни по 28-дневной летальности, ни по длительности лечения в ОРИТе и госпитале, ни по длительности ИВЛ или применения ЗПТ. A Comparison of Albumin and Saline for Fluid Resuscitation in the Intensive Care Unit (The SAFE Study), N Engl J Med 2004;350:2247-56.
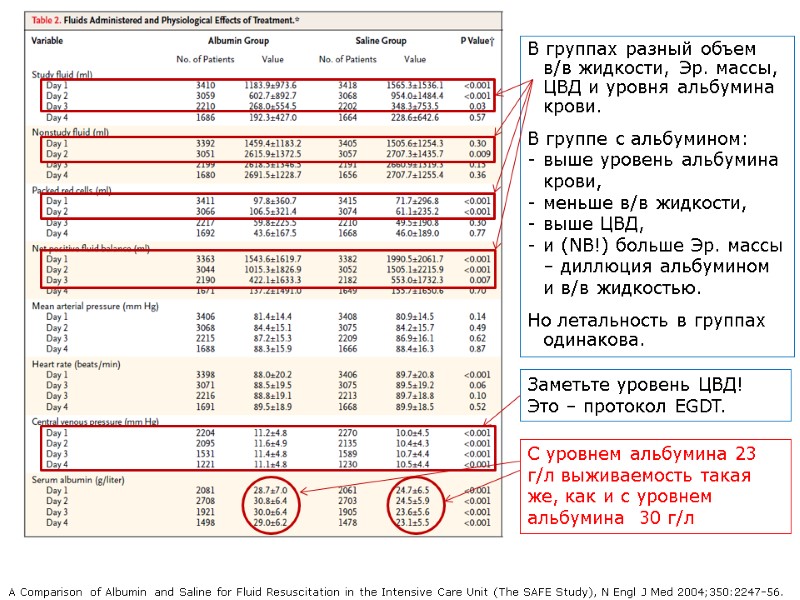
В группах разный объем в/в жидкости, Эр. массы, ЦВД и уровня альбумина крови. В группе с альбумином: выше уровень альбумина крови, меньше в/в жидкости, выше ЦВД, и (NB!) больше Эр. массы – диллюция альбумином и в/в жидкостью. Но летальность в группах одинакова. A Comparison of Albumin and Saline for Fluid Resuscitation in the Intensive Care Unit (The SAFE Study), N Engl J Med 2004;350:2247-56. С уровнем альбумина 23 г/л выживаемость такая же, как и с уровнем альбумина 30 г/л Заметьте уровень ЦВД! Это – протокол EGDT.
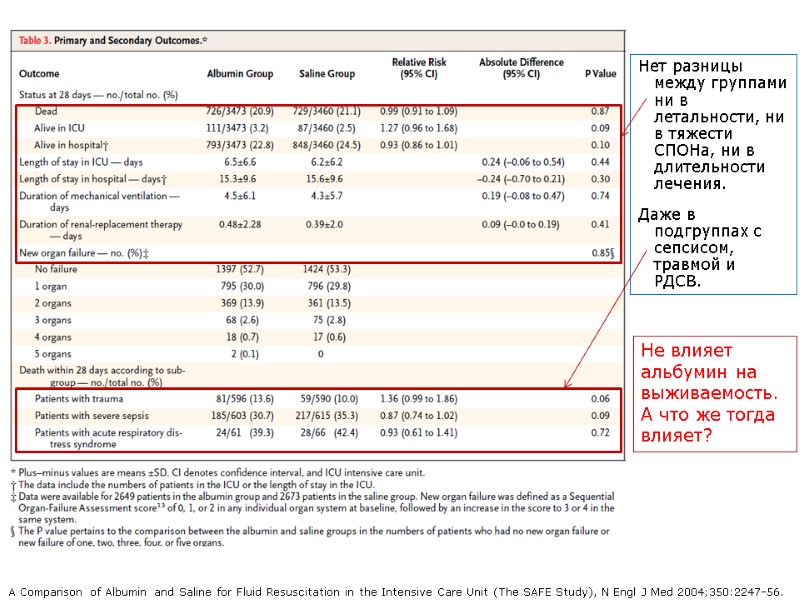
Нет разницы между группами ни в летальности, ни в тяжести СПОНа, ни в длительности лечения. Даже в подгруппах с сепсисом, травмой и РДСВ. A Comparison of Albumin and Saline for Fluid Resuscitation in the Intensive Care Unit (The SAFE Study), N Engl J Med 2004;350:2247-56. Не влияет альбумин на выживаемость. А что же тогда влияет?

Заключение статьи по SAFE-study Исследование SAFE доказало, что альбумин и физ.р-р с клинической точки зрения одинаковы для восполнения внутрисосудистого объема в гетерогенной популяции пациентов ОРИТ. Я – критерий для введения альбумина, возможно, ниже 23 г/л при условии надлежащего уровня прочих методов ИТ (согревание, перфузия, коррекция преднагрузки/волемии, оксигенации и пр.) A Comparison of Albumin and Saline for Fluid Resuscitation in the Intensive Care Unit (The SAFE Study), N Engl J Med 2004;350:2247-56.

Детали статьи вкратце (основа статьи – SAFE study) Пациенты из SAFE-study (6.045), 2009 – 2012 годы, 16 ОРИТов в Австралии и Новой Зеландии Рандомизированно лечились либо только 4% р-ром альбумина, либо физ.р-ром. В каждой из групп выделили подгруппы в зависимости от исходного уровня альбумина крови: выше 25 г/л или ниже 25 г/л. В каждой их подгрупп (выше 25 г/л или ниже 25 г/л) нет разницы в летальности в зависимости от лечения 4% р-ром альбумина или физ.р-ром! Нет также разницы в длительности лечения в ОРИТе или госпитале, а также – длительности ИВЛ или ЗПТ. Заключение. Результаты лечения с применением альбумина или физ.р-рв одинаковы, независимо от начального уровня альбумина крови. Effect of baseline serum albumin concentration on outcome of resuscitation with albumin or saline in patients in intensive care units: analysis of data from the saline versus albumin fluid evaluation (SAFE) study / BMJ, doi:10.1136/bmj.38985.398704.7C (published 13 October 2006)
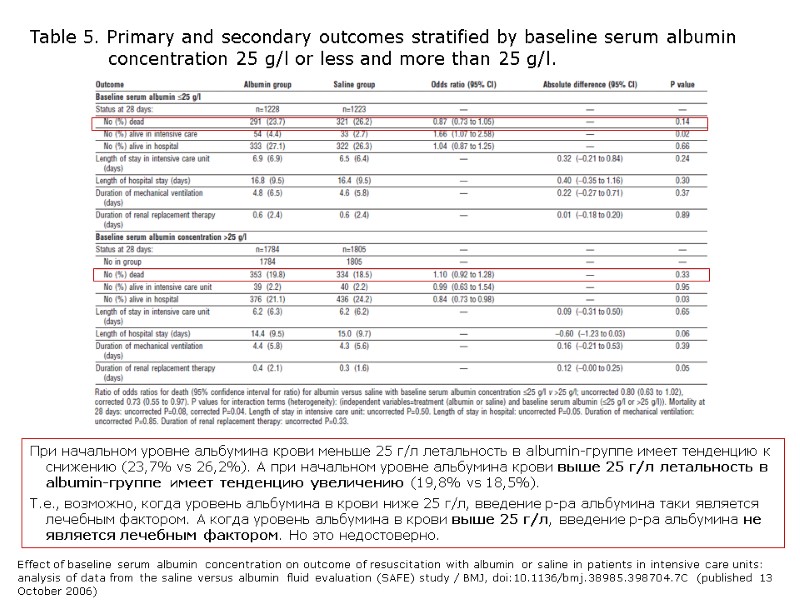
Table 5. Primary and secondary outcomes stratified by baseline serum albumin concentration 25 g/l or less and more than 25 g/l. При начальном уровне альбумина крови меньше 25 г/л летальность в albumin-группе имеет тенденцию к снижению (23,7% vs 26,2%). А при начальном уровне альбумина крови выше 25 г/л летальность в albumin-группе имеет тенденцию увеличению (19,8% vs 18,5%). Т.е., возможно, когда уровень альбумина в крови ниже 25 г/л, введение р-ра альбумина таки является лечебным фактором. А когда уровень альбумина в крови выше 25 г/л, введение р-ра альбумина не является лечебным фактором. Но это недостоверно. Effect of baseline serum albumin concentration on outcome of resuscitation with albumin or saline in patients in intensive care units: analysis of data from the saline versus albumin fluid evaluation (SAFE) study / BMJ, doi:10.1136/bmj.38985.398704.7C (published 13 October 2006)
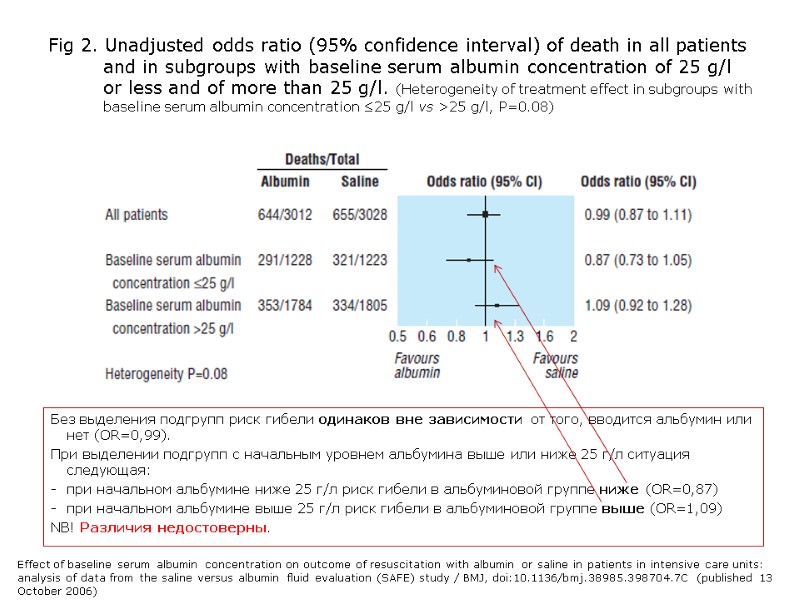
Fig 2. Unadjusted odds ratio (95% confidence interval) of death in all patients and in subgroups with baseline serum albumin concentration of 25 g/l or less and of more than 25 g/l. (Heterogeneity of treatment effect in subgroups with baseline serum albumin concentration ≤25 g/l vs >25 g/l, P=0.08) Без выделения подгрупп риск гибели одинаков вне зависимости от того, вводится альбумин или нет (OR=0,99). При выделении подгрупп с начальным уровнем альбумина выше или ниже 25 г/л ситуация следующая: при начальном альбумине ниже 25 г/л риск гибели в альбуминовой группе ниже (OR=0,87) при начальном альбумине выше 25 г/л риск гибели в альбуминовой группе выше (OR=1,09) NB! Различия недостоверны. Effect of baseline serum albumin concentration on outcome of resuscitation with albumin or saline in patients in intensive care units: analysis of data from the saline versus albumin fluid evaluation (SAFE) study / BMJ, doi:10.1136/bmj.38985.398704.7C (published 13 October 2006)

Albumin Replacement in Patients with Severe Sepsis or Septic Shock (ALBIOS) Pietro Caironi et al., N Engl J Med 2014;370:1412-21. DOI: 10.1056/NEJMoa1305727

Albumin Italian Outcome Sepsis (ALBIOS) study, (2008-2012) Многоцентровое рандомизированное исследование, 100 ОРИТ по всей Италии, 1.818 пациентов с сепсисом или септическим шоком. Альбуминовая группа получала 20% альбумин 300 мл в день и далее - до достижения уровня альбумина в крови 30 г/л. Получала весь период нахождения в ОРИТ или до 28 дней после рандомизации. Вторая группа, «кристаллоидная», не получала альбумин. Получала только кристаллоиды. Оценивали смертность через 28 и 90 дней. Заключение Включение альбумина в лечение пациентов с тяжелым сепсисом не улучшает 28- и 90- дневную выживаемость. (Funded by the Italian Medicines Agency; ALBIOS ClinicalTrials.gov number, NCT00707122.) Albumin Replacement in Patients with Severe Sepsis or Septic Shock (ALBIOS), Pietro Caironi et al., N Engl J Med 2014;370:1412-21. DOI: 10.1056/NEJMoa1305727
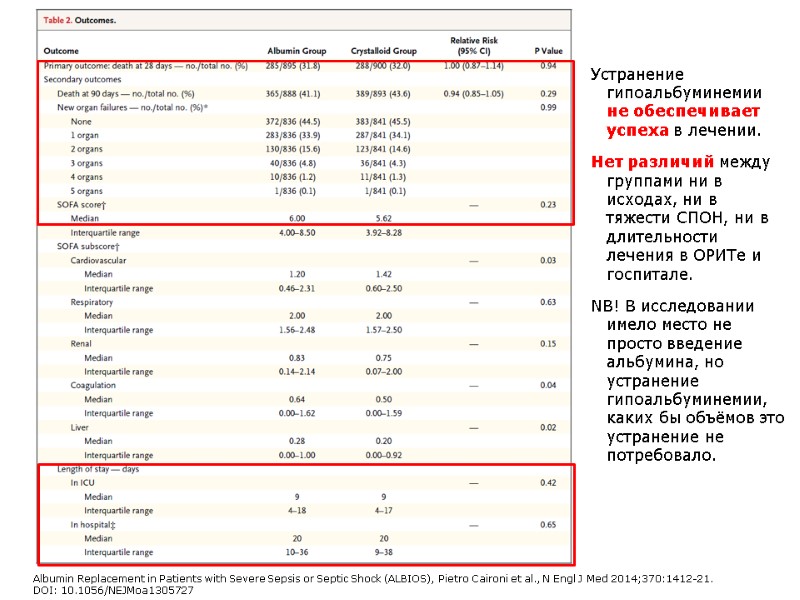
Устранение гипоальбуминемии не обеспечивает успеха в лечении. Нет различий между группами ни в исходах, ни в тяжести СПОН, ни в длительности лечения в ОРИТе и госпитале. NB! В исследовании имело место не просто введение альбумина, но устранение гипоальбуминемии, каких бы объёмов это устранение не потребовало. Albumin Replacement in Patients with Severe Sepsis or Septic Shock (ALBIOS), Pietro Caironi et al., N Engl J Med 2014;370:1412-21. DOI: 10.1056/NEJMoa1305727

EARSS study in France (2013) RCT study, France, 798 patients with septic shock of less than 6 hours duration randomized to receive Albumin group received 100 ml of 20% albumin or every 8 hours for 3 days. Almost all patients had severe hypoalbuminemia at study inclusion. There were no significant differences in mortality rates between the two groups (24.1 vs 26.3%). EARSS Study Group: Efficacy and tolerance of hyperoncotic albumin administration in septic shock patients: the EARSS study. Intensive Care Med 2011, 37(Suppl 2):S115–0438. К сожалению, по исследованию EARSS пока есть только abstract, без деталей
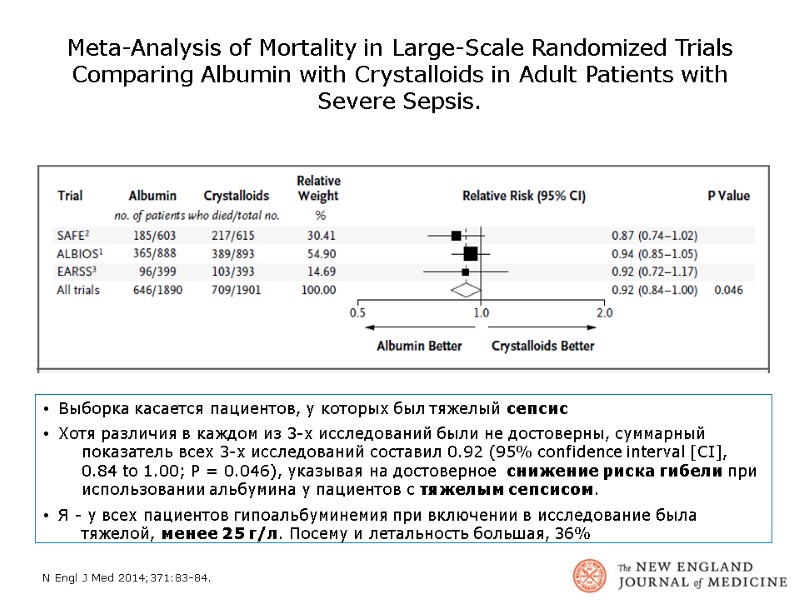
Meta-Analysis of Mortality in Large-Scale Randomized Trials Comparing Albumin with Crystalloids in Adult Patients with Severe Sepsis. Выборка касается пациентов, у которых был тяжелый сепсис Хотя различия в каждом из 3-х исследований были не достоверны, суммарный показатель всех 3-х исследований составил 0.92 (95% confidence interval [CI], 0.84 to 1.00; P = 0.046), указывая на достоверное снижение риска гибели при использовании альбумина у пациентов с тяжелым сепсисом. Я - у всех пациентов гипоальбуминемия при включении в исследование была тяжелой, менее 25 г/л. Посему и летальность большая, 36% N Engl J Med 2014;371:83-84.

Inappropriate indications to use Albumin («крик души» авторов протокола?) Albumin is not indicated in the following conditions (table II)32,33: albuminaemia > 2.5 g/dL (with the exception of the particular cases listed above); hypoalbuminaemia in the absence of oedema and acute hypotension; malnutrition; wound healing; non-haemorrhagic shock78,79; ascites responsive to diuretics; burns in the first 24 hours; protein-losing enteropathies and malabsorption; acute or chronic pancreatitis; haemodialysis80-83; cerebral ischaemia84; acute normovolaemic haemodilution in surgery; ovarian hyperstimulation syndrome85-87. Recommendations for the use of albumin and immunoglobulins, Giancarlo Liumbruno et al., Blood Transfus 2009; 7: 216-34 DOI 10.2450/2009.0094-09

А что будет, если заставить врачей ОРИТ использовать альбумин строго по протоколу, без всякого «клинического мышления» ?

Results (на ровном месте сэкономили кучу альбумина, денег, усилий, а также доказали, что протоколы пишут таки не дураки!) All patients (n=1.361) admitted to the SICU during the study period were included in this study. The implementation of albumin use guidelines resulted in a statistically significant reduction in albumin use (54%, P=.004, Figure 1). Similarly, a significant cost savings of 56% was found (Figure 2). The cost of albumin was calculated directly based on the unit cost of 12.5 g (25%) of albumin ($43 per 50-mL vial). No difference was seen in mean APACHE III scores on ICU day 1 in all 4 quarters. No difference in ICU mortality was identified with the reduction in albumin use, despite a higher APACHE III score and predicted ICU mortality in that quarter. The ICU mortality was significantly lower than the predicted ICU mortality during all quarters (Table 1). No difference in mean ICU length of stay was noted. Follow-up data for albumin use documented a persistent reduction in albumin use in the SICU during the next 6 quarters (2005-2006, Table 2). Albumin Use Guidelines and Outcome in a Surgical Intensive Care Unit, Anthony Charles et al., Arch Surg. 2008; 143(10):935-939 / Author Affiliations: Department of Surgery, Division of Acute Care Surgery, University of Michigan / 2008 American Medical Association
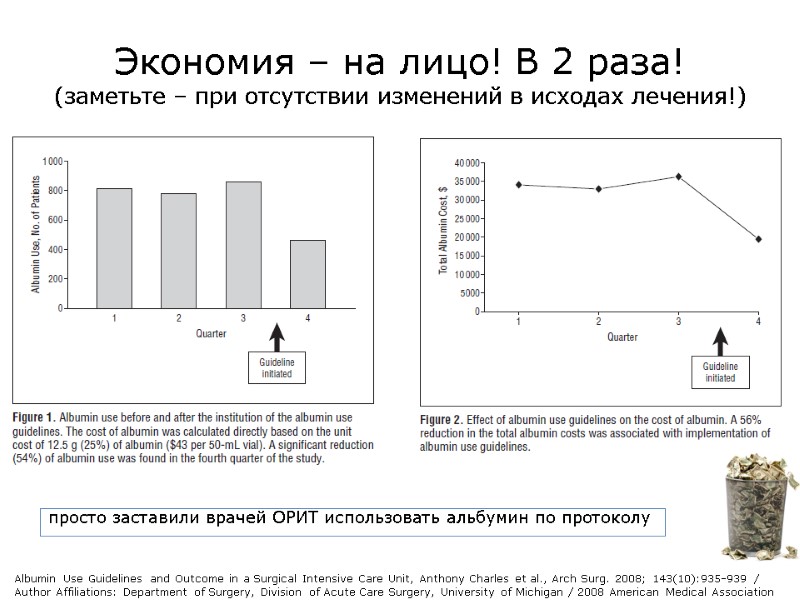
Экономия – на лицо! В 2 раза! (заметьте – при отсутствии изменений в исходах лечения!) просто заставили врачей ОРИТ использовать альбумин по протоколу Albumin Use Guidelines and Outcome in a Surgical Intensive Care Unit, Anthony Charles et al., Arch Surg. 2008; 143(10):935-939 / Author Affiliations: Department of Surgery, Division of Acute Care Surgery, University of Michigan / 2008 American Medical Association

А что пишут в протоколах, касательно альбумина?

Клінічний протокол надання медичної допомоги хворим і постраждалим з тяжким геморагічним шоком Додаток до наказу МОЗ №430 від 03-07-2006 (http://medstandart.net/browse/2103) (объём текста - 3 стр.) Тема, опис документа: Протокол надання медичної допомоги Вид допомоги: амбулаторний, стаціонарний, цільова група: не вказано Напрямок медицини: Анестезіологія та інтенсивна терапія Клінічний стан, патології: Тяжкий геморагічний шок Затверджено. Наказ МОЗ України від 03.07.2006 № 430 Клінічний протокол Надання медичної допомоги хворим і постраждалим з тяжким геморагічним шоком Код МКХ 10: Т.81.1

Показання до гемотрансфузій: За умови повного восповнення ОЦК рідиною це - зниження концентрації Нв крові до 70 – 80 г/л та нижче, та у пацієнтів з супутніми захворюваннями (ішемічна хіороба серця, серцева недостатність, судинні захворювання головного мозку чи черепно-мозкова травма, недостатність зовнішнього дихання) - зниження концентрації Нв до 90 – 100 г/л; за умови концентрації Нв крові ≥ 100 г/л показанням до гемотрансфузії може бути тільки некотрольована профузна кровотеча. Клінічний протокол надання медичної допомоги хворим і постраждалим з тяхким геморагічним шоком. Додаток до наказу МОЗ №430 від 03-07-2006. (http://medstandart.net/browse/2103) О плазме и альбумине в Протоколе ни слова

Руководство по интенсивной терапии под. ред. профессоров А.И. Трещинского и Ф.С. Глумчера, 2004 Эр. массу не льём, пока Нв ≥ 70-90 г/л СЗП не льём без массивной кровопотери и серьёзной коагулопатии. Об трансфузии альбумина ни слова. НЕ значимо. (объём текста 1,5 стр.)


Показаниями для дополнительных трансфузий являются: эритроцитной массы – снижение Hb менее 70-90 г/л или Ht менее 25%, а так же тахикардия, не объяснимая другими причинами, снижение показателей оксигенации (без признаков легочной недостаточности). СЗП – снижение ПТИ менее 60%, снижение фибриногена менее 0,8 г/л, удлиннение ТВ и АЧТВ более чем в 1,8 раза от контрольных показателей. альбумина – снижение общего белка менее 52 г/л или альбумина менее 25 г/л при отсутстивии признаков каппилярной утечки; тромбоцитной массы – снижение числа тромбоцитов менее 50х109/л или же снижение индуцированной агрегации тромбоцитов в половину от нормы. Отраслевой стандарт «Протокол ведения больных. Профилактика и лечение операционной кровопотери» для применения в системе здравоохранения Российской Федерации.
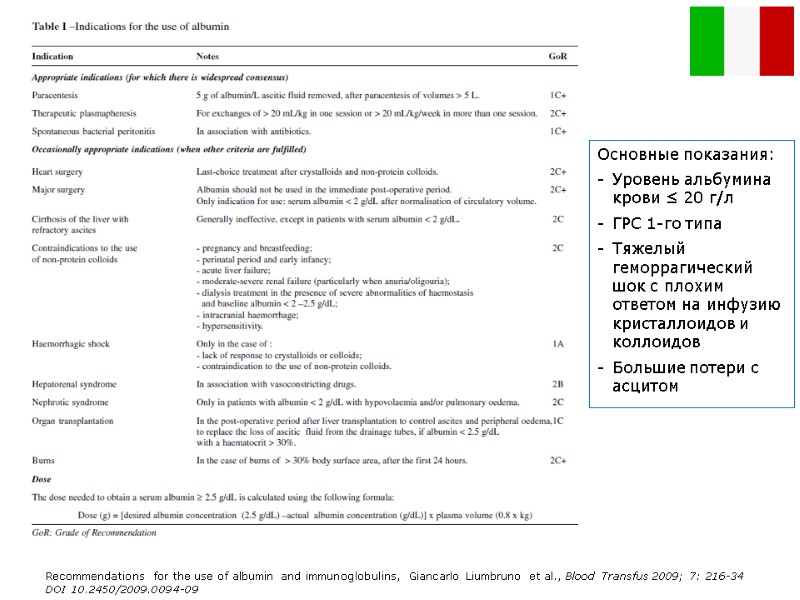
Основные показания: Уровень альбумина крови ≤ 20 г/л ГРС 1-го типа Тяжелый геморрагический шок с плохим ответом на инфузию кристаллоидов и коллоидов Большие потери с асцитом Recommendations for the use of albumin and immunoglobulins, Giancarlo Liumbruno et al., Blood Transfus 2009; 7: 216-34 DOI 10.2450/2009.0094-09

В заключении - о пользе альбумина При использовании для восполнения ОЦК не улучшает выживаемость При использовании для устранении гипоальбуминемии не улучшает выживаемость Даже у американцев в 50 % случаев альбумин применяется необоснованно! Но они – богатая страна, а мы? Уровень альбумина крови – показатель тяжести, но не призыв к введению раствора альбумина Альбумин не вреден даже в больших количествах

Так когда же нужно вводить альбумин в человека? Показания для введения альбумина: Уровень альбумина крови ≤ 20 г/л ГРС 1-го типа Тяжелый геморрагический шок с плохим ответом на инфузию кристаллоидов и коллоидов Большие потери с асцитом
Спасибо. Надеюсь, было полезно

Ну что, возьмем всё лучшее из современной медицины развитых стран или будем изобретать свой велосипед?
1030-anesteziya_i_it_pri_high_risk_abd_surgery_v3.ppt
- Количество слайдов: 93

