Лекция 2-Аналитическая химия.ppt
- Количество слайдов: 50
 Аналитическая химия Лекция 2 Химическое равновесие в гомогенной и гетерогенной системах. Кислотно-основное равновесие.
Аналитическая химия Лекция 2 Химическое равновесие в гомогенной и гетерогенной системах. Кислотно-основное равновесие.
 Методы анализа: Химические основаны на химических, в том числе электрохимических, реакциях; l Физические основаны на физических явлениях и процессах (взаимодействие вещества с потоком энергии); l Биологические основаны на явлениях жизни. l
Методы анализа: Химические основаны на химических, в том числе электрохимических, реакциях; l Физические основаны на физических явлениях и процессах (взаимодействие вещества с потоком энергии); l Биологические основаны на явлениях жизни. l
 Химические методы анализа: l Химические (классические методы) гравиметрия и титриметрия Физико-химические (инструментальные) электрохимические и оптические
Химические методы анализа: l Химические (классические методы) гравиметрия и титриметрия Физико-химические (инструментальные) электрохимические и оптические
 Классические методы анализа Определение «классические» не следует понимать как «устаревшие» . Большинство основополагающих принципов классических химических методов сохраняют свое значение и в области «высоких аналитических технологий» . Пример: Суть процессов диссоциации и восстановления химических веществ в водных растворах легко адаптируется к подобным же процессам, протекающим в пламени в условиях атомно-абсорбционного анализа
Классические методы анализа Определение «классические» не следует понимать как «устаревшие» . Большинство основополагающих принципов классических химических методов сохраняют свое значение и в области «высоких аналитических технологий» . Пример: Суть процессов диссоциации и восстановления химических веществ в водных растворах легко адаптируется к подобным же процессам, протекающим в пламени в условиях атомно-абсорбционного анализа
 Основа классических методов анализа применение химических реакций для определения вещества. В аналитических методах используется - состояние химического равновесия и величины, его характеризующее; - процесс протекания реакции во времени.
Основа классических методов анализа применение химических реакций для определения вещества. В аналитических методах используется - состояние химического равновесия и величины, его характеризующее; - процесс протекания реакции во времени.
 Основные закономерности, связанные с химическим равновесием l Ни одна химическая реакция не протекает до конца. В ходе реакции устанавливается состояние равновесия, при котором в системе в тех или иных количествах присутствуют все участвующие и образующиеся в реакции вещества; l Это справедливо и для гомогенных систем, состоящих из одной фазы, и для гетерогенных систем, включающих несколько фаз. Фаза – часть системы, обладающая во всех точках одинаковыми свойствами – показателем преломления, вязкостью и т. д.
Основные закономерности, связанные с химическим равновесием l Ни одна химическая реакция не протекает до конца. В ходе реакции устанавливается состояние равновесия, при котором в системе в тех или иных количествах присутствуют все участвующие и образующиеся в реакции вещества; l Это справедливо и для гомогенных систем, состоящих из одной фазы, и для гетерогенных систем, включающих несколько фаз. Фаза – часть системы, обладающая во всех точках одинаковыми свойствами – показателем преломления, вязкостью и т. д.
 Типы химических реакций, используемых в химическом анализе l l К а, К b β Кислотно-основные Комлексообразования константа образования! l l Окислительно-восстановительные Осаждения-растворения К р, Е о Ks (ПР)
Типы химических реакций, используемых в химическом анализе l l К а, К b β Кислотно-основные Комлексообразования константа образования! l l Окислительно-восстановительные Осаждения-растворения К р, Е о Ks (ПР)
 Любое химическое равновесие можно записать: а. А + в. В ↔ с. С + d. D В зависимости от условий состояние равновесия реакции характеризуется: l Термодинамической константой Ко = l Реальной К= l Условной К’ =
Любое химическое равновесие можно записать: а. А + в. В ↔ с. С + d. D В зависимости от условий состояние равновесия реакции характеризуется: l Термодинамической константой Ко = l Реальной К= l Условной К’ =
 Величина константы равновесия (К) (для идеальных условий) Ко = зависит от температуры; l давления; l природы растворителя (для реакций, протекающих в растворах). l Значение К позволяет оценить глубину протекания и определить направление реакции.
Величина константы равновесия (К) (для идеальных условий) Ко = зависит от температуры; l давления; l природы растворителя (для реакций, протекающих в растворах). l Значение К позволяет оценить глубину протекания и определить направление реакции.
 В ряде случаев в химических процессах принимают участие вещества в стандартном состоянии: твердые вещества; l газы при давлении 1 атм. ; l чистые жидкости (в частности, растворитель, если раствор достаточно разбавлен). l Пример: Cu. Oтв + 2 H+ ↔ Cu 2+ + H 2 O К =
В ряде случаев в химических процессах принимают участие вещества в стандартном состоянии: твердые вещества; l газы при давлении 1 атм. ; l чистые жидкости (в частности, растворитель, если раствор достаточно разбавлен). l Пример: Cu. Oтв + 2 H+ ↔ Cu 2+ + H 2 O К =
 Закон действия масс, выражение константы равновесия является его математической формулировкой, который гласит: «Для идеальных систем в состоянии химического равновесия отношение произведений концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре, давлении и в данном растворителе» .
Закон действия масс, выражение константы равновесия является его математической формулировкой, который гласит: «Для идеальных систем в состоянии химического равновесия отношение произведений концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре, давлении и в данном растворителе» .
 Идеальные и реальные системы l Идеальные системы – бесконечно разбавленные растворы, в которых частицы не испытывают взаимодействия со стороны других, проявляют себя полностью: αА = [A] = СА l Реальные системы – растворы, в которых присутствуют взаимодействия между ионами: электростатические αА ≠ [A] = СА; химические αА ≠ [A] ≠ СА.
Идеальные и реальные системы l Идеальные системы – бесконечно разбавленные растворы, в которых частицы не испытывают взаимодействия со стороны других, проявляют себя полностью: αА = [A] = СА l Реальные системы – растворы, в которых присутствуют взаимодействия между ионами: электростатические αА ≠ [A] = СА; химические αА ≠ [A] ≠ СА.
![Способы выражения концентраций l αА – активность компонента А (моль/л) l [A] – равновесная Способы выражения концентраций l αА – активность компонента А (моль/л) l [A] – равновесная](https://present5.com/presentation/5828166_54405790/image-13.jpg) Способы выражения концентраций l αА – активность компонента А (моль/л) l [A] – равновесная концентрация А l СА – общая концентрация А
Способы выражения концентраций l αА – активность компонента А (моль/л) l [A] – равновесная концентрация А l СА – общая концентрация А
 Химическое равновесие : а. А + в. В ↔ с. С + d. D В зависимости от условий состояние равновесия реакции характеризуется: l l l Термодинамической константой - идеальная система Ко = Реальной учитывает электростатические взаимодействия К= Условной учитывает химические взаимодействия К’ =
Химическое равновесие : а. А + в. В ↔ с. С + d. D В зависимости от условий состояние равновесия реакции характеризуется: l l l Термодинамической константой - идеальная система Ко = Реальной учитывает электростатические взаимодействия К= Условной учитывает химические взаимодействия К’ =
 Электростатические взаимодействия l l l Кулоновские между ионами Диполь-дипольные между полярными молекулами Ван-дер-ваальсовы между любыми частицами в растворе Электростатические взаимодействия приводят к отклонениям в поведении системы от идеального. Учесть влияние электростатических факторов позволяет метод активностей.
Электростатические взаимодействия l l l Кулоновские между ионами Диполь-дипольные между полярными молекулами Ван-дер-ваальсовы между любыми частицами в растворе Электростатические взаимодействия приводят к отклонениям в поведении системы от идеального. Учесть влияние электростатических факторов позволяет метод активностей.
![Метод активностей Сущность метода состоит в том, что вместо концентраций реагирующих веществ [A] используют Метод активностей Сущность метода состоит в том, что вместо концентраций реагирующих веществ [A] используют](https://present5.com/presentation/5828166_54405790/image-16.jpg) Метод активностей Сущность метода состоит в том, что вместо концентраций реагирующих веществ [A] используют величины, называемые активностями αА. Активность αА – концентрация, которую имел бы компонент воображаемого идеального раствора, обладающего теми же термодинамическими свойствами, что и данный реальный раствор.
Метод активностей Сущность метода состоит в том, что вместо концентраций реагирующих веществ [A] используют величины, называемые активностями αА. Активность αА – концентрация, которую имел бы компонент воображаемого идеального раствора, обладающего теми же термодинамическими свойствами, что и данный реальный раствор.
![Коэффициент активности γА = αА / [A] Мера электростатических взаимодействий между ионами или l Коэффициент активности γА = αА / [A] Мера электростатических взаимодействий между ионами или l](https://present5.com/presentation/5828166_54405790/image-17.jpg) Коэффициент активности γА = αА / [A] Мера электростатических взаимодействий между ионами или l l Мера того, насколько свойства системы отличаются от идеальной. Для идеальных растворов γА = 1.
Коэффициент активности γА = αА / [A] Мера электростатических взаимодействий между ионами или l l Мера того, насколько свойства системы отличаются от идеальной. Для идеальных растворов γА = 1.
 Величина коэффициента активности зависит от заряда и ионной силы, создаваемой всеми ионами в растворе: Коэффициенты активностей для индивидуальных ионов можно теоретически оценить по формулам Дебая-Хюккеля: l l если I < 0, 01 М I < 0, 1 М Уравнение Девиса при I = 0, 1 -0, 5 М А 0, 5 и В 0, 33 – константы, зависящие от Т и растворителя (приведены для воды); а –эмперическая константа, учитывающая размеры ионов и характеризующая среднее расстояние сближения сольватированных ионов в предположении, что они являются жесткими сферами (3 )
Величина коэффициента активности зависит от заряда и ионной силы, создаваемой всеми ионами в растворе: Коэффициенты активностей для индивидуальных ионов можно теоретически оценить по формулам Дебая-Хюккеля: l l если I < 0, 01 М I < 0, 1 М Уравнение Девиса при I = 0, 1 -0, 5 М А 0, 5 и В 0, 33 – константы, зависящие от Т и растворителя (приведены для воды); а –эмперическая константа, учитывающая размеры ионов и характеризующая среднее расстояние сближения сольватированных ионов в предположении, что они являются жесткими сферами (3 )
 Средний коэффициент активности l Для бинарного электролита АВ: l Для электролита Аm. Bn: Д/З: Разобрать зависимость среднего коэффициента активности от ионной силы. Основы аналитической химии. Т. 1. Стр. 102.
Средний коэффициент активности l Для бинарного электролита АВ: l Для электролита Аm. Bn: Д/З: Разобрать зависимость среднего коэффициента активности от ионной силы. Основы аналитической химии. Т. 1. Стр. 102.
 Допущения для расчетов активности иона или электролита в растворе: l l l Коэффициенты активности ионов одинакового заряда независимо от радиуса ионов примерно равны; Коэффициенты активностей нейтральных частиц в разбавленных растворах электролитов полагают равными единице; Очень разбавленные растворы, например насыщенный раствор малорастворимого соединения, можно считать идеальным.
Допущения для расчетов активности иона или электролита в растворе: l l l Коэффициенты активности ионов одинакового заряда независимо от радиуса ионов примерно равны; Коэффициенты активностей нейтральных частиц в разбавленных растворах электролитов полагают равными единице; Очень разбавленные растворы, например насыщенный раствор малорастворимого соединения, можно считать идеальным.
 Химические взаимодействия Компоненты системы могут участвовать в нескольких равновесиях: Одну из реакций рассматривают как главную; все остальные в качестве побочных (конкурирующих). Концентрацию отдельной формы в состоянии равновесия называют равновесной [A]. А сумму концентраций соответствующих равновесных форм называют общей СА.
Химические взаимодействия Компоненты системы могут участвовать в нескольких равновесиях: Одну из реакций рассматривают как главную; все остальные в качестве побочных (конкурирующих). Концентрацию отдельной формы в состоянии равновесия называют равновесной [A]. А сумму концентраций соответствующих равновесных форм называют общей СА.
 Уравнения баланса – уравнения, связывающие равновесные и общие концентрации химических форм вещества: l Уравнение материального баланса. Число атомов данного типа в изолированной системе неизменно (закон сохранения массы): В растворе частицы А ; АХ 2; АХ 3 l Уравнение электронейтральности. В закрытой системе общее число положительных зарядов равно общему числу отрицательных ионов (закон сохранение заряда): В растворе частицы l α-Коэффициент (мольная доля).
Уравнения баланса – уравнения, связывающие равновесные и общие концентрации химических форм вещества: l Уравнение материального баланса. Число атомов данного типа в изолированной системе неизменно (закон сохранения массы): В растворе частицы А ; АХ 2; АХ 3 l Уравнение электронейтральности. В закрытой системе общее число положительных зарядов равно общему числу отрицательных ионов (закон сохранение заряда): В растворе частицы l α-Коэффициент (мольная доля).
 α-Коэффициент (молярная доля) l l Характеристика глубины протекания конкурирующих реакций. Мера степени химических взаимодействий в системе. Величины α-коэффициентов могут изменяться в пределах от 0 до 1. При отсутствии конкурирующих реакций [A] = CA и α = 1. Пример: αCr = 2[Cr 2 O 7]/CCr
α-Коэффициент (молярная доля) l l Характеристика глубины протекания конкурирующих реакций. Мера степени химических взаимодействий в системе. Величины α-коэффициентов могут изменяться в пределах от 0 до 1. При отсутствии конкурирующих реакций [A] = CA и α = 1. Пример: αCr = 2[Cr 2 O 7]/CCr
 Связь между активностью, равновесной и общей концентрациями Взаимосвязь термодинамической, реальной и условной констант
Связь между активностью, равновесной и общей концентрациями Взаимосвязь термодинамической, реальной и условной констант
 Кислотно-основное равновесие
Кислотно-основное равновесие
 Теории кислот и оснований Теория Аррениуса (1887) Кислота – вещество, диссоциирующее с образованием протона; Основание - вещество, диссоциирующее с образованием гидроксил-иона)
Теории кислот и оснований Теория Аррениуса (1887) Кислота – вещество, диссоциирующее с образованием протона; Основание - вещество, диссоциирующее с образованием гидроксил-иона)
 Электронная теория Льюиса (1923 ) l l Кислота – акцептор электронных пар; Основание - донор электронных пар. Примеры: кислота основание Ag+ + Н+ + Cu 2+ + 2: NH 3 ↔ [Ag(NH 3)2] : ОН- ↔ Н 2 О 4: NH 3 ↔ [Cu(NH 3)]2+
Электронная теория Льюиса (1923 ) l l Кислота – акцептор электронных пар; Основание - донор электронных пар. Примеры: кислота основание Ag+ + Н+ + Cu 2+ + 2: NH 3 ↔ [Ag(NH 3)2] : ОН- ↔ Н 2 О 4: NH 3 ↔ [Cu(NH 3)]2+
 Кислотно-основная (протолитическая) теория Бренстеда – Лоури (1923) l l Кислота – частица (молекула, ион), отдающая протон; Основание - частица (молекула, ион), принимающая протон. Примеры: Кислотами и основаниями могут быть молекулы: HCl ↔ H+ + Cl- ; NH 3 + H+ ↔ NH 4+ катионы: [Al(H 2 O)6]3+ ↔ H+ + [Al(H 2 O)5 OH]2+ [Zn(OH)(H 2 O)5]+ + H+ ↔ [Zn(H 2 O)6]2+ анионы: HSO 4 - ↔ H+ + SO 42 CO 32 - + H+ ↔ HCO 3 -
Кислотно-основная (протолитическая) теория Бренстеда – Лоури (1923) l l Кислота – частица (молекула, ион), отдающая протон; Основание - частица (молекула, ион), принимающая протон. Примеры: Кислотами и основаниями могут быть молекулы: HCl ↔ H+ + Cl- ; NH 3 + H+ ↔ NH 4+ катионы: [Al(H 2 O)6]3+ ↔ H+ + [Al(H 2 O)5 OH]2+ [Zn(OH)(H 2 O)5]+ + H+ ↔ [Zn(H 2 O)6]2+ анионы: HSO 4 - ↔ H+ + SO 42 CO 32 - + H+ ↔ HCO 3 -
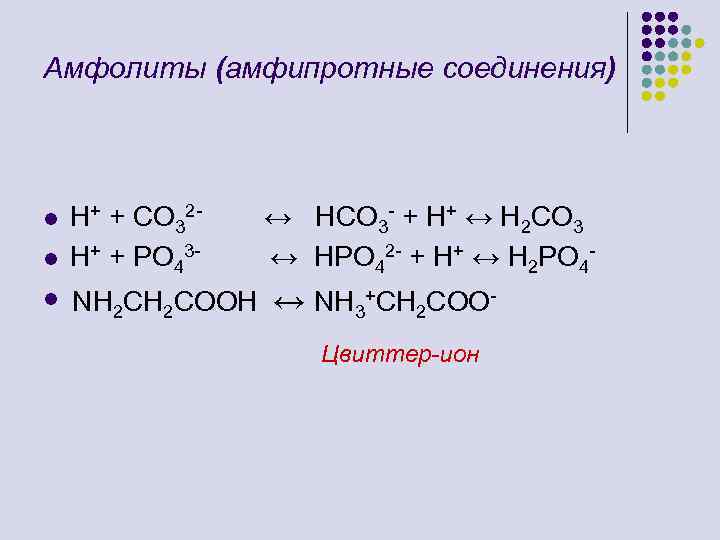 Амфолиты (амфипротные соединения) l l l H+ + CO 32 H+ + PO 43 - ↔ HCO 3 - + H+ ↔ H 2 CO 3 ↔ HPO 42 - + H+ ↔ H 2 PO 4 - NH 2 COOH ↔ NH 3+CH 2 COOЦвиттер-ион
Амфолиты (амфипротные соединения) l l l H+ + CO 32 H+ + PO 43 - ↔ HCO 3 - + H+ ↔ H 2 CO 3 ↔ HPO 42 - + H+ ↔ H 2 PO 4 - NH 2 COOH ↔ NH 3+CH 2 COOЦвиттер-ион
 Каждой кислоте соответствует сопряженное с ней основание и наоборот НА ↔ Н+ + А-; НА/A- - сопряженная кислотно-основная пара H 3 O + ↔ H + + H 2 O CH 3 COOH ↔ H+ + CH 3 COONH 4+ ↔ H+ + NH 3 HSO 4 - ↔ H+ + SO 42 -
Каждой кислоте соответствует сопряженное с ней основание и наоборот НА ↔ Н+ + А-; НА/A- - сопряженная кислотно-основная пара H 3 O + ↔ H + + H 2 O CH 3 COOH ↔ H+ + CH 3 COONH 4+ ↔ H+ + NH 3 HSO 4 - ↔ H+ + SO 42 -
 В кислотно-основном равновесии всегда участвуют две кислотно-основные пары НА + В- ↔ НВ + АК-та 1 Осн 2 К-та 2 Осн 1 Кислотно-основное взаимодействие проходит с участием растворителя
В кислотно-основном равновесии всегда участвуют две кислотно-основные пары НА + В- ↔ НВ + АК-та 1 Осн 2 К-та 2 Осн 1 Кислотно-основное взаимодействие проходит с участием растворителя
 Свойства растворителей l l l Диэлектрическая проницаемость; Способность к образованию водородных связей; Электродонорные и электроакцепторные свойства; Структурные свойства; Способность проявлять собственные кислотные или основные свойства.
Свойства растворителей l l l Диэлектрическая проницаемость; Способность к образованию водородных связей; Электродонорные и электроакцепторные свойства; Структурные свойства; Способность проявлять собственные кислотные или основные свойства.
 Классификация растворителей по кислотно-основным свойствам l l Апротонные (бензол, хлороформ, хлорбензол) Протофильные (ж. аммиак, анилин, пиридин) Протогенные (б/в H 2 SO 4, CH 3 COOH, HCOOH) Амфипротные (вода, метанол, этанол)
Классификация растворителей по кислотно-основным свойствам l l Апротонные (бензол, хлороформ, хлорбензол) Протофильные (ж. аммиак, анилин, пиридин) Протогенные (б/в H 2 SO 4, CH 3 COOH, HCOOH) Амфипротные (вода, метанол, этанол)
 Автопротолиз SH + SH ↔ SH 2+ + Sион лиония ион лиата NH 3 + NH 3 ↔ NH 4+ + NH 2 CH 3 OH + CH 3 OH ↔ CH 3 OH 2+ + CH 3 OН 2 О + Н 2 О ↔ Н 3 О+ + ОНион гидроксония гидрат ион Константа автопротолиза Кт = αSH + · αS- / α 2 SH 2 Кт. SH = αSH 2+ · αS-; Кт W = αH 3 O + · αOH- KW = 0, 13· 10 -14 (t = 00 C) 1, 0· 10 -14 (t = 250 C) 48· 10 -14 (t = 1000 C)
Автопротолиз SH + SH ↔ SH 2+ + Sион лиония ион лиата NH 3 + NH 3 ↔ NH 4+ + NH 2 CH 3 OH + CH 3 OH ↔ CH 3 OH 2+ + CH 3 OН 2 О + Н 2 О ↔ Н 3 О+ + ОНион гидроксония гидрат ион Константа автопротолиза Кт = αSH + · αS- / α 2 SH 2 Кт. SH = αSH 2+ · αS-; Кт W = αH 3 O + · αOH- KW = 0, 13· 10 -14 (t = 00 C) 1, 0· 10 -14 (t = 250 C) 48· 10 -14 (t = 1000 C)
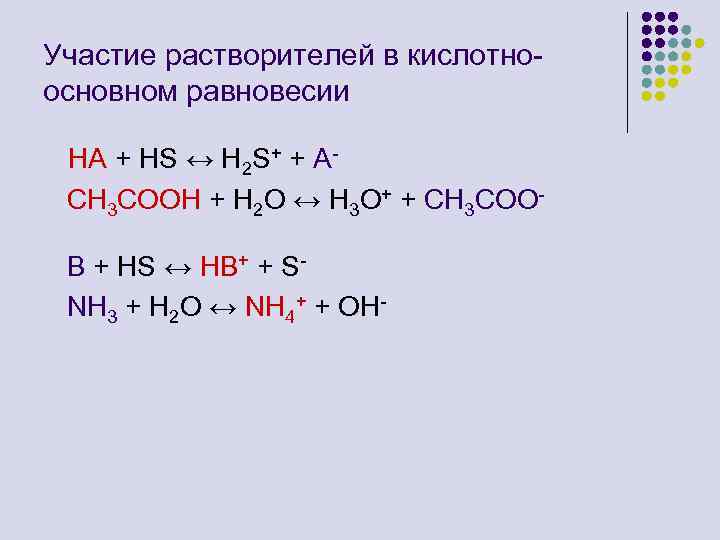 Участие растворителей в кислотноосновном равновесии HA + HS ↔ H 2 S+ + ACH 3 COOH + H 2 O ↔ H 3 O+ + CH 3 COOB + HS ↔ HB+ + SNH 3 + H 2 O ↔ NH 4+ + OH-
Участие растворителей в кислотноосновном равновесии HA + HS ↔ H 2 S+ + ACH 3 COOH + H 2 O ↔ H 3 O+ + CH 3 COOB + HS ↔ HB+ + SNH 3 + H 2 O ↔ NH 4+ + OH-
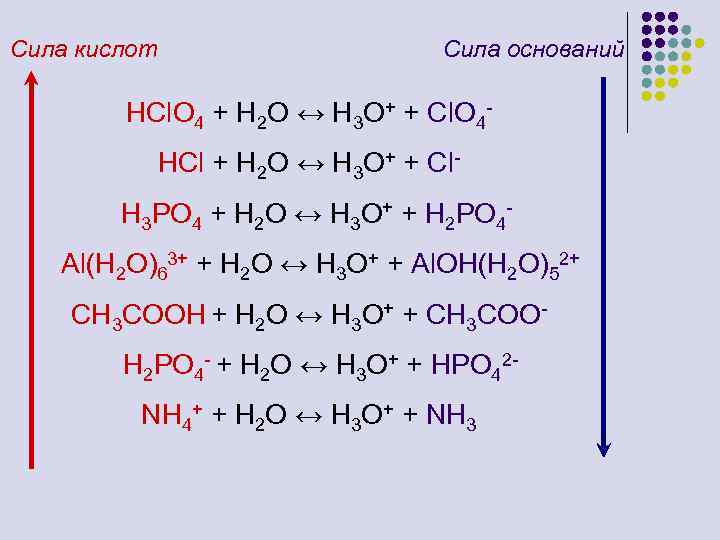 Сила кислот Сила оснований HCl. O 4 + H 2 O ↔ H 3 O+ + Cl. O 4 HCl + H 2 O ↔ H 3 O+ + Cl. H 3 PO 4 + H 2 O ↔ H 3 O+ + H 2 PO 4 Al(H 2 O)63+ + H 2 O ↔ H 3 O+ + Al. OH(H 2 O)52+ CH 3 COOH + H 2 O ↔ H 3 O+ + CH 3 COOH 2 PO 4 - + H 2 O ↔ H 3 O+ + HPO 42 NH 4+ + H 2 O ↔ H 3 O+ + NH 3
Сила кислот Сила оснований HCl. O 4 + H 2 O ↔ H 3 O+ + Cl. O 4 HCl + H 2 O ↔ H 3 O+ + Cl. H 3 PO 4 + H 2 O ↔ H 3 O+ + H 2 PO 4 Al(H 2 O)63+ + H 2 O ↔ H 3 O+ + Al. OH(H 2 O)52+ CH 3 COOH + H 2 O ↔ H 3 O+ + CH 3 COOH 2 PO 4 - + H 2 O ↔ H 3 O+ + HPO 42 NH 4+ + H 2 O ↔ H 3 O+ + NH 3
 l Константа кислотности НА Ka. HA, SH = αH 2 S+·αA-/αHA Ka. HA, H 2 O = αH 3 O+·αA-/αHA l Константа основности B Kb. B, SH = αHB+·αS-/αB Kb. B, H 2 O = αHB+·αOH-/αB
l Константа кислотности НА Ka. HA, SH = αH 2 S+·αA-/αHA Ka. HA, H 2 O = αH 3 O+·αA-/αHA l Константа основности B Kb. B, SH = αHB+·αS-/αB Kb. B, H 2 O = αHB+·αOH-/αB
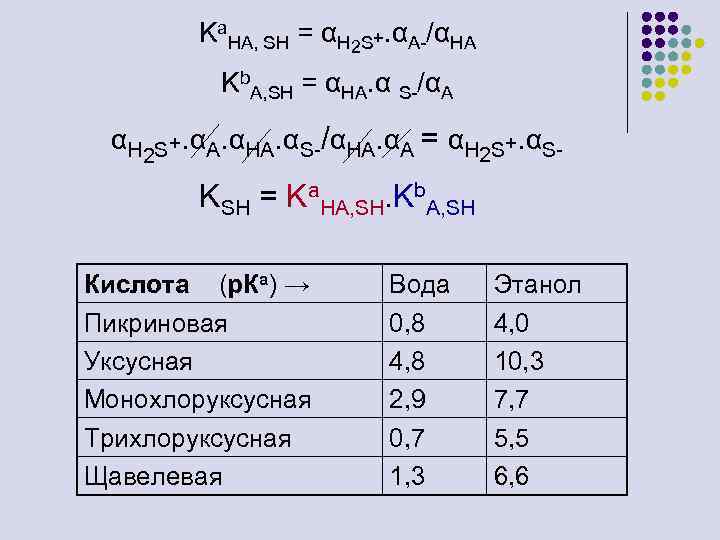 Ka. HA, SH = αH 2 S+. αA-/αHA Kb. A, SH = αHA. α S-/αA αH 2 S+. αA. αHA. αS-/αHA. αA = αH 2 S+. αS- KSH = Ka. HA, SH. Kb. A, SH Кислота (р. Ка) → Пикриновая Уксусная Монохлоруксусная Трихлоруксусная Щавелевая Вода 0, 8 4, 8 2, 9 0, 7 1, 3 Этанол 4, 0 10, 3 7, 7 5, 5 6, 6
Ka. HA, SH = αH 2 S+. αA-/αHA Kb. A, SH = αHA. α S-/αA αH 2 S+. αA. αHA. αS-/αHA. αA = αH 2 S+. αS- KSH = Ka. HA, SH. Kb. A, SH Кислота (р. Ка) → Пикриновая Уксусная Монохлоруксусная Трихлоруксусная Щавелевая Вода 0, 8 4, 8 2, 9 0, 7 1, 3 Этанол 4, 0 10, 3 7, 7 5, 5 6, 6
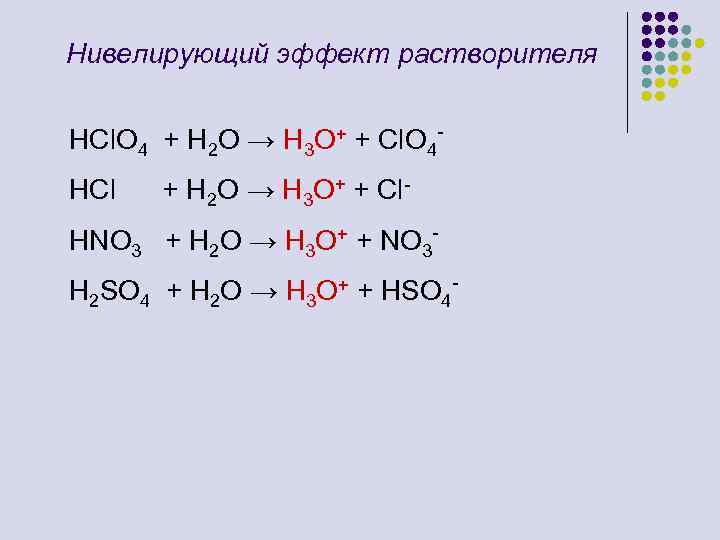 Нивелирующий эффект растворителя HCl. O 4 + H 2 O → H 3 O+ + Cl. O 4 HCl + H 2 O → H 3 O+ + Cl- HNO 3 + H 2 O → H 3 O+ + NO 3 H 2 SO 4 + H 2 O → H 3 O+ + HSO 4 -
Нивелирующий эффект растворителя HCl. O 4 + H 2 O → H 3 O+ + Cl. O 4 HCl + H 2 O → H 3 O+ + Cl- HNO 3 + H 2 O → H 3 O+ + NO 3 H 2 SO 4 + H 2 O → H 3 O+ + HSO 4 -
 Дифференцирующий эффект растворителя Константы диссоциации кислот в CH 3 COOH (лед) Кислота HCl. O 4 H 2 SO 4 HCl Ка 1, 6· 10 -6 6, 0· 10 -9 1, 4· 10 -9 HNO 3 4, 2· 10 -10
Дифференцирующий эффект растворителя Константы диссоциации кислот в CH 3 COOH (лед) Кислота HCl. O 4 H 2 SO 4 HCl Ка 1, 6· 10 -6 6, 0· 10 -9 1, 4· 10 -9 HNO 3 4, 2· 10 -10
 Таким образом l l l Сила кислот нивелируется (выравнивается) в растворителях с основными свойствами, и дифференцируется в растворителях с кислотными свойствами. Сила оснований нивелируется (выравнивается) в растворителях с кислотными свойствами, и дифференцируется в растворителях с основными свойствами. В результате нивелирующего эффекта растворителя в растворе самая сильная кислота – ион лиония, самое сильное основание – ион лиата.
Таким образом l l l Сила кислот нивелируется (выравнивается) в растворителях с основными свойствами, и дифференцируется в растворителях с кислотными свойствами. Сила оснований нивелируется (выравнивается) в растворителях с кислотными свойствами, и дифференцируется в растворителях с основными свойствами. В результате нивелирующего эффекта растворителя в растворе самая сильная кислота – ион лиония, самое сильное основание – ион лиата.
 Диссоциация – взаимодействие кислоты или основания с растворителем 1. H 3 A + SH ↔ H 2 A- + SH 2+ 2. H 2 A- + SH ↔ HA 2 - + SH 2+ 3. HA- + SH ↔ A 3 - + SH 2+ K a 1 > K a 2 > K a 3 Ka 1. H 3 PO 4 ↔ H 2 PO 4 - + H 3 O+ 7, 6· 10 -3 2. H 2 PO 4 - ↔ HPO 42 - + H 3 O+ 6, 2· 10 -8 3. HPO 42 - ↔ PO 43 - + H 3 O+ 1, 0· 10 -12
Диссоциация – взаимодействие кислоты или основания с растворителем 1. H 3 A + SH ↔ H 2 A- + SH 2+ 2. H 2 A- + SH ↔ HA 2 - + SH 2+ 3. HA- + SH ↔ A 3 - + SH 2+ K a 1 > K a 2 > K a 3 Ka 1. H 3 PO 4 ↔ H 2 PO 4 - + H 3 O+ 7, 6· 10 -3 2. H 2 PO 4 - ↔ HPO 42 - + H 3 O+ 6, 2· 10 -8 3. HPO 42 - ↔ PO 43 - + H 3 O+ 1, 0· 10 -12
![Расчет р. Н растворов кислот и оснований Серенсен (1909) р. Н = - lg[H+] Расчет р. Н растворов кислот и оснований Серенсен (1909) р. Н = - lg[H+]](https://present5.com/presentation/5828166_54405790/image-43.jpg) Расчет р. Н растворов кислот и оснований Серенсен (1909) р. Н = - lg[H+] -lga. H+ = -lg[H+]·γH+ = p. H Факторы, которые оказывают влияние на р. Н: l l l природа кислот и оснований, природа растворителя; концентрация кислот и оснований; все возможные равновесия в системе.
Расчет р. Н растворов кислот и оснований Серенсен (1909) р. Н = - lg[H+] -lga. H+ = -lg[H+]·γH+ = p. H Факторы, которые оказывают влияние на р. Н: l l l природа кислот и оснований, природа растворителя; концентрация кислот и оснований; все возможные равновесия в системе.
 Расчет р. Н в растворах Раствор сильной кислоты: HA + H 2 O ↔ H 3 [H 3 O+] = CHA; р. Н = - lg. CHA O+ + A- (1) Раствор сильного основания: A + H 2 O ↔ HA + OH[OH-] = CA; [H 3 O+] = KW/[OH-]; р. Н = p. KW - p. OH (2) СНА < 10 -6 M
Расчет р. Н в растворах Раствор сильной кислоты: HA + H 2 O ↔ H 3 [H 3 O+] = CHA; р. Н = - lg. CHA O+ + A- (1) Раствор сильного основания: A + H 2 O ↔ HA + OH[OH-] = CA; [H 3 O+] = KW/[OH-]; р. Н = p. KW - p. OH (2) СНА < 10 -6 M
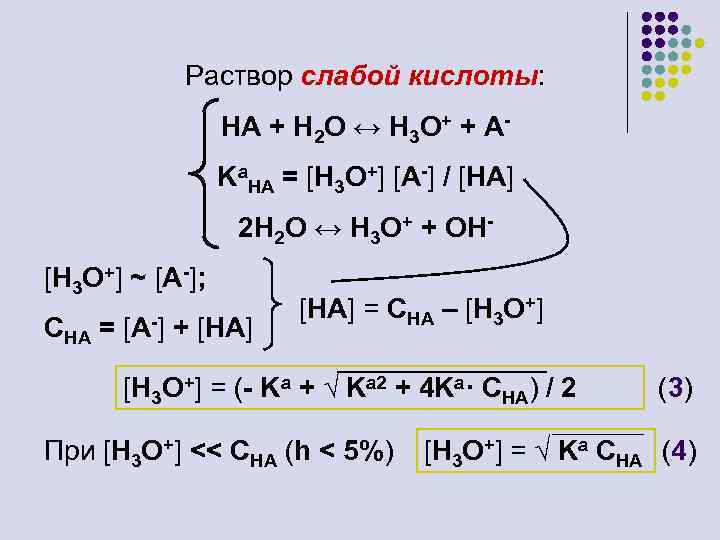 Раствор слабой кислоты: HA + H 2 O ↔ H 3 O+ + AKa. HA = [H 3 O+] [A-] / [HA] 2 H 2 O ↔ H 3 O+ + OH[H 3 O+] ~ [A-]; CHA = [A-] + [HA] = CHA – [H 3 O+] = (- Ka + √ Ka 2 + 4 Ka· CHA) / 2 При [H 3 O+] << CHA (h < 5%) (3) [H 3 O+] = √ Ka CHA (4)
Раствор слабой кислоты: HA + H 2 O ↔ H 3 O+ + AKa. HA = [H 3 O+] [A-] / [HA] 2 H 2 O ↔ H 3 O+ + OH[H 3 O+] ~ [A-]; CHA = [A-] + [HA] = CHA – [H 3 O+] = (- Ka + √ Ka 2 + 4 Ka· CHA) / 2 При [H 3 O+] << CHA (h < 5%) (3) [H 3 O+] = √ Ka CHA (4)
![Раствор слабого основания: A + H 2 O ↔ HA + OH[OH-] = √Kb. Раствор слабого основания: A + H 2 O ↔ HA + OH[OH-] = √Kb.](https://present5.com/presentation/5828166_54405790/image-46.jpg) Раствор слабого основания: A + H 2 O ↔ HA + OH[OH-] = √Kb. ACA; [H 3 O+] = KW / √ Kb. ACA; (5) При h > 5% - более точная формула: [H 3 O+] 2 KW = ----------------- Kb + √ Kb 2 + 4 Kb· CA (6)
Раствор слабого основания: A + H 2 O ↔ HA + OH[OH-] = √Kb. ACA; [H 3 O+] = KW / √ Kb. ACA; (5) При h > 5% - более точная формула: [H 3 O+] 2 KW = ----------------- Kb + √ Kb 2 + 4 Kb· CA (6)
 l l В растворе амфолитов устанавливается равновесие: HA- + H 2 O H 3 O+ + A 2 HA- + H 3 O+ H 2 A + H 2 O 2 H 2 O H 3 O+ + OHСогласно уравнению материального баланса: [H 3 O+] = [A 2 -] – [H 2 A] – [OH-] (7) Д/З: Допущения при расчетах р. Н в растворах амфолитах для конкретных систем Расчет р. Н растворов амфолитов
l l В растворе амфолитов устанавливается равновесие: HA- + H 2 O H 3 O+ + A 2 HA- + H 3 O+ H 2 A + H 2 O 2 H 2 O H 3 O+ + OHСогласно уравнению материального баланса: [H 3 O+] = [A 2 -] – [H 2 A] – [OH-] (7) Д/З: Допущения при расчетах р. Н в растворах амфолитах для конкретных систем Расчет р. Н растворов амфолитов
 Буферные растворы - смесь слабой кислоты и сопряженного с ней основания; - р. Н не изменяется при разбавлении или добавлении небольших количеств кислоты или основания CH 3 COOH + CH 3 COONa NH 4 Cl + NH 3 p. H = p. Ka. HA – lg CHA + lg CA (8) p. H = 14 - p. Ka. HA + lg CHA - lg CA (9)
Буферные растворы - смесь слабой кислоты и сопряженного с ней основания; - р. Н не изменяется при разбавлении или добавлении небольших количеств кислоты или основания CH 3 COOH + CH 3 COONa NH 4 Cl + NH 3 p. H = p. Ka. HA – lg CHA + lg CA (8) p. H = 14 - p. Ka. HA + lg CHA - lg CA (9)
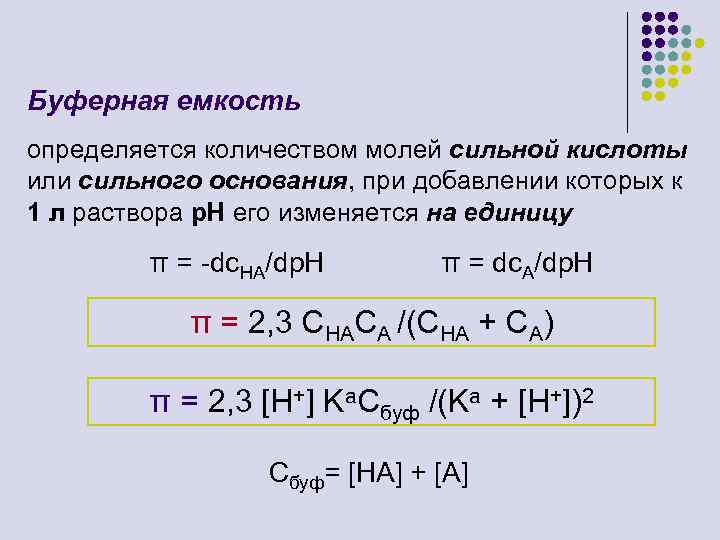 Буферная емкость определяется количеством молей сильной кислоты или сильного основания, при добавлении которых к 1 л раствора р. Н его изменяется на единицу π = -dc. HA/dp. H π = dc. A/dp. H π = 2, 3 CHACA /(CHA + CA) π = 2, 3 [H+] Ka. Cбуф /(Ka + [H+])2 Сбуф= [НA] + [A]
Буферная емкость определяется количеством молей сильной кислоты или сильного основания, при добавлении которых к 1 л раствора р. Н его изменяется на единицу π = -dc. HA/dp. H π = dc. A/dp. H π = 2, 3 CHACA /(CHA + CA) π = 2, 3 [H+] Ka. Cбуф /(Ka + [H+])2 Сбуф= [НA] + [A]
 Домашнее задание Вывод формул для расчета р. Н в растворах кислот и оснований, смесей различных по силе кислот и оснований, многоосновных кислот и оснований, в неводных растворах Разобрано в учебнике, задачнике, решение задач - на семинарах
Домашнее задание Вывод формул для расчета р. Н в растворах кислот и оснований, смесей различных по силе кислот и оснований, многоосновных кислот и оснований, в неводных растворах Разобрано в учебнике, задачнике, решение задач - на семинарах


