Лаба 4ГМ.ppt
- Количество слайдов: 13

Амплификация ДНК Лабораторная работа № 4 для студентов специальности «Микробиология»

Открытие ПЦР • • В начале 1970 -х годов норвежскому ученому Хьеллю Клеппе (Kjell Kleppe) пришла в голову мысль, что можно амплифицировать ДНК с помощью пары коротких одноцепочечных молекул ДНК — синтетических праймеров. Однако в то время эта идея осталась невостребованной. Полимеразная цепная реакция была вновь открыта в 1983 году Кэри Маллисом (Kary Mullis). Его целью было создание метода, который бы позволил амплифицировать ДНК в ходе многократных последовательных удвоений исходной молекулы ДНК с помощью фермента ДНКполимеразы.

Теория ПЦР • • • ПЦР (PCR) позволяет многократно воспроизводить (амплифицировать) выбранный фрагмент ДНК без помощи рестриктаз, векторов или клетки-хозяина. Для этого нужно иметь в своем распоряжении • два олигонуклеотида (праймера), каждый из которых будет гибридизоваться с одной из цепей на противоположных концах подлежащего амплификации фрагмента ДНК, • достаточное количество дезоксирибонуклеозидтрифосфатов и • специальную термостабильную ДНКполимеразу. Праймер синтезируют, а полимеразу получают из термостабильных бактерий.

Принцип ПЦР • основан на репликации ДНК и включает 3 стадии: 1)расплетение и расхождение нитей; 2)присоединение праймеров; 3)достраивание цепи дочерних нитей. • Количество циклов обычно составляет около 20. Добавление свежих порций ДНК-полимеразы при каждом цикле не требуется, благодаря термической устойчивости Taq DNA- полимеразы. • За двадцать циклов ПЦР удается увеличить количество исследуемого материала ДНК примерно в миллион раз.
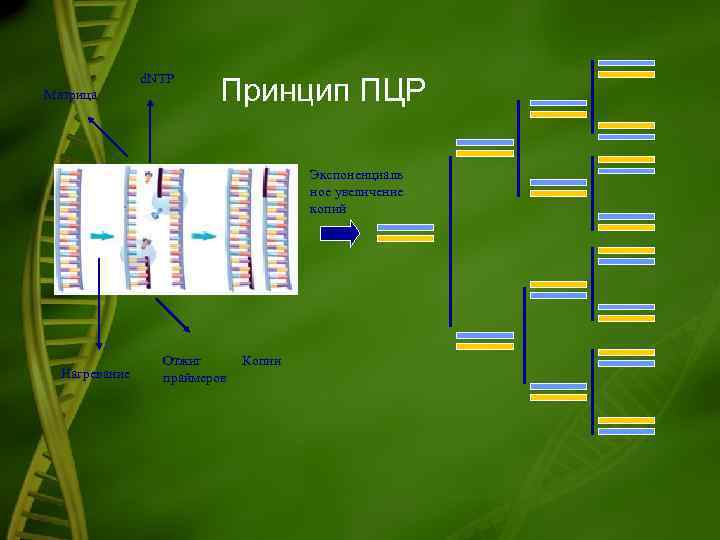
d. NTP Матрица Принцип ПЦР Экспоненциаль ное увеличение копий Нагревание Отжиг праймеров Копии
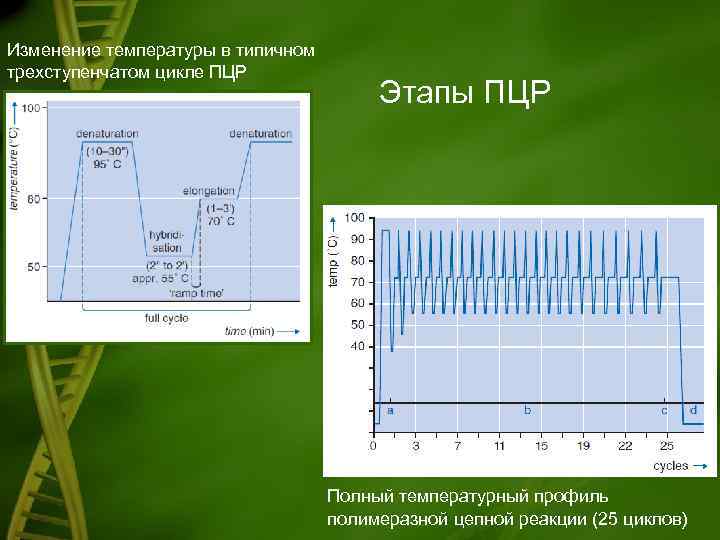
Изменение температуры в типичном трехступенчатом цикле ПЦР Этапы ПЦР Полный температурный профиль полимеразной цепной реакции (25 циклов)

Taq-полимераза • • Одна из первых термостабильных ДНК-полимераз была выделена из бактерий Thermus aquaticus и названа Taq-полимеразой. Недостаток этой полимеразы заключается в том, что вероятность внесения ошибочного нуклеотида у неё достаточно высока (10 -5 на 1 цикл), так как у этого фермента отсутствуют механизмы исправления ошибок (3'→ 5' экзонуклеазная активность). Полимераза Pfu, выделенная из архей, обладает таким механизмом, её использование значительно уменьшает число мутаций в ДНК, но скорость работы ниже, чем у Taq. Сейчас применяют смеси Taq и Pfu, чтобы добиться одновременно высокой скорости полимеризации и высокой точности копирования.
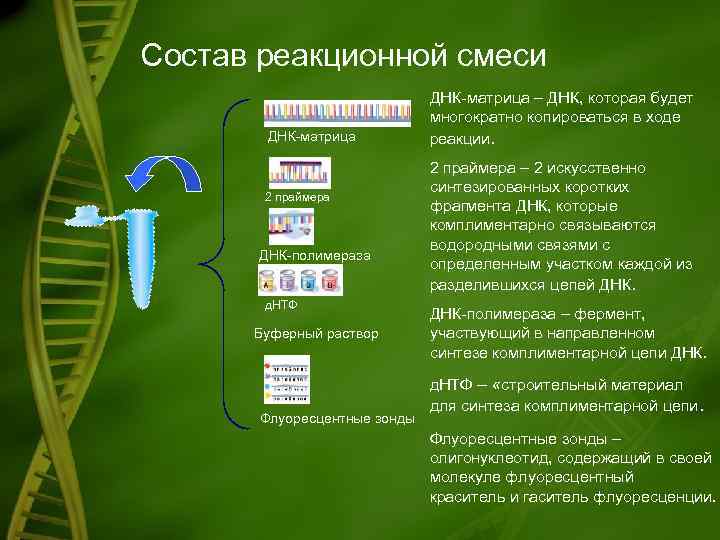
Состав реакционной смеси ДНК-матрица 2 праймера ДНК-полимераза д. НТФ Буферный раствор Флуоресцентные зонды ДНК-матрица – ДНК, которая будет многократно копироваться в ходе реакции. 2 праймера – 2 искусственно синтезированных коротких фрагмента ДНК, которые комплиментарно связываются водородными связями с определенным участком каждой из разделившихся цепей ДНК-полимераза – фермент, участвующий в направленном синтезе комплиментарной цепи ДНК. д. НТФ – «строительный материал для синтеза комплиментарной цепи. Флуоресцентные зонды – олигонуклеотид, содержащий в своей молекуле флуоресцентный краситель и гаситель флуоресценции.

Ход реакции ПЦР • • • Денатурация Двухцепочечную ДНК-матрицу нагревают до 94 -96°C (или до 98 °C, если используется особенно термостабильная полимераза) на 0, 5 -2 мин. , чтобы цепи ДНК разошлись. Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК. Иногда перед первым циклом (до добавления полимеразы) проводят предварительный прогрев реакционной смеси в течение 2 -5 мин. для полной денатурации матрицы и праймеров. Такой приём называется горячим стартом, он позволяет снизить количество неспецифичных продуктов реакции. Отжиг Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от состава праймеров и обычно выбирается на 4 -5°С ниже их температуры плавления. Время стадии - 0, 5 -2 мин. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре). Элонгация ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это - стадия элонгации. Полимераза начинает синтез второй цепи от 3'конца праймера, который связался с матрицей, и движется вдоль матрицы. Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7 -10 мин.

Проведение амплификации • На данной стадии происходит накопление коротких специфических фрагментов ДНК в количестве, необходимом для их дальнейшей детекции. • • • Порядок процедур: Внесение материала в пробирки с реакционной смесью. Добавление минерального масла. Вортексирование. Постановка проб в амплификатор. • • • Термостатируемая крышка Градиент температуры вдоль нагревающего блока Возможность регуляции скорости перехода от одного сегмента цикла к другому «Терцик» фирмы ДНК-технология (Москва) •

Детекция продуктов амплификации • В большинстве методик на данном этапе проводится разделение смеси продуктов амплификации, методом горизонтального электрофореза в агарозном геле. • В качестве альтернативы электрофоретическому методу детекции, имеющему некоторые недостатки: субъективность чтения результатов, ограничения по определению ДНК различных микроорганизмов в одной реакции, могут быть предложены гибридизационные схемы детекции. В этих схемах образующийся в результате амплификации фрагмент ДНК гибридизуется (образует 2 -х цепочечные комплексы - "гибриды") со специфическим олигонуклеотидным зондом. Регистрация таких комплексов может быть проведена колориметрически или флуориметрически флуоресцентная амплификация ( «Джин» )
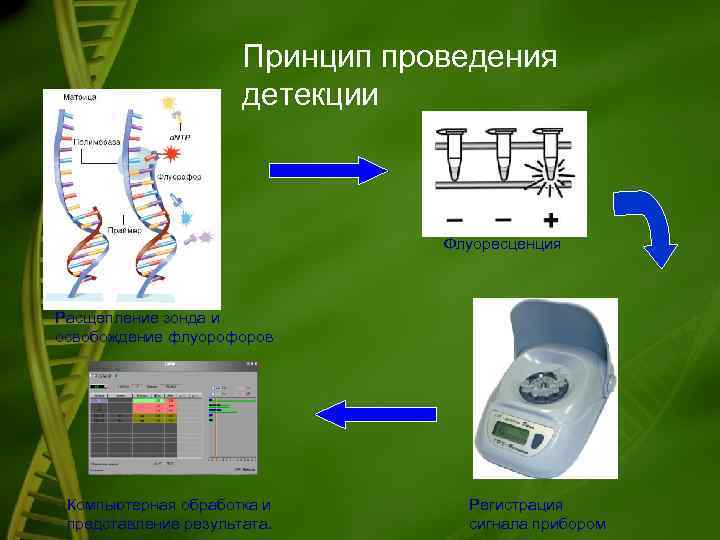
Принцип проведения детекции Флуоресценция Расщепление зонда и освобождение флуорофоров Компьютерная обработка и представление результата. Регистрация сигнала прибором
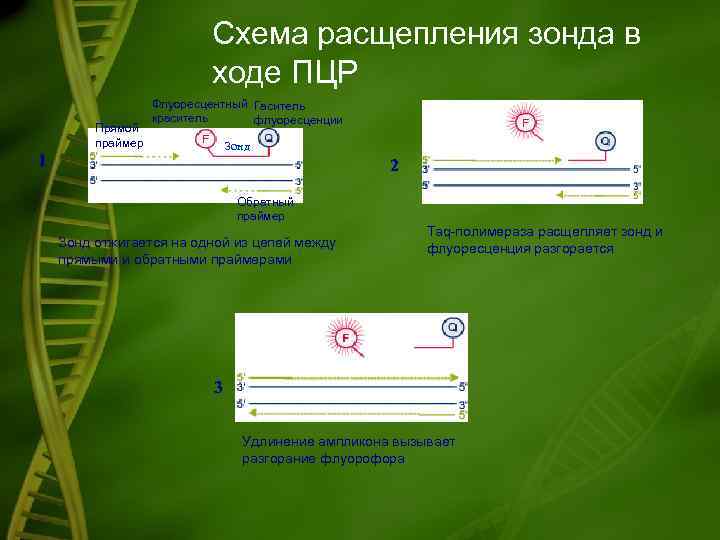
Схема расщепления зонда в ходе ПЦР Прямой праймер Флуоресцентный Гаситель краситель флуоресценции Зонд 1 2 Обратный праймер Зонд отжигается на одной из цепей между прямыми и обратными праймерами Taq-полимераза расщепляет зонд и флуоресценция разгорается 3 Удлинение ампликона вызывает разгорание флуорофора
Лаба 4ГМ.ppt