 Амоніак і солі амонію
Амоніак і солі амонію
 Аміак № 1
Аміак № 1
 Аміак Аміа к, амоніа к, NH 3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря, добре розчинний у воді.
Аміак Аміа к, амоніа к, NH 3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря, добре розчинний у воді.
 Фізичні властивості Аміак — безбарвний газ з характерним різким запахом і їдким смаком. Він майже у два рази легший від повітря. При − 33, 35°С і звичайному тиску аміак скраплюється в безбарвну рідину, а при − 77, 75 °C замерзає, перетворюючись у безбарвну кристалічну масу. Його зберігають і транспортують у рідкому стані в сталевих балонах під тиском 6— 7 атм. Розчин аміаку у воді називають аміачною водою або нашатирним спиртом. При нагріванні розчину аміак легко випаровується.
Фізичні властивості Аміак — безбарвний газ з характерним різким запахом і їдким смаком. Він майже у два рази легший від повітря. При − 33, 35°С і звичайному тиску аміак скраплюється в безбарвну рідину, а при − 77, 75 °C замерзає, перетворюючись у безбарвну кристалічну масу. Його зберігають і транспортують у рідкому стані в сталевих балонах під тиском 6— 7 атм. Розчин аміаку у воді називають аміачною водою або нашатирним спиртом. При нагріванні розчину аміак легко випаровується.
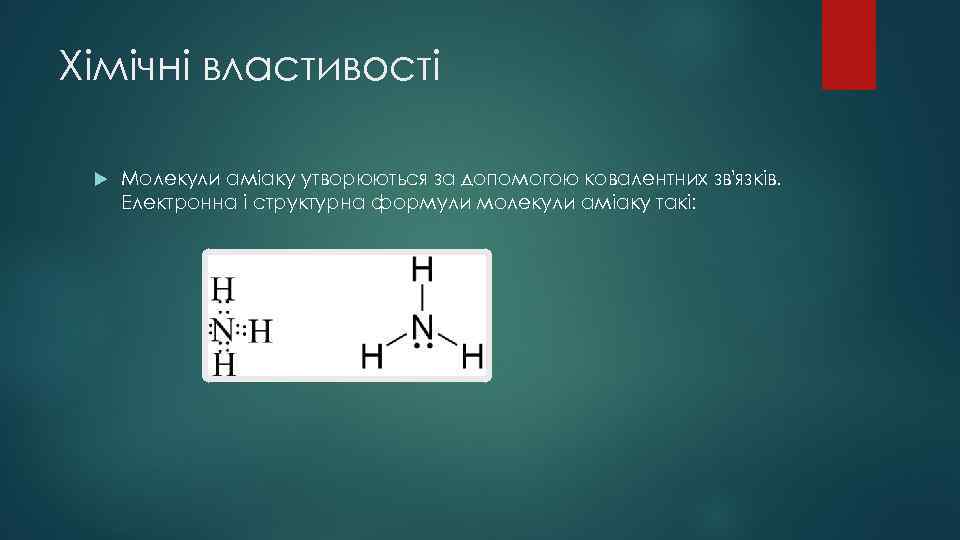 Хімічні властивості Молекули аміаку утворюються за допомогою ковалентних зв'язків. Електронна і структурна формули молекули аміаку такі:
Хімічні властивості Молекули аміаку утворюються за допомогою ковалентних зв'язків. Електронна і структурна формули молекули аміаку такі:
 Aтом азоту має негативний заряд, а атом водню — позитивний. У хімічному відношенні аміак є відновником, а сам звичайно окиснюється до вільного азоту. Так, в атмосфері кисню аміак горить за реакцією: 4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O
Aтом азоту має негативний заряд, а атом водню — позитивний. У хімічному відношенні аміак є відновником, а сам звичайно окиснюється до вільного азоту. Так, в атмосфері кисню аміак горить за реакцією: 4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O
 Застосування аміаку Незначна кількість аміаку присутня в повітрі при розкладанні тварин і рослинності. У незначних кількостях він може входити до складу дощової води. Але для промислового використання аміак одержують штучним шляхом. Аміак майже наполовину легший за повітря. Після стиснення й охолодження він перетворюється в рідину, що нагадує воду, але кипить при температурі мінус 34° С. Після стискання аміак випаровується. При цьому він поглинає багато тепла. От чому його використають у холодильниках. Аміак «домашнього застосування» , що є в тебе дома – це водяний розчин аміаку. Його додають у воду під час прання. При сполученні з кислотами виходять аміачні солі. Багато з них досить корисні. Хлорид амонію застосовується у зварюванні, при виготовленні сухих джерел живлення й у медицині. Сульфат амонію є гарним добривом. Нітрат амонію використається як добриво і як вибухова речовина. Нашатирний спирт також містить карбонат амонію.
Застосування аміаку Незначна кількість аміаку присутня в повітрі при розкладанні тварин і рослинності. У незначних кількостях він може входити до складу дощової води. Але для промислового використання аміак одержують штучним шляхом. Аміак майже наполовину легший за повітря. Після стиснення й охолодження він перетворюється в рідину, що нагадує воду, але кипить при температурі мінус 34° С. Після стискання аміак випаровується. При цьому він поглинає багато тепла. От чому його використають у холодильниках. Аміак «домашнього застосування» , що є в тебе дома – це водяний розчин аміаку. Його додають у воду під час прання. При сполученні з кислотами виходять аміачні солі. Багато з них досить корисні. Хлорид амонію застосовується у зварюванні, при виготовленні сухих джерел живлення й у медицині. Сульфат амонію є гарним добривом. Нітрат амонію використається як добриво і як вибухова речовина. Нашатирний спирт також містить карбонат амонію.
 Відкриття аміаку Термін «аміак» починається від сполучення за назвою «хлорид амонію» , відкритого біля храму Юпітера Аммона в Єгипті. Першим, хто одержав чистий аміак, був англійський хімік Джозеф Прістлі. Це відбулося в 1774 році, тоді його назвали «лужним газом» .
Відкриття аміаку Термін «аміак» починається від сполучення за назвою «хлорид амонію» , відкритого біля храму Юпітера Аммона в Єгипті. Першим, хто одержав чистий аміак, був англійський хімік Джозеф Прістлі. Це відбулося в 1774 році, тоді його назвали «лужним газом» .
 Солі амонію #2
Солі амонію #2
 Солі амонію - тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів. У воді добре розчиняються.
Солі амонію - тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів. У воді добре розчиняються.
 Солі амонію утворюються при взаємодії відповідних кислот з амоніаком або розчином гідроксиду амонію. Більшість солей амонію безбарвні. При взаємодії з сильними основами і нагріванні солі амонію легко розкладаються з утворенням амоніаку. В термічному відношенні солі амонію нестійкі і при нагріванні порівняно легко розкладаються, наприклад: NH 4 Cl = NH 3 + HCl NH 4 NO 2 = N 2 + 2 H 2 O NH 4 NO 3 = N 2 O + 2 H 2 O (NH 4)2 SO 4 = 2 NH 3 + H 2 SO 4
Солі амонію утворюються при взаємодії відповідних кислот з амоніаком або розчином гідроксиду амонію. Більшість солей амонію безбарвні. При взаємодії з сильними основами і нагріванні солі амонію легко розкладаються з утворенням амоніаку. В термічному відношенні солі амонію нестійкі і при нагріванні порівняно легко розкладаються, наприклад: NH 4 Cl = NH 3 + HCl NH 4 NO 2 = N 2 + 2 H 2 O NH 4 NO 3 = N 2 O + 2 H 2 O (NH 4)2 SO 4 = 2 NH 3 + H 2 SO 4