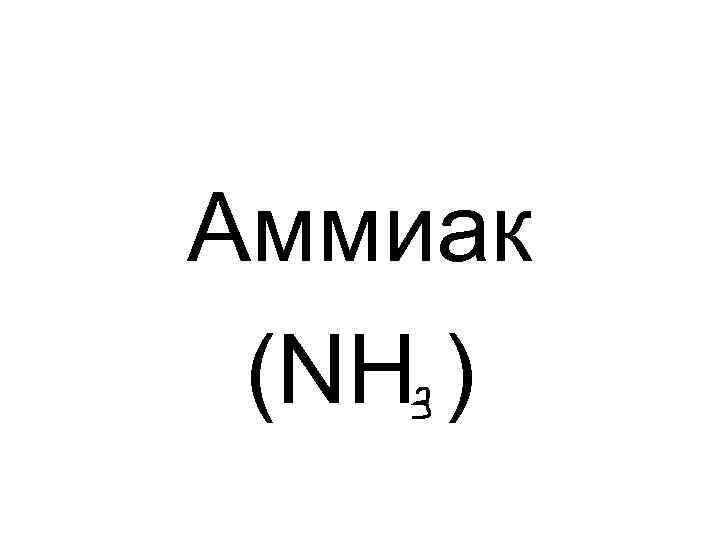
 Аммиак (NH )
Аммиак (NH )
 • На внешнем энергетическом уровне атомы азота содержат пять электронов, из которых три - неспаренные. Именно они и участвуют в формировании трех ковалентных связей с тремя атомами водорода при образовании молекулы аммиака.
• На внешнем энергетическом уровне атомы азота содержат пять электронов, из которых три - неспаренные. Именно они и участвуют в формировании трех ковалентных связей с тремя атомами водорода при образовании молекулы аммиака.
 Получение • В лаборатории: 1) Используют действие сильных щелочей на соли аммония: 2)Обычно получают слабым нагреванием смеси хлорида аммония с гашеной известью:
Получение • В лаборатории: 1) Используют действие сильных щелочей на соли аммония: 2)Обычно получают слабым нагреванием смеси хлорида аммония с гашеной известью:
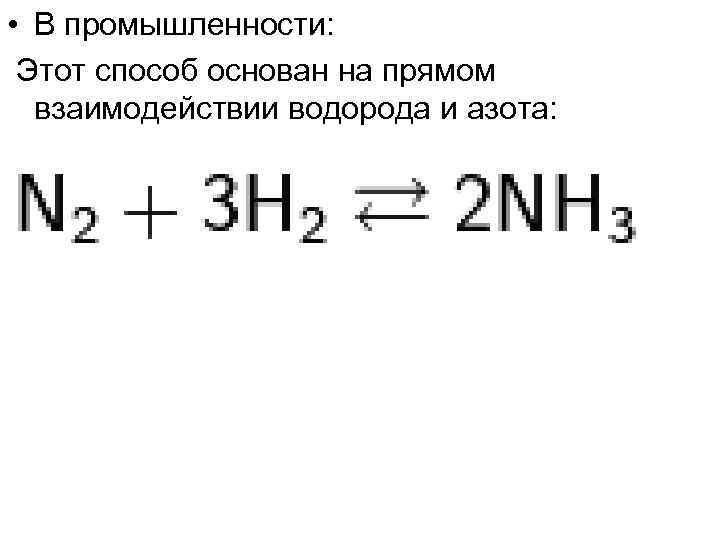 • В промышленности: Этот способ основан на прямом взаимодействии водорода и азота:
• В промышленности: Этот способ основан на прямом взаимодействии водорода и азота:
 Физические свойства • бесцветный газ с резким характерным запахом (запах нашатырного спирта) • почти вдвое легче воздуха • ядовит • может находиться в сжиженном, жидком и твердом состоянии • затвердевает при -78 °С.
Физические свойства • бесцветный газ с резким характерным запахом (запах нашатырного спирта) • почти вдвое легче воздуха • ядовит • может находиться в сжиженном, жидком и твердом состоянии • затвердевает при -78 °С.
 Физические свойства • • • Жидкий аммиак tкип − 33, 35 °C tпл − 77, 70 °C вязкий легко переходит в бесцветную жидкость практически не проводит электрический ток хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. • Твердый аммиак • в твердом состоянии выглядит как бесцветные кристаллы в виде кубиков
Физические свойства • • • Жидкий аммиак tкип − 33, 35 °C tпл − 77, 70 °C вязкий легко переходит в бесцветную жидкость практически не проводит электрический ток хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. • Твердый аммиак • в твердом состоянии выглядит как бесцветные кристаллы в виде кубиков
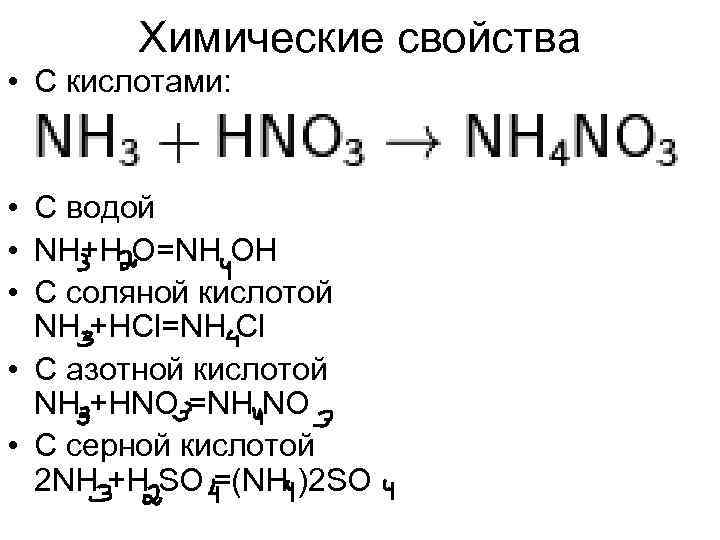 Химические свойства • С кислотами: • С водой • NH+H O=NH OH • С соляной кислотой NH +HCl=NH Cl • С азотной кислотой NH +HNO =NH NO • С серной кислотой 2 NH +H SO =(NH )2 SO
Химические свойства • С кислотами: • С водой • NH+H O=NH OH • С соляной кислотой NH +HCl=NH Cl • С азотной кислотой NH +HNO =NH NO • С серной кислотой 2 NH +H SO =(NH )2 SO
 Использование человеком • • • В химической промышленности: производство азотных удобрений взрывчатых веществ и полимеров азотной кислоты соли жидкий аммиак используют в качестве растворителя. • в холодильной технике используется в качестве холодильного агента (R 717)
Использование человеком • • • В химической промышленности: производство азотных удобрений взрывчатых веществ и полимеров азотной кислоты соли жидкий аммиак используют в качестве растворителя. • в холодильной технике используется в качестве холодильного агента (R 717)
 • • В медицине: применяется при обморочных состояниях укусах насекомых для обработки рук хирурга
• • В медицине: применяется при обморочных состояниях укусах насекомых для обработки рук хирурга