 Аммиак
Аммиак
 • Аммиак (в европейских языках его название звучит как «аммониак» ) своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH 2)2 CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
• Аммиак (в европейских языках его название звучит как «аммониак» ) своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH 2)2 CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
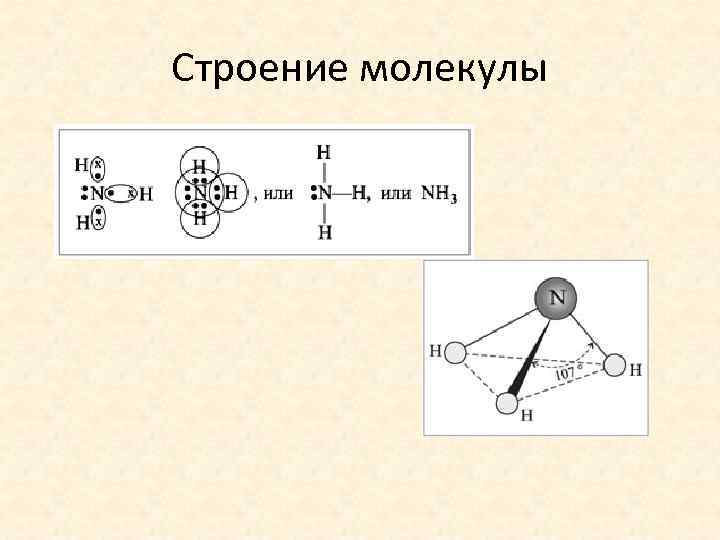 Строение молекулы
Строение молекулы
 Получение промышленный способ • Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: • • • N 2(г) + 3 H 2(г) ↔ 2 NH 3(г) + 45, 9 к. Дж Условия: катализатор – пористое железо температура – 450 – 500 ˚С давление – 25 – 30 МПа Это так называемый процесс Габера (немецкий физик, разработал физико химические основы метода).
Получение промышленный способ • Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: • • • N 2(г) + 3 H 2(г) ↔ 2 NH 3(г) + 45, 9 к. Дж Условия: катализатор – пористое железо температура – 450 – 500 ˚С давление – 25 – 30 МПа Это так называемый процесс Габера (немецкий физик, разработал физико химические основы метода).
 Производство аммиака • • Колонна синтеза аммиака: 1 люк для выгрузки катализатора; 2 центр, труба; 3 корпус; 4 люк для загрузки катализатора; 5 теплообменник; 6 трубы для ввода холодного газа; • 7 катализатор.
Производство аммиака • • Колонна синтеза аммиака: 1 люк для выгрузки катализатора; 2 центр, труба; 3 корпус; 4 люк для загрузки катализатора; 5 теплообменник; 6 трубы для ввода холодного газа; • 7 катализатор.
 В лаборатории • Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: • NH 4 Cl + Na. OH = NH 3↑ + Na. Cl + H 2 O • (NH 4)2 SO 4 + Ca(OH)2 = 2 NH 3↑ + Ca. SO 4 + 2 H 2 O • Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH 4 OH ↔ NH 3↑ + H 2 O • При получении аммиака держите пробирку приёмник дном кверху, так как аммиак легче воздуха:
В лаборатории • Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: • NH 4 Cl + Na. OH = NH 3↑ + Na. Cl + H 2 O • (NH 4)2 SO 4 + Ca(OH)2 = 2 NH 3↑ + Ca. SO 4 + 2 H 2 O • Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH 4 OH ↔ NH 3↑ + H 2 O • При получении аммиака держите пробирку приёмник дном кверху, так как аммиак легче воздуха:
 Химические свойства • 1. Горение аммиака (при нагревании) • 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 20 • 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) • 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O
Химические свойства • 1. Горение аммиака (при нагревании) • 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 20 • 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) • 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O
 • с оксидами металлов • 2 NH 3 + 3 Cu. O = 3 Cu + N 2 + 3 H 2 O • С окислителями • 2 NH 3 + 3 Cl 2 = N 2 + 6 HCl (при нагревании) • аммиак – непрочное соединение, при нагревании разлагается • 2 NH 3↔ N 2 + 3 H 2
• с оксидами металлов • 2 NH 3 + 3 Cu. O = 3 Cu + N 2 + 3 H 2 O • С окислителями • 2 NH 3 + 3 Cl 2 = N 2 + 6 HCl (при нагревании) • аммиак – непрочное соединение, при нагревании разлагается • 2 NH 3↔ N 2 + 3 H 2
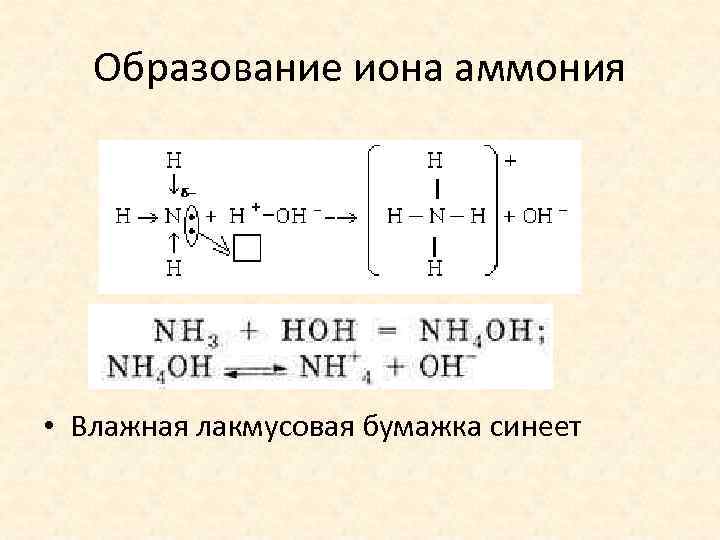 Образование иона аммония • Влажная лакмусовая бумажка синеет
Образование иона аммония • Влажная лакмусовая бумажка синеет
 Получение • 1 способ Аммиак + кислота: • NH 3 + HNO 3 → NH 4 NO 3 • 2 способ Аммиачная вода + кислота: • 2 NH 4 OH + H 2 SO 4 → (NH 4)2 SO 4+ 2 Н 2 O
Получение • 1 способ Аммиак + кислота: • NH 3 + HNO 3 → NH 4 NO 3 • 2 способ Аммиачная вода + кислота: • 2 NH 4 OH + H 2 SO 4 → (NH 4)2 SO 4+ 2 Н 2 O
 Соли аммония • • • NH 4 Cl – хлорид аммония (NH 4)2 SO 4 - сульфат аммония NH 4 NO 3 – нитрат аммония (NH 4)3 PO 4 – ортофосфат аммония (NH 4)2 HPO 4 – гидроортофосфат аммония NH 4 H 2 PO 4 – дигидроортофосфат аммония
Соли аммония • • • NH 4 Cl – хлорид аммония (NH 4)2 SO 4 - сульфат аммония NH 4 NO 3 – нитрат аммония (NH 4)3 PO 4 – ортофосфат аммония (NH 4)2 HPO 4 – гидроортофосфат аммония NH 4 H 2 PO 4 – дигидроортофосфат аммония
 СПЕЦИФИЧЕСКИЕ • • • 1. Разложение при нагревании. a) если кислота летучая • NH 4 Cl → NH 3 + HCl (при нагревании) • NH 4 HCO 3 → NH 3 + НO + CO 2 2 б) если анион проявляет окислительные свойства • NH 4 NO 3 → N 2 O + 2 НO (при нагревании) 2 • (NH 4)2 Cr 2 O 7 → N 2 + Cr. O 3 + 4 Н 2 O (при нагревании) 2 2. Качественная реакция на NH 4+ ион аммония. При нагревании со щелочами выделяется газ аммиак • NH 4 Cl + Na. OH → Na. Cl + NH 3 + НO (при нагревании) 2 3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая: • NH 4 Cl + Н 2 O → NH 4 OH + HCl • NH 4+ + Н 2 O → NH 4 OH + H+
СПЕЦИФИЧЕСКИЕ • • • 1. Разложение при нагревании. a) если кислота летучая • NH 4 Cl → NH 3 + HCl (при нагревании) • NH 4 HCO 3 → NH 3 + НO + CO 2 2 б) если анион проявляет окислительные свойства • NH 4 NO 3 → N 2 O + 2 НO (при нагревании) 2 • (NH 4)2 Cr 2 O 7 → N 2 + Cr. O 3 + 4 Н 2 O (при нагревании) 2 2. Качественная реакция на NH 4+ ион аммония. При нагревании со щелочами выделяется газ аммиак • NH 4 Cl + Na. OH → Na. Cl + NH 3 + НO (при нагревании) 2 3. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая: • NH 4 Cl + Н 2 O → NH 4 OH + HCl • NH 4+ + Н 2 O → NH 4 OH + H+


