Амины.pptx
- Количество слайдов: 29
Амины Выполнила Рублева Марина, студентка группы ЭБ 13 -01 Б; преподаватель: Казаченко Алла Семеновна

План: определение классификация изомерия номенклатура свойства аминов (физические, химические) получение значение для жизнедеятельности человека и животных (применение) список литературы
Определение Амины - органические соединения, являющиеся производными аммиака, в молекулах которых один, два или три атома водорода замещены на углеводородные радикалы.
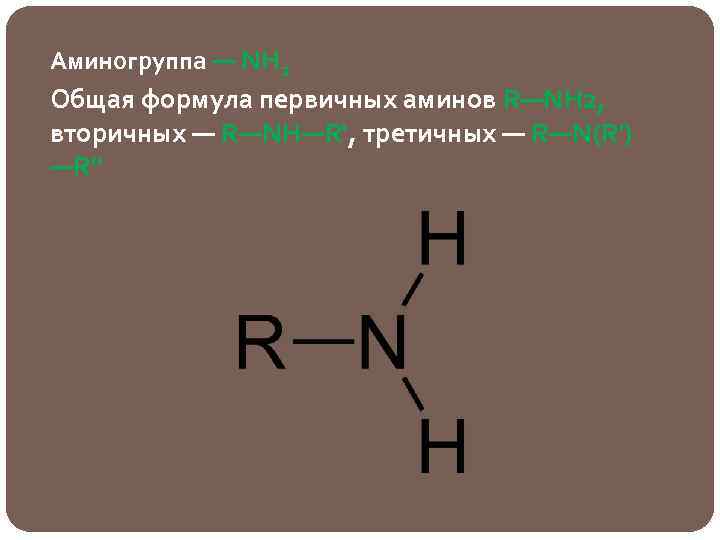
Аминогруппа — NH 2 Общая формула первичных аминов R—NH 2, вторичных — R—NH—R', третичных — R—N(R') —R"
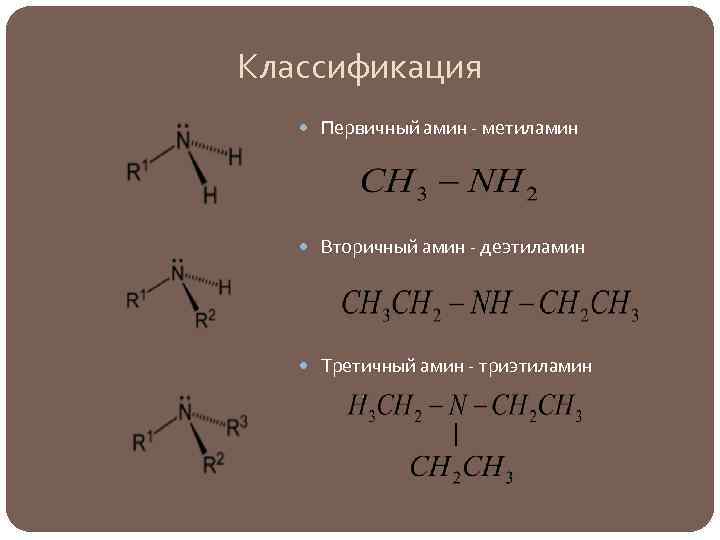
Классификация Первичный амин - метиламин Вторичный амин - деэтиламин Третичный амин - триэтиламин
![Четвертичное аммониевое соединение вида [R 4 N]+Сl- является органическим аналогом аммониевой соли Четвертичное аммониевое соединение вида [R 4 N]+Сl- является органическим аналогом аммониевой соли](https://present5.com/presentation/49537683_245934970/image-6.jpg)
Четвертичное аммониевое соединение вида [R 4 N]+Сl- является органическим аналогом аммониевой соли

ион аммония: ион тетраэтиламмония: Существуют ионы, которые являются продуктом формального замещения на углеводородный радикал всех атомов водорода в ионе аммония.

Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются матическими аминами
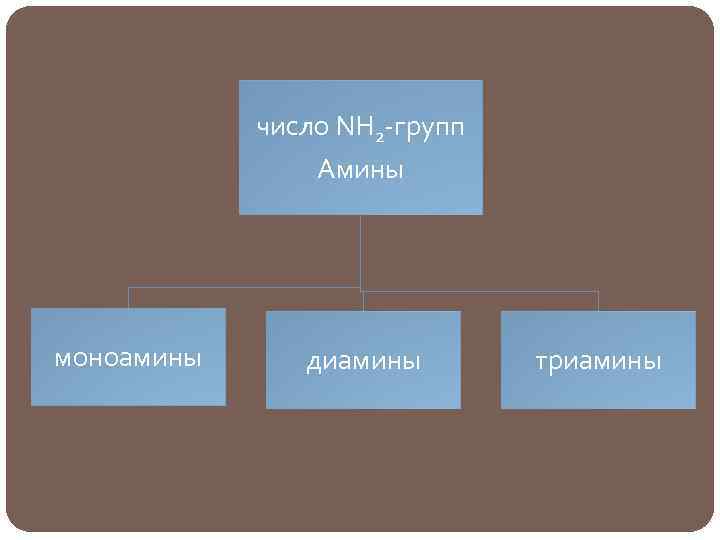
число NH 2 -групп Амины моноамины диамины триамины

По типу органической группы, связанной с азотом, различают: алифатические СH 3 – N< ароматические С 6 H 5 – N< жирно-ароматические (содержат ароматический и алифатический радикалы)

Изомерия Ш Изомерия углеродного скелета (начиная с бутиламина): бутиламин изобутиламин

Ш Изомерия положения функциональной группы (начиная с пропиламина): пропиламин изопропиламин

Ш Межклассовая изомерия: Первичный амин прапиламин. Вторичный амин метилэтиламин. Третичный амин триметиламин.

Номенклатура К названию органических остатков, связанных с азотом, добавляют слово «амин» , при этом группы упоминают в алфавитном порядке: CH 3 NHC 3 Н 7 — метилпропиламин, CH 3 N(С 6 Н 5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино» , «диамино» , «триамино» , указывая числовой индекс атома углерода: 2 -аминопентан Для некоторых аминов используются тривиальные названия: С 6 Н 5 NH 2 — анилин (систематическое название — фениламин).

Физические свойства аминов Простейшие амины (метиламин, диметиламин, триметиламин) – газообразные вещества. Остальные низшие амины – жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака. Высшие амины — твердые вещества. Первичные и вторичные амины способны образовывать водородные связи. Это приводит к повышению их температуры. Анилин (C 6 H 5 NH 2) – маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184 C

Химические свойства 1. Атом азота аминогруппы за счет не поделенной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, вступая в роли донора. В связи с этим амины способны присоединять катион ИОН АММОНИЯ ИОН ЭТИЛАММОНИЯ

2. Амины горят на воздухе с образованием углекислого газа, воды и азота:

3. Амины вступают в реакцию нуклеофильного замещения, выступая в роли нуклеофилов:

4. Амины взаимодействую с производными карбоновых кислот (сложными эфирами, хлорагидридами, ангидридами), образуя амиды (продукты замещения гидроксильной группы на остаток амина) – важнейший класс органических соединений:

5. Взаимодействуют с кислотами, образуют алкиламиновые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды: RNH 2 + HCl → [RNH 3]Cl−

6. Растворяясь в воде, амины по такой же схеме захватывают протон, в результате в растворе появляются ионы ОН–, что соответствует образованию щелочной среды, ее можно обнаружить с помощью обычных индикаторов. C 2 H 5 NH 2 + H 2 O ® [C 2 H 5 NH 3]+ + OH–

Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. При помощи азотистой кислоты первичные, вторичные и третичные амины отличают друг от друга. Из первичных аминов образуются первичные спирты: C 2 H 5 NH 2 + HNO 2 → C 2 H 5 OH + N 2 +H 2 O Вторичные амины образуют с азотистой кислотой желтые, трудно растворимые нитрозамины — соединения, содержащие фрагмент >N-N=O: (C 2 H 5)2 NH + HNO 2 → (C 2 H 5)2 N-N=O + H 2 O Третичные амины при обычной температуре в азотистой кислоте просто растворяются.

Получение аминов • Восстановление азотсодержащих соединений: нитросоединений (реакция Зинина). Эту реакцию впервые осуществил Н. Н. Зинин в 1842 году. Действуя на нитробензол сульфидом аммония, он получил анилин: C 6 H 5 NO 2 + 3(NH 4)2 S → C 6 H 5 NH 2 + 6 NH 3 + 3 S + 2 H 2 O

Ш Получение аминов из галогенопроизводных: В результате этой реакции образуется соль амина (гидробромид этиламмония), из которой действием щёлочи можно выделить первичный амин (этиламин):

При взаимодействии полученного первичного амина и галогенопроизводного и последующей обработке щелочью получают вторичный амин (диэтиламин):

Повторение процедуры приводит к образованию третичного амина: Третичный амин может ещё раз вступить в реакцию с бромэтаном. При этом образуется четвертичная аммонийная соль, образованная бромид-ионом и катионом тетраэтиламмония:
Значение для жизнедеятельности человека и животных Амины широко применяются для получения лекарств, полимерных материалов. Анилин – важнейшее соединение данного класса, которое используется для производства анилиновых красителей, лекарств (сульфаниламидных препаратов), полимерных материалов (анилиноформальдегидных смол).

Вредное воздействие Амины являются очень токсичными веществами. Опасно как вдыхание их паров, так и контакт с кожей. В случае попадания амина на незащищенные участки кожи необходимо быстро и аккуратно, не увеличивая площадь поражения, очистить пораженный участок кожи ватой, смоченной в спирте. В случае отравления вывести пострадавшего на свежий воздух, обратиться к врачу.

Спасибо за внимание!
Амины.pptx