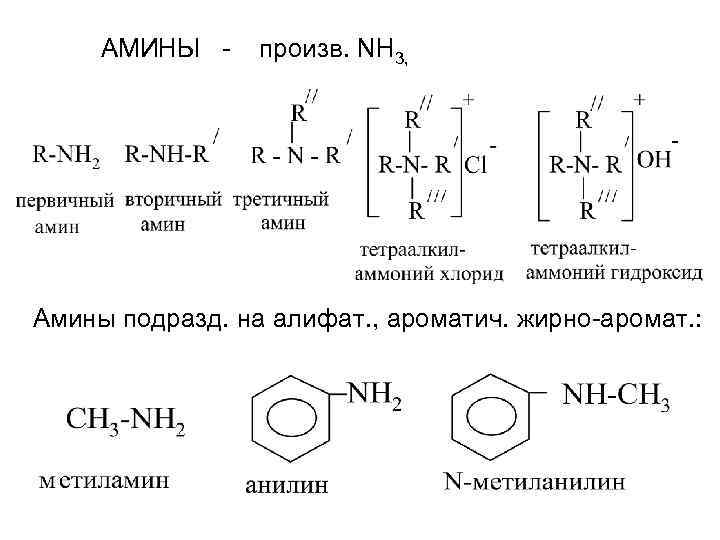
 АМИНЫ - произв. NH 3, Амины подразд. на алифат. , ароматич. жирно-аромат. :
АМИНЫ - произв. NH 3, Амины подразд. на алифат. , ароматич. жирно-аромат. :
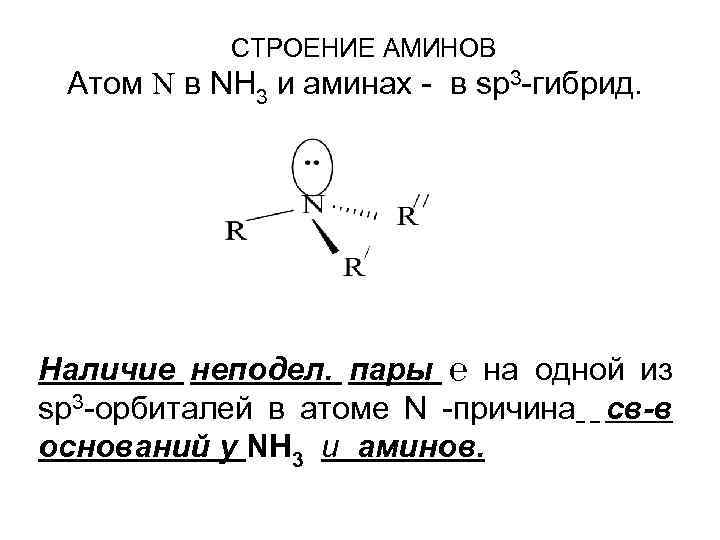 СТРОЕНИЕ АМИНОВ Атом N в NH 3 и аминах - в sp 3 -гибрид. Наличие неподел. пары ℮ на одной из sp 3 -орбиталей в атоме N -причина св-в оснований у NH 3 и аминов.
СТРОЕНИЕ АМИНОВ Атом N в NH 3 и аминах - в sp 3 -гибрид. Наличие неподел. пары ℮ на одной из sp 3 -орбиталей в атоме N -причина св-в оснований у NH 3 и аминов.
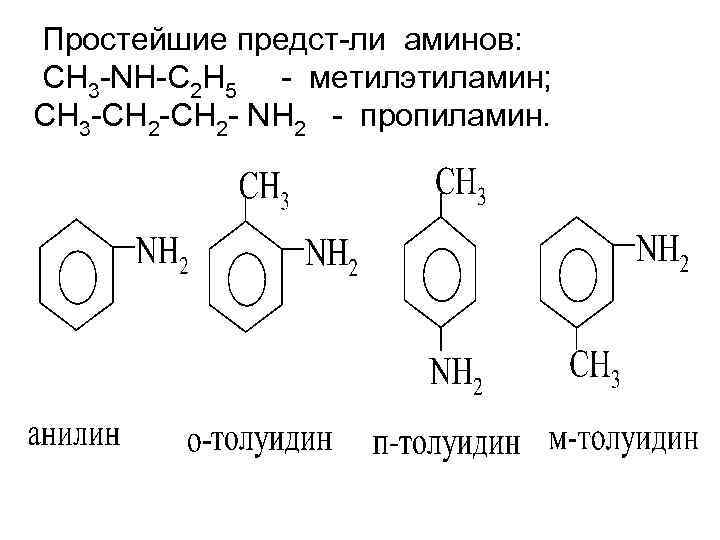 Простейшие предст-ли аминов: СН 3 -NН-С 2 Н 5 - метилэтиламин; СН 3 -СН 2 - NН 2 - пропиламин.
Простейшие предст-ли аминов: СН 3 -NН-С 2 Н 5 - метилэтиламин; СН 3 -СН 2 - NН 2 - пропиламин.
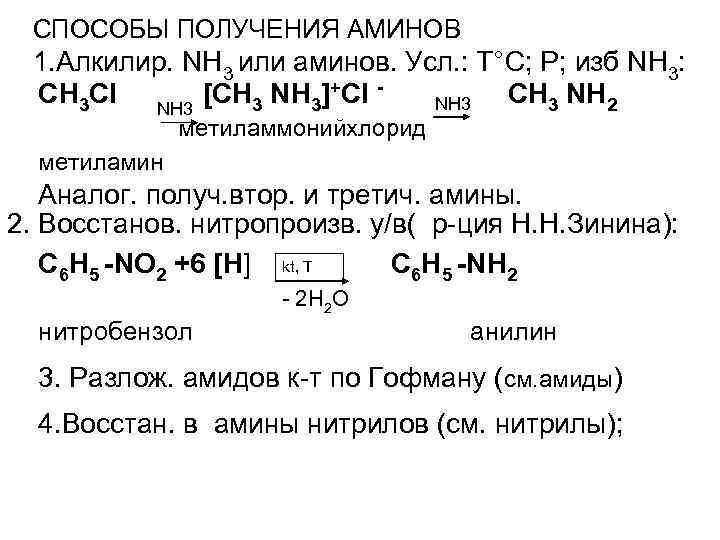 СПОСОБЫ ПОЛУЧЕНИЯ АМИНОВ 1. Алкилир. NH 3 или аминов. Усл. : Т°С; Р; изб NH 3: CH 3 Cl NH 3 [CH 3 NH 3]+Сl CH 3 NH 2 NH 3 метиламмонийхлорид метиламин Аналог. получ. втор. и третич. амины. 2. Восстанов. нитропроизв. у/в( р-ция Н. Н. Зинина): С 6 Н 5 -NО 2 +6 [Н] kt, T С 6 Н 5 -NН 2 - 2 Н 2 О нитробензол анилин 3. Разлож. амидов к-т по Гофману (см. амиды) 4. Восстан. в амины нитрилов (см. нитрилы);
СПОСОБЫ ПОЛУЧЕНИЯ АМИНОВ 1. Алкилир. NH 3 или аминов. Усл. : Т°С; Р; изб NH 3: CH 3 Cl NH 3 [CH 3 NH 3]+Сl CH 3 NH 2 NH 3 метиламмонийхлорид метиламин Аналог. получ. втор. и третич. амины. 2. Восстанов. нитропроизв. у/в( р-ция Н. Н. Зинина): С 6 Н 5 -NО 2 +6 [Н] kt, T С 6 Н 5 -NН 2 - 2 Н 2 О нитробензол анилин 3. Разлож. амидов к-т по Гофману (см. амиды) 4. Восстан. в амины нитрилов (см. нитрилы);
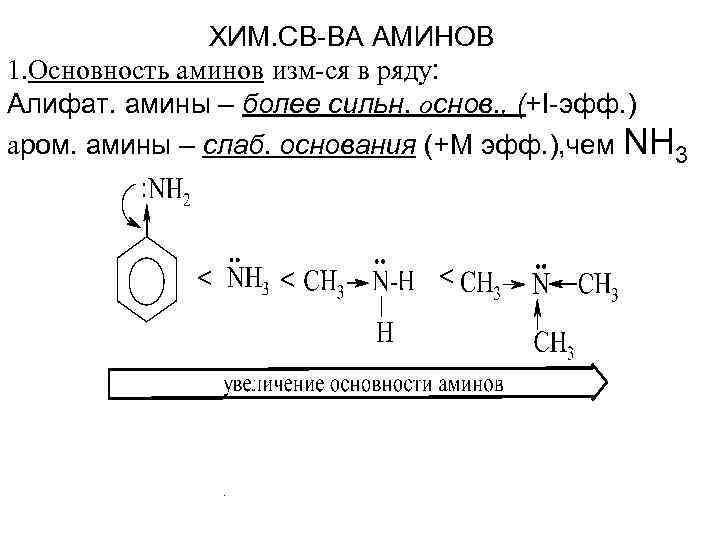 ХИМ. СВ-ВА АМИНОВ 1. Основность аминов изм-ся в ряду: Алифат. амины – более сильн. основ. , (+I-эфф. ) аром. амины – слаб. основания (+М эфф. ), чем NH 3
ХИМ. СВ-ВА АМИНОВ 1. Основность аминов изм-ся в ряду: Алифат. амины – более сильн. основ. , (+I-эфф. ) аром. амины – слаб. основания (+М эфф. ), чем NH 3
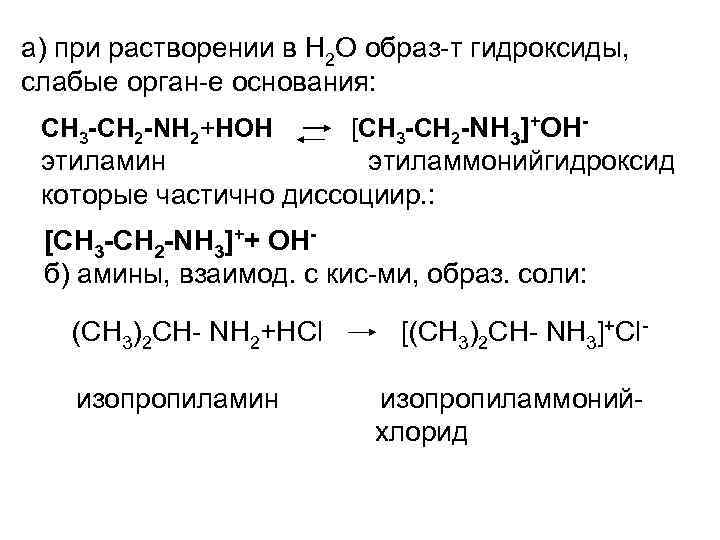 а) при растворении в Н 2 О образ-т гидроксиды, слабые орган-е основания: СН 3 -СН 2 -NН 2+НОН [СН 3 -СН 2 -NН 3]+ОН- этиламин этиламмонийгидроксид которые частично диссоциир. : [СН 3 -СН 2 -NН 3]++ ОНб) амины, взаимод. с кис-ми, образ. соли: (СН 3)2 СН- NН 2+НСl изопропиламин [(СН 3)2 СН- NН 3]+Сlизопропиламмонийхлорид
а) при растворении в Н 2 О образ-т гидроксиды, слабые орган-е основания: СН 3 -СН 2 -NН 2+НОН [СН 3 -СН 2 -NН 3]+ОН- этиламин этиламмонийгидроксид которые частично диссоциир. : [СН 3 -СН 2 -NН 3]++ ОНб) амины, взаимод. с кис-ми, образ. соли: (СН 3)2 СН- NН 2+НСl изопропиламин [(СН 3)2 СН- NН 3]+Сlизопропиламмонийхлорид
 2. Алкилир. аминов. Введен. алкила в мол-лу амина. В кач-ве реаг. применяют RНа 1. Р-ция алкилир. можно получ. вторич. и третич. амины из первич. (см. получ. амин. ) Третич. амины при взаимодейст. с RHal, образ. четвертич. аммон. соли: (СН 3)2 СН-N(СН 3)2 + СН 3 Сl диметилизопропиламин (третич. ) [(СН 3)2 СН- N- (СН 3)3]+Сlтриметилизопропиламмонийхлори д (четвертич. аммон. соль)
2. Алкилир. аминов. Введен. алкила в мол-лу амина. В кач-ве реаг. применяют RНа 1. Р-ция алкилир. можно получ. вторич. и третич. амины из первич. (см. получ. амин. ) Третич. амины при взаимодейст. с RHal, образ. четвертич. аммон. соли: (СН 3)2 СН-N(СН 3)2 + СН 3 Сl диметилизопропиламин (третич. ) [(СН 3)2 СН- N- (СН 3)3]+Сlтриметилизопропиламмонийхлори д (четвертич. аммон. соль)
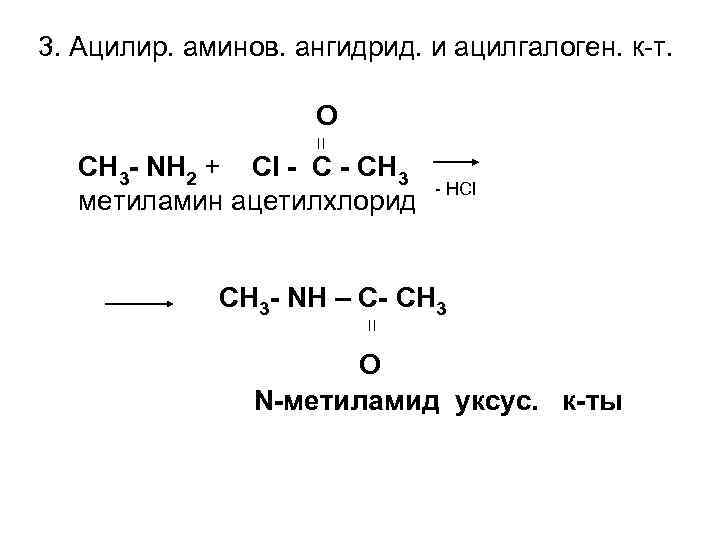 3. Ацилир. аминов. ангидрид. и ацилгалоген. к-т. О ׀׀ СН 3 - NН 2 + Сl - СН 3 метиламин ацетилхлорид - HCl СН 3 - NН – С- СН 3 ׀׀ О N-метиламид уксус. к-ты
3. Ацилир. аминов. ангидрид. и ацилгалоген. к-т. О ׀׀ СН 3 - NН 2 + Сl - СН 3 метиламин ацетилхлорид - HCl СН 3 - NН – С- СН 3 ׀׀ О N-метиламид уксус. к-ты
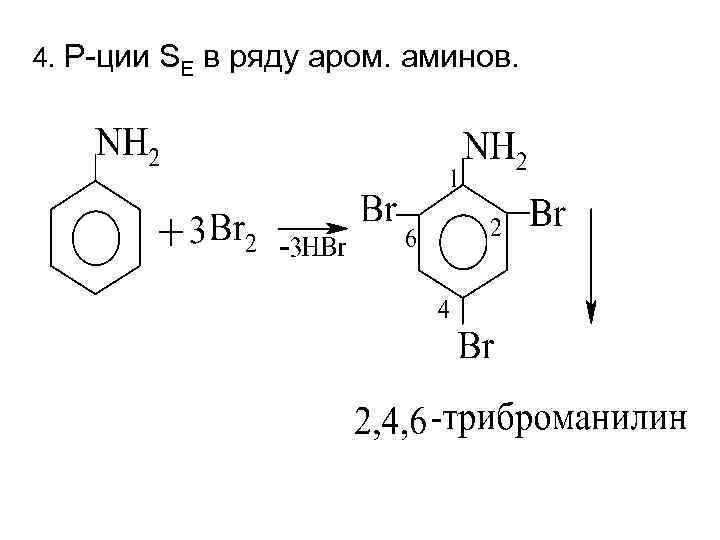 4. Р-ции SE в ряду аром. аминов.
4. Р-ции SE в ряду аром. аминов.
 5. Р-ция с НNО 2. При взаим. аминов с НNО 2 образ-ся соед. : первич. амины превр-ся в спирты, вторич. - в нитрозоамины, трет. не реагир. Р-ция первич. алифат. аминов с НNО 2 : (н/у соедин. )
5. Р-ция с НNО 2. При взаим. аминов с НNО 2 образ-ся соед. : первич. амины превр-ся в спирты, вторич. - в нитрозоамины, трет. не реагир. Р-ция первич. алифат. аминов с НNО 2 : (н/у соедин. )
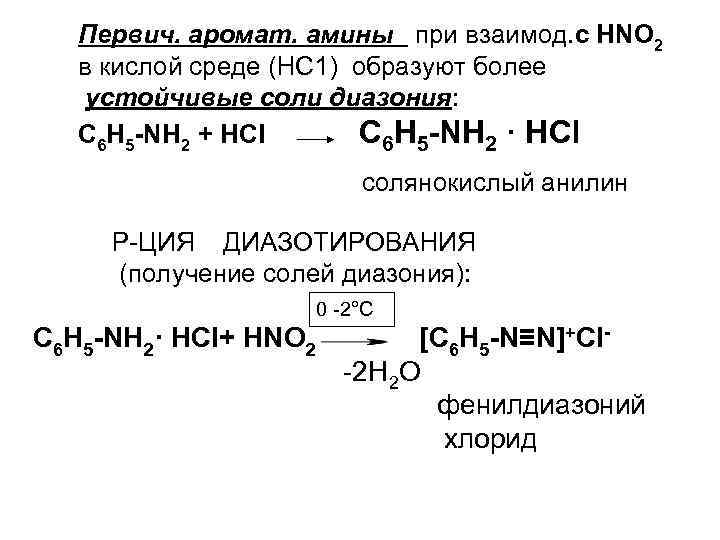 Первич. аромат. амины при взаимод. с НNО 2 в кислой среде (НС 1) образуют более устойчивые соли диазония: С 6 Н 5 -NН 2 + НСl С 6 Н 5 -NН 2 · НСl солянокислый анилин Р-ЦИЯ ДИАЗОТИРОВАНИЯ (получение солей диазония): 0 -2°С С 6 Н 5 -NН 2· НСl+ НNО 2 [С 6 Н 5 -N≡N]+Cl-2 Н 2 О фенилдиазоний хлорид
Первич. аромат. амины при взаимод. с НNО 2 в кислой среде (НС 1) образуют более устойчивые соли диазония: С 6 Н 5 -NН 2 + НСl С 6 Н 5 -NН 2 · НСl солянокислый анилин Р-ЦИЯ ДИАЗОТИРОВАНИЯ (получение солей диазония): 0 -2°С С 6 Н 5 -NН 2· НСl+ НNО 2 [С 6 Н 5 -N≡N]+Cl-2 Н 2 О фенилдиазоний хлорид
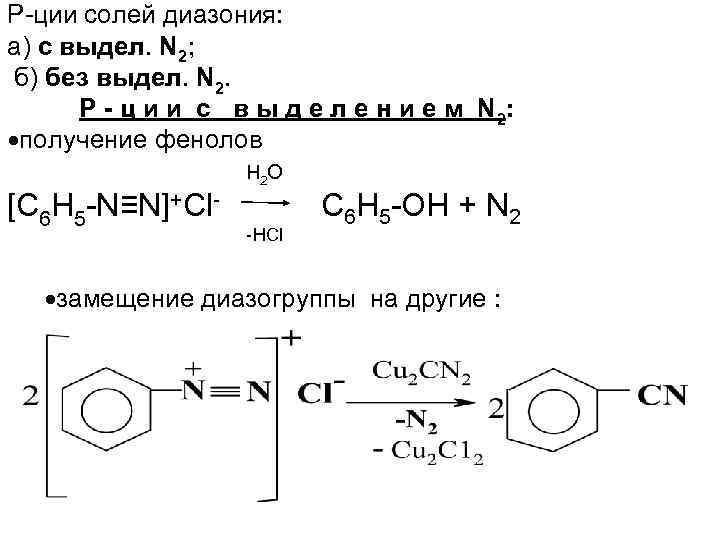 Р-ции солей диазония: а) с выдел. N 2; б) без выдел. N 2. Р - ц и и с в ы д е л е н и е м N 2: получение фенолов [С 6 Н 5 -N≡N]+Cl- H 2 O -HCl С 6 Н 5 -OH + N 2 замещение диазогруппы на другие :
Р-ции солей диазония: а) с выдел. N 2; б) без выдел. N 2. Р - ц и и с в ы д е л е н и е м N 2: получение фенолов [С 6 Н 5 -N≡N]+Cl- H 2 O -HCl С 6 Н 5 -OH + N 2 замещение диазогруппы на другие :
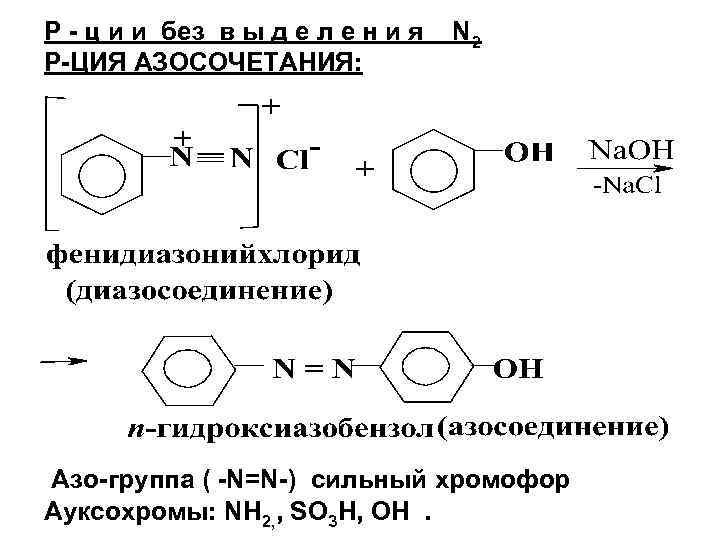 Р - ц и и без в ы д е л е н и я Р-ЦИЯ АЗОСОЧЕТАНИЯ: N 2 Азо-группа ( -N=N-) сильный хромофор Ауксохромы: NН 2, , SO 3 H, OH.
Р - ц и и без в ы д е л е н и я Р-ЦИЯ АЗОСОЧЕТАНИЯ: N 2 Азо-группа ( -N=N-) сильный хромофор Ауксохромы: NН 2, , SO 3 H, OH.