аминокислоты, белки.ppt
- Количество слайдов: 66

Амины. Аминокислоты. Белки.

Амины

Амины алифатического ряда • Амины - органические соединения, которые можно рассматривать как производные углеводородов, образованные в результате замещения атомов водорода в углеводородной молекуле остатками аммиака (аминогруппами). Амины рассматривают и как производные аммиака, в котором атомы водорода замещены углеводородными радикалами R – H NH 3 R – NH 2 углеводород аммиак амин

Так как в аммиаке радикалами могут быть последовательно замещены все водородные атомы, существуют три группы аминов. Амины, в которых азот соединен с одним радикалом, называются первичными, с двумя радикалами – вторичными и с тремя радикалами – третичными R R | | R – NH 2 R – NH R – N – R первичный вторичный третичный амин амин

Амины могут содержать одну, две и более аминогрупп, соответственно различают моноамины, диамины и т. д. Следует иметь в виду, что диамины с двумя аминогруппами при одном углеродном атоме не существуют. Поэтому простейшим диамином является этилендиамин, содержащий две аминогруппы при различных углеродных атомах: NH 2 – CH 2 – NH 2 этилендиамин (1, 2 - этандиамин)

С аминами тесно связаны органические вещества, являющиеся производными аммониевых соединений. Производные гидроксида аммония, содержащие в комплексном аммониевом катионе вместо атомов водорода радикалы, называют гидроксидами замещенного аммония; соединения, содержащие ион четырехзамещенного аммония, в котором с азотом вместо всех четырех атомов водорода связаны четыре радикала, называют четвертичными аммониевыми основаниями:
![[NH 4]+ OH- Гидроксид аммония гидроксид четырехзамещенного аммония (четвертичное аммониевое основание) [NH 4]+ OH- Гидроксид аммония гидроксид четырехзамещенного аммония (четвертичное аммониевое основание)](https://present5.com/presentation/150394450_272751135/image-7.jpg)
[NH 4]+ OH- Гидроксид аммония гидроксид четырехзамещенного аммония (четвертичное аммониевое основание)

Номенклатура аминов По правилам Международной номенклатуры, если аминогруппа в соединении является главной, наличие ее обозначают окончанием –амин; когда имеется несколько таких групп, используют окончание с греческими числительными – диамин, триамин и т. д.

Для наименования первичных аминов или диаминов с первичными аминогруппами указанные окончания добавляются к названиям соответствующих одновалентных или двухвалентных радикалов: CH 3 | CH 3 – NH 2 CH 3 – CH – NH 2 метиламин изопропиламин CH 2 – CH 2 | | NH 2 NH 2 тетраметилендиамин

Названия аминов могут быть произведены и от заместительных названий соответствующих углеводородов, тогда цифрами указывают атомы углерода главной цепи, связанные с аминогруппой. Например CH 3 5 4 │ 3 2 1 CH 3 ― CH ― CH 2 ― CH 3 │ NH 2 4 -метилпентанамин-2

Названия вторичных и третичных аминов с одинаковыми радикалами образуются из названий этих радикалов и указывающих их число греческих числительных. Например: CH 2 ― CH 3 │ СH 3 ― NH ― CH 3 ― CH 2 ― N ― CH 2 ― CH 3 диметиламин триэтиламин
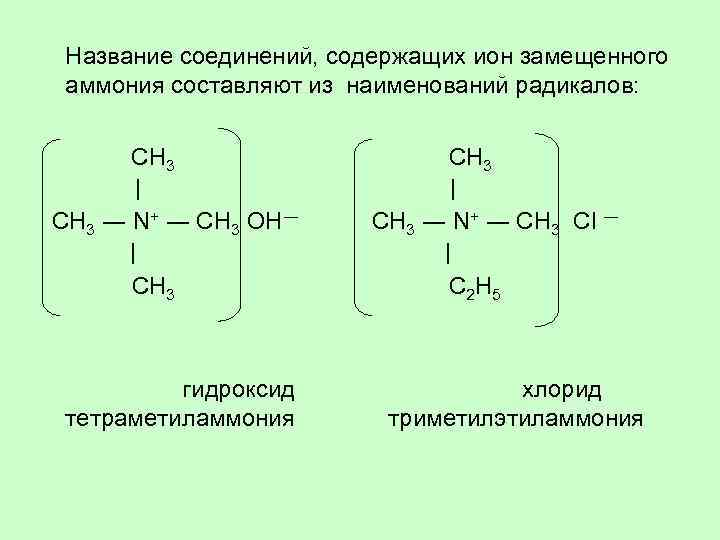
Название соединений, содержащих ион замещенного аммония составляют из наименований радикалов: CH 3 CH 3 │ │ CH 3 ― N+ ― CH 3 OH― CH 3 ― N+ ― CH 3 Cl ― │ │ CH 3 C 2 H 5 гидроксид хлорид тетраметиламмония триметилэтиламмония

Химические свойства Как производные аммиака амины проявляют основные свойства и являются органическими основаниями. Подобно аммиаку амины с водой образуют катионы замещенного аммония и гидроксильные анионы: + CH 3 NH 2 + HOH CH 3 NH 3 + OH ¯ метиламин ион метиламина

Водные растворы аминов можно представить как растворы гидроксидов замещенного аммония; в случае метиламина – гидроксида метиламмония CH 3 NH 3 OH. Они имеют щелочную реакцию и окрашивают лакмус в синий цвет.

Под влиянием простейших алкильных радикалов основные свойства аминогруппы увеличиваются, поэтому амины жирного ряда являются более сильными основаниями, чем аммиак. Особенно сильные основные свойства проявляют четвертичные аммониевые основания.
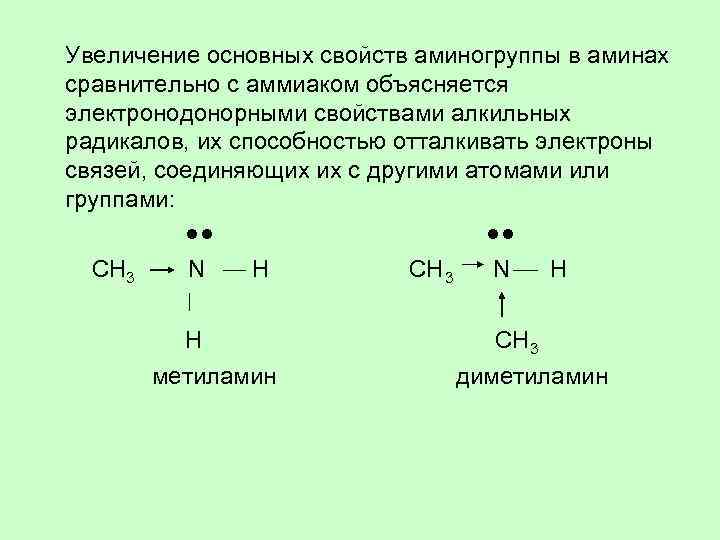
Увеличение основных свойств аминогруппы в аминах сравнительно с аммиаком объясняется электронодонорными свойствами алкильных радикалов, их способностью отталкивать электроны связей, соединяющих их с другими атомами или группами: ●● CH 3 N H CH 3 N H CH 3 метиламин диметиламин

Алкилы увеличивают общую электронную плотность атома азота, несущего неподеленную электронную пару, и, следовательно, его способность присоединять протон. Как основание аммиак с кислотами дает соли аммония. Аналогично проявляются основные свойства аминов.
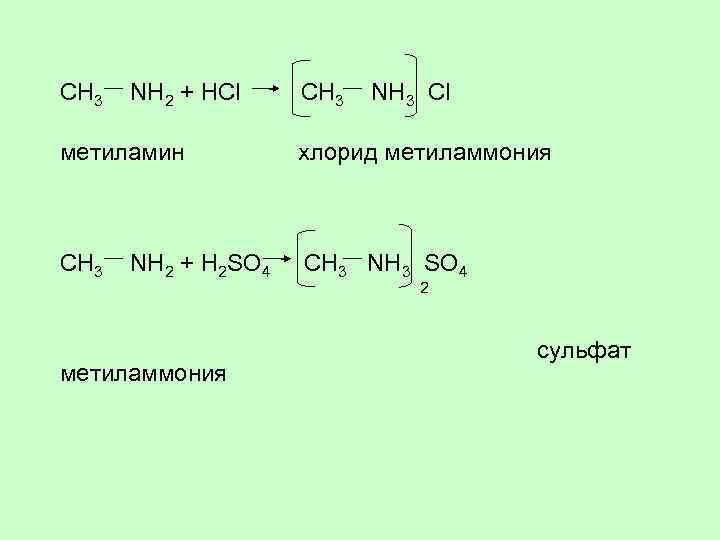
CH 3 NH 2 + HCl CH 3 NH 3 Cl метиламин хлорид метиламмония CH 3 NH 2 + H 2 SO 4 CH 3 NH 3 SO 4 2 метиламмония сульфат

Едкие щелочи, как более сильные основания, вытесняют амины из их солей. CH 3―NH 3 Cl + Na. OH → CH 3―NH 2 + H 2 O + Na. Cl метиламин Реакция ускоряется при нагревании.
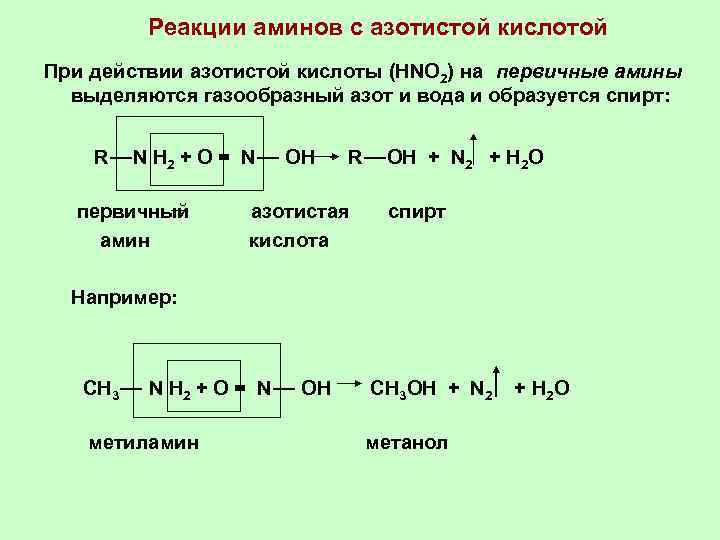
Реакции аминов с азотистой кислотой При действии азотистой кислоты (HNO 2) на первичные амины выделяются газообразный азот и вода и образуется спирт: R―N H 2 + O = N― OH первичный амин R―OH + N 2 + H 2 O азотистая кислота спирт Например: CH 3― N H 2 + O = N― OH CH 3 OH + N 2 метиламин метанол + H 2 O
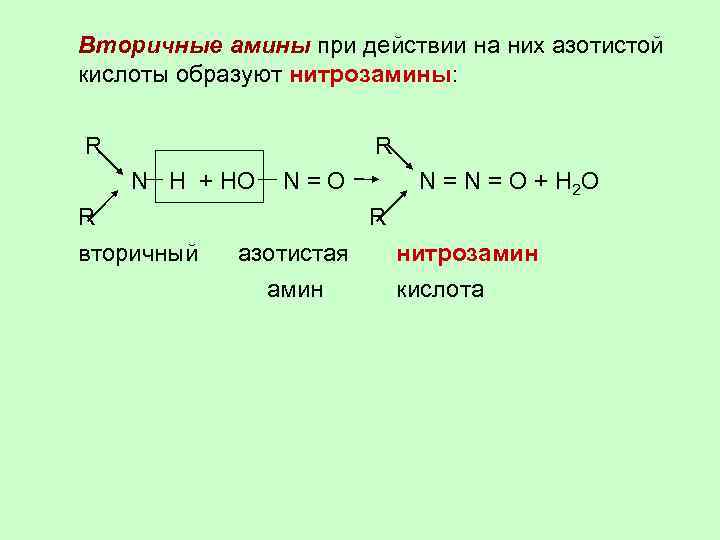
Вторичные амины при действии на них азотистой кислоты образуют нитрозамины: R R N H + HO N = О + H 2 O R R вторичный азотистая нитрозамин кислота
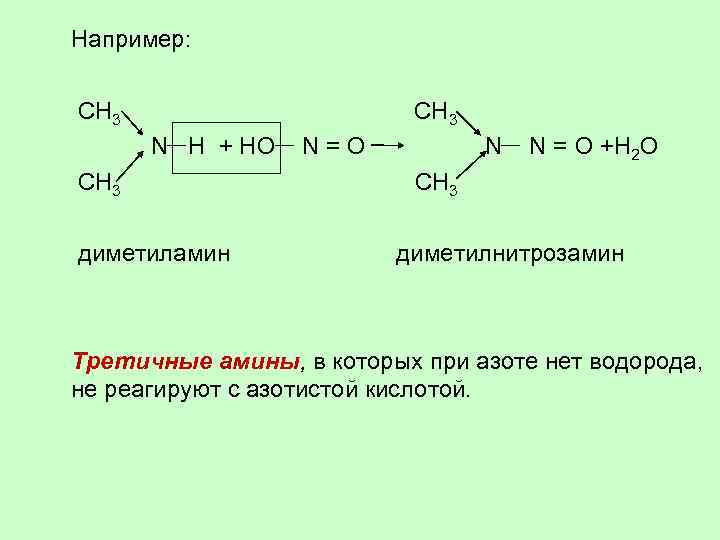
Например: CH 3 N H + HO N = О N N = О +H 2 O CH 3 CH 3 диметиламин диметилнитрозамин Третичные амины, в которых при азоте нет водорода, не реагируют с азотистой кислотой.

Аминокислоты.

Аминокислоты – это органические соединения, в состав которых входят две функциональные группы: карбоксильная –COOH и аминогруппа –NH 2. Простейшая аминокислота – это аминоуксусная кислота NH 2 COOH, называемая также глицином.

Если один атом водорода в метильном радикале молекулы уксусной кислоты заменить на группу –NH 2, то получится формула аминоуксусной кислоты: CH 3 COOH - уксусная кислота NH 2 COOH – аминоуксусная кислота NH 2 – функциональная группа, называемая аминогруппой.

Амфотерность аминокислот Одновременное наличие в молекулах аминокислот двух функциональных групп определяет их своеобразные химические свойства. Карбоксильная группа – СООН в аминокислотах определяет их кислотные свойства.

Аминогруппа – NH 2 определяет основные свойства вещества, так как способна присоединять к себе катион водорода за счёт наличия свободной электронной пары у атома азота: - NH 2 + H+ - NH 3+. . Так же ведёт себя аммиак, образуя при этом ион аммония NH 4+ : NH 3 + H+ NH 4+. . Аминокислоты – это органические вещества, которые обладают одновременно кислотными и основными свойствами.

Свойства АК. 1. Образование солей Образование внутренних солей Формула не отражает строения АК. Аминогруппа нейтрализует карбоксильную группу, поэтому АК в твёрдом виде и в растворе при p. H = изоэлектрической точке находятся в виде цвиттерионов:
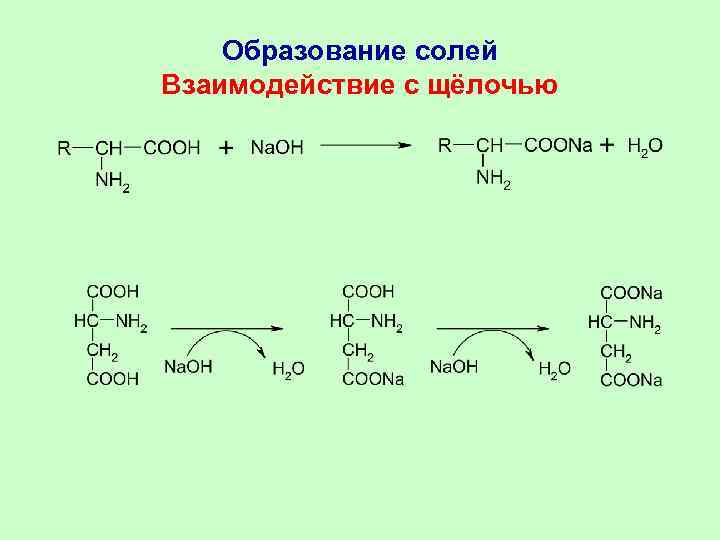
Образование солей Взаимодействие с щёлочью
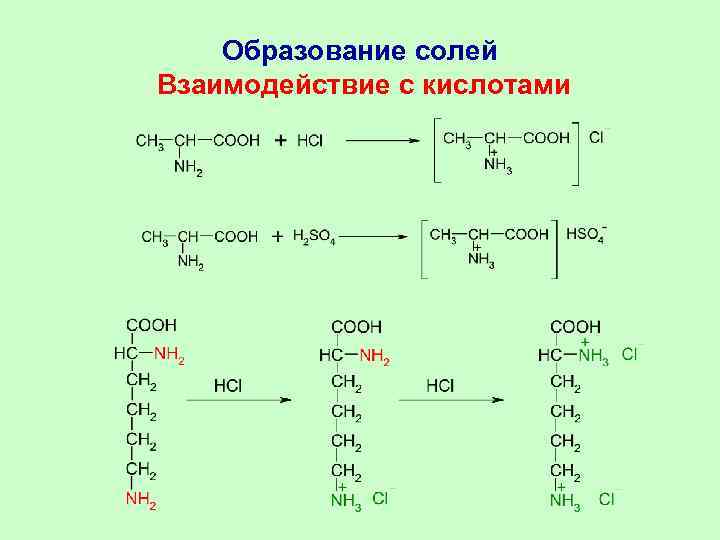
Образование солей Взаимодействие с кислотами
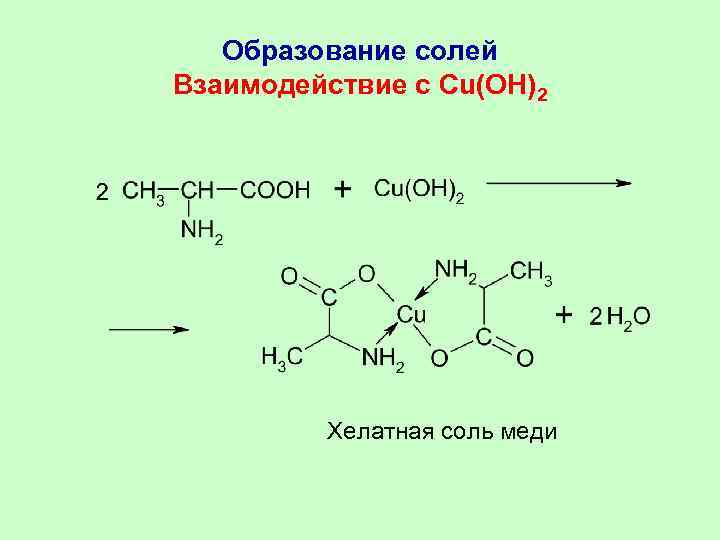
Образование солей Взаимодействие с Cu(OH)2 Хелатная соль меди
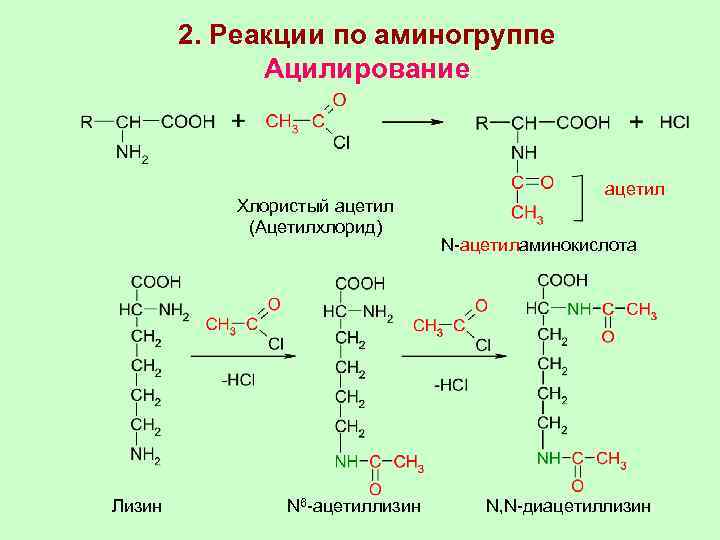
2. Реакции по аминогруппе Ацилирование Хлористый ацетил (Ацетилхлорид) ацетил N-ацетиламинокислота Лизин N 6 -ацетиллизин N, N-диацетиллизин
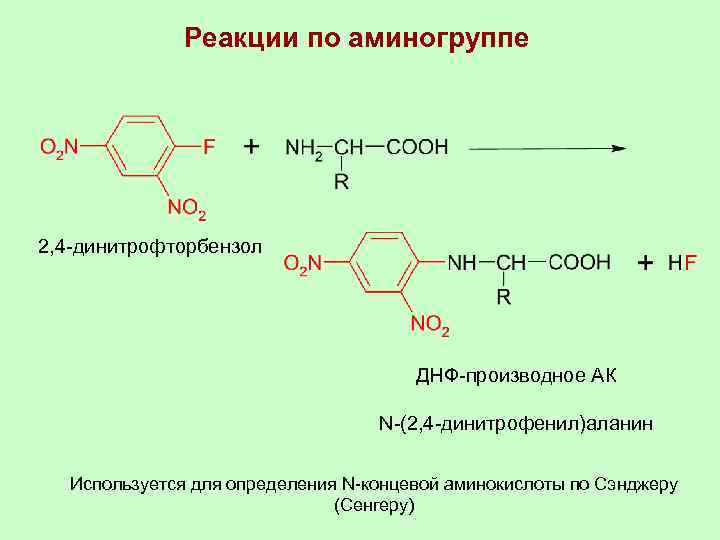
Реакции по аминогруппе 2, 4 -динитрофторбензол ДНФ-производное АК N-(2, 4 -динитрофенил)аланин Используется для определения N-концевой аминокислоты по Сэнджеру (Сенгеру)
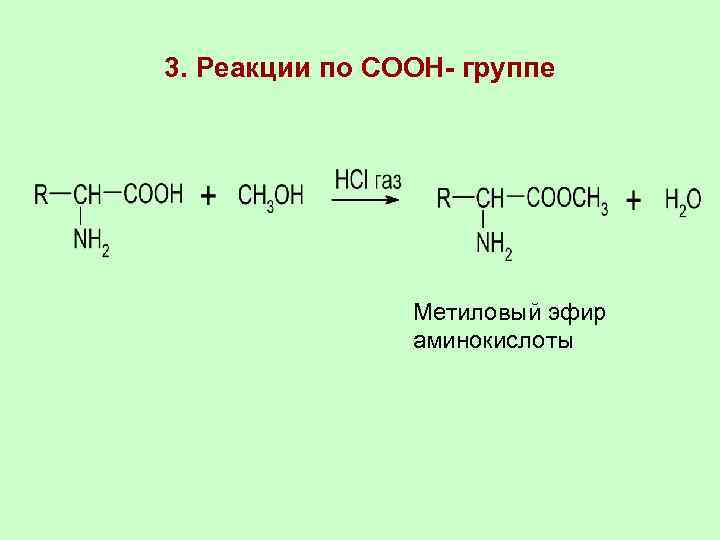
3. Реакции по COOH- группе Метиловый эфир аминокислоты

Реакция поликонденсации Благодаря наличию кислотной и основной групп молекулы аминокислот способны взаимодействовать друг с другом и образовывать полимеры – белки. HNH-CH 2 -COOH + HNH-CH 2 -COOH НNH-CH 2 CO- NH-CH 2 COOH + H 2 O

Реакции получения полимеров, которые сопровождаются образованием низкомолекулярного продукта, например воды, называются реакциями поликонденсации. При соединении молекул аминокислот друг с другом возникает связь, называемая пептидной. Связь между остатком аминогруппы -NH- одной молекулы аминокислоты и остатком карбоксильной группы –СОдругой молекулы аминокислоты называется пептидной связью: -CO-NH-.
Белки.
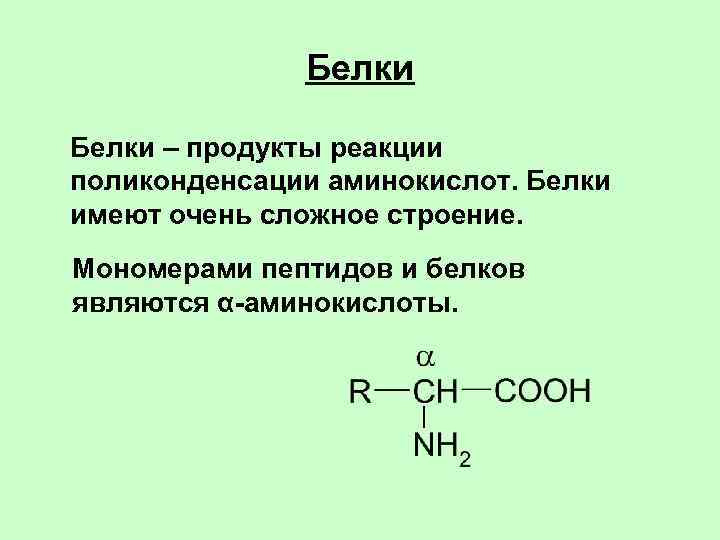
Белки – продукты реакции поликонденсации аминокислот. Белки имеют очень сложное строение. Мономерами пептидов и белков являются α-аминокислоты.

• В общем виде аминокислоты, участвующие в образовании белков, могут быть представлены формулой: H 2 N–CH(R)–COOH. Группа R, присоединенная к атому углерода , определяет различие между аминокислотами, образующими белки. • В организмах живых существ содержится более 100 различных аминокислот, однако, в строительстве белков используются не все, а только 20, так называемых «фундаментальных» .
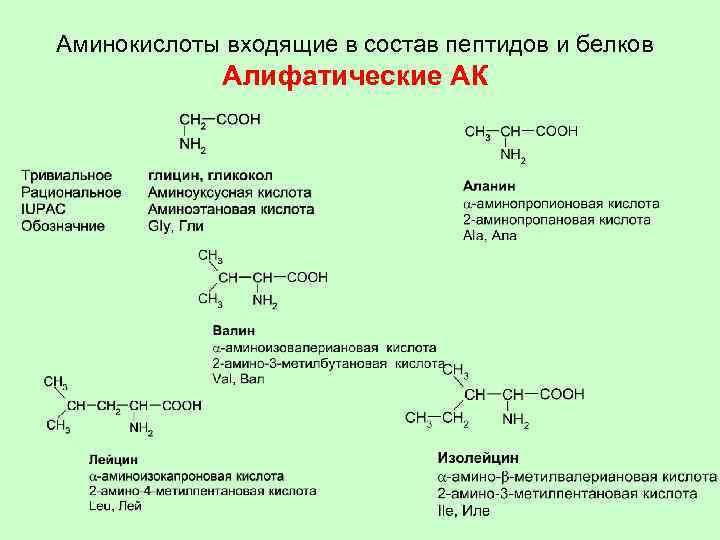
Аминокислоты входящие в состав пептидов и белков Алифатические АК
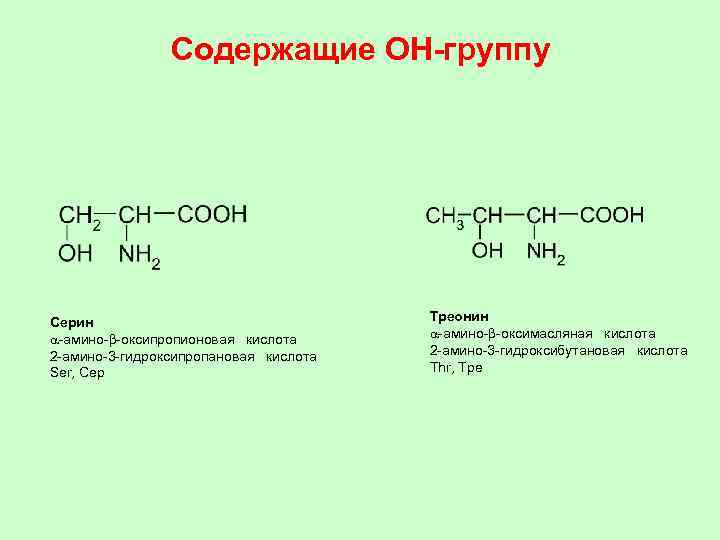
Содержащие ОН-группу Ceрин a-амино-b-оксипропионовая кислота 2 -амино-3 -гидроксипропановая кислота Ser, Сeр Трeонин a-амино-b-оксимасляная кислота 2 -амино-3 -гидроксибутановая кислота Thr, Трe
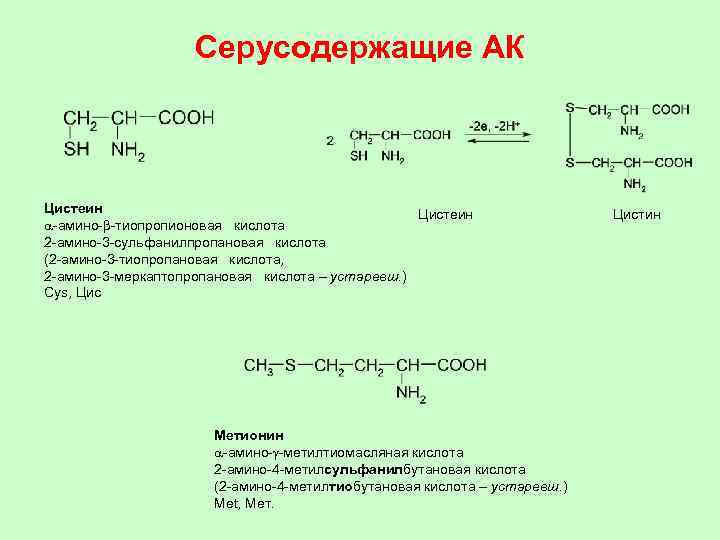
Серусодержащие АК Цистeин Цистеин Цистин a-амино-b-тиопропионовая кислота 2 -амино-3 -сульфанилпропановая кислота (2 -амино-3 -тиопропановая кислота, 2 -амино-3 -мeркаптопропановая кислота – устаревш. ) Cys, Цис Мeтионин a-амино-g-мeтилтиомасляная кислота 2 -амино-4 -метилсульфанилбутановая кислота (2 -амино-4 -метилтиобутановая кислота – устаревш. ) Met, Мет.
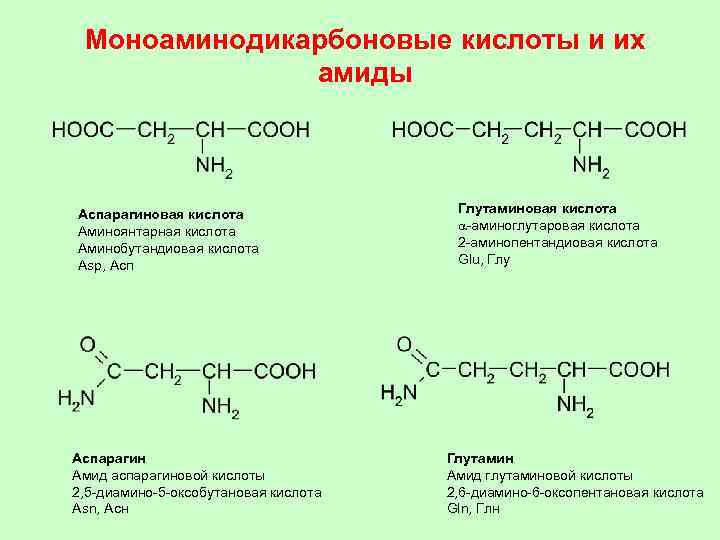
Моноаминодикарбоновые кислоты и их амиды Аспарагиновая кислота Аминоянтарная кислота Аминобутандиовая кислота Asp, Аспарагин Амид аспарагиновой кислоты 2, 5 -диамино-5 -оксобутановая кислота Asn, Асн Глутаминовая кислота a-aминоглутаровая кислота 2 -аминопентандиовая кислота Glu, Глутамин Амид глутаминовой кислоты 2, 6 -диамино-6 -оксопентановая кислота Gln, Глн

Содержащие аминогруппу Лизин a, e-диаминокапроновая кислота 2, 6 -диаминогексановая кислота Lys, Лиз Аргинин a-амино-d-гуанидилвалериановая кислота 2 -амино-5 -[амино(имино)метил]аминопентановая к-та Arg, Арг
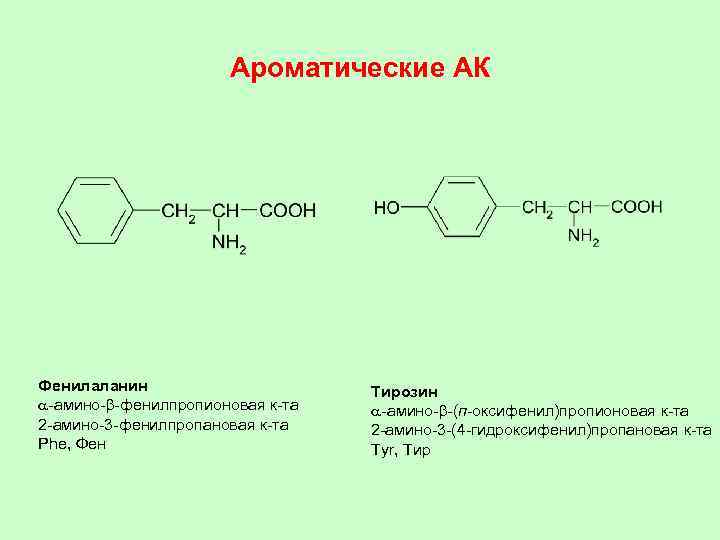
Ароматические АК Фенилаланин a-амино-b-фенилпропионовая к-та 2 -амино-3 -фенилпропановая к-та Phe, Фен Тирозин a-амино-b-(п-оксифенил)пропионовая к-та 2 -амино-3 -(4 -гидроксифенил)пропановая к-та Tyr, Тир
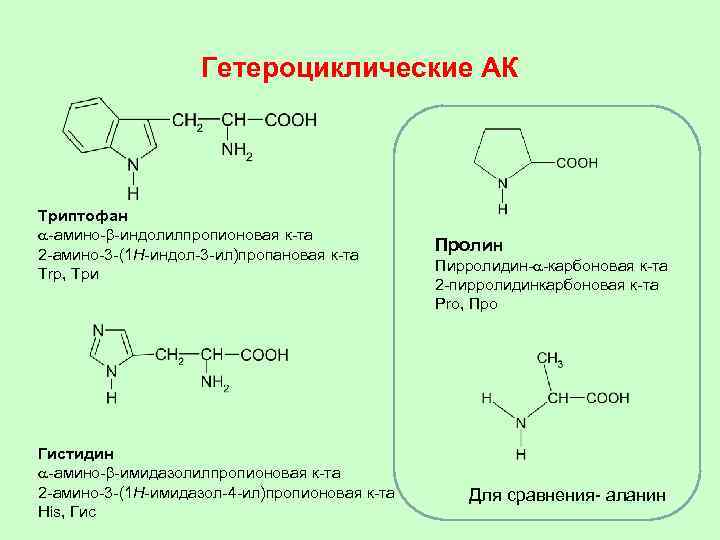
Гетероциклические АК Триптофан a-амино-b-индолилпропионовая к-та 2 -амино-3 -(1 H-индол-3 -ил)пропановая к-та Trp, Три Гистидин a-амино-b-имидазолилпропионовая к-та 2 -амино-3 -(1 H-имидазол-4 -ил)пропионовая к-та His, Гис Пролин Пирролидин-a-карбоновая к-та 2 -пирролидинкарбоновая к-та Pro, Про Для сравнения- аланин
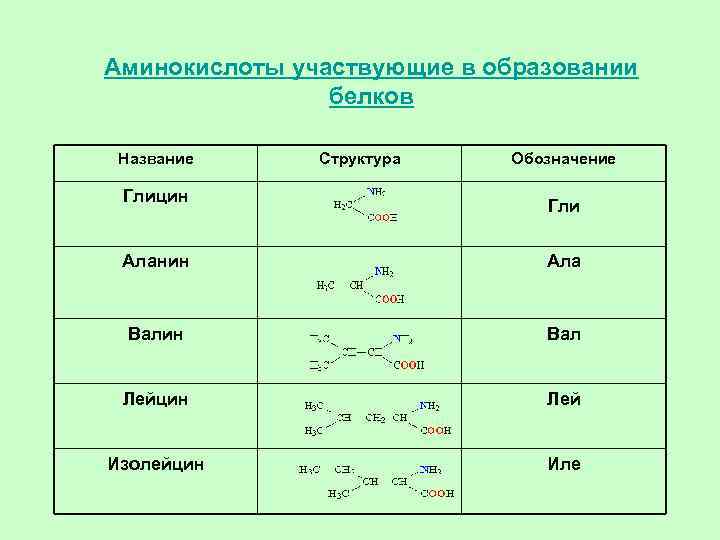
Аминокислоты участвующие в образовании белков Название Глицин Структура Обозначение Гли Аланин Ала Валин Вал Лейцин Лей Изолейцин Иле
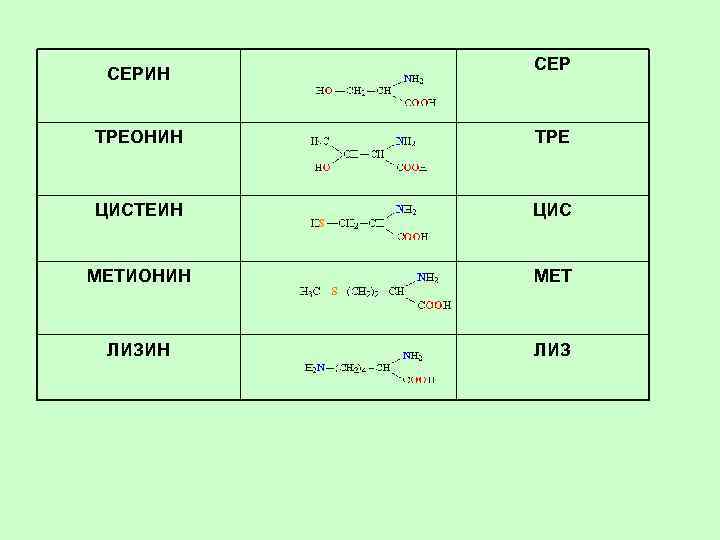
СЕРИН СЕР ТРЕОНИН ТРЕ ЦИСТЕИН ЦИС МЕТИОНИН МЕТ ЛИЗИН ЛИЗ
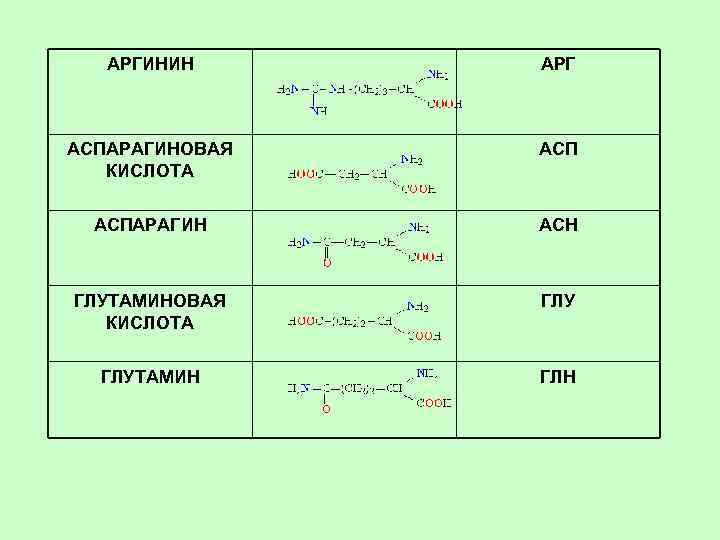
АРГИНИН АРГ АСПАРАГИНОВАЯ КИСЛОТА АСПАРАГИН АСН ГЛУТАМИНОВАЯ КИСЛОТА ГЛУТАМИН ГЛН
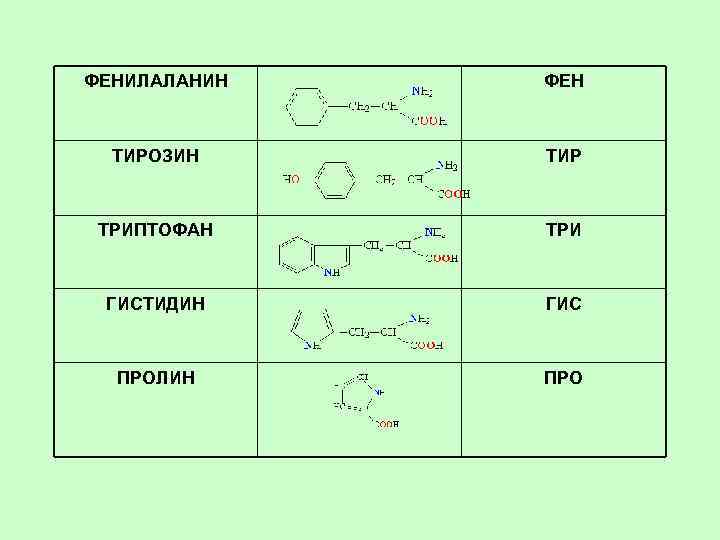
ФЕНИЛАЛАНИН ФЕН ТИРОЗИН ТИР ТРИПТОФАН ТРИ ГИСТИДИН ГИС ПРОЛИН ПРО
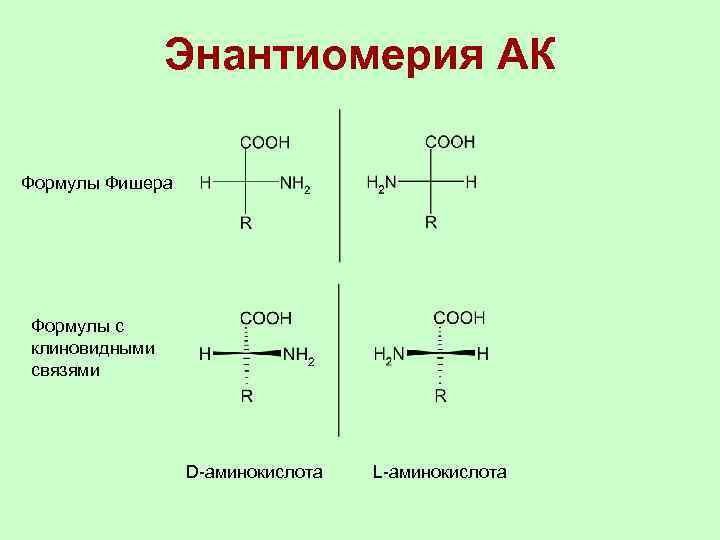
Энантиомерия АК Формулы Фишера Формулы с клиновидными связями D-аминокислота L-аминокислота

Энантиомерия АК В природных белках присутствуют остатки только L-аминокислот. В пептидах бактериального происхождения есть остатки Dаминокислот. Глицин не имеет энантиомеров, т. к. нет хирального атома углерода.
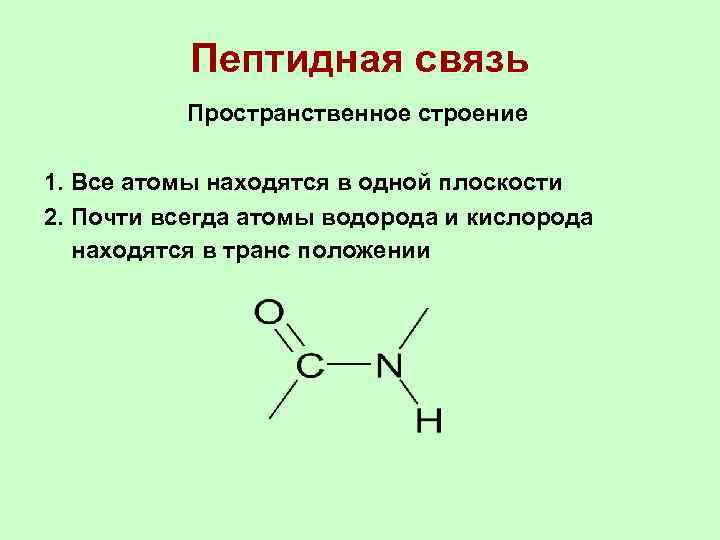
Пептидная связь Пространственное строение 1. Все атомы находятся в одной плоскости 2. Почти всегда атомы водорода и кислорода находятся в транс положении
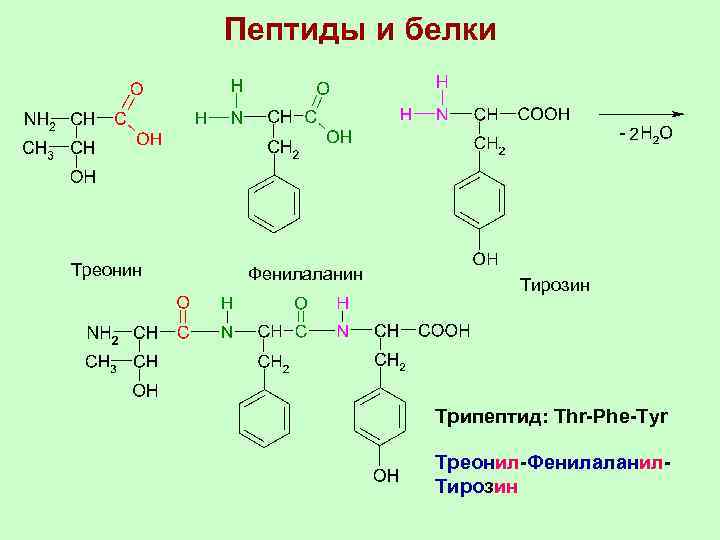
Пептиды и белки Треонин Фенилаланин Тирозин Трипептид: Thr-Phe-Tyr Треонил-Фенилаланил. Тирозин

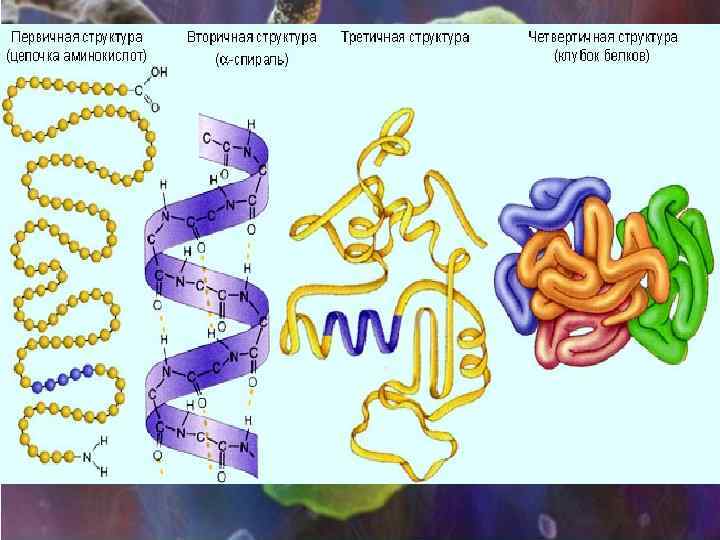
Уровни структурной организации белка • первичная структура – аминокислотная последовательность • вторичная структура – локальные высокоупорядоченные конформации белковой цепи (a-спираль, b-структура) • третичная структура – форма белковой молекулы; трёхмерная нативная структура белка • четвертичная структура – агрегат из нескольких молекул белка

первичная структура • первичная структура – последовательность аминокислотных остатков в молекуле белка или пептида. NH 2 -Tyr-Pro-Lys-Gly-Phe-Tyr-Lys-COOH Первичная структура определяет все остальные уровни структурной организации белка

Вторичная структура • Вторичная структура- локальные высокоупорядоченные конформации белковой цепи – спирали и складчатые слои.
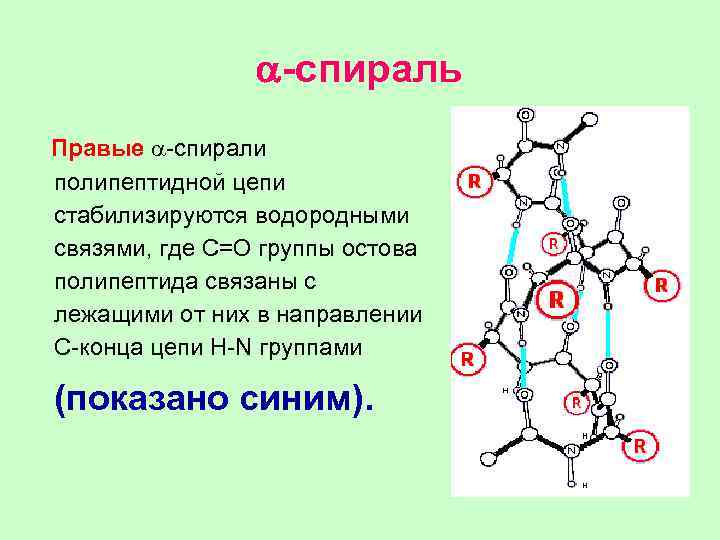
a-спираль Правые a-спирали полипептидной цепи стабилизируются водородными связями, где С=О группы остова полипептида связаны с лежащими от них в направлении С-конца цепи H-N группами (показано синим).
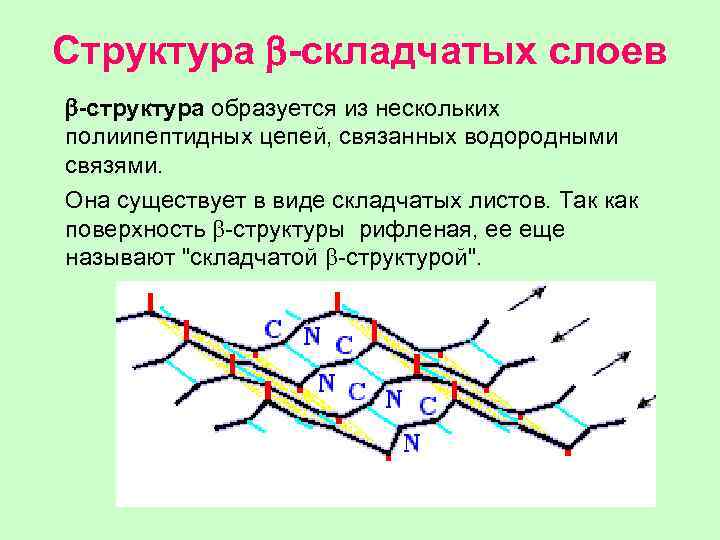
Структура b-складчатых слоев b-структура образуется из нескольких полиипептидных цепей, связанных водородными связями. Она существует в виде складчатых листов. Так как поверхность b-структуры рифленая, ее еще называют "складчатой b-структурой".
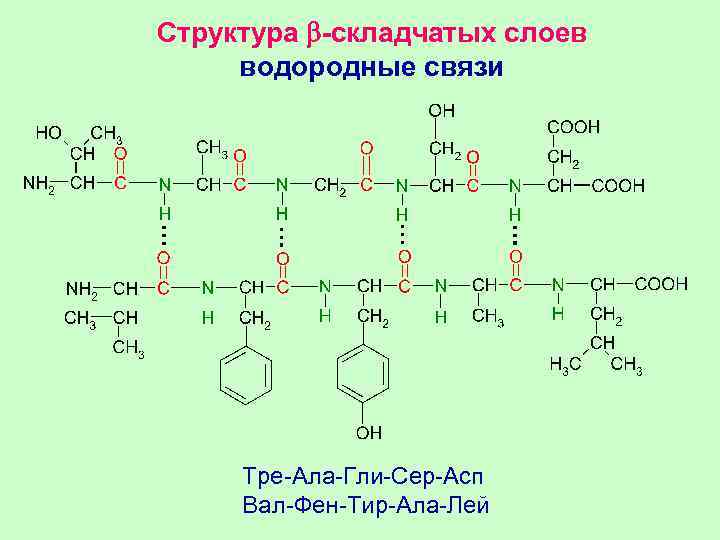
Структура b-складчатых слоев водородные связи Тре-Ала-Гли-Сер-Асп Вал-Фен-Тир-Ала-Лей

Третичная структура • третичная структура – форма белковой молекулы; трёхмерная структура белка. • Укладка нерегулярных областей и a и b-структур в глобулу определяет третичную структуру белка

Взаимодействия остатков АК в третичной структуре Остатки АК в белковой глобуле взаимодействуют за счёт: 1. Гидрофобных взаимодействий 2. Ковалентных связей (дисульфидные –S–S– связи в цистеине) 3. Ионных связей (Глу-COO- H 3 N+-Лиз) 4. Водородных связей (Глу-COO-…HO-Тир)
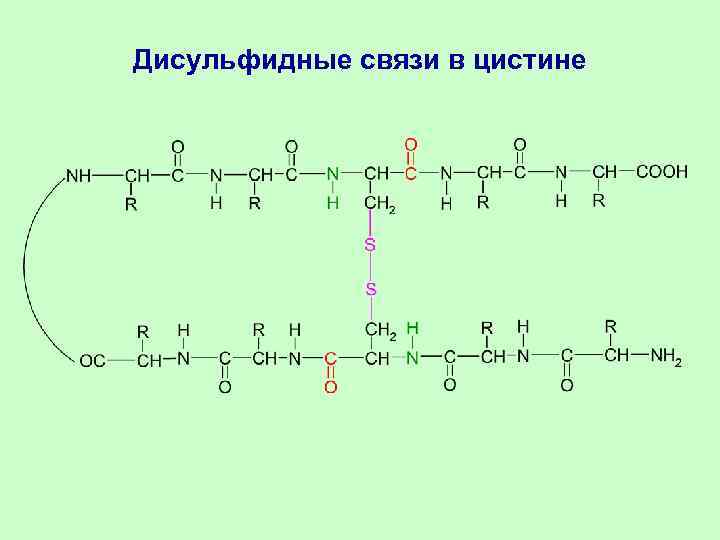
Дисульфидные связи в цистине
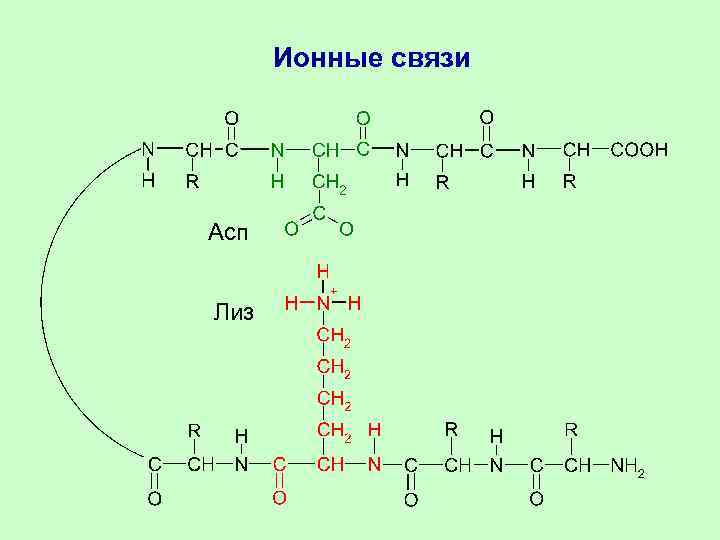
Ионные связи Асп Лиз

Четвертичная структура • Четвертичная структура- агрегат нескольких белковых молекул образующих одну структуру • Взаимодействия: ионные, водородные, гидрофобные, ковалентные (дисульфидные) • Протомер - отдельная полипептидная цепь • Субъединица- функциональная единица
аминокислоты, белки.ppt