Аминокислоты.pptx
- Количество слайдов: 22
 Аминокислоты Выполнила: Зиганшина Гульнара Группа 111 -О
Аминокислоты Выполнила: Зиганшина Гульнара Группа 111 -О
 Аминокислоты – это производные углеводородов, в молекулах которых содержится одновременно карбоксильная и аминная группы.
Аминокислоты – это производные углеводородов, в молекулах которых содержится одновременно карбоксильная и аминная группы.
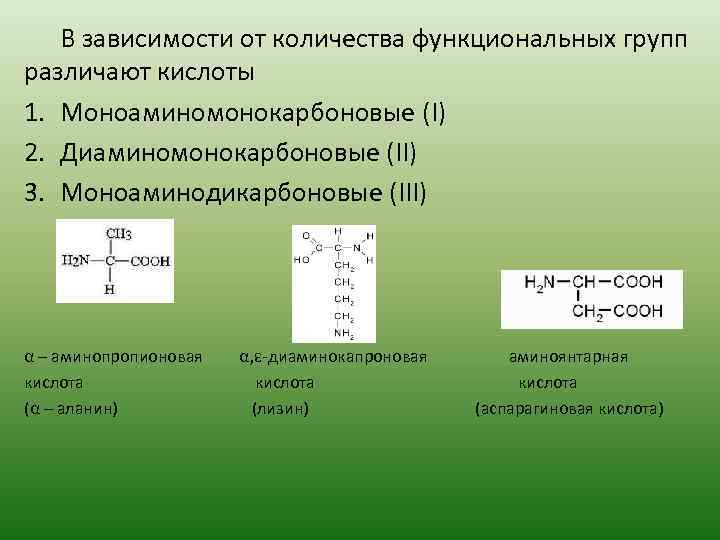 В зависимости от количества функциональных групп различают кислоты 1. Моноаминомонокарбоновые (I) 2. Диаминомонокарбоновые (II) 3. Моноаминодикарбоновые (III) α – аминопропионовая кислота (α – аланин) α, ε-диаминокапроновая кислота (лизин) аминоянтарная кислота (аспарагиновая кислота)
В зависимости от количества функциональных групп различают кислоты 1. Моноаминомонокарбоновые (I) 2. Диаминомонокарбоновые (II) 3. Моноаминодикарбоновые (III) α – аминопропионовая кислота (α – аланин) α, ε-диаминокапроновая кислота (лизин) аминоянтарная кислота (аспарагиновая кислота)
 Строение аминокислот В зависимости от положения аминогруппы по отношению к карбоксильной группе в углеродной цепи различают α-, β-, γаминокислоты. Аминокислоты делят на: Ø Природные Ø Синтетические
Строение аминокислот В зависимости от положения аминогруппы по отношению к карбоксильной группе в углеродной цепи различают α-, β-, γаминокислоты. Аминокислоты делят на: Ø Природные Ø Синтетические
 Номенклатура По систематической номенклатуре из называют как соответствующие карбоновые кислоты с добавлением приставки амино-. Положение аминогруппы в углеродной цепи указываеют цифрой. Н 3 С-СН 2 -СН(СН 3)-СН(NН 2)-СООН 2 -амино-3 -метилпентановая кислота (изолейцин)
Номенклатура По систематической номенклатуре из называют как соответствующие карбоновые кислоты с добавлением приставки амино-. Положение аминогруппы в углеродной цепи указываеют цифрой. Н 3 С-СН 2 -СН(СН 3)-СН(NН 2)-СООН 2 -амино-3 -метилпентановая кислота (изолейцин)
 Важнейшие аминокислоты
Важнейшие аминокислоты
 Изомерия аминокислот зависит от строения углеродной цепи и от расположения в ней аминогруппы и карбоксила α-аминопропионовая β-аминопропионовая
Изомерия аминокислот зависит от строения углеродной цепи и от расположения в ней аминогруппы и карбоксила α-аминопропионовая β-аминопропионовая
 Различают D-аминокислоты и Lаминокислоты. Расположение аминогруппы в проекционной формуле слева соответствует L-конфигурации, а справа – D -конфигурации.
Различают D-аминокислоты и Lаминокислоты. Расположение аминогруппы в проекционной формуле слева соответствует L-конфигурации, а справа – D -конфигурации.
 Получение аминокислот 1. Получение из карбоновых кислот: Р(красный) СН 3 СООН + Сl 2 Сl. СН 2 СООН + НСl Сl. СН 2 СООН + 2 NН 3 Н 2 N-СН 2 -CООН + NH 4 Cl 2. Присоединение аммиака к непредельным кислотам СН 2=СН-СООН+NН 3 Н 2 N-СН 2 -СООН Присоединение идет по правилу Марковникова
Получение аминокислот 1. Получение из карбоновых кислот: Р(красный) СН 3 СООН + Сl 2 Сl. СН 2 СООН + НСl Сl. СН 2 СООН + 2 NН 3 Н 2 N-СН 2 -CООН + NH 4 Cl 2. Присоединение аммиака к непредельным кислотам СН 2=СН-СООН+NН 3 Н 2 N-СН 2 -СООН Присоединение идет по правилу Марковникова
 3. Получение из циангидринов альдегидов и кетонов (циангидринный метод). Важной реакцией получения α-аминокислот является действие аммиака на циангидрины альдегидов и кетонов С последующим омылением аминонитрила в аминокислоту:
3. Получение из циангидринов альдегидов и кетонов (циангидринный метод). Важной реакцией получения α-аминокислот является действие аммиака на циангидрины альдегидов и кетонов С последующим омылением аминонитрила в аминокислоту:
 4. Гидролиз полипептидов (белков)
4. Гидролиз полипептидов (белков)
 Физические свойства аминокислот Аминокислоты – бесцветные кристаллические вещества с высокой температурой плавления, хорошо растворимые в воде и нерастворимы в эфире. Реакция водных растворов моноаминокарбоновых кисот близка к нейтральной.
Физические свойства аминокислот Аминокислоты – бесцветные кристаллические вещества с высокой температурой плавления, хорошо растворимые в воде и нерастворимы в эфире. Реакция водных растворов моноаминокарбоновых кисот близка к нейтральной.
 Химические свойства аминокислот 1. Взаимодействие с щелочами Н 2 N-СН 2 -СООН + Na. OH → H 2 N-CH 2 -COONa + Н 2 О. Взаимодействие с сильными кислотами Н 2 N-СН 2 -СООН + HCl→ [Н 3 N-СН 2 -СООН]+Сl-
Химические свойства аминокислот 1. Взаимодействие с щелочами Н 2 N-СН 2 -СООН + Na. OH → H 2 N-CH 2 -COONa + Н 2 О. Взаимодействие с сильными кислотами Н 2 N-СН 2 -СООН + HCl→ [Н 3 N-СН 2 -СООН]+Сl-
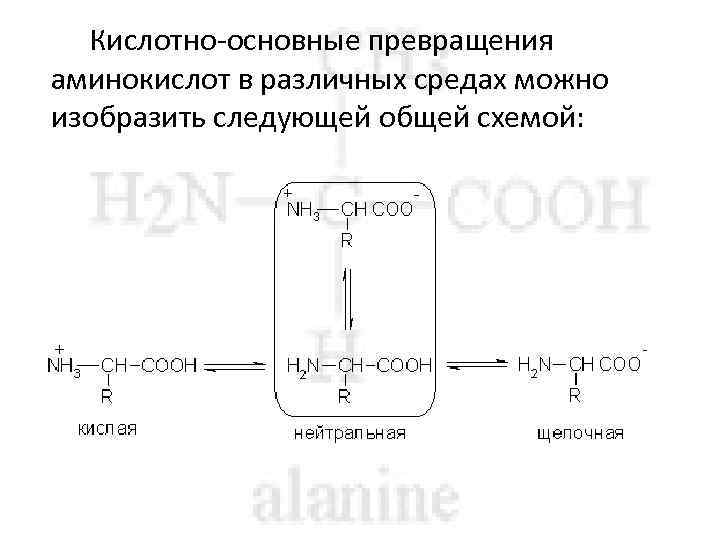 Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:
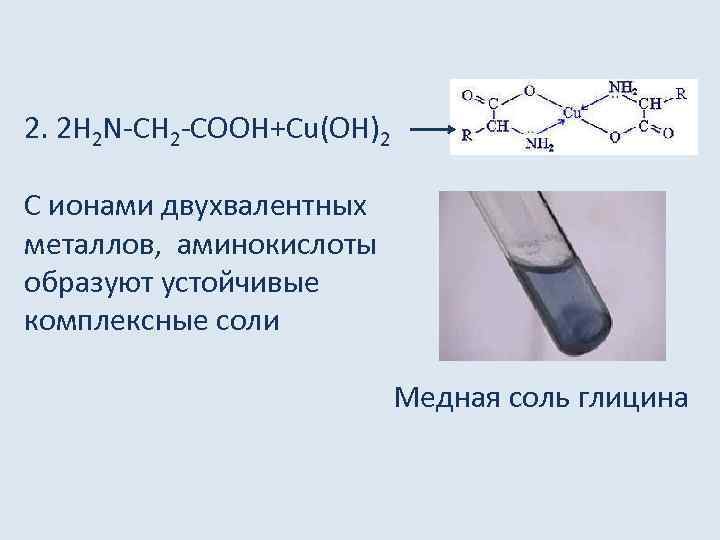 2. 2 Н 2 N-СН 2 -СООН+Сu(ОН)2 С ионами двухвалентных металлов, аминокислоты образуют устойчивые комплексные соли Медная соль глицина
2. 2 Н 2 N-СН 2 -СООН+Сu(ОН)2 С ионами двухвалентных металлов, аминокислоты образуют устойчивые комплексные соли Медная соль глицина
 3. Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир: H 2 N-CH(R)-COOH + R'OH H 2 N-CH(R)-COOR'+Н 2 О. 4. Взаимодействие с аммиаком NH 2 -CH(R)-COOH + H-NH 2 → NH 2 -CH(R)-CONH 2+ H 2 O
3. Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир: H 2 N-CH(R)-COOH + R'OH H 2 N-CH(R)-COOR'+Н 2 О. 4. Взаимодействие с аммиаком NH 2 -CH(R)-COOH + H-NH 2 → NH 2 -CH(R)-CONH 2+ H 2 O

 7. Алкилирование и ацилирование аминокислот СН 3 - I + Н NН-СН 2 -СООН СН 3 NН-СН 2 -СООН +НI N-метилглицин При взаимодействии с аминокислотами ангидридов и галогеногидридов кислот аминокислота легко ацилируется: СН 3 СОСl+НNН-СН 2 -СООН СН 3 -СО-NН-СН 2 -СООН+НCl N-ацетилглицин
7. Алкилирование и ацилирование аминокислот СН 3 - I + Н NН-СН 2 -СООН СН 3 NН-СН 2 -СООН +НI N-метилглицин При взаимодействии с аминокислотами ангидридов и галогеногидридов кислот аминокислота легко ацилируется: СН 3 СОСl+НNН-СН 2 -СООН СН 3 -СО-NН-СН 2 -СООН+НCl N-ацетилглицин
 При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: H 2 N-CH 2—СООН ↔ +Н 3 N-СН 2—СОO-.
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: H 2 N-CH 2—СООН ↔ +Н 3 N-СН 2—СОO-.
 Реакция поликонденсации
Реакция поликонденсации
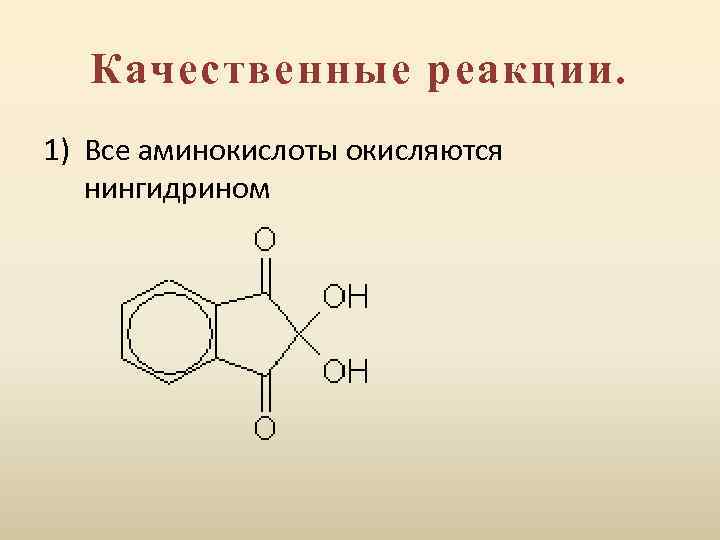 Качественные реакции. 1) Все аминокислоты окисляются нингидрином
Качественные реакции. 1) Все аминокислоты окисляются нингидрином
 2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос — желтый).
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой (от греч. ксантос — желтый).


