Аминокислоты, пептиды, белки.ppt
- Количество слайдов: 98

Аминокислоты, пептиды, белки

Значение белков для организма, их функции Важнейшее значение для организма имеют белки, составляющие основу жизненных процессов. Основные функции живой клетки: размножение, обмен веществ, деление связаны с клеточными белками. Все химические превращения, протекающие в организме, происходят под влиянием катализаторов - ферментов, представляющих собой белковые вещества. Белками являются многие гормоны – регуляторы процессов жизнедеятельности. Белковую природу имеют и биологические яды – токсины, и вирусы – возбудители инфекционных заболеваний. Белки также выполняют и другие функции в организме - опорные и защитные. Например, коллаген – составная часть костей и сухожилий, кожи обеспечивает прочность скелета, кератин – белок кожи, выполняет защитные функции.

Аминокислоты - структурные элементы белков Началом изучения строения белков принято считать 1820 г, когда А. Браконно в результате кислого гидролиза кожи и сухожилий выделил первую АК - глицин или гликокол. В 1935 г. стало ясно, что белки состоят из αаминокислот L-ряда. При гидролизе белков выделено более 100 АК, 20 из них встречаются чаще других.

Номенклатура и классификация АК n Для номенклатуры АК характерно обилие тривиальных названий, причем название обычно происходит от источников выделения кислоты. Например, тирозин был выделен из сыра, аспарагин из спаржи, цистеин из камней мочевого пузыря. n Классифицируют АК по химическому строению и по наличию тех или иных групп.
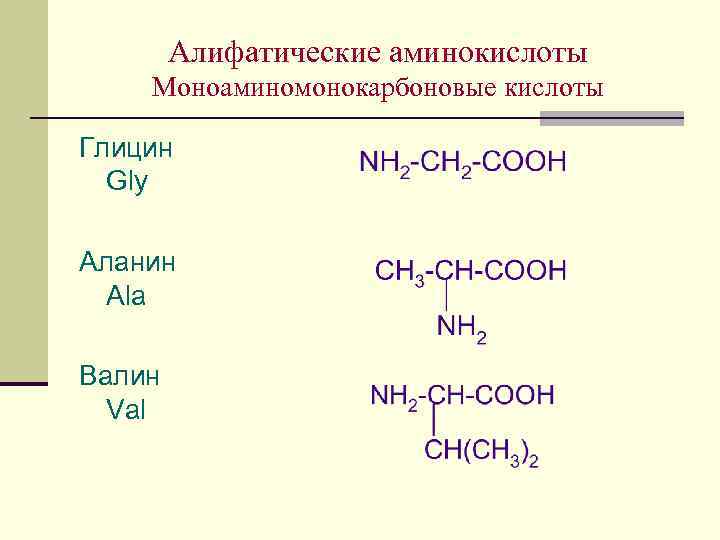
Алифатические аминокислоты Моноаминомонокарбоновые кислоты Глицин Gly Аланин Ala Валин Val
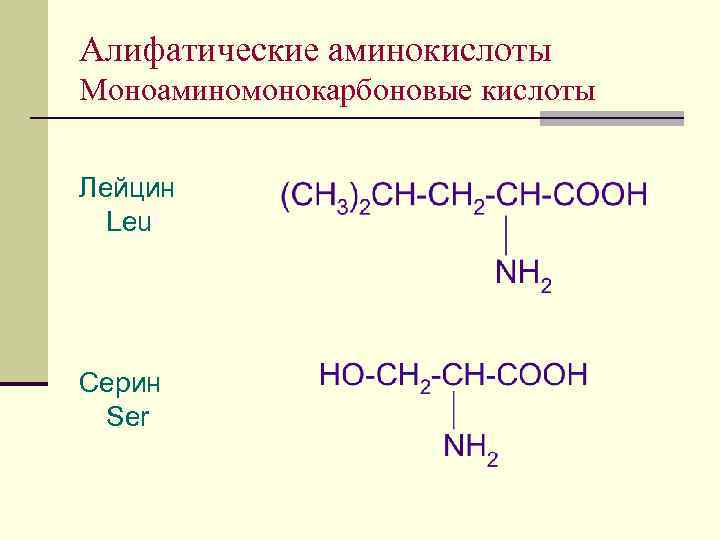
Алифатические аминокислоты Моноаминомонокарбоновые кислоты Лейцин Leu Серин Ser
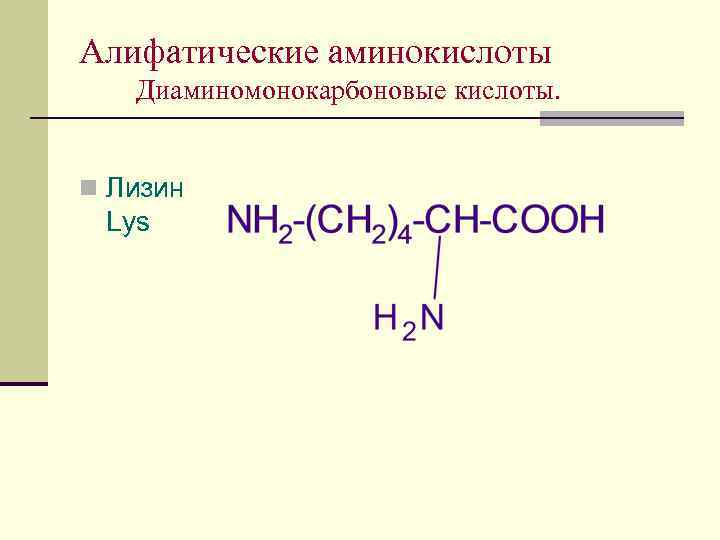
Алифатические аминокислоты Диаминомонокарбоновые кислоты. n Лизин Lys
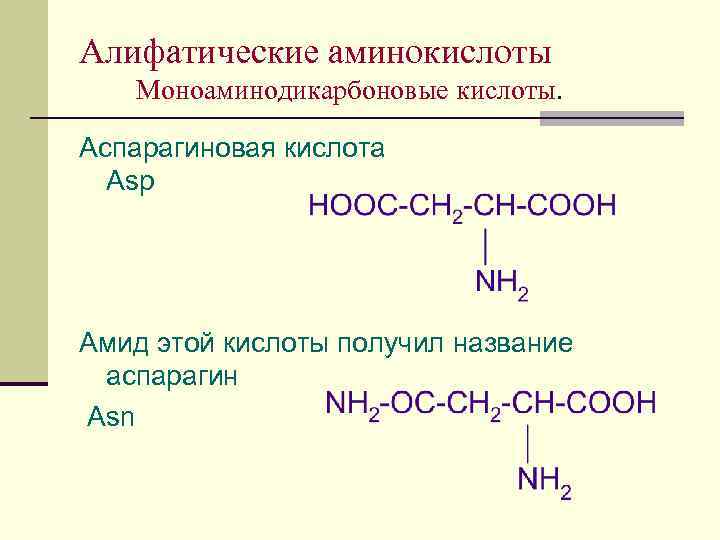
Алифатические аминокислоты Моноаминодикарбоновые кислоты. Аспарагиновая кислота Asp Амид этой кислоты получил название аспарагин Asn
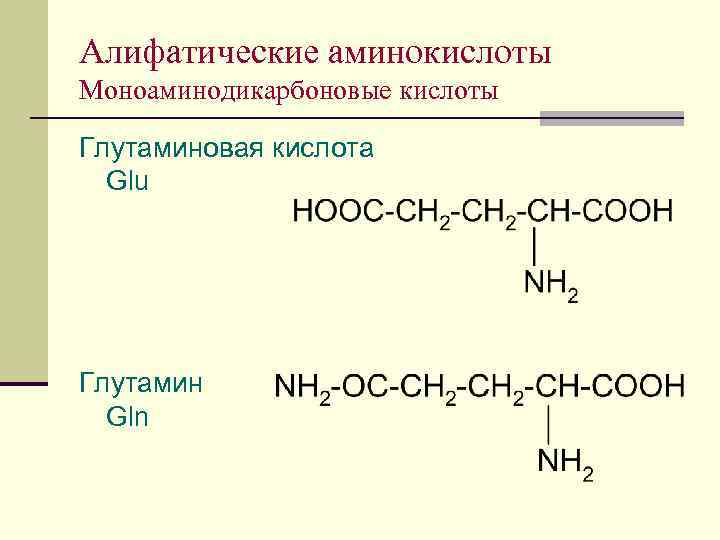
Алифатические аминокислоты Моноаминодикарбоновые кислоты Глутаминовая кислота Glu Глутамин Gln
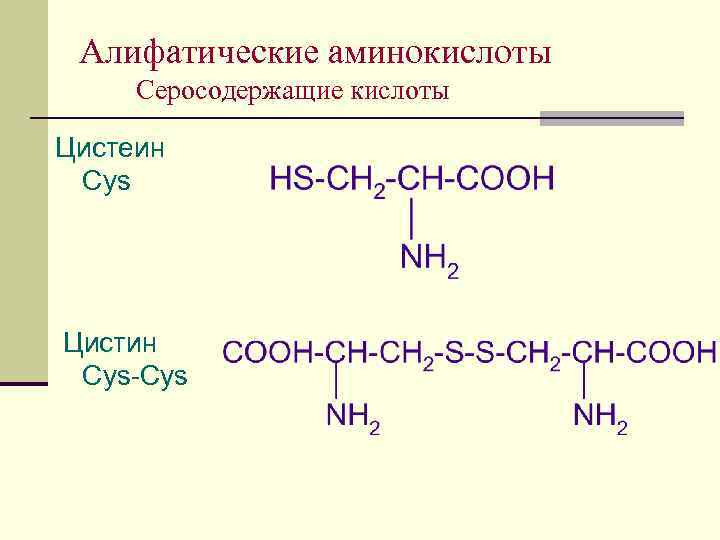
Алифатические аминокислоты Серосодержащие кислоты Цистеин Cys Цистин Cys-Cys
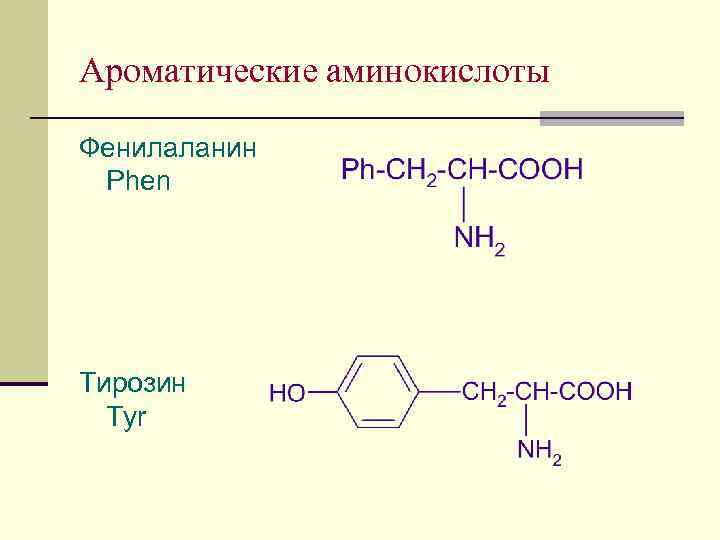
Ароматические аминокислоты Фенилаланин Phen Тирозин Tyr
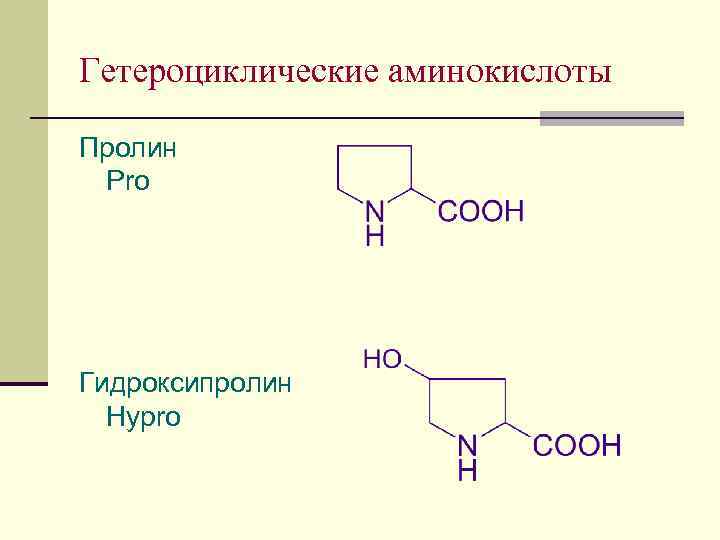
Гетероциклические аминокислоты Пролин Pro Гидроксипролин Hypro
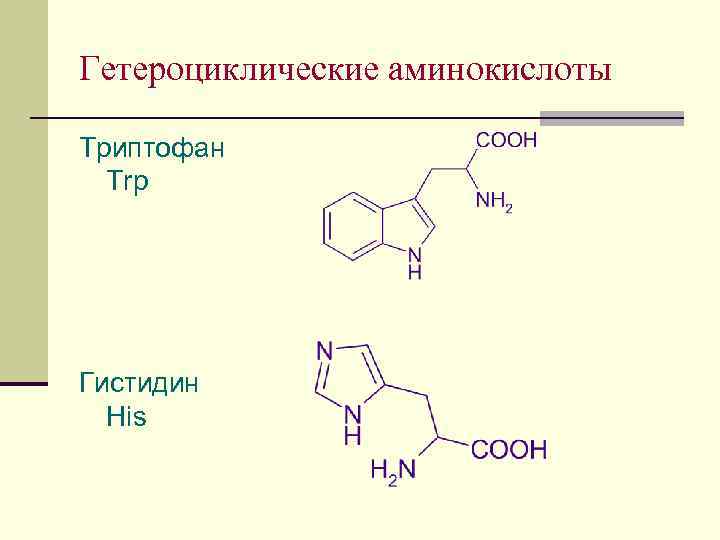
Гетероциклические аминокислоты Триптофан Trp Гистидин His

Аминокислоты n Аминокислоты делятся на заменимые (синтезируемые в организме) и незаменимые (аминокислоты, которые должны поступать с пищей). n Незаменимые АК: валин, лейцин, изолейцин, лизин, треонин, метионин, фенилаланин, триптофан
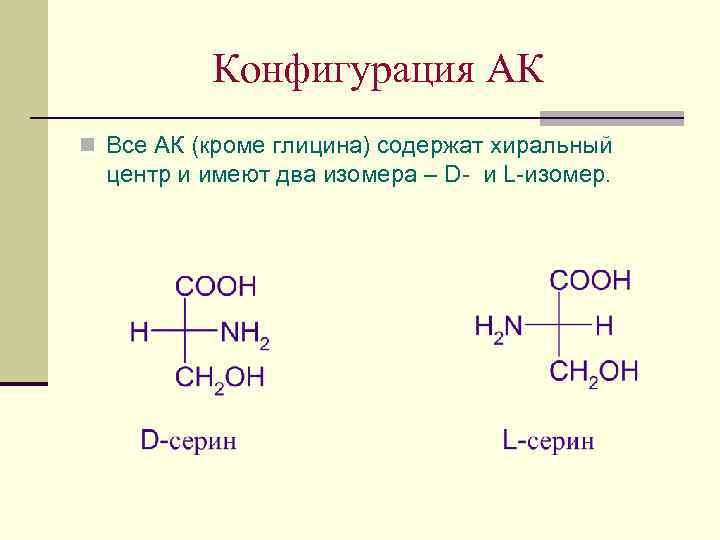
Конфигурация АК n Все АК (кроме глицина) содержат хиральный центр и имеют два изомера – D- и L-изомер.
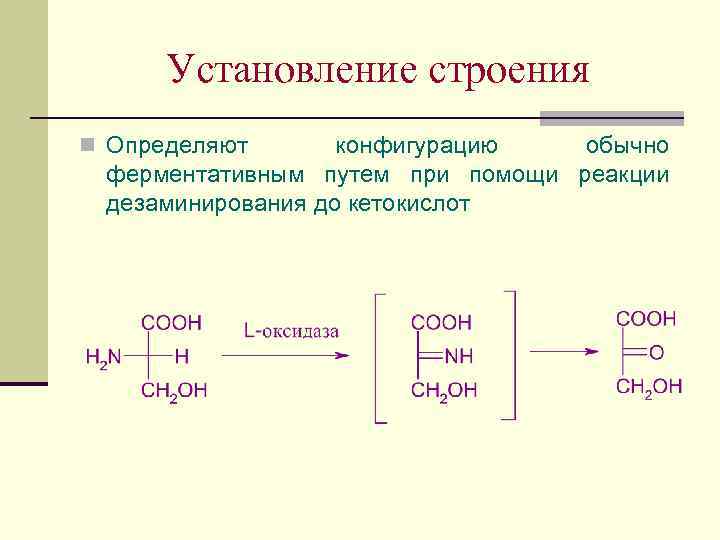
Установление строения n Определяют конфигурацию обычно ферментативным путем при помощи реакции дезаминирования до кетокислот
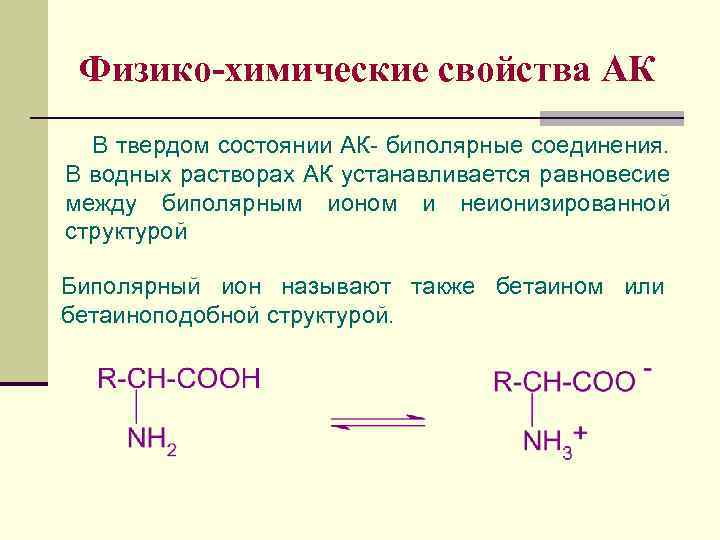
Физико-химические свойства АК В твердом состоянии АК- биполярные соединения. В водных растворах АК устанавливается равновесие между биполярным ионом и неионизированной структурой Биполярный ион называют также бетаином или бетаиноподобной структурой.

Физико-химические свойства АК n В кислой среде АК ведут себя как основание и заряжаются положительно, в щелочной – как кислота и заряжаются отрицательно. Наименьшая электропроводность раствора достигается при наибольшей концентрации бетаина. Значение p. H растворов АК, при которых кислота электронейтральна, называется изоэлектрической точкой.

Физико-химические свойства АК n Изоэлектрическая точка не совпадает с нейтральностью раствора. Например, моноаминомонокарбоновые кислоты электронейтральны в слабокислой среде. n На этом основан метод разделения АК - метод электрофореза.

Химические свойства АК Реакции карбоксильных групп n 1. Образование солей при p. H > p. Hi. n 2. Образование сложных эфиров. n Синтезируются при пропускании тока HCl через спиртовой раствор АК. Обычно при этом выделяется гидрохлориды сложных эфиров.

Химические свойства АК Реакции карбоксильных групп Сложные эфиры АК очень реакционноспособны, используются для получения различных производных: амидов, азидов и гидроксамовых кислот.
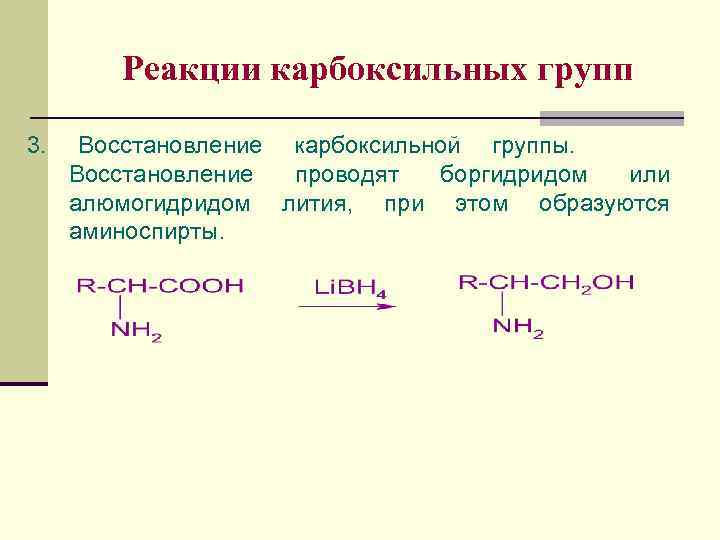
Реакции карбоксильных групп 3. Восстановление карбоксильной группы. Восстановление проводят боргидридом или алюмогидридом лития, при этом образуются аминоспирты.
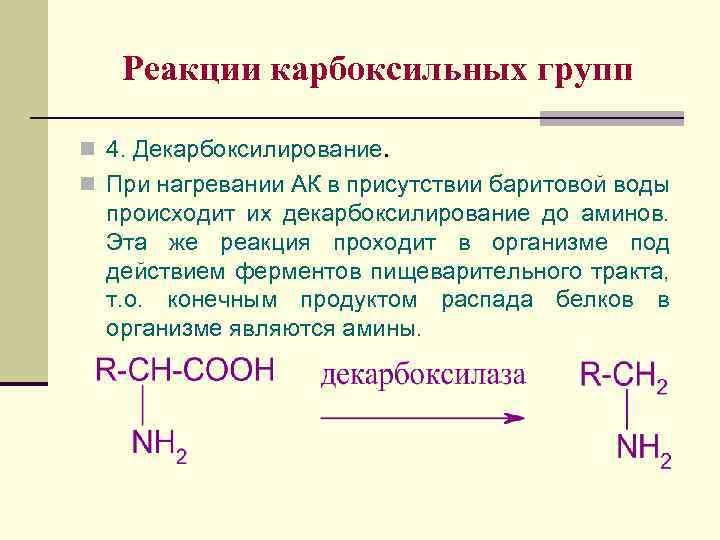
Реакции карбоксильных групп n 4. Декарбоксилирование. n При нагревании АК в присутствии баритовой воды происходит их декарбоксилирование до аминов. Эта же реакция проходит в организме под действием ферментов пищеварительного тракта, т. о. конечным продуктом распада белков в организме являются амины.
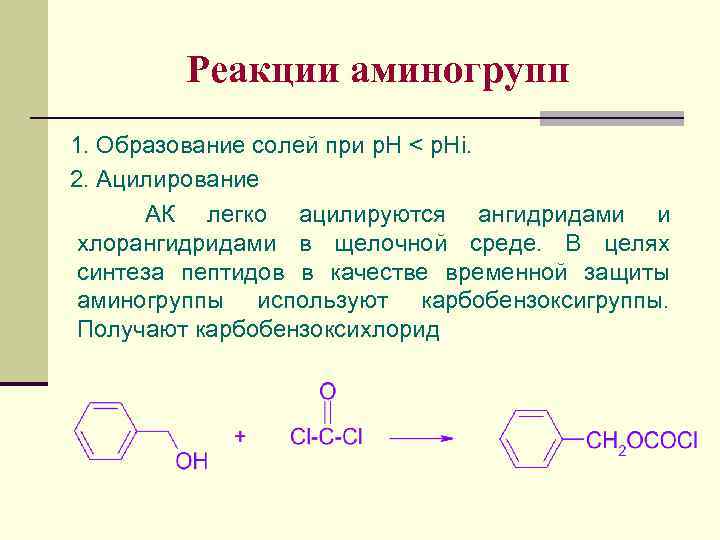
Реакции аминогрупп 1. Образование солей при p. H < p. Hi. 2. Ацилирование АК легко ацилируются ангидридами и хлорангидридами в щелочной среде. В целях синтеза пептидов в качестве временной защиты аминогруппы используют карбобензоксигруппы. Получают карбобензоксихлорид
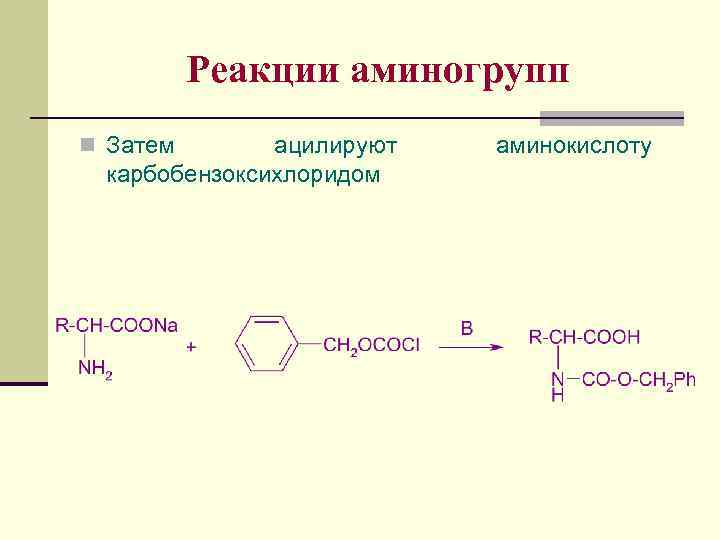
Реакции аминогрупп n Затем ацилируют карбобензоксихлоридом аминокислоту

Реакции аминогрупп 3. Алкилирование. Алкилируются галоидными алкилами.

Реакции аминогрупп Исчерпывающее метилирование приводит к бетаину, содержащемся в соке свеклы (beta vulgaris).

Реакции аминогрупп 4. Трансаминирование. При кипячении водных растворов АК с α-кетокислотами образуются новая α-кетокислота и новая АК. В организме эта реакция происходит под действием ферментов - трансаминаз. Это основной процесс новообразования АК в природе.

Реакции с одновременным участием амино- и карбоксигрупп 1. Образование комплексов с ионами металлов. Почти все АК образуют комплексы хелатного типа с ионами двухвалентных металлов.

Реакции с одновременным участием амино- и карбоксигрупп 2. Реакция с нингидрином. Эта реакция имеет значения для идентификации АК методом бумажной хроматографии. Аминокислоты образуют с нингидрином краситель – фиолетовый Руэмана.

Реакции с одновременным участием амино- и карбоксигрупп 2. Реакция с нингидрином

Реакции с одновременным участием амино- и карбоксигрупп 2. Реакция с нингидрином

Реакции с одновременным участием амино- и карбоксигрупп 3. Образование дикетопиперазинов. При нагревании АК в высококипящих растворителях происходит образование дикетопиперазинов, гидролиз которых приводит сначала к дипептиду, а затем к исходным АК.
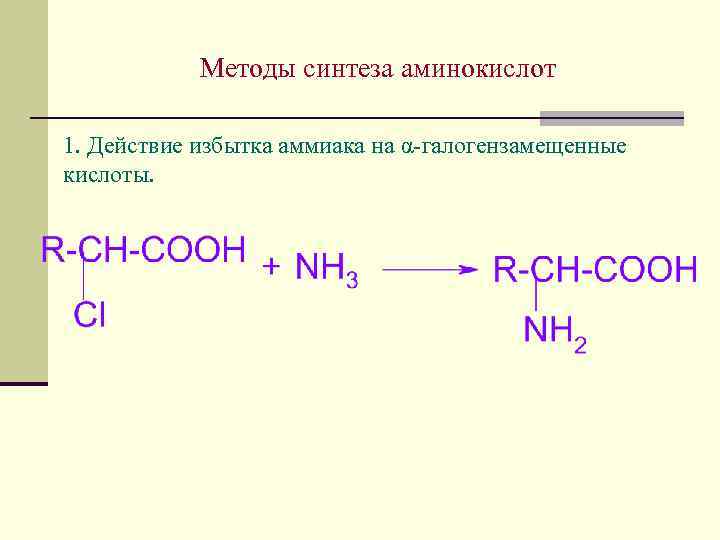
Методы синтеза аминокислот 1. Действие избытка аммиака на α-галогензамещенные кислоты.
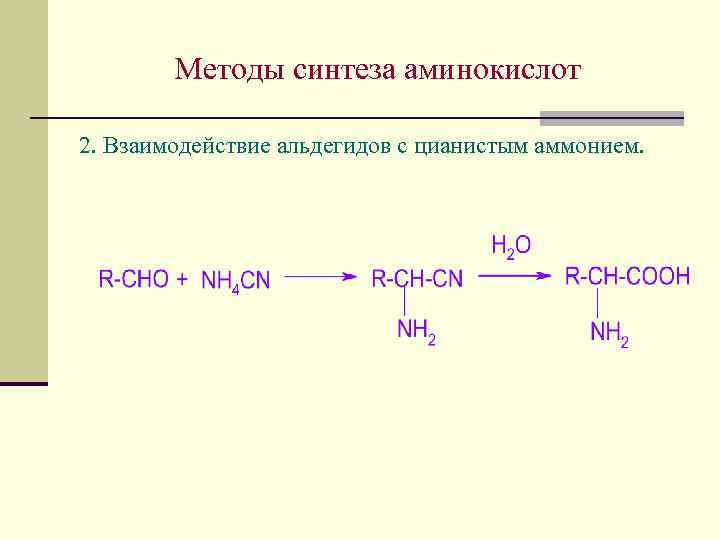
Методы синтеза аминокислот 2. Взаимодействие альдегидов с цианистым аммонием.
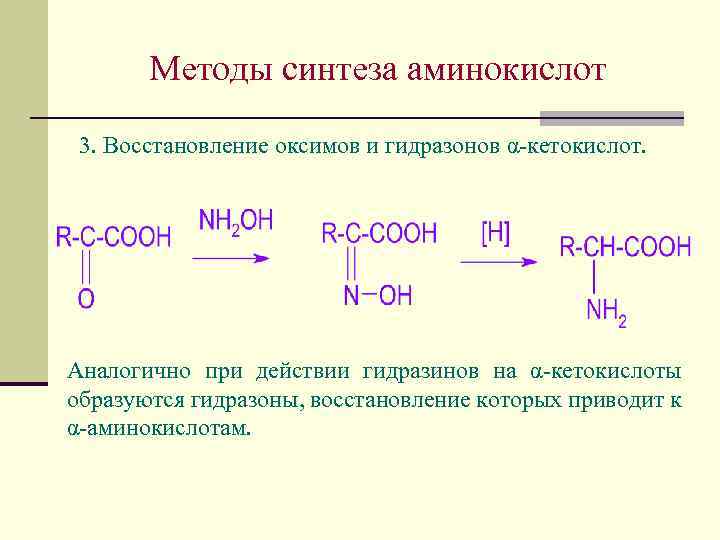
Методы синтеза аминокислот 3. Восстановление оксимов и гидразонов α-кетокислот. Аналогично при действии гидразинов на α-кетокислоты образуются гидразоны, восстановление которых приводит к α-аминокислотам.
Методы синтеза аминокислот 4. Способ Феофилактова

Методы синтеза аминокислот 5. Реакция с диазосоединениями

Методы синтеза аминокислот 6. Синтез через гидразиды кислот

Методы синтеза аминокислот 7. Нитрозирование малоновой кислоты
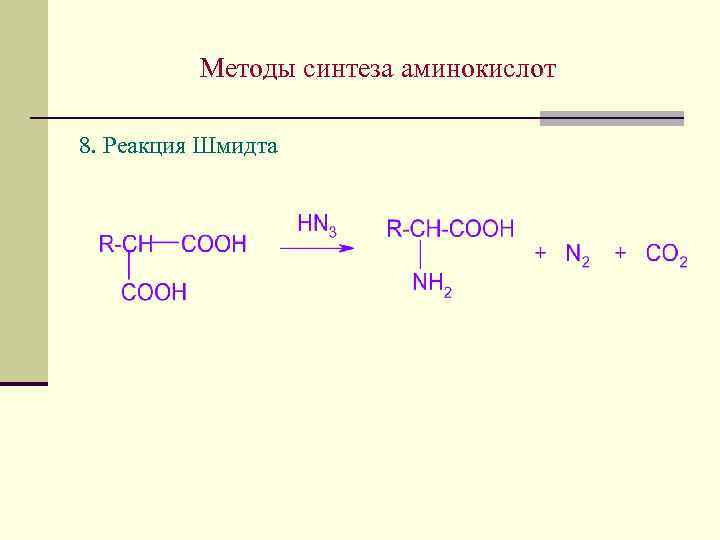
Методы синтеза аминокислот 8. Реакция Шмидта

Методы синтеза аминокислот 9. Азлактонный синтез или реакция Эрленмейера-Плехля

Методы синтеза аминокислот 10. Синтез Терентьева.

Методы синтеза аминокислот 11. Конденсация альдегидов с нитроуксусным эфиром

Методы синтеза аминокислот 12. Алкилирование нитроацетата галоидными бензилами

Медико-биологическое значение α-аминокислот α-Аминокислоты занимают ключевое положение в азотистом обмене. Многие из них используются в медицине. Глицин используется для улучшения метаболических процессов в головном мозге, он улучшает память, сон, оказывает успокаивающее действие на нервную систему, оказывает положительное действие при мышечной дистрофии. Глутаминовая кислота применяется для лечения заболеваний центральной нервной системы, метионин и гистидин при лечении заболеваний печени, цистеин – глазных болезней и т. д.

Определение аминокислотного состава белка Для этих целей служит гидролиз – кислотный, щелочной или ферментативный. Любые пептиды и белки полностью гидролизуются при нагревании в запаянной ампуле (в вакууме или инертной атмосфере) с 20%-й соляной кислотой при температуре 110 о С в течение 24 ч. Кислотный гидролиз проходит полнее и при этом образуется меньше побочных продуктов. Недостатком этого метода является частичная деструкция некоторых АК с образованием новых.

Определение аминокислотного состава белка К ферментативному гидролизу прибегают, когда нужно провести гидролиз в мягких условиях, для неполного или ступенчатого расщепления белка. Щелочной гидролиз используют сравнительно редко, т. к. он зачастую проходит неполно и с образованием значительного количества побочных продуктов.

Определение аминокислотного состава белка Аминокислотный состав устанавливается путем анализа пептидных и белковых гидролизатов в основном хроматографическими методами. Чаще всего используют распределительную хроматографию на бумаге, при этом проявляют АК нингидрином, или ионообменную хроматографию на ионообменных смолах. Разделение аминокислот производят также методом электрофореза, основанном на свойствах АК при различных значениях р. Н раствора двигаться к катоду или к аноду в зависимости от их изоэлектрической точки.

Пептиды Условно считают, что пептиды содержат в молекуле до 100, а белки – свыше 100 аминокислотных остатков. В свою очередь принято различать олигопептиды (до 10 аминокислотных звеньев) и полипептиды, содержащие до 100 остатков АК. Пептидную или белковую молекулу формально можно представить как продукт поликонденсации АК.

Пептиды N-конец полипептида С-конец

Пептиды и белки принято записывать с N-конца. Первичная структура пептидов и белков – это аминокислотная последовательность, порядок чередования АК-х остатков. Первичная структура определяется путем последовательного отщепления АК с какого-либо конца цепи и их идентификации.

Химические способы отщепления АК с N-конца 1. Метод динитрофенилирования. При арилировании пептида динитрофторбензолом образуются меченый пептид, гидролиз которого приводит к образованию динитрофенилпроизводного концевой аминокислоты, определяемое хроматографически или методом ГЖХ.

Химические способы отщепления АК с N-конца 2. Метод Эдмана. Пептид ацилируют фенилизотиоцианатом, внутримолекулярная циклизация образовавшегося продукта приводит к отщеплению фенилтиогидантоинового производного концевой АК. Метод Эдмана позволяет последовательно отщеплять АК с N-конца, не разрушая структуру пептида.

Химические способы отщепления АК с Nконца

Химические способы отщепления АК с N-конца 3. Дансильный метод. Заключается в действии дансилхлорида на пептид.

Химические способы отщепления АК с Nконца Дансильный метод отличается высокой чувствительностью, т. к. дансилпроизводное аминокислот обладает высокой флуоресценцией, позволяющей определять их даже в ничтожной концентрации.

Пептидные гормоны Наиболее важными пептидными гормонами являются окситацин, вазопрессин и инсулин. Строение первых двух установил Дю Виньо в 1953 г. Окситацин вызывает сокращение гладкой мускулатуры, применяется в гинекологии и акушерской практике. Вазопрессин регулирует минеральный обмен, баланс жидкости в организме. Оба содержат по 9 остатков АК и одну дисульфидную связь
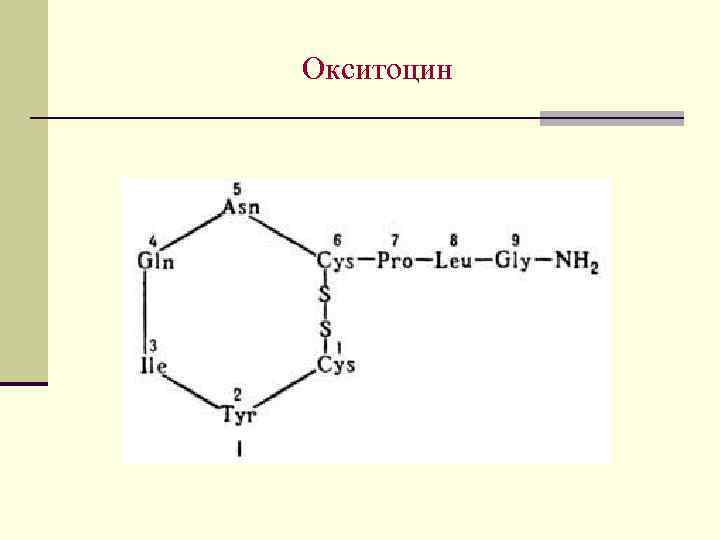
Окситоцин
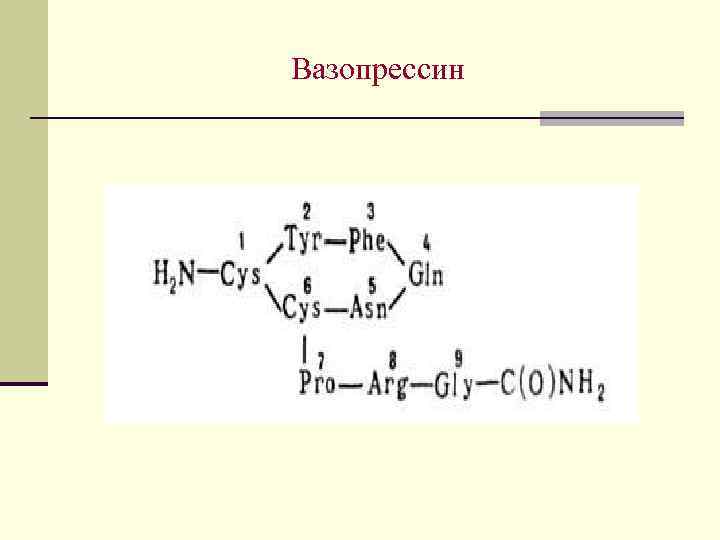
Вазопрессин

Инсулин Строение инсулина было установлено Ф. Сенгером в 1953 г. Состоит инсулин из двух пептидных цепей, одна содержит 21 остаток АК, вторая – 30, связаны эти цепи двумя дисульфильдными мостиками. Гормон инсулин вырабатывается поджелудочной железой, регулирует содержание глюкозы в крови.

Нейропептиды К нейропептидам относят группу пептидов головного мозга, которые влияют на процессы обучения и запоминания, регулируют сон, имеют обезболивающее действие. С содержанием тех или иных пептидов в мозге связывают возникновение нервно-психических заболеваний, например шизофрении. Наиболее простые по строению нейропептиды были выделены из мозга животных в 1974 г и получили название энкефалины. Это пентапептиды, имеющие следующее строение: Tyr-Gly-Phe-Met – метионин-энкефалин Tyr-Gly-Phe-Leu - лейцин- энкефалин.

Эндорфины n К нейропептидам относятся и эндорфины По мнению некоторых ученых, эндорфины ответственны за развитие влюбленности, т. е. они «молекулы долговременных любовных отношений» . Известно, что действуют эндорфины на опиатные рецепторы, т. е. обладают морфиноподобным эффектом. Эндорфины также вызывают анальгезию (утоляют боль), влияют на память и способность обучаться, вызывают эйфорию (поэтому их называют «гормонами радости» или «природными наркотиками» ). Среди эндорфинов наиболее активен b-эндорфин, состоящий из 31 аминокислотного остатка: n n NH 2–Tyr–Gly–Phe–Met–Thr–Ser–Glu–Lys–Ser–Gln–Thr–Pro– Leu–Val–Thr–Leu–Phe–Lys–Asn–Ala–Ile–Lys–Asn–Ala–His–Lys–Gly–Gln–COOH n b-Эндорфин

Принципы пептидного синтеза n Осуществить синтез пептидов и белков из АК по формальной схеме, представленной выше, невозможно вследствие малого эффективного положительного заряда на атоме углерода карбонильной группы. Для успешного осуществления синтеза пептидов необходимо повысить положительный заряд на этом атоме путем введения в структуру АК активирующей группы. В качестве активирующих групп используют Х= Наl, N 3, -O-CO-R, -O-CO-O-R. Кроме того, необходимо защитить аминогруппу, не участвующую в реакции, в первой АК и карбоксильную группу во второй.

Принципы пептидного синтеза n В качестве защитной группы для аминофрагмента используют обычно карбобензоксигруппу, снятие которой происходит в мягких условиях, не разрушающих пептидную связь. Карбоксильную группу второй АК защищают этерификацией или образованием солей.

Принципы пептидного синтеза Началом систематического синтеза пептидов считается 1903 г, когда Э. Фишер провел реакцию между хлорангидридами хлорзамещенных кислот и натриевыми солями аминокислот.

Принципы пептидного синтеза На последней стадии хлор был замещен на аминогруппу действием избытка аммиака, т. о. Фишером был получен пептид из 18 остатков АК, который по некоторым свойствам (например, способностью высаливаться) напоминал белок.

Принципы пептидного синтеза Азидный метод Курциуса. В качестве защиты аминогруппы Курциус использовал карбобензоксигруппу, которая на последней стадии снималась каталитическим гидрированием или гидрогенолизом. Для активации карбоксильной группы использовалась азидная группа, для синтеза которой на первую АК действовали гидразин-гидратом, полученный гидразид переводили в азид реакцией с азотистой кислотой.

Принципы пептидного синтеза. Азидный метод Курциуса

Принципы пептидного синтеза n В 1955 г были разработаны методы, не требующие предварительной активации карбоксильной группы первой аминокислоты путем перевода ее в хлорангидридную или азидную. Активация происходила в процессе реакции при добавлении циклогексилкарбодиимида или этоксиацетилена. n Реакции проходят легко, в процессе синтеза из оптически активных АК не происходит рацемизации пептидов.

Принципы пептидного синтеза

Синтез пептидов

Синтез пептидов В современных методах синтеза пептидов для защиты аминогруппы используют карбобензоксигруппу, которая легко снимается каталитическим гидрированием или гидрогенолизом. Карбоксильную группу активируют путем перевода ее в смешанный ангидрид взаимодействием с этоксикарбохлоридом.

Принципиальная схема синтеза пептидов и белков

Принципиальная схема синтеза пептидов и белков

Принципиальная схема синтеза пептидов и белков n Далее снимают защиту у карбоксильной группы пептида и этот процесс повторяют необходимое число раз, на последней стадии снимают защиты аминогруппы первой аминокислоты и карбоксильной группы последней. Первым примером синтеза биологически активных пептидов послужило воссоздание полной структуры двух гормонов – окситоцина и вазопрессина (1953 -1955).

Твердофазный метод Меррифилда n В начале 60 -х годов для синтеза белков был разработан твердофазный метод американским ученым Р. Меррифилдом. В этом методе 1 -я АК закрепляется на полимерном носителе, и к ней последовательно подшиваются новые АК. По окончании синтеза готовая полипептидная цепь отрывается от носителя.

Твердофазный метод Меррифилда

Твердофазный метод Меррифилда

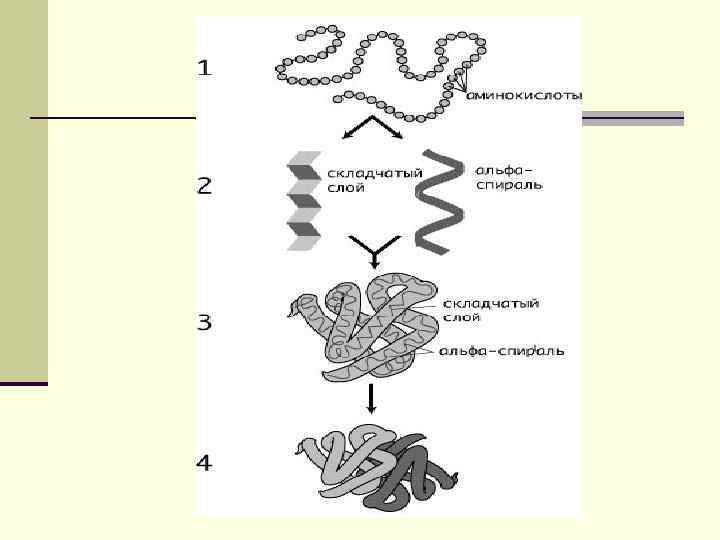
Строение белка Различают первичную, вторичную и третичную структуры белка. Некоторые белки имеют и четвертичную структуру. Под первичной структурой белка понимается конкретная последовательность аминокислотных остатков в полипептидной цепи. Вторичная структура - это конформация полипептидной цепи, т. е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO. Существуют три основных способа укладки полипептидной цепи в пространстве – α-спираль, β-структура и β-изгиб.
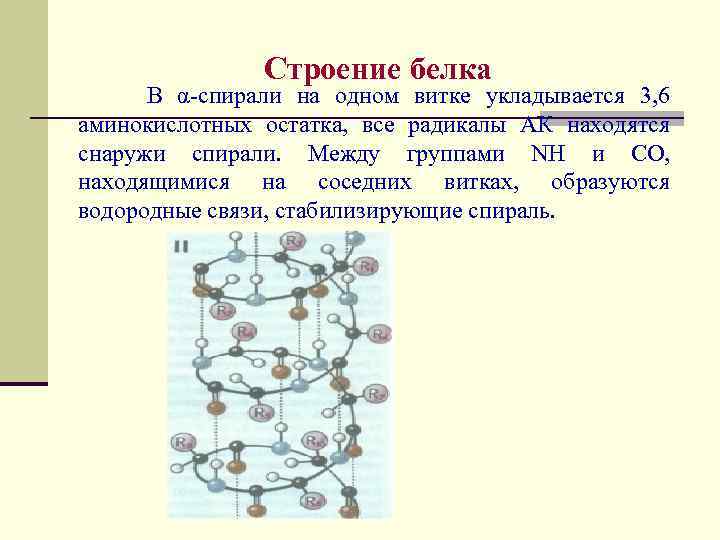
Строение белка В α-спирали на одном витке укладывается 3, 6 аминокислотных остатка, все радикалы АК находятся снаружи спирали. Между группами NH и CO, находящимися на соседних витках, образуются водородные связи, стабилизирующие спираль.
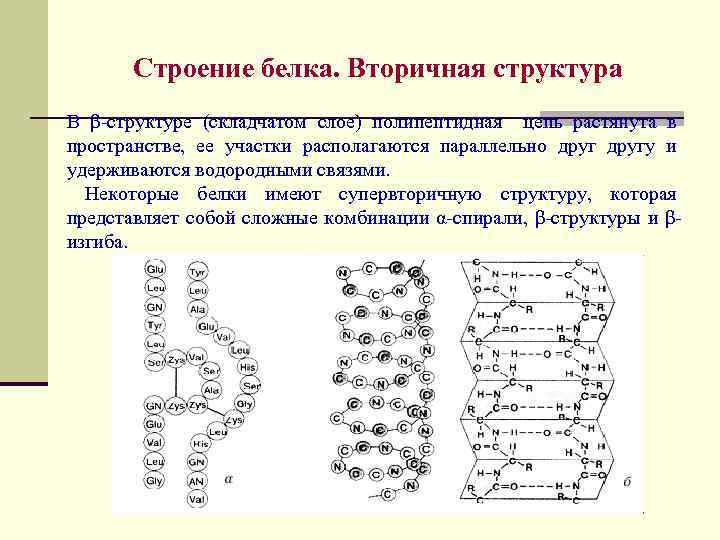
Строение белка. Вторичная структура В β-структуре (складчатом слое) полипептидная цепь растянута в пространстве, ее участки располагаются параллельно другу и удерживаются водородными связями. Некоторые белки имеют супервторичную структуру, которая представляет собой сложные комбинации α-спирали, β-структуры и βизгиба.

Строение белка Тройная суперспираль коллагена

Третичная структура белка – это трехмерная конфигурация закрученной α-спирали и β-структуры в пространстве, образующаяся за счет дисульфидных мостиков между цистеиновыми остатками, находящимися в разных местах полипептидной цепи. В образовании третичной стуктуры участвуют также ионные взаимодействия групп NH 3+ и СОО - и гидрофобные взаимодействия, т. е. стремление молекулы свернуться так, чтобы гидрофобные углеводородные остатки оказались внутри структуры, а полярные группы снаружи.

Третичная структура белка
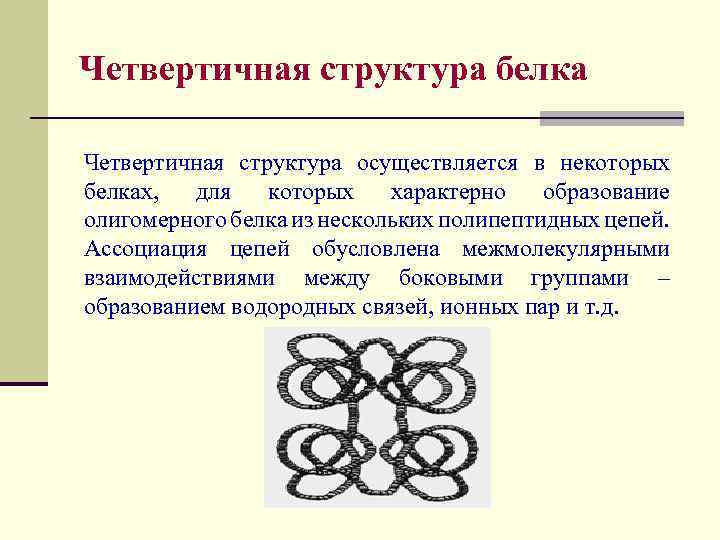
Четвертичная структура белка Четвертичная структура осуществляется в некоторых белках, для которых характерно образование олигомерного белка из нескольких полипептидных цепей. Ассоциация цепей обусловлена межмолекулярными взаимодействиями между боковыми группами – образованием водородных связей, ионных пар и т. д.

Строение белка Спирали могут свиваться в клубок, образуя глобулы или располагаться рядом, образуя нитевидные структуры – фибриллы. Поэтому различают белки глобулярные и фибриллярные. Примеры глобулярных белков – альбумин (яичный белок), глобин (белковая часть гемоглобина, почти все ферменты. К фибриллярным белкам относятся кератин (волосы, роговая ткань), миоинозин (мускульная ткань), коллаген (соединительная ткань).

Сложные белки В организме наибольшее значение имеют сложные белки, в которых белковая молекула связана с небелковой (простетической группой). Некоторые белки в качестве простетической группы содержат углеводы (гликопротеиды), жиры (липопротеиды), НК (нуклеопротеиды), гетероциклы (хромопротеиды).

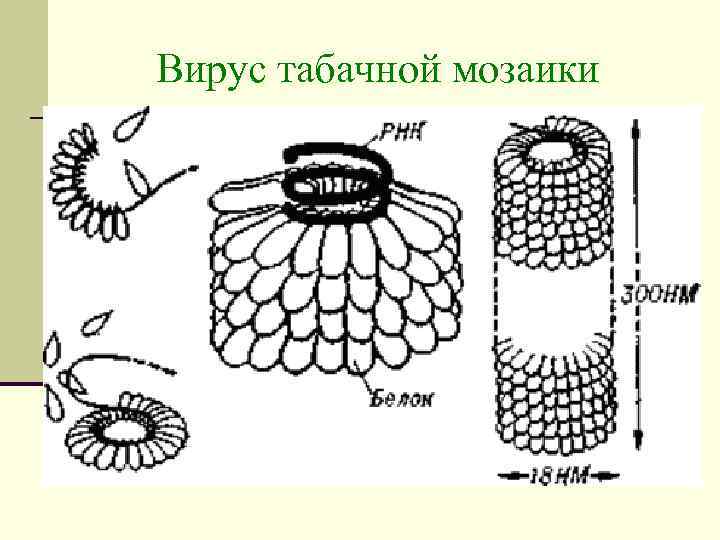
Нуклеопротеиды К нуклеопротеидам относятся вирусы. Типичным нуклеопротеидом является вирус табачной мозаики, гигантская молекула которой (Мм = 40 000) состоит на 94% из белка и на 6% из РНК и представляет собой полый цилиндр, внутри которого молекулы РНК. n Вирус табачной мозаики – первый открытый вирус (Д. И. Ивановский, 1892). n
Вирус табачной мозаики
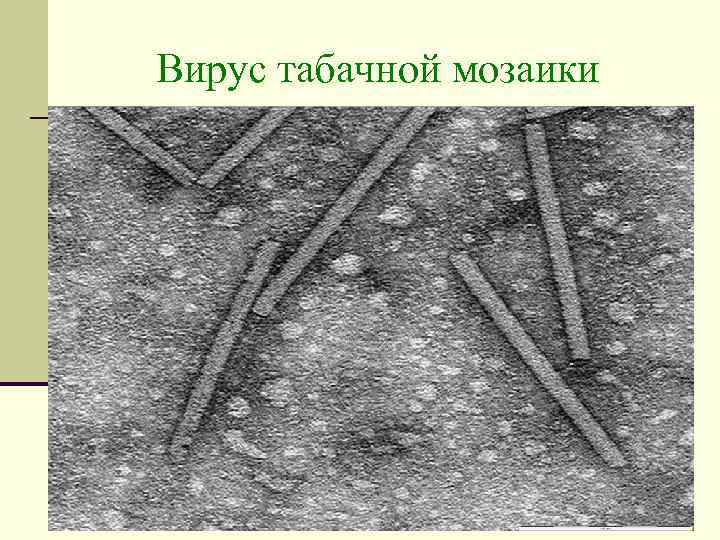
Вирус табачной мозаики

Вирус табачной мозаики
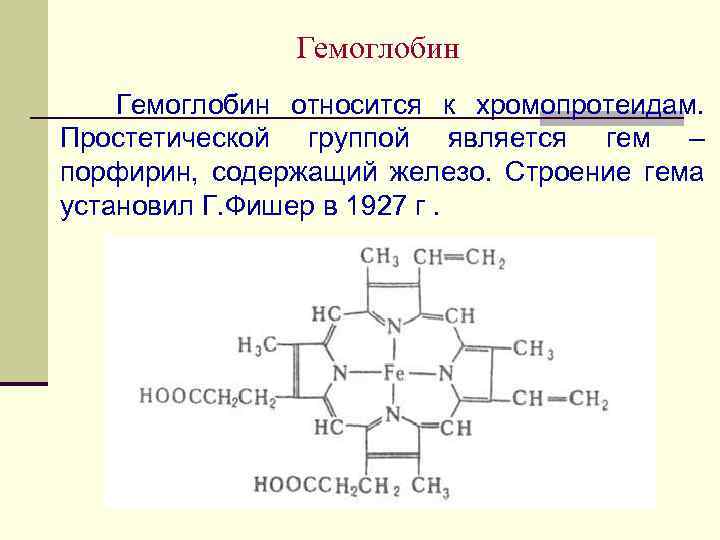
Гемоглобин Гемоглобин относится к хромопротеидам. Простетической группой является гем – порфирин, содержащий железо. Строение гема установил Г. Фишер в 1927 г.

Гемоглобин В гемоглобине гем соединен с белком (глобином) через остаток гистидина. Двухвалентный ион железа имеет координационное число, равное шести. Четыре координационных связи идут на соединение с пиррольными циклами, одна связывает железо с имидазольным циклом в остатке гистидина, шестая - на связь с молекулой кислорода.

Гемоглобин

Гемоглобин

Гемоглобин n Гем расположен в углублении, так называемом гемовом кармане. Во внутреннюю, гидрофобную часть кармана, гем погружен неполярными винильными радикалами, а гидрофильные пропионатные боковые радикалы направлены к поверхности и находятся рядом с аминогруппами лизинового и аргининовых остатков белка. Пиррольные кольца гема и неполярные радикалы аминокислотных остатков, выстилающих карман, связаны силами гидрофобного взаимодействия.
Аминокислоты, пептиды, белки.ppt