aminoacids и белки.ppt
- Количество слайдов: 35
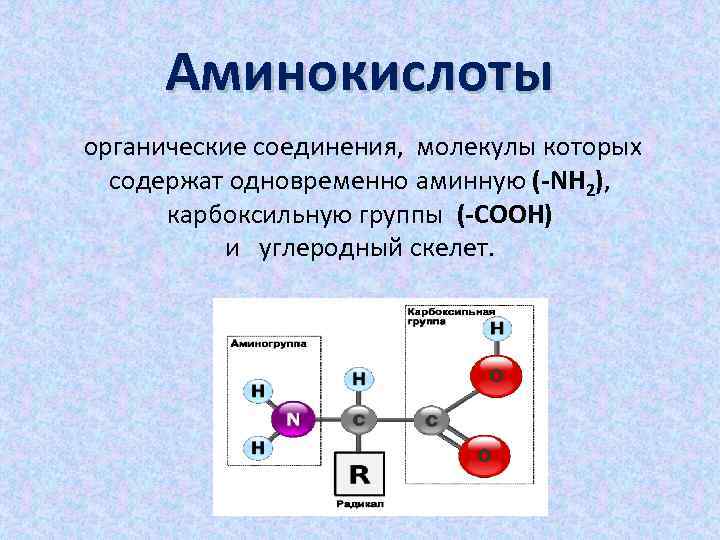 Аминокислоты органические соединения, молекулы которых содержат одновременно аминную (-NH 2), карбоксильную группы (-СООН) и углеродный скелет.
Аминокислоты органические соединения, молекулы которых содержат одновременно аминную (-NH 2), карбоксильную группы (-СООН) и углеродный скелет.
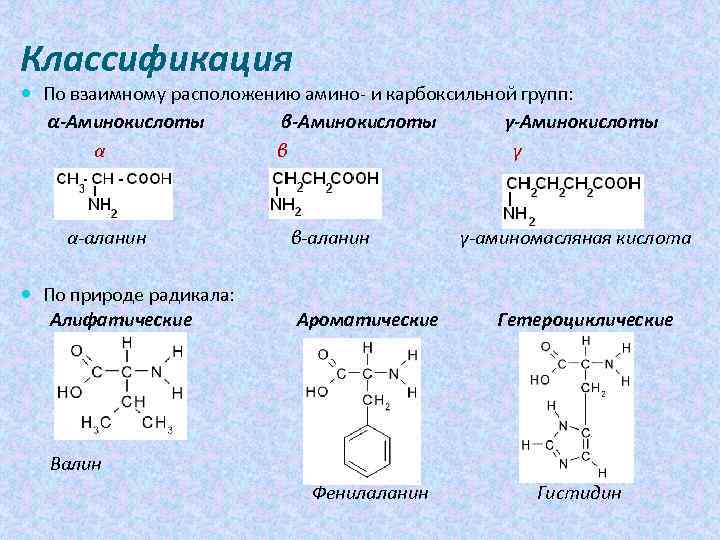 Классификация По взаимному расположению амино- и карбоксильной групп: α-Аминокислоты β-Аминокислоты γ-Аминокислоты α β γ α-аланин По природе радикала: Алифатические β-аланин Ароматические γ-аминомасляная кислота Гетероциклические Валин Фенилаланин Гистидин
Классификация По взаимному расположению амино- и карбоксильной групп: α-Аминокислоты β-Аминокислоты γ-Аминокислоты α β γ α-аланин По природе радикала: Алифатические β-аланин Ароматические γ-аминомасляная кислота Гетероциклические Валин Фенилаланин Гистидин
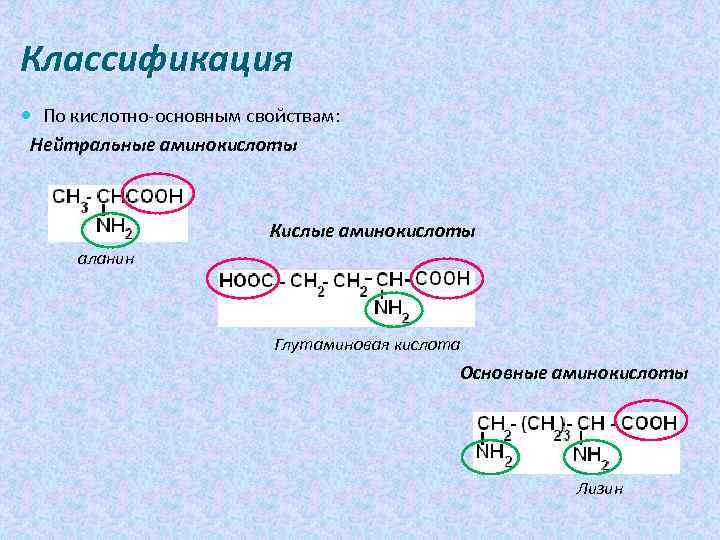 Классификация По кислотно-основным свойствам: Нейтральные аминокислоты Кислые аминокислоты аланин Глутаминовая кислота Основные аминокислоты Лизин
Классификация По кислотно-основным свойствам: Нейтральные аминокислоты Кислые аминокислоты аланин Глутаминовая кислота Основные аминокислоты Лизин
 Номенклатура аминокислот Международная : к названию кислоты прибавляют приставку «амино» и указывают арабской цифрой расположение аминогруппы относительно карбоксильной. Нумерацию начинают с атома углерода карбоксильной группы 4 -метил-4 -аминопентановая кислота Рациональная: к тривиальному названию карбоновой кислоты добавляют приставку «амино» с указанием положения аминогруппы буквой греческого алфавита. Тривиальная: для a-аминокислот применяют тривиальные названия.
Номенклатура аминокислот Международная : к названию кислоты прибавляют приставку «амино» и указывают арабской цифрой расположение аминогруппы относительно карбоксильной. Нумерацию начинают с атома углерода карбоксильной группы 4 -метил-4 -аминопентановая кислота Рациональная: к тривиальному названию карбоновой кислоты добавляют приставку «амино» с указанием положения аминогруппы буквой греческого алфавита. Тривиальная: для a-аминокислот применяют тривиальные названия.
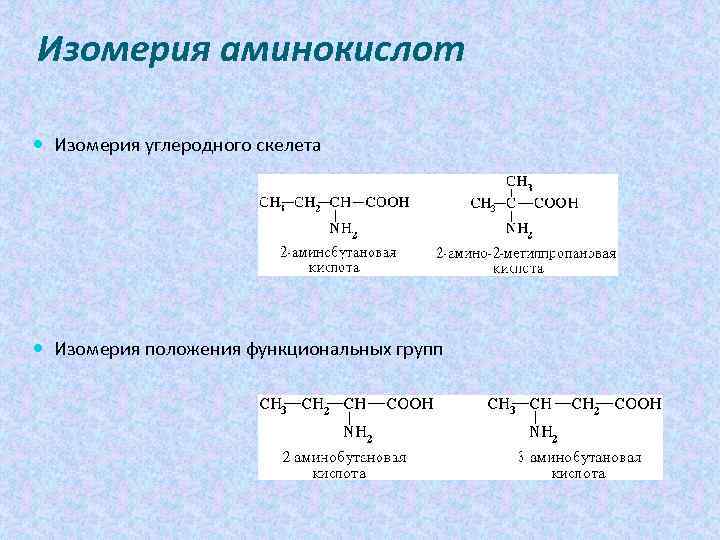 Изомерия аминокислот Изомерия углеродного скелета Изомерия положения функциональных групп
Изомерия аминокислот Изомерия углеродного скелета Изомерия положения функциональных групп
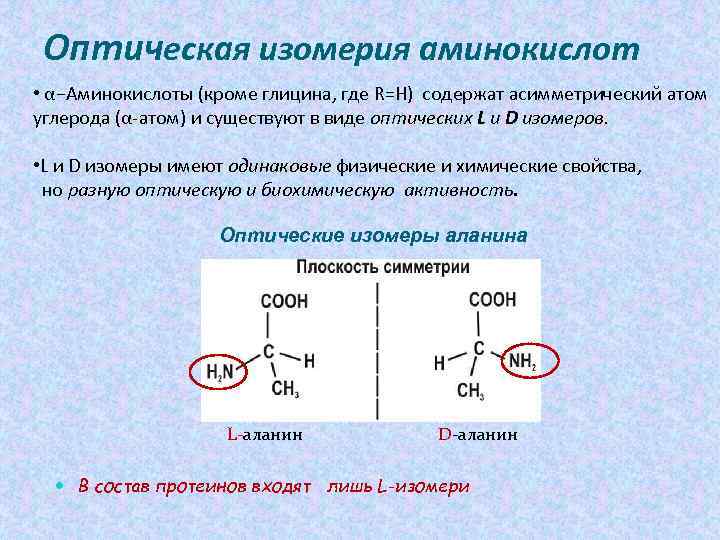 Оптическая изомерия аминокислот • α−Аминокислоты (кроме глицина, где R=Н) содержат асимметрический атом углерода (α-атом) и существуют в виде оптических L и D изомеров. • L и D изомеры имеют одинаковые физические и химические свойства, но разную оптическую и биохимическую активность. Оптические изомеры аланина L-аланин D-аланин В состав протеинов входят лишь L-изомери
Оптическая изомерия аминокислот • α−Аминокислоты (кроме глицина, где R=Н) содержат асимметрический атом углерода (α-атом) и существуют в виде оптических L и D изомеров. • L и D изомеры имеют одинаковые физические и химические свойства, но разную оптическую и биохимическую активность. Оптические изомеры аланина L-аланин D-аланин В состав протеинов входят лишь L-изомери
 Физические свойства Аминокислоты : бесцветные кристаллические вещества; с высокой температурой плавления, плавятся с разложением; хорошо растворимы в воде; водные растворы электропроводны; водные растворы одноосновных аминокислот нейтральны.
Физические свойства Аминокислоты : бесцветные кристаллические вещества; с высокой температурой плавления, плавятся с разложением; хорошо растворимы в воде; водные растворы электропроводны; водные растворы одноосновных аминокислот нейтральны.
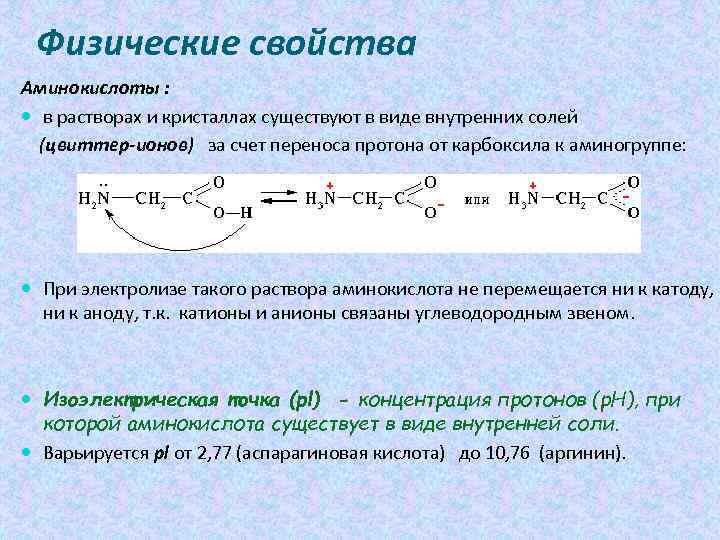 Физические свойства Аминокислоты : в растворах и кристаллах существуют в виде внутренних солей (цвиттер-ионов) за счет переноса протона от карбоксила к аминогруппе: При электролизе такого раствора аминокислота не перемещается ни к катоду, ни к аноду, т. к. катионы и анионы связаны углеводородным звеном. Изоэлектрическая точка (pl) - концентрация протонов (р. Н), при которой аминокислота существует в виде внутренней соли. Варьируется pl от 2, 77 (аспарагиновая кислота) до 10, 76 (аргинин).
Физические свойства Аминокислоты : в растворах и кристаллах существуют в виде внутренних солей (цвиттер-ионов) за счет переноса протона от карбоксила к аминогруппе: При электролизе такого раствора аминокислота не перемещается ни к катоду, ни к аноду, т. к. катионы и анионы связаны углеводородным звеном. Изоэлектрическая точка (pl) - концентрация протонов (р. Н), при которой аминокислота существует в виде внутренней соли. Варьируется pl от 2, 77 (аспарагиновая кислота) до 10, 76 (аргинин).
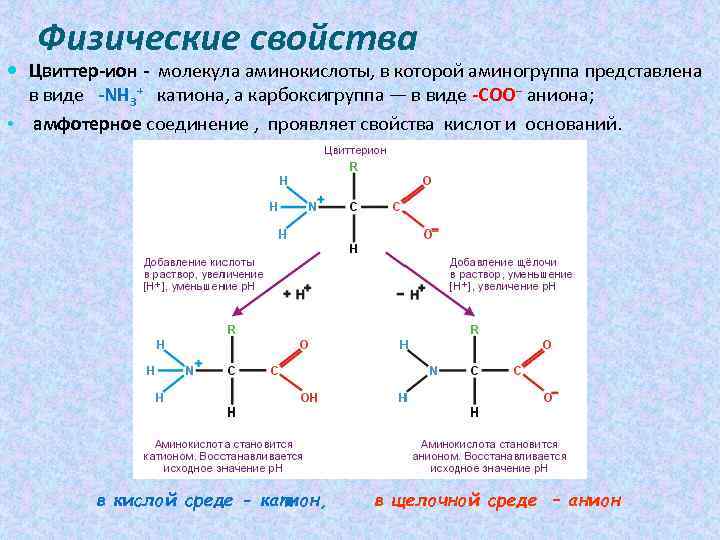 Физические свойства Цвиттер-ион - молекула аминокислоты, в которой аминогруппа представлена в виде -NH 3+ катиона, а карбоксигруппа — в виде -COO− аниона; • амфотерное соединение , проявляет свойства кислот и оснований. в кислой среде - катион, в щелочной среде – анион
Физические свойства Цвиттер-ион - молекула аминокислоты, в которой аминогруппа представлена в виде -NH 3+ катиона, а карбоксигруппа — в виде -COO− аниона; • амфотерное соединение , проявляет свойства кислот и оснований. в кислой среде - катион, в щелочной среде – анион
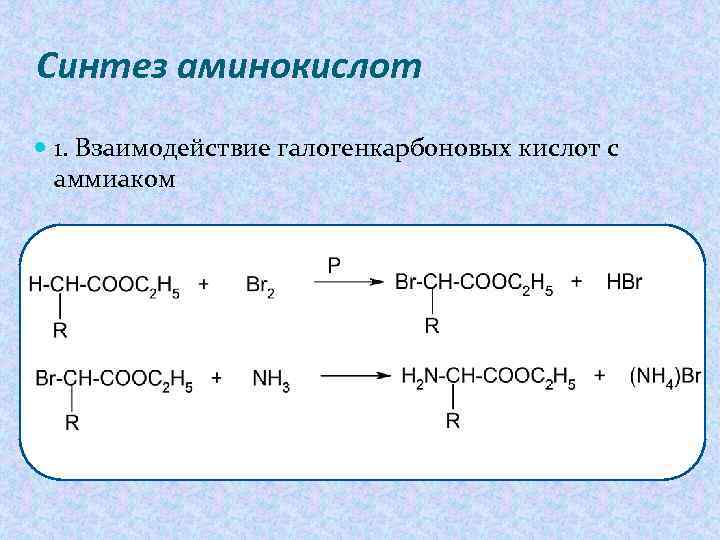 Синтез аминокислот 1. Взаимодействие галогенкарбоновых кислот с аммиаком
Синтез аминокислот 1. Взаимодействие галогенкарбоновых кислот с аммиаком
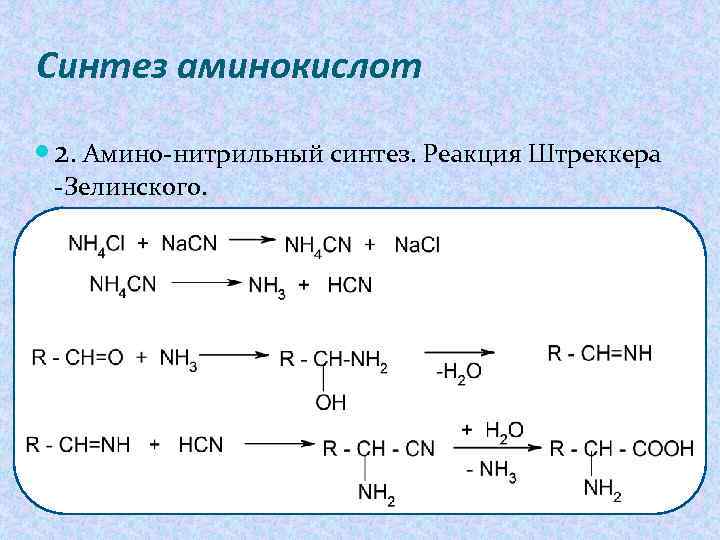 Синтез аминокислот 2. Амино-нитрильный синтез. Реакция Штреккера -Зелинского.
Синтез аминокислот 2. Амино-нитрильный синтез. Реакция Штреккера -Зелинского.
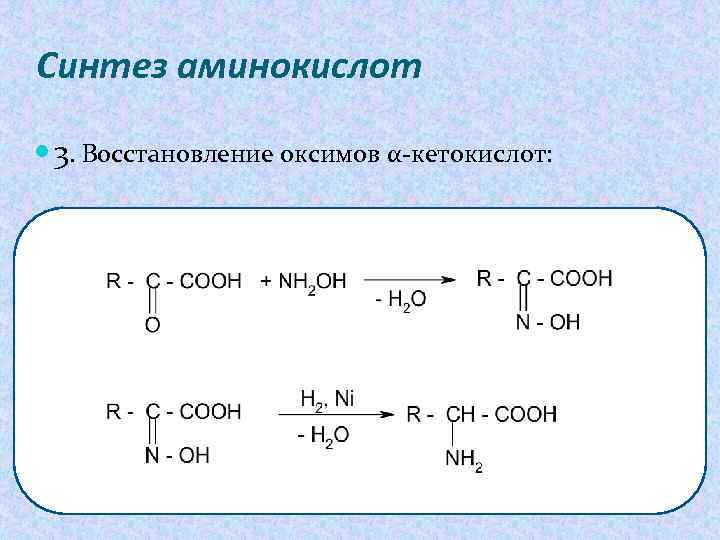 Синтез аминокислот 3. Восстановление оксимов α-кетокислот:
Синтез аминокислот 3. Восстановление оксимов α-кетокислот:
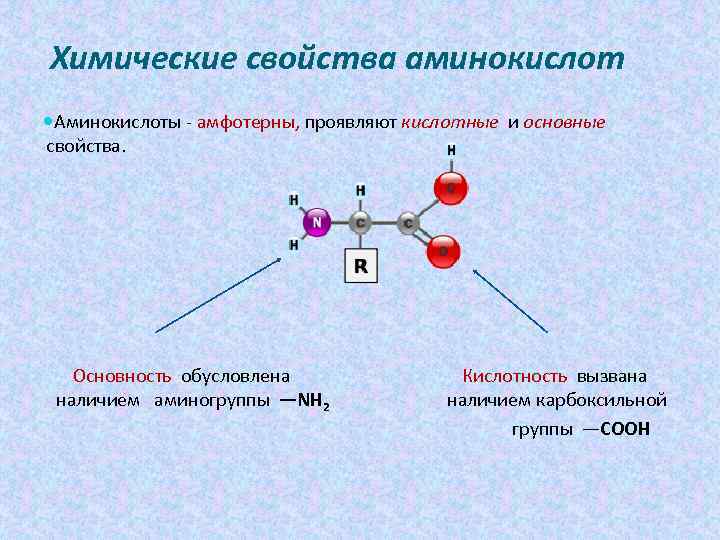 Химические свойства аминокислот Аминокислоты - амфотерны, проявляют кислотные и основные свойства. Основность обусловлена Кислотность вызвана наличием аминогруппы —NH 2 наличием карбоксильной группы —COOH
Химические свойства аминокислот Аминокислоты - амфотерны, проявляют кислотные и основные свойства. Основность обусловлена Кислотность вызвана наличием аминогруппы —NH 2 наличием карбоксильной группы —COOH
 Химические свойства аминокислот 1. Аминокислоты образуют соли как с кислотами (по группе NH 2), так и со щелочами (по группе СООН):
Химические свойства аминокислот 1. Аминокислоты образуют соли как с кислотами (по группе NH 2), так и со щелочами (по группе СООН):
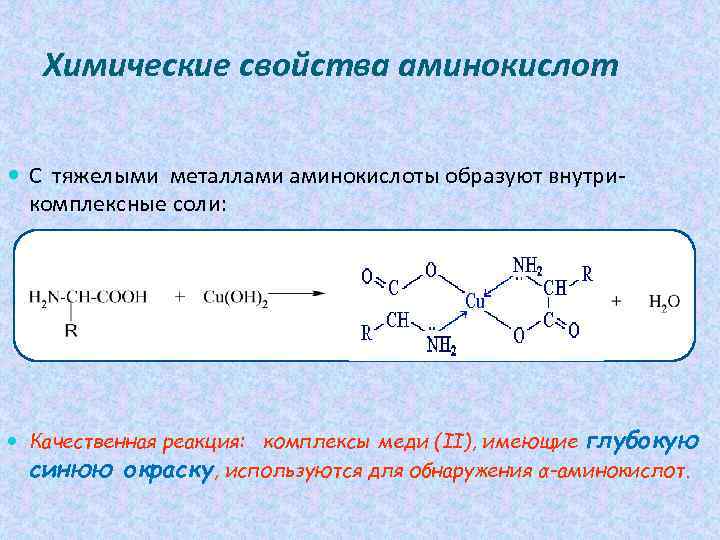 Химические свойства аминокислот С тяжелыми металлами аминокислоты образуют внутрикомплексные соли: Качественная реакция: комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Химические свойства аминокислот С тяжелыми металлами аминокислоты образуют внутрикомплексные соли: Качественная реакция: комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
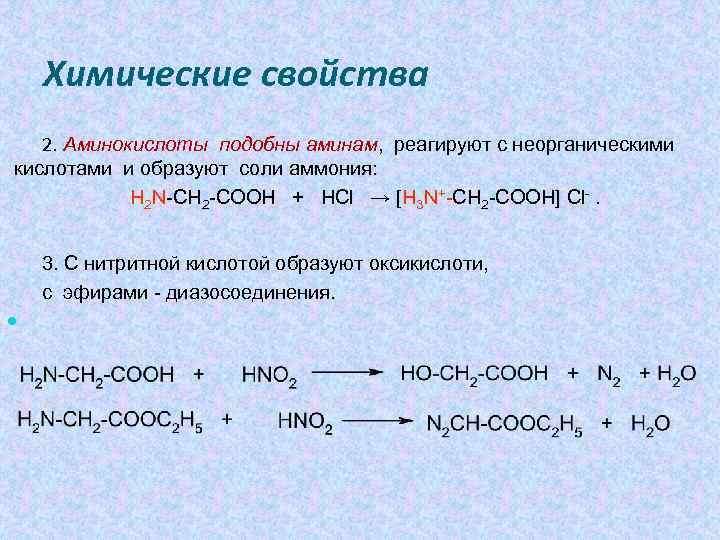 Химические свойства 2. Аминокислоты подобны аминам, реагируют с неорганическими кислотами и образуют соли аммония: H 2 N-CH 2 -COOH + HCl → [H 3 N+-CH 2 -COOH] Cl-. 3. С нитритной кислотой образуют оксикислоти, с эфирами - диазосоединения.
Химические свойства 2. Аминокислоты подобны аминам, реагируют с неорганическими кислотами и образуют соли аммония: H 2 N-CH 2 -COOH + HCl → [H 3 N+-CH 2 -COOH] Cl-. 3. С нитритной кислотой образуют оксикислоти, с эфирами - диазосоединения.
 Химические свойства 4. Аминокислоты реагируют как карбоновые кислоты , образуя функциональные производные: а) соли: H 2 N–CH 2–COOH + Na. OH → H 2 N–CH 2–COO– Na+ + H 2 O б) сложные эфиры:
Химические свойства 4. Аминокислоты реагируют как карбоновые кислоты , образуя функциональные производные: а) соли: H 2 N–CH 2–COOH + Na. OH → H 2 N–CH 2–COO– Na+ + H 2 O б) сложные эфиры:
 Химические свойства 5. α-Декарбоксилирование характерно для животных тканей, сопровождается отщеплением карбоксильной группы, стоящей по соседству с α-С- атомом. : Биогенные амины Продукт ферментного α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК). ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты образуется α-аланин:
Химические свойства 5. α-Декарбоксилирование характерно для животных тканей, сопровождается отщеплением карбоксильной группы, стоящей по соседству с α-С- атомом. : Биогенные амины Продукт ферментного α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК). ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты образуется α-аланин:
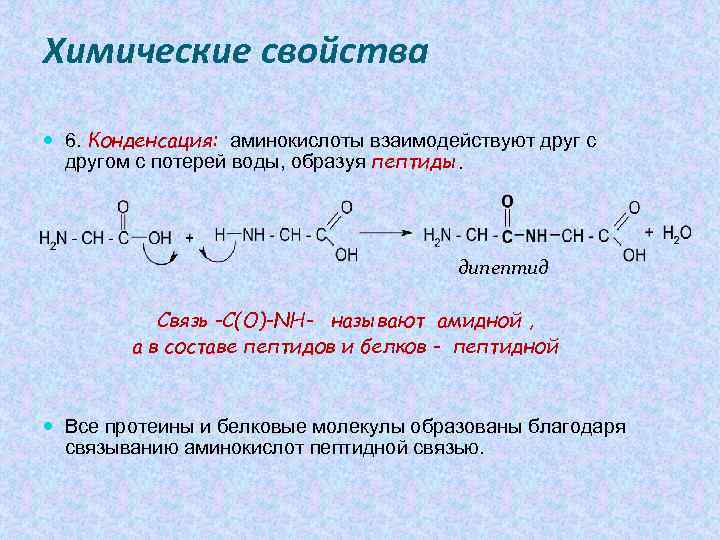 Химические свойства 6. Конденсация: аминокислоты взаимодействуют друг с другом с потерей воды, образуя пептиды. дипептид Связь -С(О)-NH- называют амидной , а в составе пептидов и белков - пептидной Все протеины и белковые молекулы образованы благодаря связыванию аминокислот пептидной связью.
Химические свойства 6. Конденсация: аминокислоты взаимодействуют друг с другом с потерей воды, образуя пептиды. дипептид Связь -С(О)-NH- называют амидной , а в составе пептидов и белков - пептидной Все протеины и белковые молекулы образованы благодаря связыванию аминокислот пептидной связью.
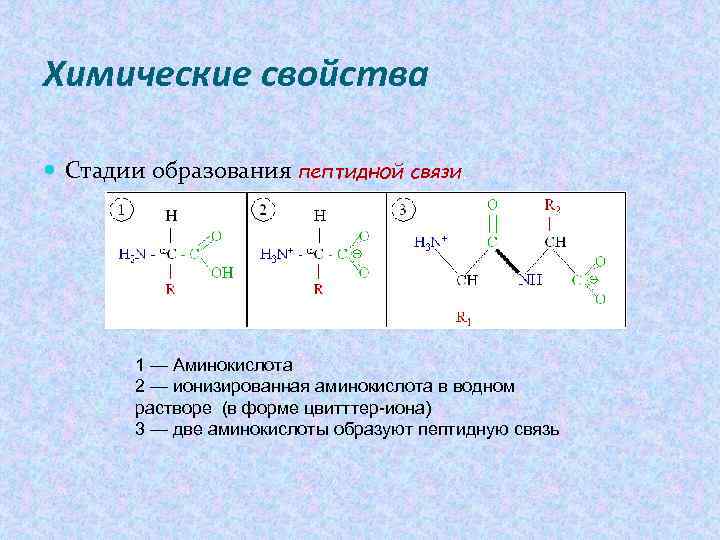 Химические свойства Стадии образования пептидной связи. 1 — Аминокислота 2 — ионизированная аминокислота в водном растворе (в форме цвитттер-иона) 3 — две аминокислоты образуют пептидную связь
Химические свойства Стадии образования пептидной связи. 1 — Аминокислота 2 — ионизированная аминокислота в водном растворе (в форме цвитттер-иона) 3 — две аминокислоты образуют пептидную связь
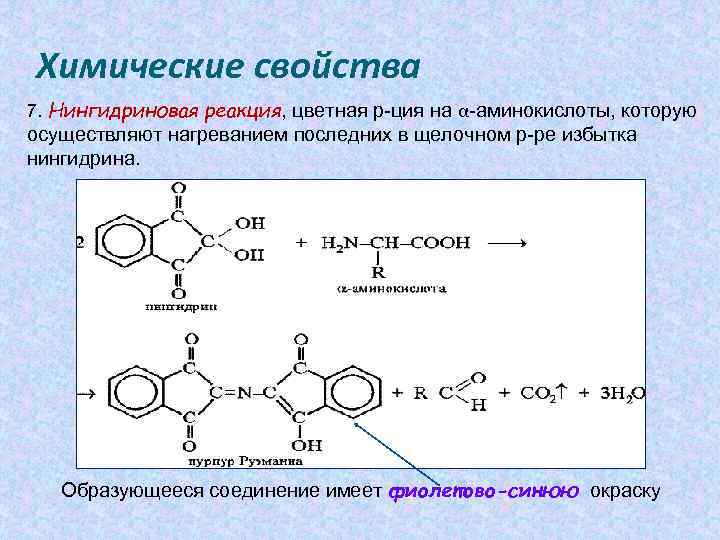 Химические свойства 7. Нингидриновая реакция, цветная р-ция на α-аминокислоты, которую осуществляют нагреванием последних в щелочном р-ре избытка нингидрина. Образующееся соединение имеет фиолетово-синюю окраску
Химические свойства 7. Нингидриновая реакция, цветная р-ция на α-аминокислоты, которую осуществляют нагреванием последних в щелочном р-ре избытка нингидрина. Образующееся соединение имеет фиолетово-синюю окраску
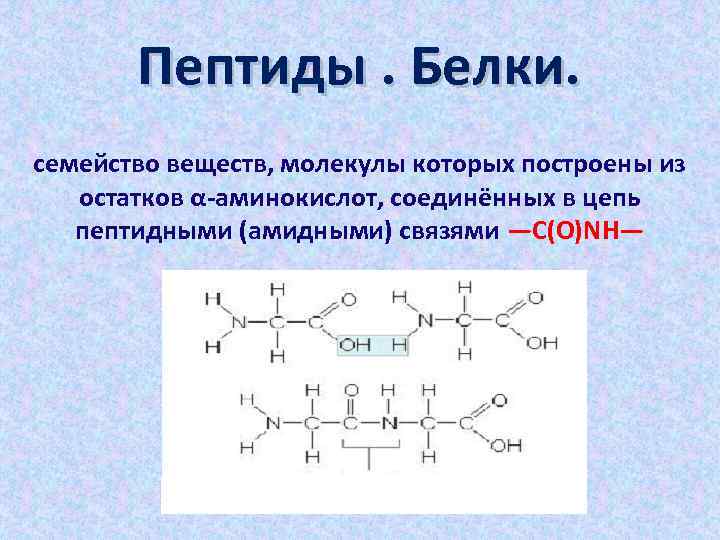 Пептиды. Белки. семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—
Пептиды. Белки. семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—
 Пептиды. Белки. Поликонденсация α- аминокислот приводит к полиамидам, которые называют пептидами или полипептидами Белки — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью.
Пептиды. Белки. Поликонденсация α- аминокислот приводит к полиамидам, которые называют пептидами или полипептидами Белки — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью.
 Номенклатура пептидов и белков Аминокислота: со свободною аминогруппою на конце полиамида называется N–концевою аминокислотой, с несвязанною карбоксильною группою - С– концевою. Аминокислотные остатки нумеруются один за одним, начиная с N–концевой аминокислоты. дипептид H 2 N–CHR–C(О)– NH–CHR–CООН остаток N – концевой кислоты C – концевой кислоты
Номенклатура пептидов и белков Аминокислота: со свободною аминогруппою на конце полиамида называется N–концевою аминокислотой, с несвязанною карбоксильною группою - С– концевою. Аминокислотные остатки нумеруются один за одним, начиная с N–концевой аминокислоты. дипептид H 2 N–CHR–C(О)– NH–CHR–CООН остаток N – концевой кислоты C – концевой кислоты
 Номенклатура пептидов и белков в названии полиамида перечисляют остатки аминокислот, первой указывают N-концевую кислоту, а последней – С-концевая. Глицилсерилаланин (g. Ly – ser – a. La): Н 2 N–CH 2–C(О)–NH–CH(CH 2 OH)–C(О)–NH–СH(CH 3)–СOOH остаток N – концевой кислоты C – концевой кислоты
Номенклатура пептидов и белков в названии полиамида перечисляют остатки аминокислот, первой указывают N-концевую кислоту, а последней – С-концевая. Глицилсерилаланин (g. Ly – ser – a. La): Н 2 N–CH 2–C(О)–NH–CH(CH 2 OH)–C(О)–NH–СH(CH 3)–СOOH остаток N – концевой кислоты C – концевой кислоты
 Анализ белков - установление природы и порядка чередования остатков аминокислот в полипептидной цепи Гидролиз белков при нагревании с разбавленными кислотами или щелочами проводит к смеси альфааминокислот.
Анализ белков - установление природы и порядка чередования остатков аминокислот в полипептидной цепи Гидролиз белков при нагревании с разбавленными кислотами или щелочами проводит к смеси альфааминокислот.
 Анализ белков Гидролиз бывает полным, неполным и избирательным. Неполный гидролиз приводит к расщеплению на небольшие пептидные фрагменты. Избирательный гидролиз под действием ферментов (протеаз: пепсина, трипсина. пептидазы) вызывает расщепление пептидной связи, образованной только одной определенной аминокислотой.
Анализ белков Гидролиз бывает полным, неполным и избирательным. Неполный гидролиз приводит к расщеплению на небольшие пептидные фрагменты. Избирательный гидролиз под действием ферментов (протеаз: пепсина, трипсина. пептидазы) вызывает расщепление пептидной связи, образованной только одной определенной аминокислотой.
 Анализ белков Если полипептид перед гидролизом обработать реактивом Сенгера (2, 4 -динитрофторбензол), то можна установить N–концевую аминокислоту − она образует стойко окрашенное производное динитроанилина.
Анализ белков Если полипептид перед гидролизом обработать реактивом Сенгера (2, 4 -динитрофторбензол), то можна установить N–концевую аминокислоту − она образует стойко окрашенное производное динитроанилина.
 Анализ белков: реактив Сенгера
Анализ белков: реактив Сенгера
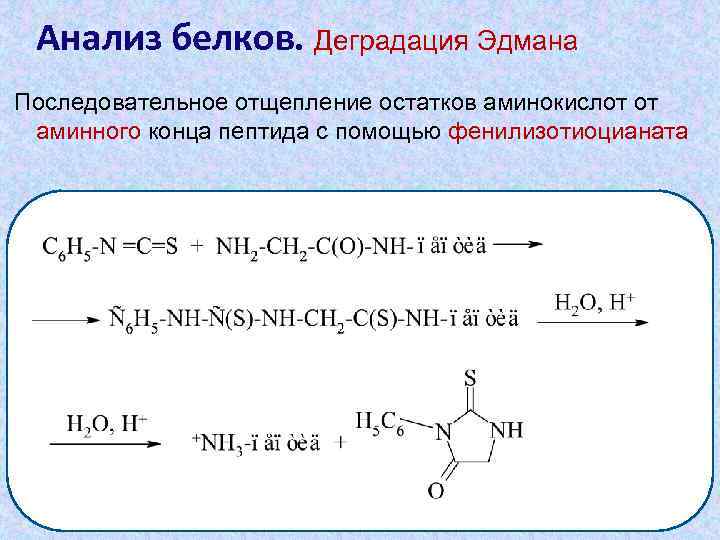 Анализ белков. Деградация Эдмана Последовательное отщепление остатков аминокислот от аминного конца пептида с помощью фенилизотиоцианата
Анализ белков. Деградация Эдмана Последовательное отщепление остатков аминокислот от аминного конца пептида с помощью фенилизотиоцианата
 Анализ белков. Последовательное отщепление остатков аминокислот от карбоксильного конца пептида
Анализ белков. Последовательное отщепление остатков аминокислот от карбоксильного конца пептида
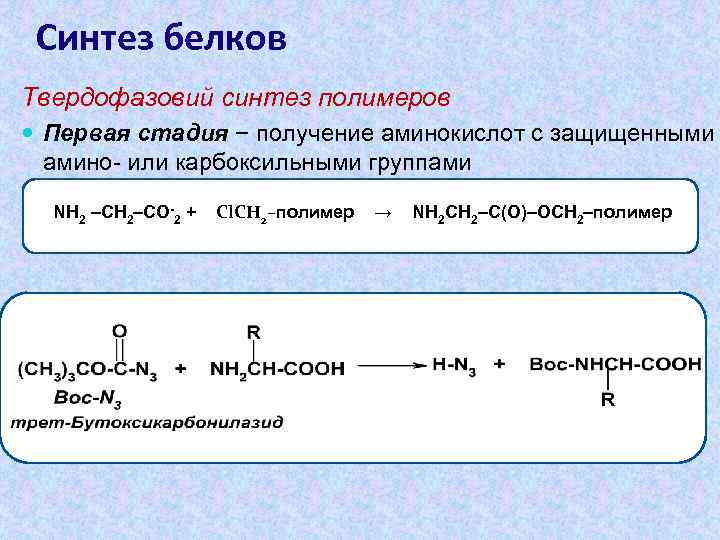 Синтез белков Твердофазовий синтез полимеров Первая стадия − получение аминокислот с защищенными амино- или карбоксильными группами NH 2 –CH 2–CO-2 + Cl. CH 2–полимер → NH 2 CH 2–C(O)–OCH 2–полимер
Синтез белков Твердофазовий синтез полимеров Первая стадия − получение аминокислот с защищенными амино- или карбоксильными группами NH 2 –CH 2–CO-2 + Cl. CH 2–полимер → NH 2 CH 2–C(O)–OCH 2–полимер
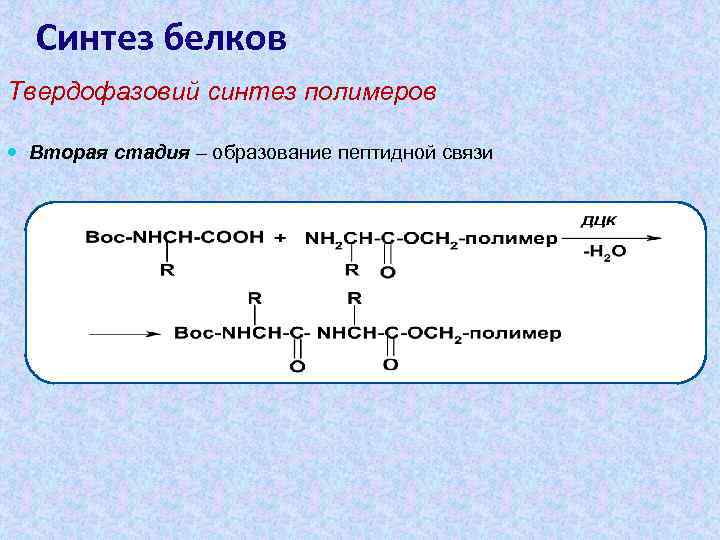 Синтез белков Твердофазовий синтез полимеров Вторая стадия – образование пептидной связи
Синтез белков Твердофазовий синтез полимеров Вторая стадия – образование пептидной связи
 Синтез белков Твердофазовий синтез полимеров Третья стадия − избирательное отщепление защищающих групп гидролиз Вос-производного: снятие Вос-защиты и полимера:
Синтез белков Твердофазовий синтез полимеров Третья стадия − избирательное отщепление защищающих групп гидролиз Вос-производного: снятие Вос-защиты и полимера:
 Синтез белков Классический метод Затраты: допуская, что каждая стадия заканчивается с выходом 90%, синтез из 100 стадий будет иметь 0, 003 % выход
Синтез белков Классический метод Затраты: допуская, что каждая стадия заканчивается с выходом 90%, синтез из 100 стадий будет иметь 0, 003 % выход


