ХИМИЯ Лекция 10.Аминокислоты леч.изм..ppt
- Количество слайдов: 40
 Аминокислоты N H 2 – C H – C O O H R Производные карбоновых кислот, содержащие в своем составе одну или несколько аминогрупп.
Аминокислоты N H 2 – C H – C O O H R Производные карбоновых кислот, содержащие в своем составе одну или несколько аминогрупп.
 Аминокислоты n Природные Их около 150, они были обнаружены в живых организмах, около 20 из них входят в состав белков. Половина этих аминокислот – незаменимые (не синтезируются в организме человека), они поступают с пищей. n Синтетические Получают кислотным гидролизом белков либо из карбоновых кислот, воздействуя на них галогеном и, далее, аммиаком.
Аминокислоты n Природные Их около 150, они были обнаружены в живых организмах, около 20 из них входят в состав белков. Половина этих аминокислот – незаменимые (не синтезируются в организме человека), они поступают с пищей. n Синтетические Получают кислотным гидролизом белков либо из карбоновых кислот, воздействуя на них галогеном и, далее, аммиаком.
 Номенклатура n По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Номенклатура n По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе.
 Номенклатура Часто используется другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита. n
Номенклатура Часто используется другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита. n
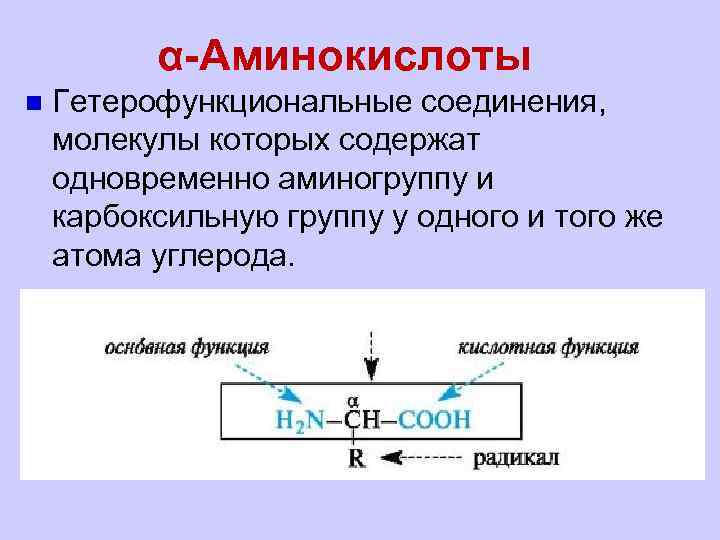 α-Аминокислоты n Гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
α-Аминокислоты n Гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
 Важнейшие α-аминокислоты
Важнейшие α-аминокислоты
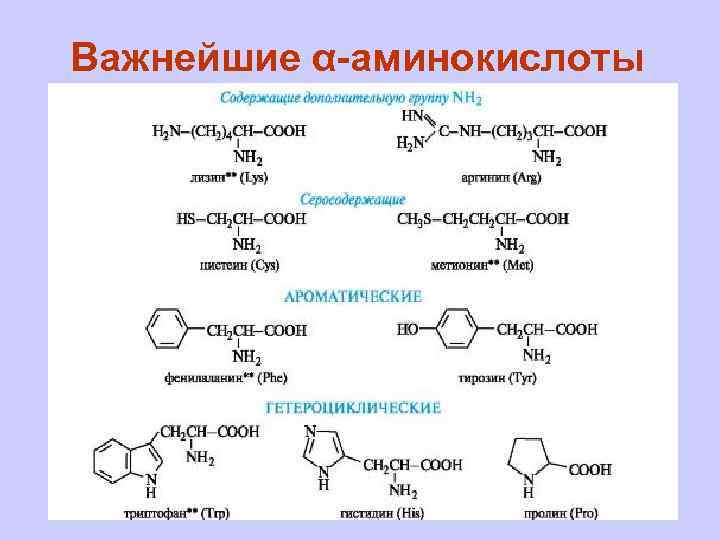 Важнейшие α-аминокислоты
Важнейшие α-аминокислоты
 n Названия α-аминокислот могут быть построены по заместительной номенклатуре, но чаще используются их тривиальные названия.
n Названия α-аминокислот могут быть построены по заместительной номенклатуре, но чаще используются их тривиальные названия.
 Алифатические α-аминокислоты n n n В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют: нейтральные аминокислоты - по одной группе NH 2 и СООН; основные аминокислоты - две группы NH 2 и одна группа СООН; кислые аминокислоты - одна группа NH 2 и две группы СООН.
Алифатические α-аминокислоты n n n В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют: нейтральные аминокислоты - по одной группе NH 2 и СООН; основные аминокислоты - две группы NH 2 и одна группа СООН; кислые аминокислоты - одна группа NH 2 и две группы СООН.
 В алифатическом радикале могут содержаться «дополнительные» функциональные группы: n гидроксильная - серин, треонин; n карбоксильная - аспарагиновая и глутаминовая кислоты; n тиольная - цистеин; n амидная - аспарагин, глутамин.
В алифатическом радикале могут содержаться «дополнительные» функциональные группы: n гидроксильная - серин, треонин; n карбоксильная - аспарагиновая и глутаминовая кислоты; n тиольная - цистеин; n амидная - аспарагин, глутамин.
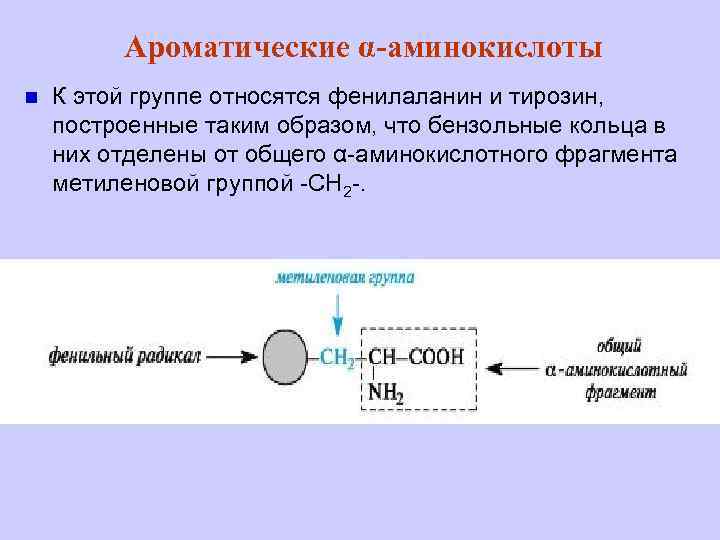 Ароматические α-аминокислоты n К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН 2 -.
Ароматические α-аминокислоты n К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН 2 -.
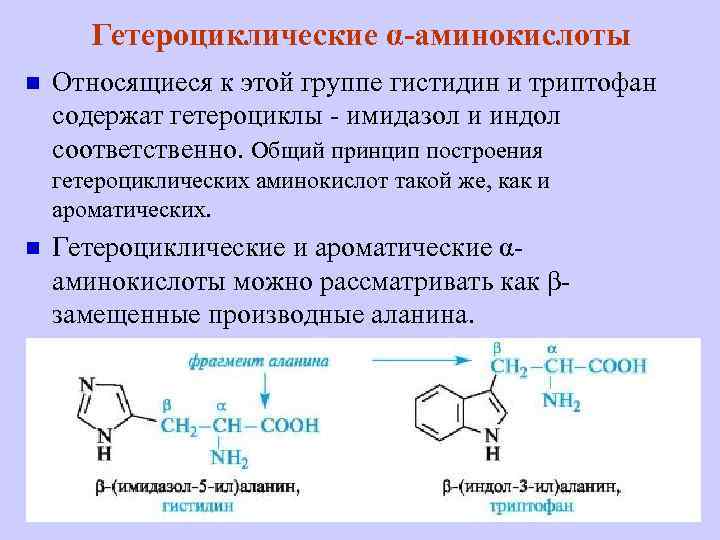 Гетероциклические α-аминокислоты n Относящиеся к этой группе гистидин и триптофан содержат гетероциклы - имидазол и индол соответственно. Общий принцип построения гетероциклических аминокислот такой же, как и ароматических. n Гетероциклические и ароматические αаминокислоты можно рассматривать как βзамещенные производные аланина.
Гетероциклические α-аминокислоты n Относящиеся к этой группе гистидин и триптофан содержат гетероциклы - имидазол и индол соответственно. Общий принцип построения гетероциклических аминокислот такой же, как и ароматических. n Гетероциклические и ароматические αаминокислоты можно рассматривать как βзамещенные производные аланина.
 n n В зависимости от бокового радикала выделяют аминокислоты с неполярными (гидрофобными) радикалами и аминокислоты c полярными (гидрофильными) радикалами. К первой группе относятся аминокислоты с алифатическими боковыми радикалами - аланин, валин, лейцин, изолейцин, метионин - и ароматическими боковыми радикалами - фенилаланин, триптофан.
n n В зависимости от бокового радикала выделяют аминокислоты с неполярными (гидрофобными) радикалами и аминокислоты c полярными (гидрофильными) радикалами. К первой группе относятся аминокислоты с алифатическими боковыми радикалами - аланин, валин, лейцин, изолейцин, метионин - и ароматическими боковыми радикалами - фенилаланин, триптофан.
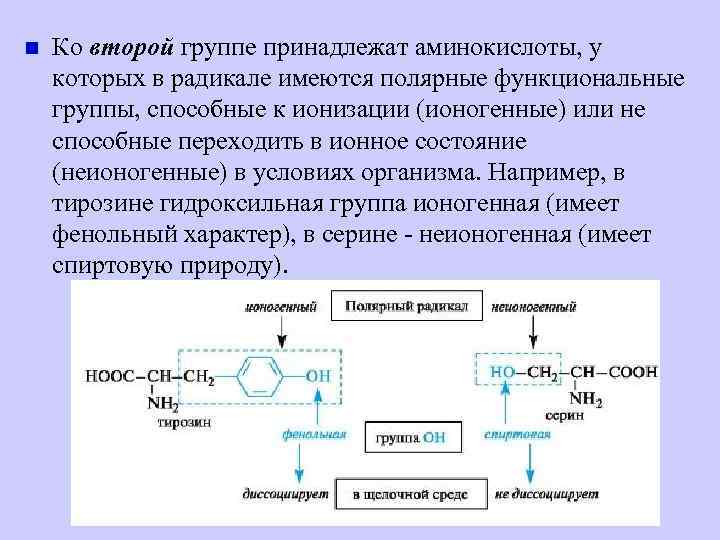 n Ко второй группе принадлежат аминокислоты, у которых в радикале имеются полярные функциональные группы, способные к ионизации (ионогенные) или не способные переходить в ионное состояние (неионогенные) в условиях организма. Например, в тирозине гидроксильная группа ионогенная (имеет фенольный характер), в серине - неионогенная (имеет спиртовую природу).
n Ко второй группе принадлежат аминокислоты, у которых в радикале имеются полярные функциональные группы, способные к ионизации (ионогенные) или не способные переходить в ионное состояние (неионогенные) в условиях организма. Например, в тирозине гидроксильная группа ионогенная (имеет фенольный характер), в серине - неионогенная (имеет спиртовую природу).
 Изомерия аминокислот n углеродного скелета; n положения функциональных групп; n межклассовая (нитросоединения); n оптическая.
Изомерия аминокислот n углеродного скелета; n положения функциональных групп; n межклассовая (нитросоединения); n оптическая.
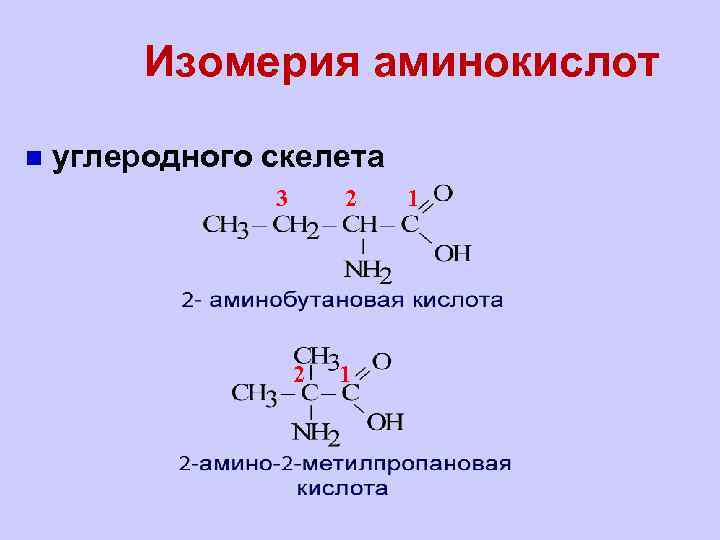 Изомерия аминокислот n углеродного скелета 3 2 2 1 1
Изомерия аминокислот n углеродного скелета 3 2 2 1 1
 Изомерия аминокислот n положения функциональных групп
Изомерия аминокислот n положения функциональных групп
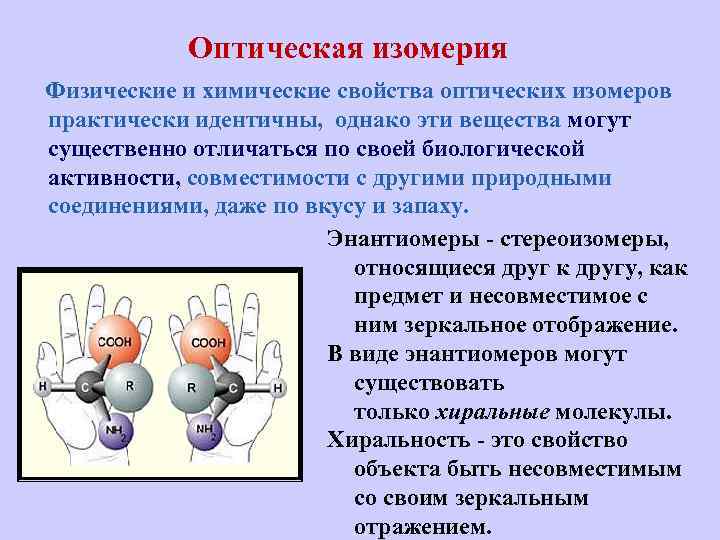 Оптическая изомерия Физические и химические свойства оптических изомеров практически идентичны, однако эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху. Энантиомеры - стереоизомеры, относящиеся друг к другу, как предмет и несовместимое с ним зеркальное отображение. В виде энантиомеров могут существовать только хиральные молекулы. Хиральность - это свойство объекта быть несовместимым со своим зеркальным отражением.
Оптическая изомерия Физические и химические свойства оптических изомеров практически идентичны, однако эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху. Энантиомеры - стереоизомеры, относящиеся друг к другу, как предмет и несовместимое с ним зеркальное отображение. В виде энантиомеров могут существовать только хиральные молекулы. Хиральность - это свойство объекта быть несовместимым со своим зеркальным отражением.
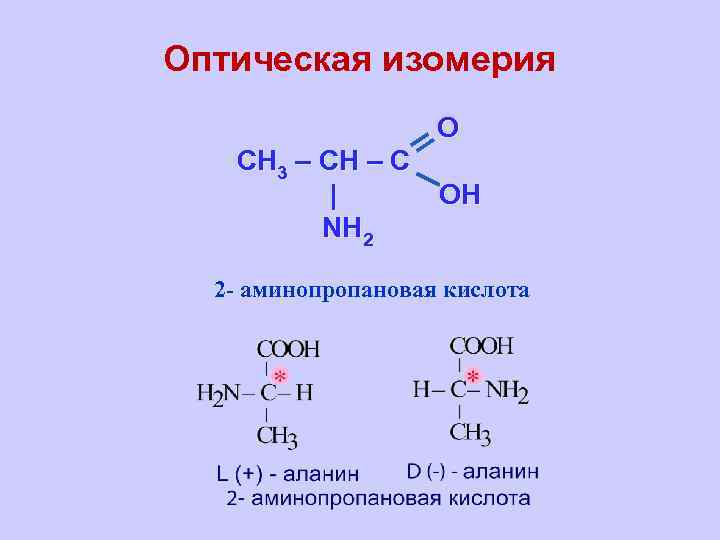 Оптическая изомерия O CH 3 – CH – C | OH NH 2 2 - аминопропановая кислота
Оптическая изомерия O CH 3 – CH – C | OH NH 2 2 - аминопропановая кислота
 Физические свойства Аминокислоты n n n бесцветные; кристаллические; хорошо растворимы в воде, но нерастворимы в эфире; в зависимости от R могут быть сладкими, горькими или безвкусными; обладают оптической активностью; плавятся с разложением при температуре выше 200º.
Физические свойства Аминокислоты n n n бесцветные; кристаллические; хорошо растворимы в воде, но нерастворимы в эфире; в зависимости от R могут быть сладкими, горькими или безвкусными; обладают оптической активностью; плавятся с разложением при температуре выше 200º.
 Химические свойства n n Наличие аминои карбоксильной групп определяет двойственность химических свойств аминокислот. Амфотерность (от греч. amphуteros – «и тот и другой» ) – способность некоторых веществ в зависимости от условий проявлять либо кислотные, либо основные свойства; амфотерные вещества иногда называют амфолитами.
Химические свойства n n Наличие аминои карбоксильной групп определяет двойственность химических свойств аминокислот. Амфотерность (от греч. amphуteros – «и тот и другой» ) – способность некоторых веществ в зависимости от условий проявлять либо кислотные, либо основные свойства; амфотерные вещества иногда называют амфолитами.
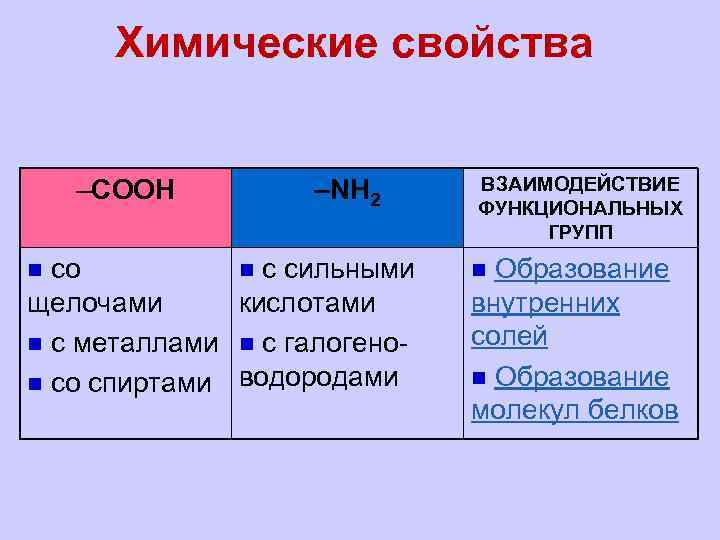 Химические свойства –СООН –NH 2 со n с сильными щелочами кислотами n с металлами n с галогеноn со спиртами водородами n ВЗАИМОДЕЙСТВИЕ ФУНКЦИОНАЛЬНЫХ ГРУПП Образование внутренних солей n Образование молекул белков n
Химические свойства –СООН –NH 2 со n с сильными щелочами кислотами n с металлами n с галогеноn со спиртами водородами n ВЗАИМОДЕЙСТВИЕ ФУНКЦИОНАЛЬНЫХ ГРУПП Образование внутренних солей n Образование молекул белков n
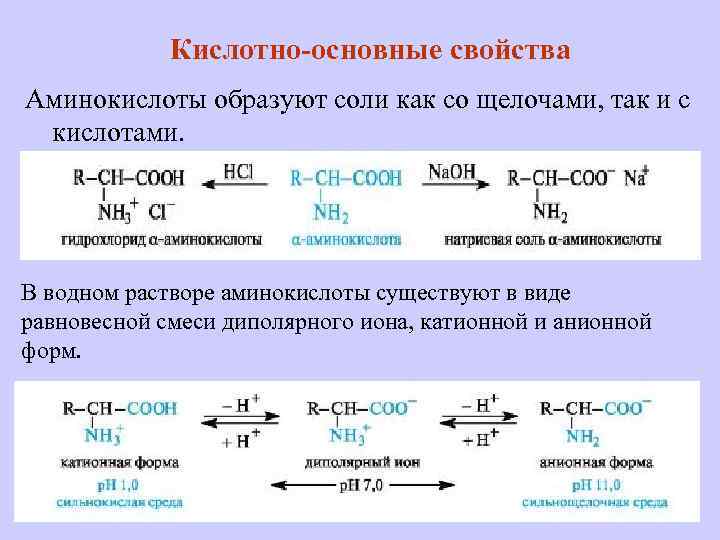 Кислотно-основные свойства Аминокислоты образуют соли как со щелочами, так и с кислотами. В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.
Кислотно-основные свойства Аминокислоты образуют соли как со щелочами, так и с кислотами. В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.
 Аналитически важные реакции α-аминокислот n α-Аминокислоты как гетерофункциональные соединения вступают в реакции, характерные как для карбоксильной, так и для аминогруппы. Некоторые химические свойства аминокислот обусловлены функциональными группами в радикале.
Аналитически важные реакции α-аминокислот n α-Аминокислоты как гетерофункциональные соединения вступают в реакции, характерные как для карбоксильной, так и для аминогруппы. Некоторые химические свойства аминокислот обусловлены функциональными группами в радикале.
 Этерификация n При взаимодействии аминокислот со спиртами в присутствии кислотного катализатора (например, газообразный хлороводород) с хорошим выходом получаются сложные эфиры в виде гидрохлоридов. Для выделения свободных эфиров реакционную смесь обрабатывают газообразным аммиаком.
Этерификация n При взаимодействии аминокислот со спиртами в присутствии кислотного катализатора (например, газообразный хлороводород) с хорошим выходом получаются сложные эфиры в виде гидрохлоридов. Для выделения свободных эфиров реакционную смесь обрабатывают газообразным аммиаком.
 Реакция с формальдегидом n n Практическое значение имеет реакция с формальдегидом, которая лежит в основе количественного определения аминокислот методом формольного титрования (метод Сёренсена). Амфотерность аминокислот не позволяет проводить непосредственно титрование их щелочью в аналитических целях. При взаимодействии аминокислот с формальдегидом получаются относительно устойчивые аминоспирты - Nгидроксиметильные производные, свободную карбоксильную группу которых затем титруют щелочью.
Реакция с формальдегидом n n Практическое значение имеет реакция с формальдегидом, которая лежит в основе количественного определения аминокислот методом формольного титрования (метод Сёренсена). Амфотерность аминокислот не позволяет проводить непосредственно титрование их щелочью в аналитических целях. При взаимодействии аминокислот с формальдегидом получаются относительно устойчивые аминоспирты - Nгидроксиметильные производные, свободную карбоксильную группу которых затем титруют щелочью.
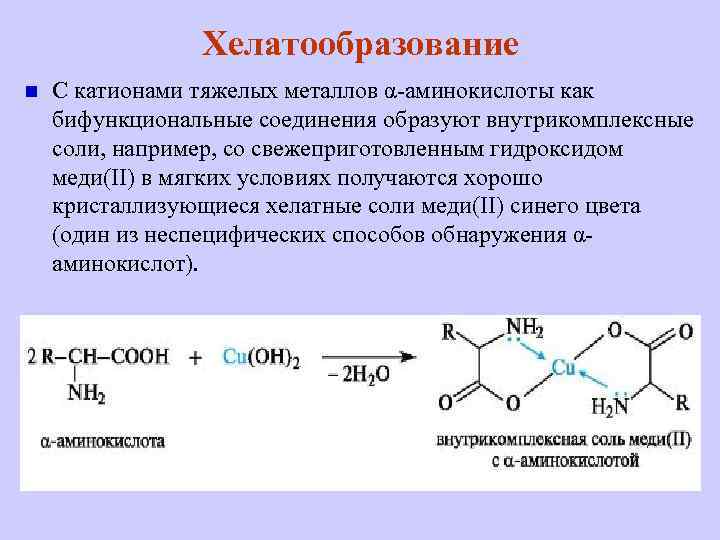 Хелатообразование n С катионами тяжелых металлов α-аминокислоты как бифункциональные соединения образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди(II) в мягких условиях получаются хорошо кристаллизующиеся хелатные соли меди(II) синего цвета (один из неспецифических способов обнаружения αаминокислот).
Хелатообразование n С катионами тяжелых металлов α-аминокислоты как бифункциональные соединения образуют внутрикомплексные соли, например, со свежеприготовленным гидроксидом меди(II) в мягких условиях получаются хорошо кристаллизующиеся хелатные соли меди(II) синего цвета (один из неспецифических способов обнаружения αаминокислот).
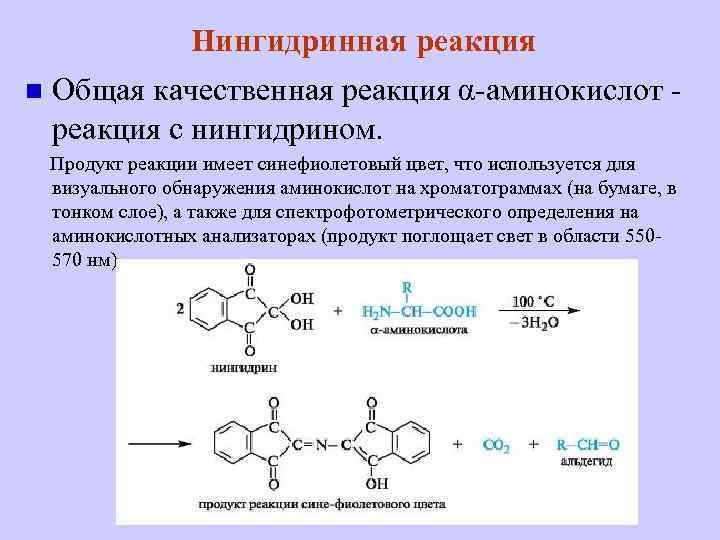 Нингидринная реакция n Общая качественная реакция α-аминокислот - реакция с нингидрином. Продукт реакции имеет синефиолетовый цвет, что используется для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое), а также для спектрофотометрического определения на аминокислотных анализаторах (продукт поглощает свет в области 550570 нм).
Нингидринная реакция n Общая качественная реакция α-аминокислот - реакция с нингидрином. Продукт реакции имеет синефиолетовый цвет, что используется для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое), а также для спектрофотометрического определения на аминокислотных анализаторах (продукт поглощает свет в области 550570 нм).
 Дезаминирование n В лабораторных условиях эта реакция осуществляется при действии азотистой кислоты на α-аминокислоты. При этом образуется соответствующая α-гидроксикислота и выделяется газообразный азот, по объему которого судят о количестве вступившей в реакцию аминокислоты (метод Ван -Слайка).
Дезаминирование n В лабораторных условиях эта реакция осуществляется при действии азотистой кислоты на α-аминокислоты. При этом образуется соответствующая α-гидроксикислота и выделяется газообразный азот, по объему которого судят о количестве вступившей в реакцию аминокислоты (метод Ван -Слайка).
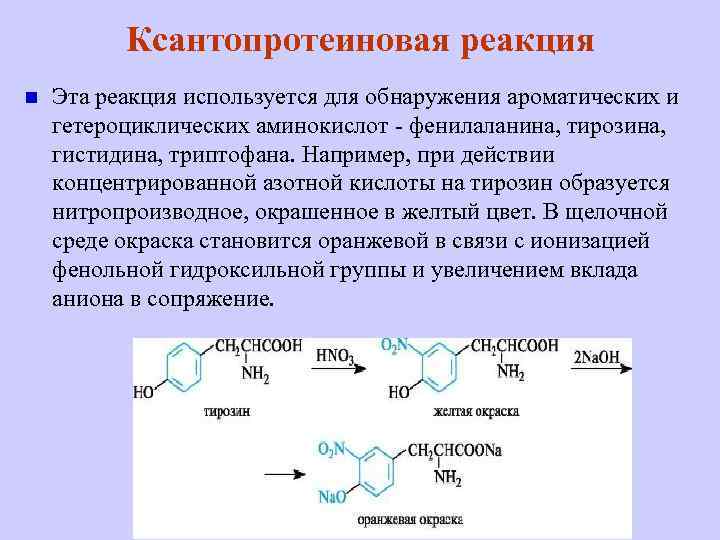 Ксантопротеиновая реакция n Эта реакция используется для обнаружения ароматических и гетероциклических аминокислот - фенилаланина, тирозина, гистидина, триптофана. Например, при действии концентрированной азотной кислоты на тирозин образуется нитропроизводное, окрашенное в желтый цвет. В щелочной среде окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.
Ксантопротеиновая реакция n Эта реакция используется для обнаружения ароматических и гетероциклических аминокислот - фенилаланина, тирозина, гистидина, триптофана. Например, при действии концентрированной азотной кислоты на тирозин образуется нитропроизводное, окрашенное в желтый цвет. В щелочной среде окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.
 Биологически важные химические реакции В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким превращениям относятся n трансаминирование, n декарбоксилирование, n элиминирование, n альдольное расщепление, n окислительное дезаминирование, n окисление тиольных групп.
Биологически важные химические реакции В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким превращениям относятся n трансаминирование, n декарбоксилирование, n элиминирование, n альдольное расщепление, n окислительное дезаминирование, n окисление тиольных групп.
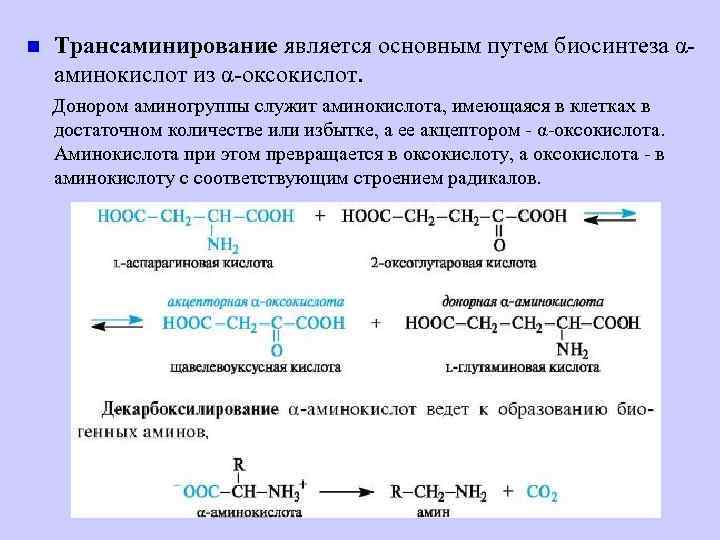 n Трансаминирование является основным путем биосинтеза αаминокислот из α-оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором - α-оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота - в аминокислоту с соответствующим строением радикалов.
n Трансаминирование является основным путем биосинтеза αаминокислот из α-оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором - α-оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота - в аминокислоту с соответствующим строением радикалов.
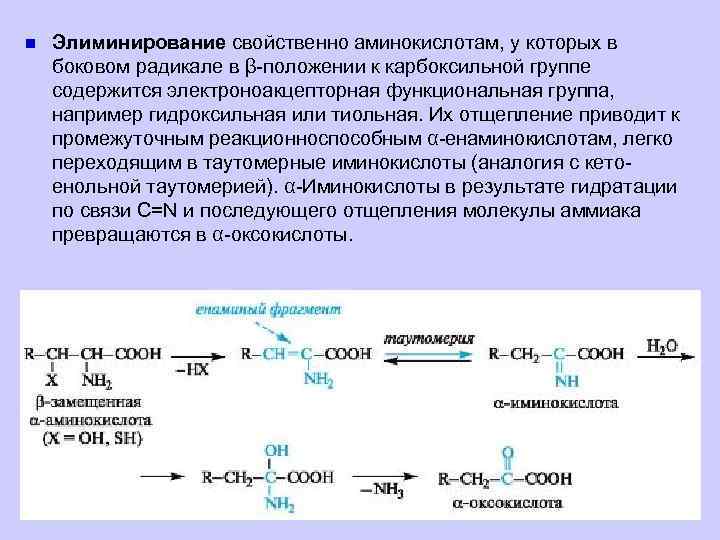 n Элиминирование свойственно аминокислотам, у которых в боковом радикале в β-положении к карбоксильной группе содержится электроноакцепторная функциональная группа, например гидроксильная или тиольная. Их отщепление приводит к промежуточным реакционноспособным α-енаминокислотам, легко переходящим в таутомерные иминокислоты (аналогия с кетоенольной таутомерией). α-Иминокислоты в результате гидратации по связи C=N и последующего отщепления молекулы аммиака превращаются в α-оксокислоты.
n Элиминирование свойственно аминокислотам, у которых в боковом радикале в β-положении к карбоксильной группе содержится электроноакцепторная функциональная группа, например гидроксильная или тиольная. Их отщепление приводит к промежуточным реакционноспособным α-енаминокислотам, легко переходящим в таутомерные иминокислоты (аналогия с кетоенольной таутомерией). α-Иминокислоты в результате гидратации по связи C=N и последующего отщепления молекулы аммиака превращаются в α-оксокислоты.
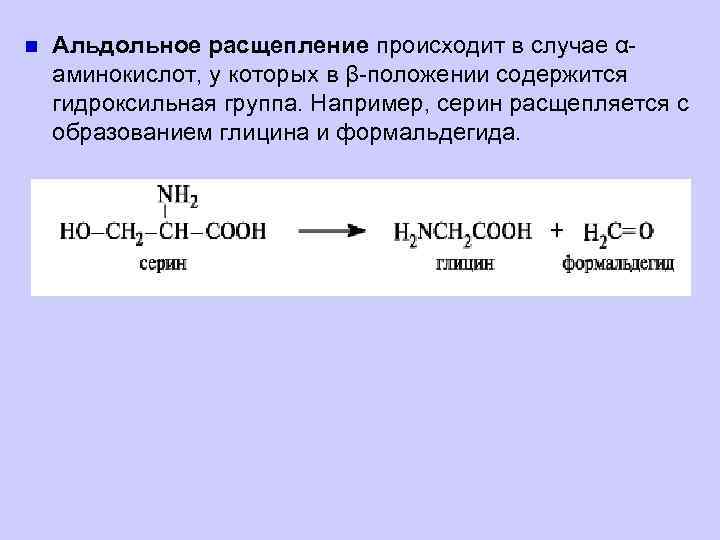 n Альдольное расщепление происходит в случае αаминокислот, у которых в β-положении содержится гидроксильная группа. Например, серин расщепляется с образованием глицина и формальдегида.
n Альдольное расщепление происходит в случае αаминокислот, у которых в β-положении содержится гидроксильная группа. Например, серин расщепляется с образованием глицина и формальдегида.
 n Окислительное дезаминирование α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из L-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегидрирование (окисление) глутаминовой кислоты до α-иминоглутаровой кислоты. На второй стадии происходит гидролиз, в результате которого получаются αоксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента.
n Окислительное дезаминирование α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из L-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегидрирование (окисление) глутаминовой кислоты до α-иминоглутаровой кислоты. На второй стадии происходит гидролиз, в результате которого получаются αоксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента.
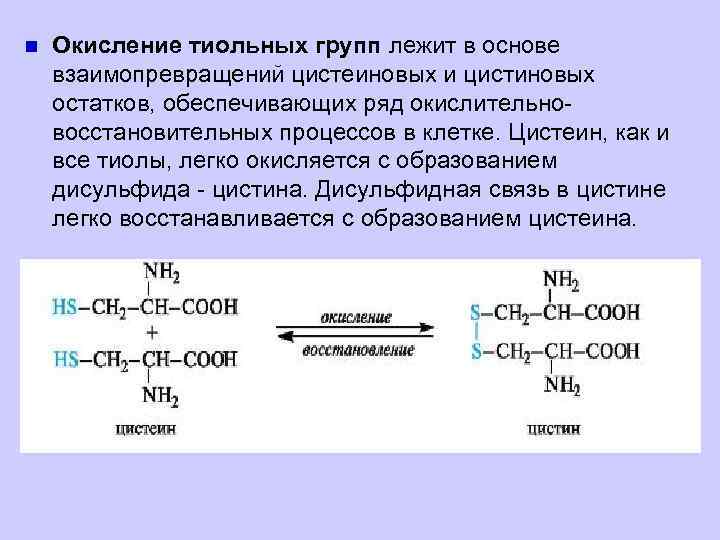 n Окисление тиольных групп лежит в основе взаимопревращений цистеиновых и цистиновых остатков, обеспечивающих ряд окислительновосстановительных процессов в клетке. Цистеин, как и все тиолы, легко окисляется с образованием дисульфида - цистина. Дисульфидная связь в цистине легко восстанавливается с образованием цистеина.
n Окисление тиольных групп лежит в основе взаимопревращений цистеиновых и цистиновых остатков, обеспечивающих ряд окислительновосстановительных процессов в клетке. Цистеин, как и все тиолы, легко окисляется с образованием дисульфида - цистина. Дисульфидная связь в цистине легко восстанавливается с образованием цистеина.
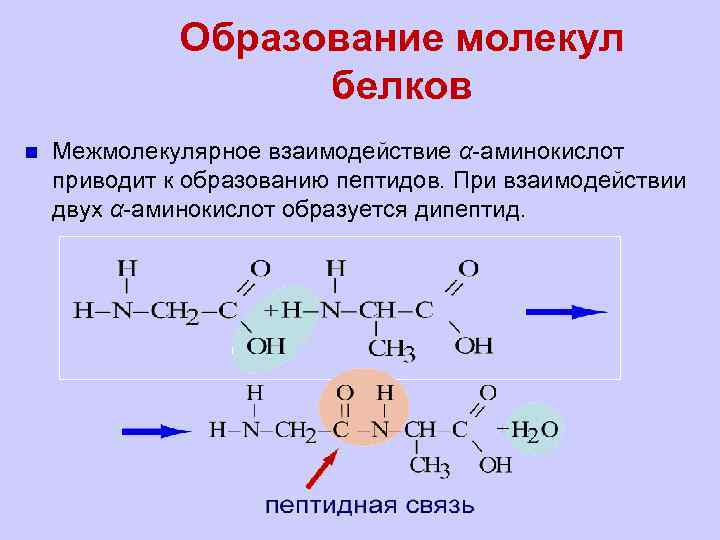 Образование молекул белков n Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов. При взаимодействии двух α-аминокислот образуется дипептид.
Образование молекул белков n Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов. При взаимодействии двух α-аминокислот образуется дипептид.
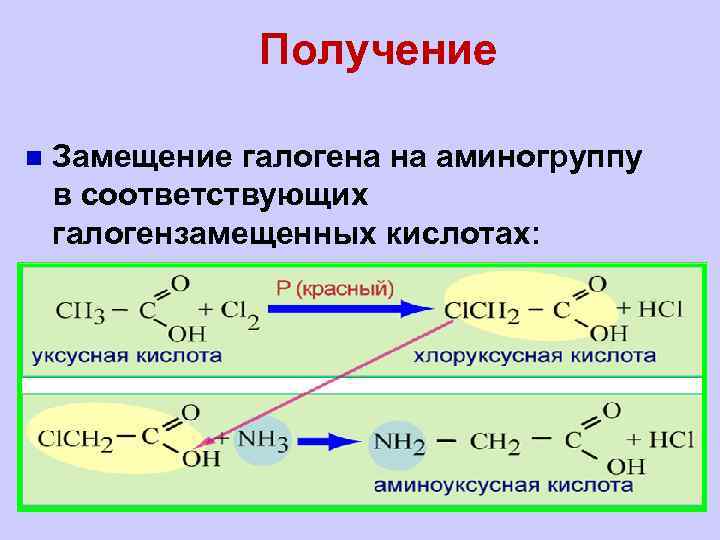 Получение n Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
Получение n Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
 Получение аминокислот n Присоединение аммиака к α, β-непредельным кислотам с образованием β-аминокислот: CH 2=CH–COOH + NH 3 H 2 N–CH 2–COOH n Гидролиз белков
Получение аминокислот n Присоединение аммиака к α, β-непредельным кислотам с образованием β-аминокислот: CH 2=CH–COOH + NH 3 H 2 N–CH 2–COOH n Гидролиз белков
 Фенилкетонури я (фенилпировиноград ная олигофрения) – наследственное заболевание, связанное с нарушением метаболизма аминокислот. Сопровождается накоплением фенилаланина и его токсических Аспартам – заменитель сахара. В кишечном тракте продуктов, распадается, образуя две сильно возбуждающие что приводит аминокислоты, аспартат и фенилаланин, а также к тяжёлому метиловый, или древесный, спирт и формальдегид, поражению ЦНС, которые способны вызывать повреждения глазного проявляющемуся нерва вплоть до слепоты. В числе прочих побочных в виде нарушения эффектов аспартама – образование опухолей в мозге умственного и вторичные неврологические расстройства. . развития.
Фенилкетонури я (фенилпировиноград ная олигофрения) – наследственное заболевание, связанное с нарушением метаболизма аминокислот. Сопровождается накоплением фенилаланина и его токсических Аспартам – заменитель сахара. В кишечном тракте продуктов, распадается, образуя две сильно возбуждающие что приводит аминокислоты, аспартат и фенилаланин, а также к тяжёлому метиловый, или древесный, спирт и формальдегид, поражению ЦНС, которые способны вызывать повреждения глазного проявляющемуся нерва вплоть до слепоты. В числе прочих побочных в виде нарушения эффектов аспартама – образование опухолей в мозге умственного и вторичные неврологические расстройства. . развития.


