аминоК,белки.ppt
- Количество слайдов: 95

АМИНОКИСЛОТЫ, БЕЛКИ
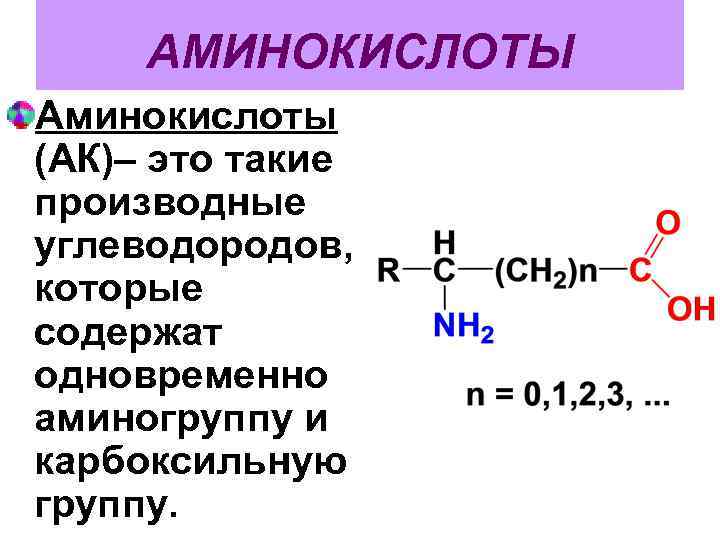
АМИНОКИСЛОТЫ Аминокислоты (АК)– это такие производные углеводородов, которые содержат одновременно аминогруппу и карбоксильную группу.

В зависимости от количества функциональных групп различают: - моноаминокарбоновые кислоты, - моноаминодикарбоновые кислоты, - диаминокарбоновые кислоты и т. п.

В зависимости от взаимного расположения –СООН и –NH 2 – групп различают , , - и т. д. аминокислоты. В зависимости от строения углеводородного радикала АК делятся на алифатические, ароматические , гетероциклические.

Отдельные АК дополнительно содержат гидрокси- и тиольные группы. АК, в которых содержится по одной NH 2 и СООН- группе называются нейтральными, те, в которых число аминогрупп превышает число СООН –групп, называют основными, если кислотных групп больше – кислыми аминокислотами.

Номенклатура • Для наименования АК широко используют тривиальные названия, которые ничего не говорят о структуре, зато имеют преимущество – они значительно короче.

• По рациональной номенклатуре АК рассматривают как замещенные соответствующих кислот, положение NH 2 -групп обозначают префиксами , , . В номенклатуре ИЮПАК NH 2 группу называют амино и указывают номер С-атома, с которым она связана, затем следует название кислоты.
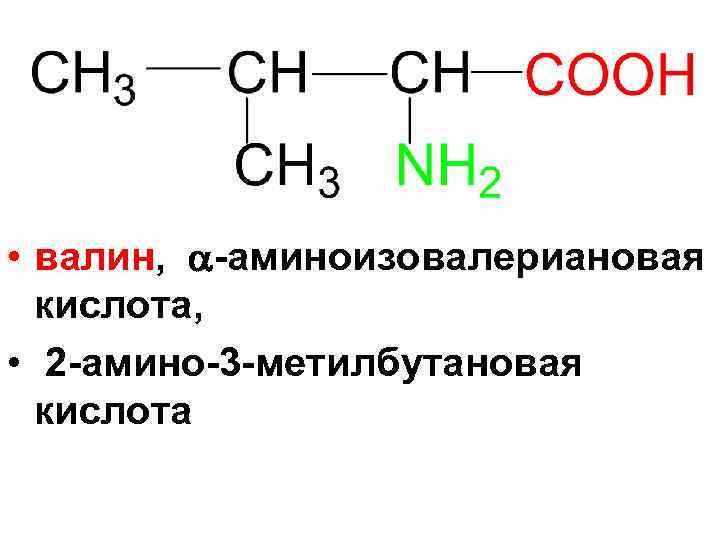
• валин, -аминоизовалериановая кислота, • 2 -амино-3 -метилбутановая кислота

• -АК (кроме аминоуксусной содержат) 1 и более асим. Сатомов и могут существовать в виде нескольких стереоизомеров, число которых определяется по фле N=2 n. • Каждой паре энантиомеров соответствует 1 рацемическая форма.
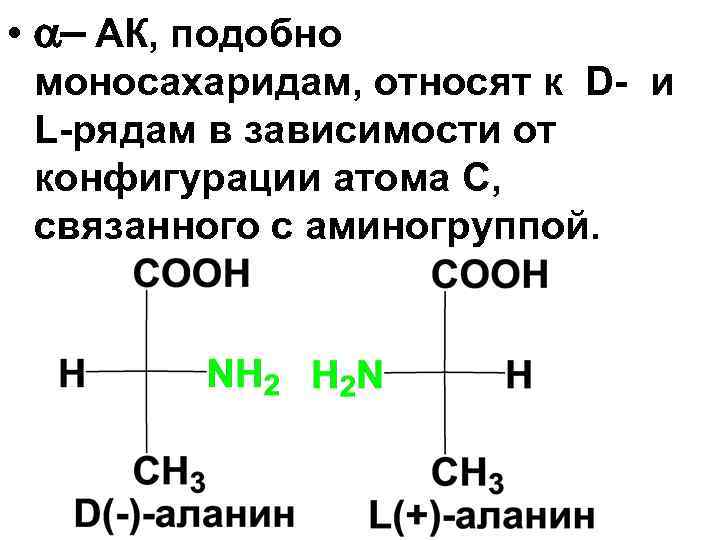
• - АК, подобно моносахаридам, относят к D- и L-рядам в зависимости от конфигурации атома С, связанного с аминогруппой.

• Большинство природных АК, участвующих в биохимических процессах содержат первичную аминогруппу, находящуюся в -положении. Практически все, входящие в состав белков АК, относятся к Lряду, D- формы встречаются очень редко.

В настоящее время в природных объектах обнаружено около 100 -АК. Известно 20 наиболее важных -АК, 10 из которых незаменимые. К ним относят такие АК, которые не могут синтезироваться в организме человека.
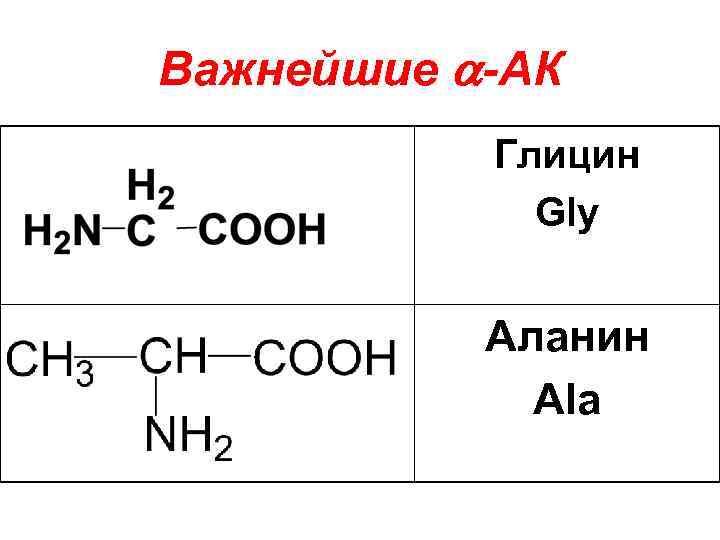
Важнейшие -АК Глицин Gly Аланин Ala
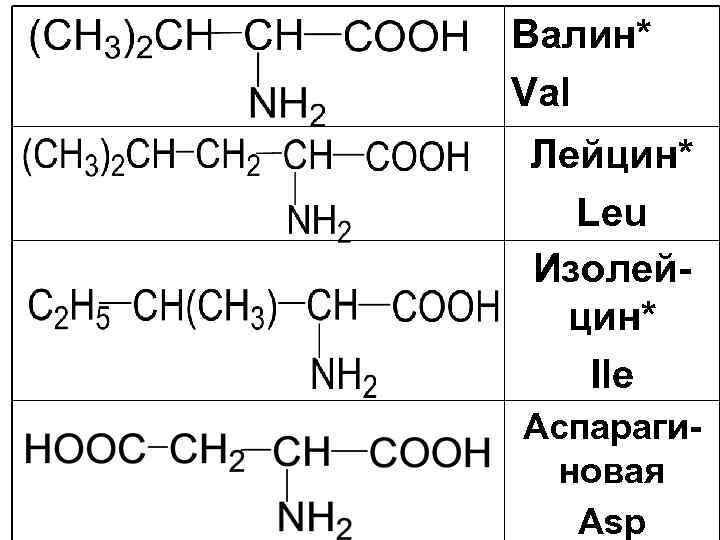
Валин* Val Лейцин* Leu Изолейцин* Ile Аспарагиновая Asp
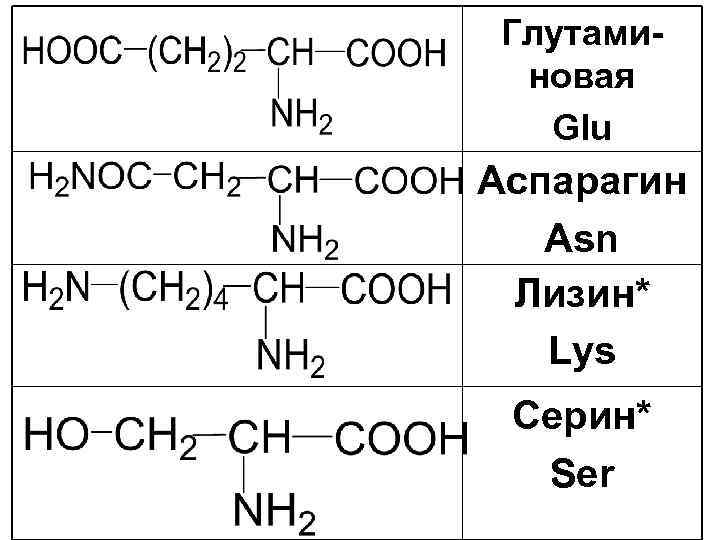
Глутаминовая Glu Аспарагин Asn Лизин* Lys Серин* Ser
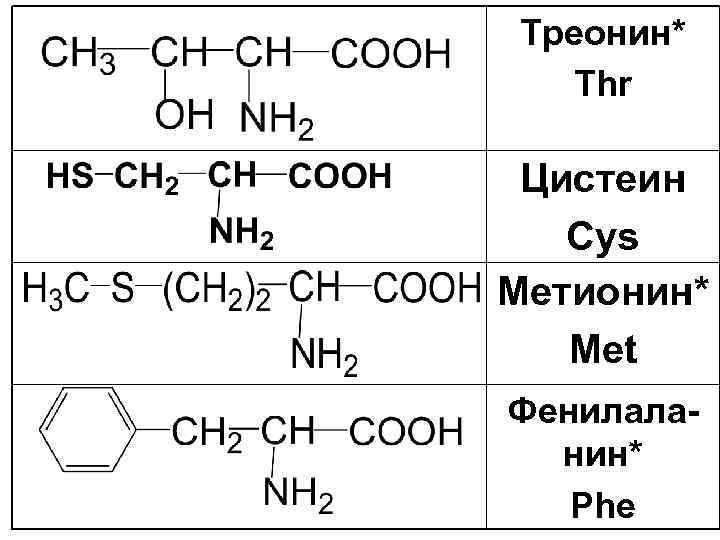
Треонин* Thr Цистеин Cys Метионин* Met Фенилаланин* Phe
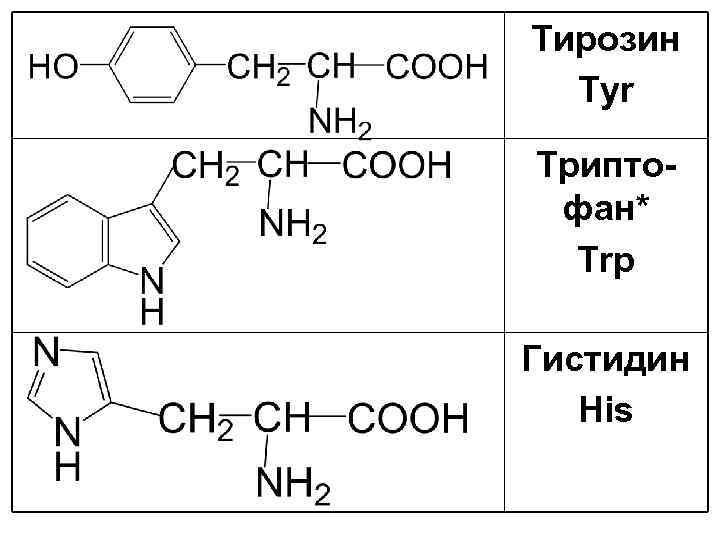
Тирозин Tyr Триптофан* Trp Гистидин His
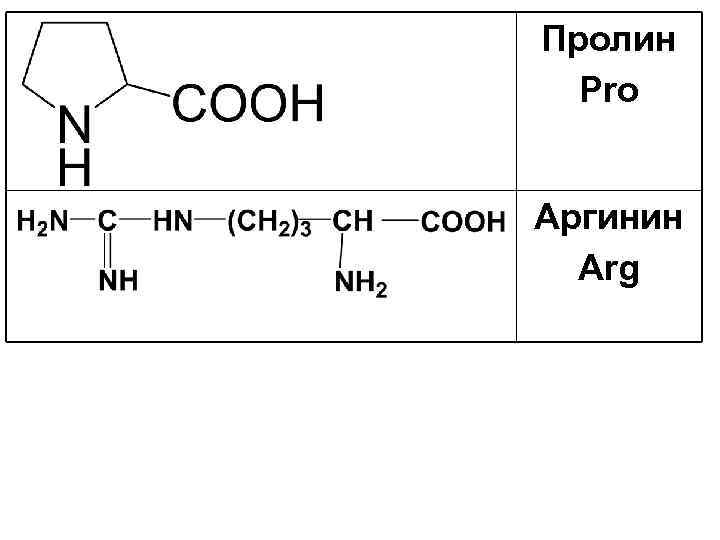
Пролин Pro Аргинин Arg

Способы получения: -АК • 1). Аминирование -галогензамещенных к-т (последние получают по Гелю-Фольганду-Зелинскому Br 2+P)
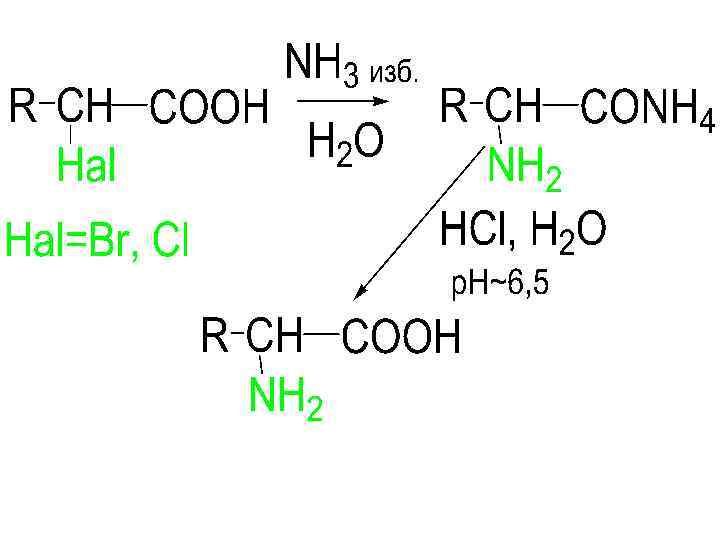

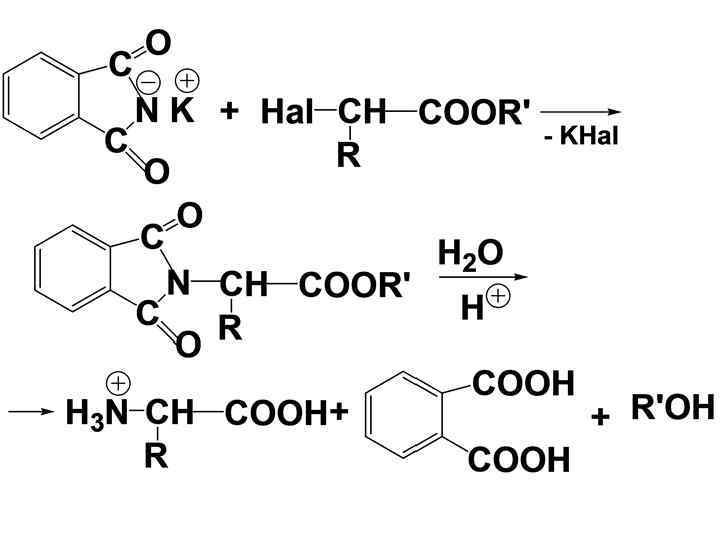
• 2). Аминирование эфиров галогензамещенных к-т (синтез Габриэля) • Эфир обрабатывают фталимидом калия с последующим расщеплением фталимидного производного (высокий выход)

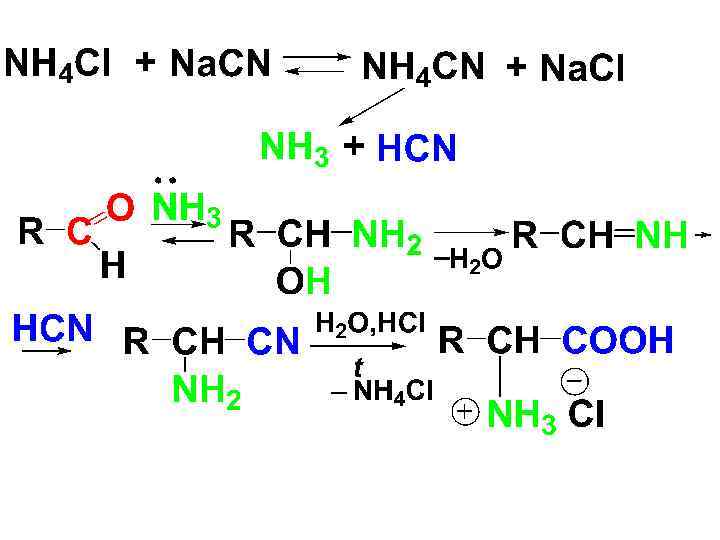
• 3). Циангидринный синтез (синтез Шреккера-Зелинского) • Альдегид обрабатывают смесью хлорида аммония и цианида калия либо натрия. В результате взаимодействия последних образуются HCN и аммиак.

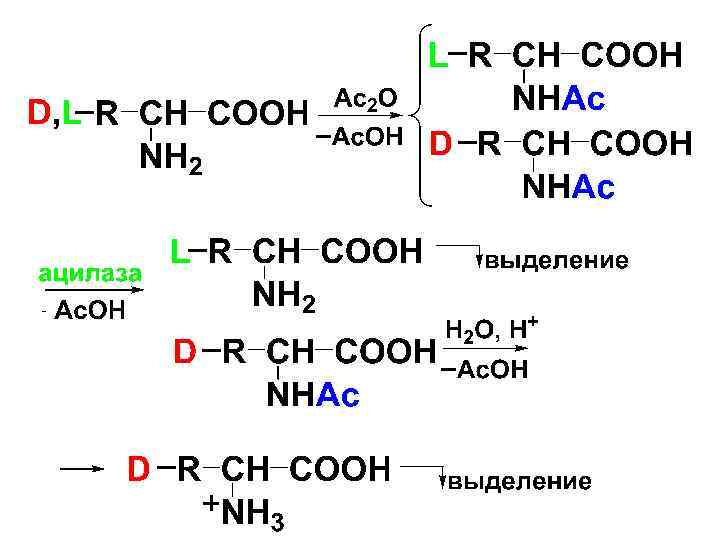
• Однако в результате синтеза образуются рацематы, активной формой которых является лишь один компонент. Хим. метод разделения довольно сложен, поэтому чаще всего пользуются энзиматическим методом.

• Разделение рацемической смеси • Вначале смесь ацетилируют, затем обрабатывают ферментом ацилазой. Ацилаза дезацетилирует ацильные производные природной формы -АК L-ряда.

• Полученная смесь легко разделяется, т. к. свободная АК легко растворяется в кислотах и щелочах, а ацетильное производное только в щелочах. Затем гидролизуют Nацилированное производное DАК разб. кислотой и освобождают D-АК ( в виде соли).

• Для синтеза , - и т. д. АК могут быть использованы соответствующие галогенопроизводные к-ты и их производные, напр. лактамы, а также продукты перегруппировки Бекмана оксимов циклических
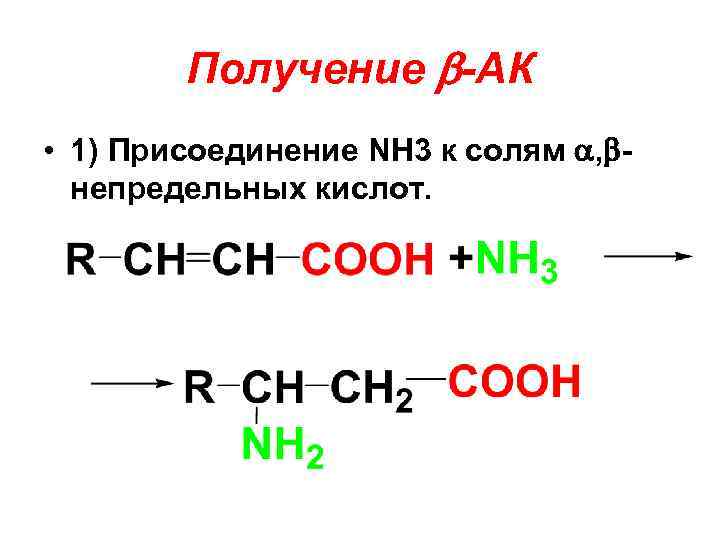
Получение -АК • 1) Присоединение NH 3 к солям , непредельных кислот.

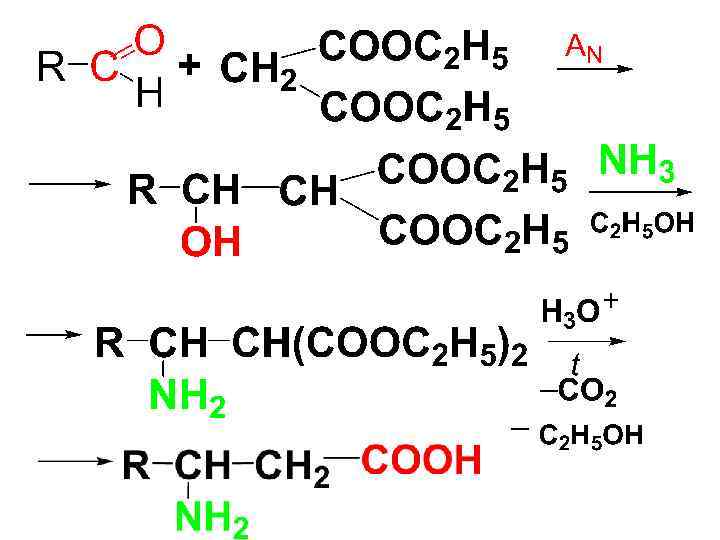
• 2) Синтез Родионова с малоновым эфиром • Действие на малоновый эфир альдегида и аммиака (с увеличением на 2 С-атома)
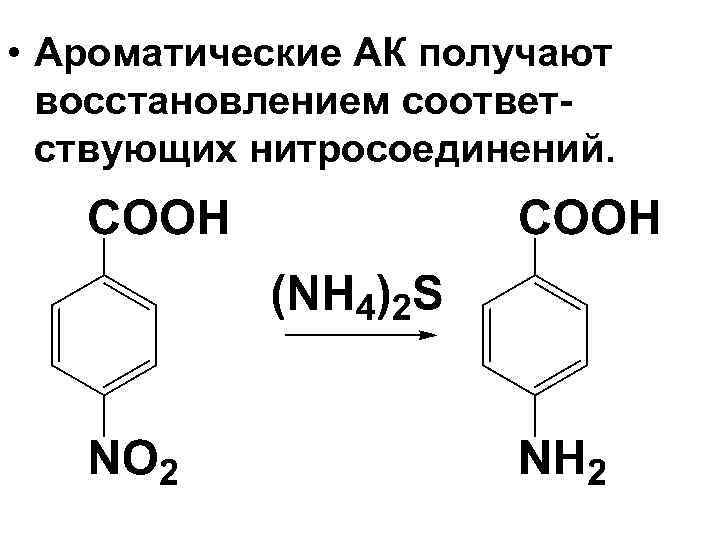
• Ароматические АК получают восстановлением соответствующих нитросоединений.

ФИЗИЧЕСКИЕ СВОЙСТВА • АК представляют собой бесц. крист. вещества с высокой Тпл. (150 – 330 о. С). Плавятся как правило с разложением, нелетучи, хорошо растворимы в воде, плохо в орг. растворителях. АК L-ряда обычно сладкие на вкус, D-ряда –горькие. Организмом человека и животных усваиваются только АК L-ряда.

• В состав молекулы АК входит аминогруппа, обладающая основными свойствами и карбоксильная группа, обладающая кислотными свойствами, которые вступают во внутримолекулярное взаимодействие, образуя внутреннюю соль или диполярный ион (цвиттер-ион).
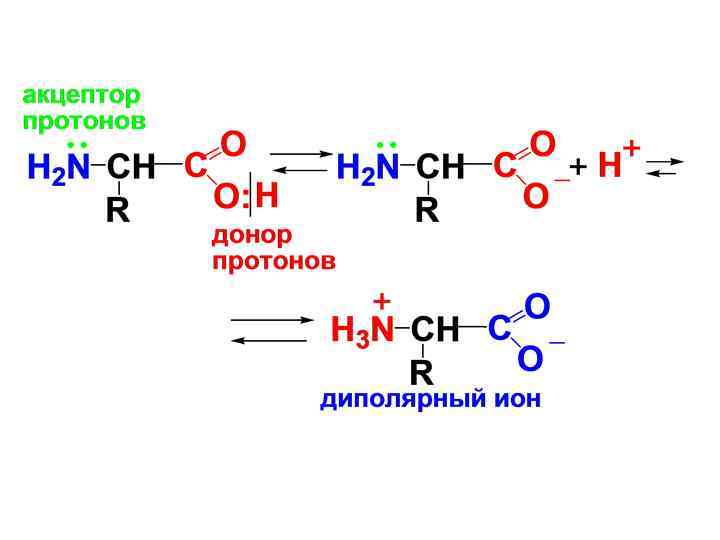

• -АК в твердом виде находятся в виде диполярных ионов, в водном растворе в виде равновесной смеси катионной, анионной форм и диполярных ионов. Равновесие зависит от р. Н среды.
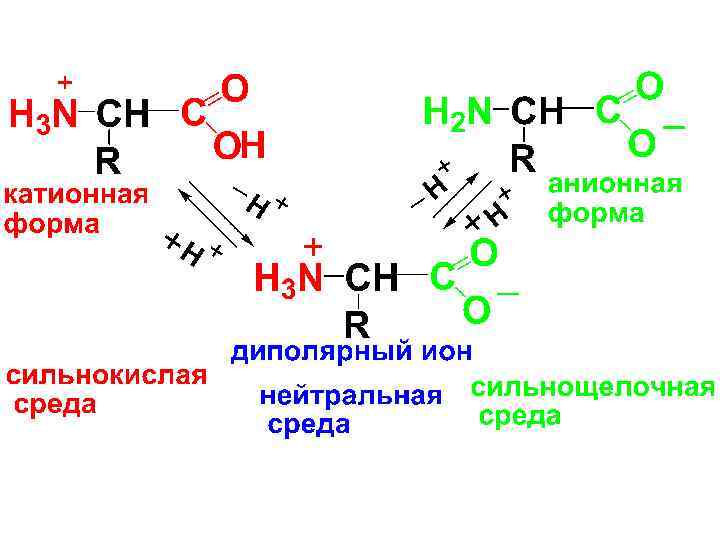

• Значение р. Н, при котором рры АК электронейтральны и не проводят электрический ток, называют изоэлектрической точкой
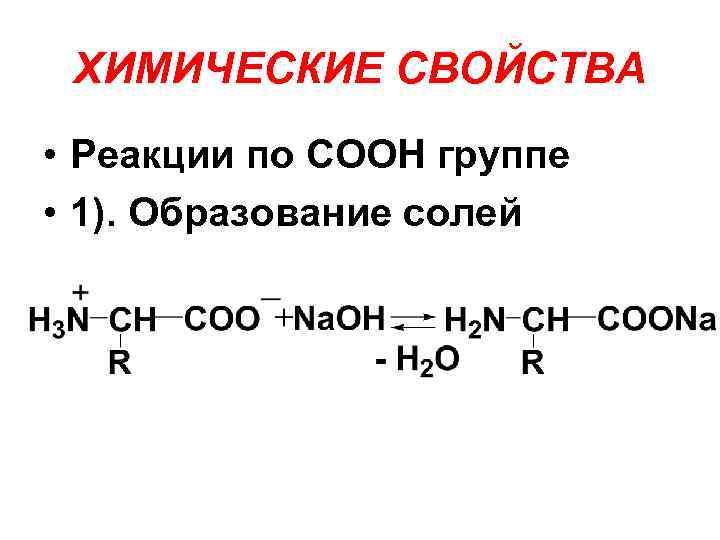
ХИМИЧЕСКИЕ СВОЙСТВА • Реакции по СООН группе • 1). Образование солей
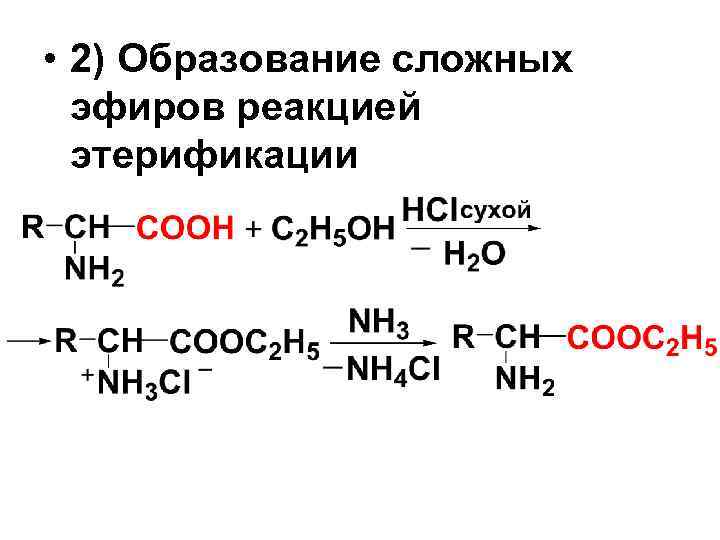
• 2) Образование сложных эфиров реакцией этерификации
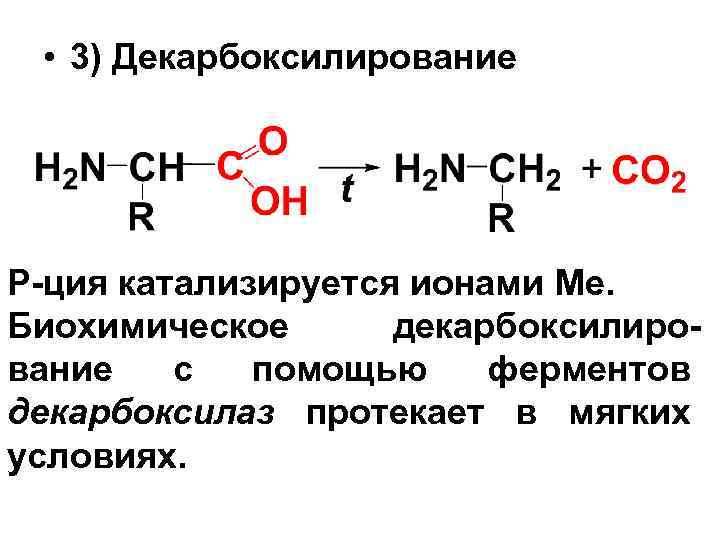
• 3) Декарбоксилирование Р-ция катализируется ионами Ме. Биохимическое декарбоксилирование с помощью ферментов декарбоксилаз протекает в мягких условиях.
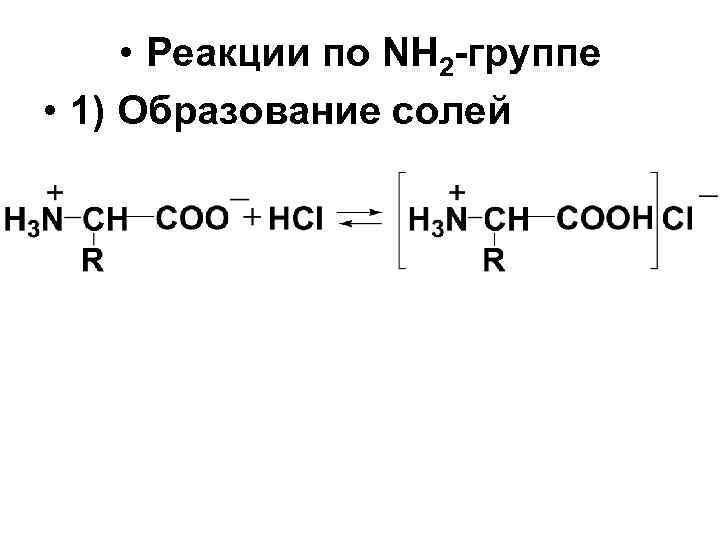
• Реакции по NH 2 -группе • 1) Образование солей
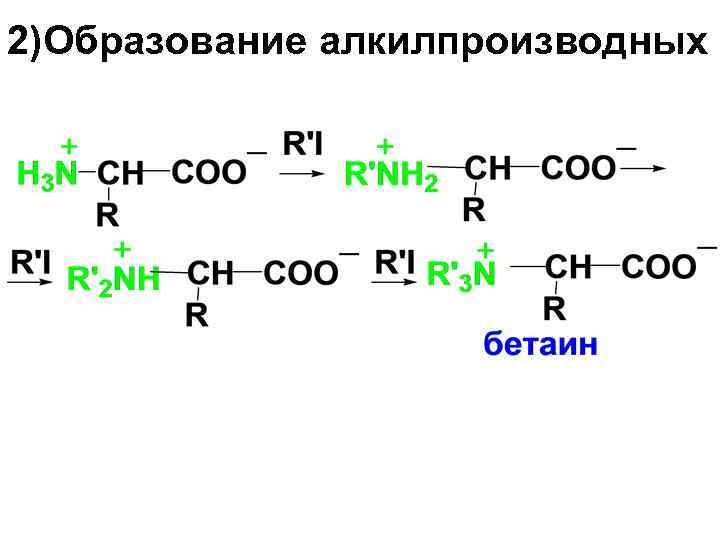
2)Образование алкилпроизводных

• Внутренние соли четвертичных аммонийных солей АК называют бетаинами.
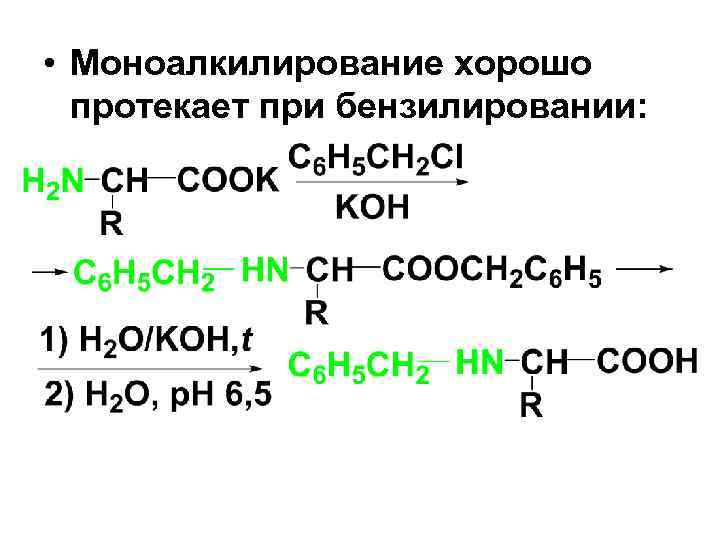
• Моноалкилирование хорошо протекает при бензилировании:

• 3) Арилирование • При действии 2, 4 -динитрофторбензола (реактива Сэнгера) в слабощелочном р-ре образуется замещенный 2, 4 динитроанилин. Р-ция используется для идентификации аминокислотного состава пептидов
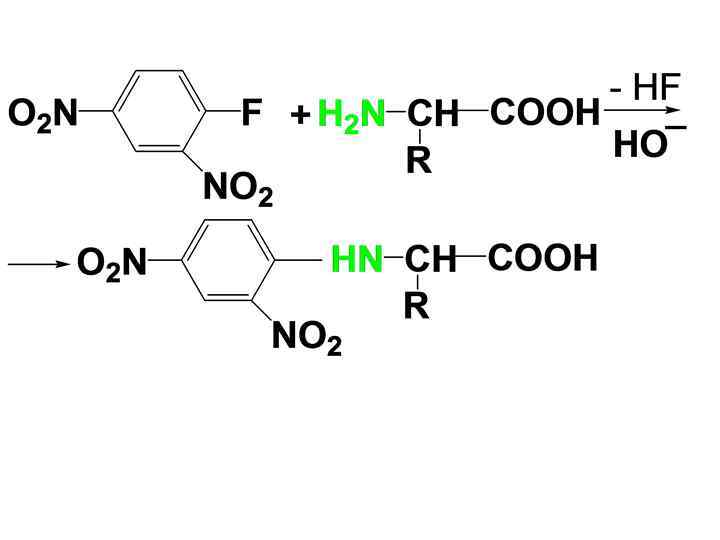

• 4) Образование ацилпроизводных. • N-ацилирование АК осуществляется легко ангидридами и галогенангидридами кислот при комнатной т-ре.
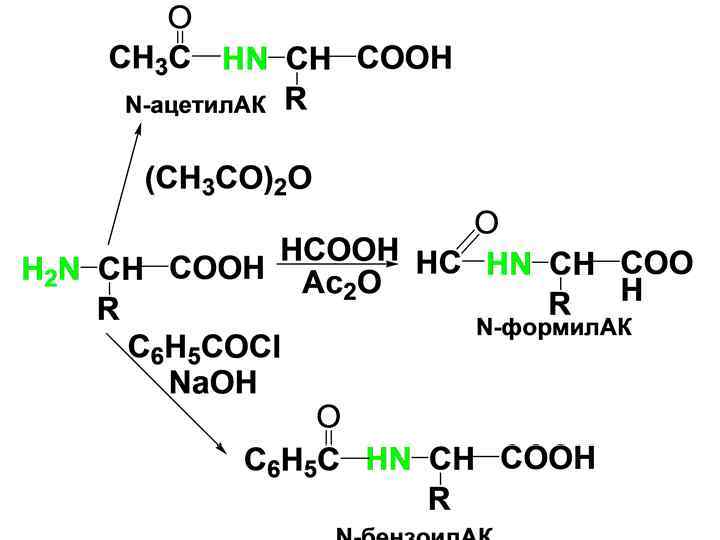

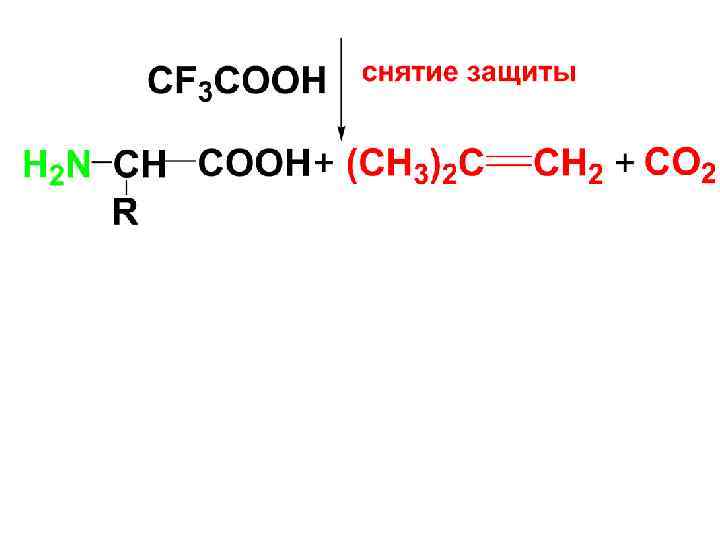
• Реакция ацилирования имеет большое значение при синтезе пептидов для защиты аминогруппы. • Защитные группы должны легко вводиться, быть устойчивыми в условиях синтеза и легко удаляться. Таким требованиям удовлетворяют следующие защиты:
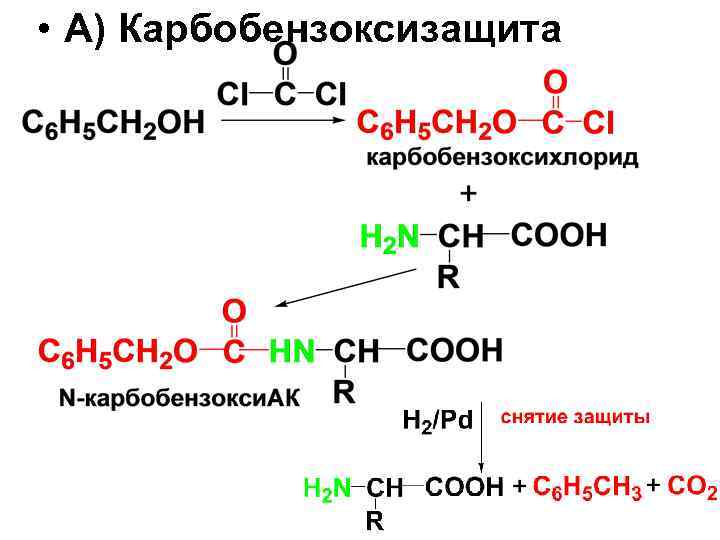
• А) Карбобензоксизащита
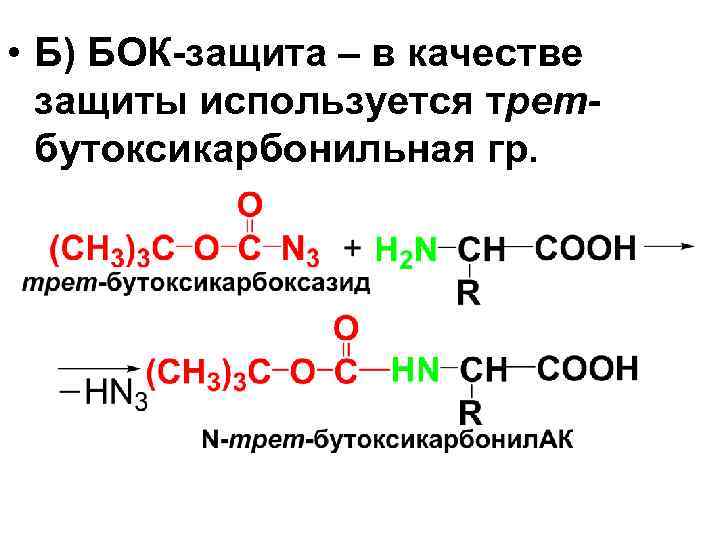
• Б) БОК-защита – в качестве защиты используется третбутоксикарбонильная гр.
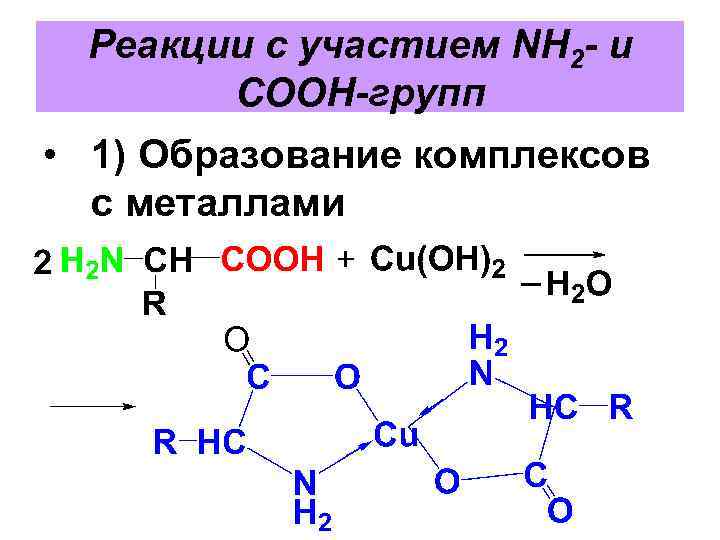
Реакции с участием NH 2 - и COOH-групп • 1) Образование комплексов с металлами
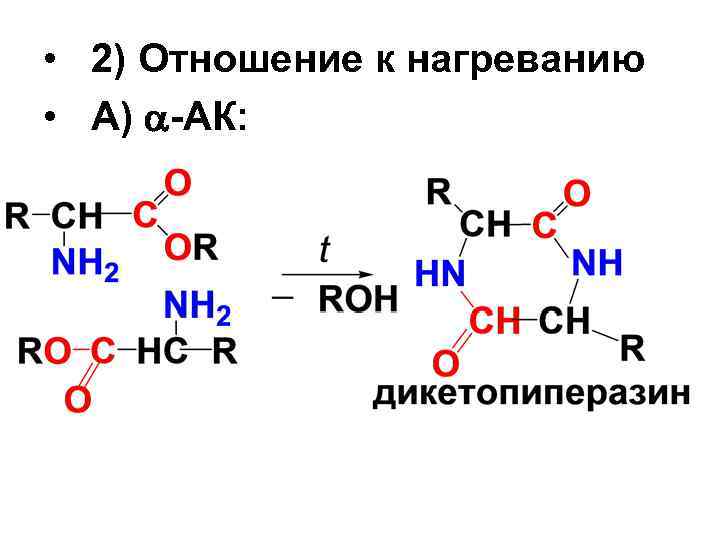
• 2) Отношение к нагреванию • А) -АК:
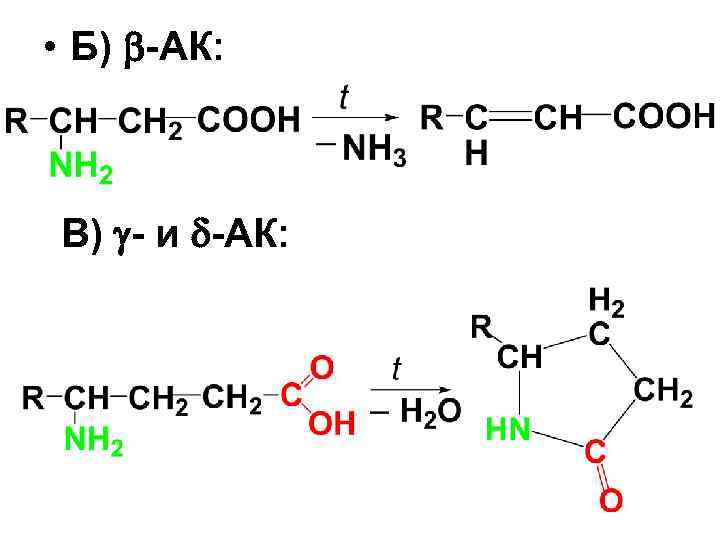
• Б) -АК: В) - и -АК:

Качественные реакции на АК • 1) Нингидриновая р-ция • При окислительном дезаминировании -АК под действием нингидрина (трикетона) происходит окрашивание р-ра АК в характерную синюю окраску. Ее дает продукт конденсации нингидрина с аммиаком.
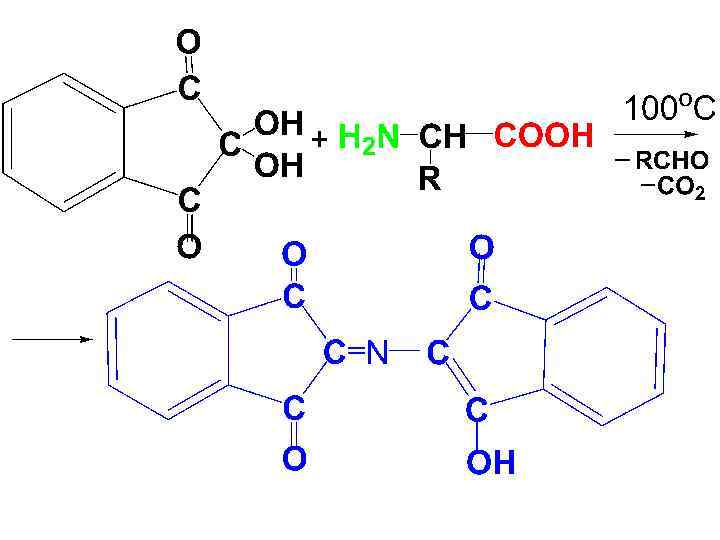

• 2) Ксантопротеиновая р-ция • Дают только ароматические и гетероциклические АК. Под действием конц. HNO 3 при нагревании образуются нитропроизводные, имеющие желтую окраску. В щелочной среде окраска изменяется на оранжевую.
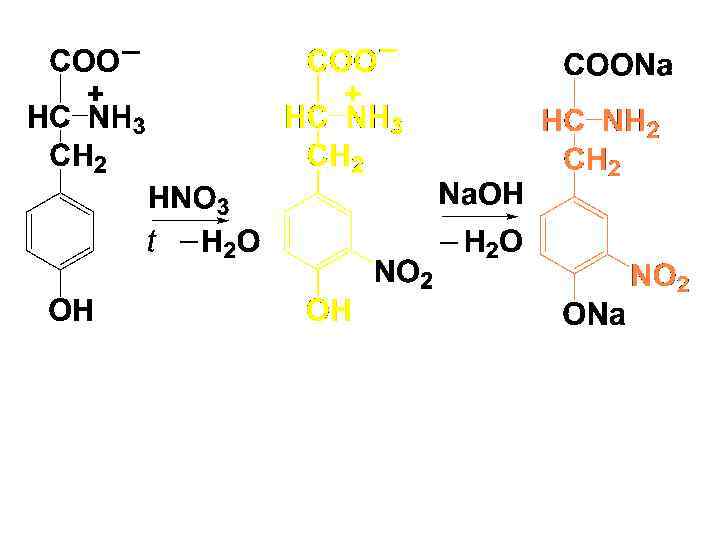

• 3) Реакция Фоля • Эту р-цию дают серосодержащие АК. При действии на такие АК гидроксида натрия при нагревании выделяется сульфид натрия, который затем с ацетатом свинца образует осадок черного цвета.
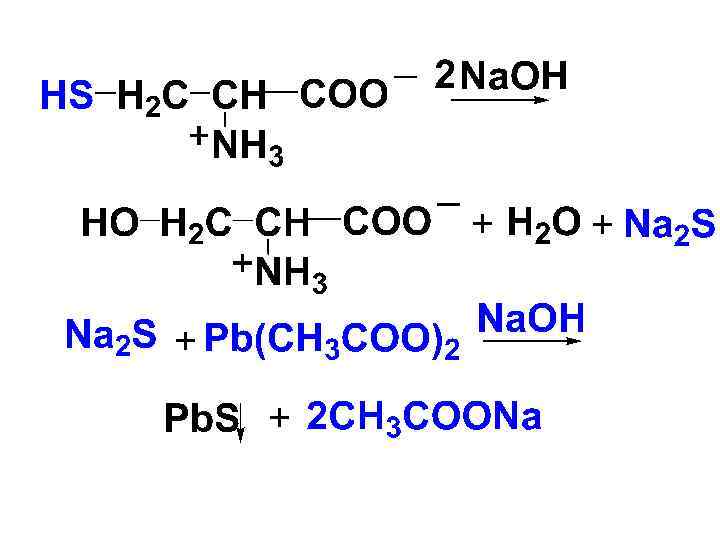

ПЕПТИДЫ, БЕЛКИ • Пептиды и белки широко распространены в природе. Велико их разнообразие, что обусловлено АК-ым составом и строго определенной АК-ой последовательностью. В составе пептидов и белков обнаружено более 100 АК.

• В составе белков только 20 АК, пептиды же имеют более разнообразный состав, причем содержат и АК D-ряда. Более того, пептиды в отличие от белков могут содержать разветвленные цепи, циклические структуры.

СТРОЕНИЕ • 1. Первичная структура • Пептиды и белки построены из остатков -АК, связанных между собой амидной (пептидной) связью. Молекулу пептида или белка можно рассматривать как продукт поликонденсации -АК, протекающей с образованием амидной связи между фрагментами АК.
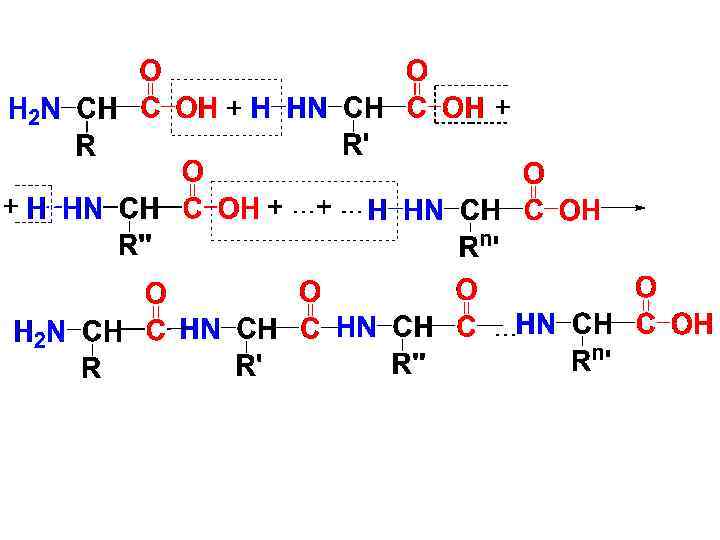

• Пептиды делят на олигопептиды (низкомолекулярные пептиды) с числом АК-ых остатков до 10 и полипептиды, в состав молекул которых входит до 100 АК-ых остатков.

• Полипептидная цепь пептидов и белков имеет неразветвленное строение и состоит из чередующихся амидных и метиновых групп. Конец цепи, на к-ром находится АК со свободной NH 2 -группой, называется N-концом; второй конец, на к-ром находится АК со свободной СООН-гр. – С-концом.
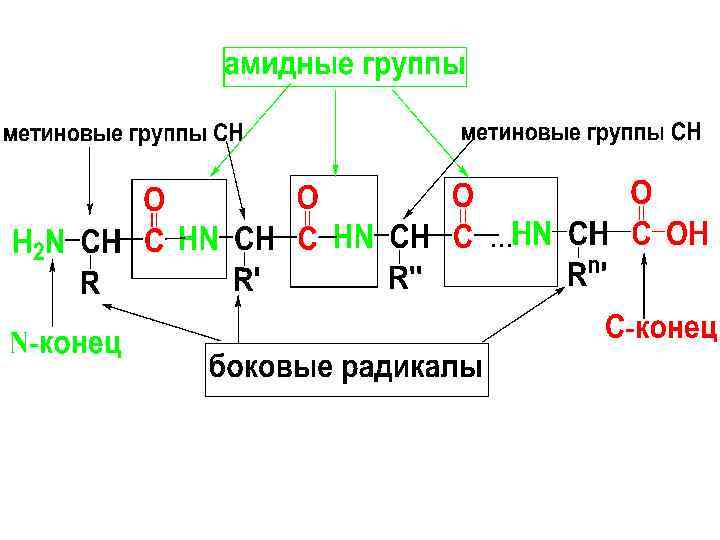

• Строение полипептидной молекулы определяется двумя важными характеристиками – АКым составом и АК-ой последовательностью. • Аминокислотный состав пептидов и белков – это природа и количественное соотношение входящих в них -АК.

• Первичная структура пептидов и белков – это аминокислотная последовательность, т. е. порядок чередования аминокислотных остатков. • Первичная стр-ра определяется путем последовательного отщепления -АК с N- или Сконца и их идентификации

• Полипептидная цепь представляет собой ряд расположенных под углом друг к другу плоскостей пептидных гр. , соединенных между собой через -С-атомы связями С - N и С Сsp 2.
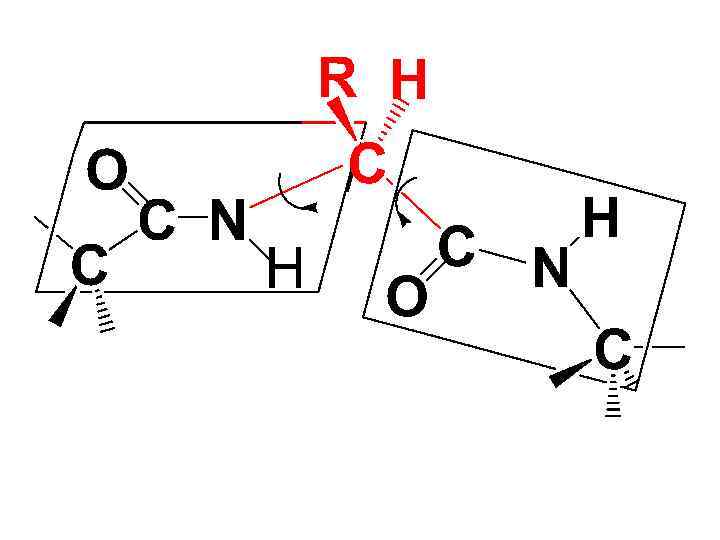

• Вращение вокруг этих связей ограничено из-за наличия объемных боковых радикалов. Таким образом, строение пептидной гр. во многом определяет пространственную структуру полипептидной цепи

• Высокомолекулярные полипептиды и белки обладают весьма сложным пространственным строением. Кроме первичной структуры для них характерны более высокие уровни структурной организации, которые называют вторичной, третичной и четвертичной структурами.

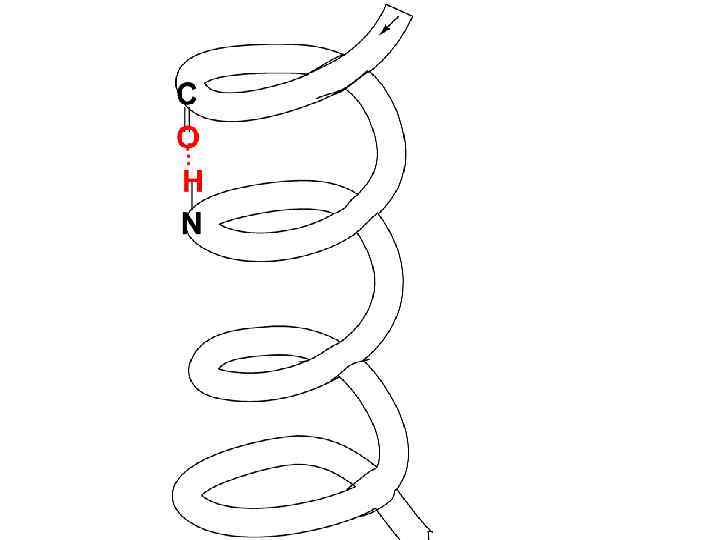
• Вторичная структура описывает пространственное строение одной полипептидной цепи. • Наиболее энергетически устойчивая пространственная структура (конформация) полипептидной цепи – • -спираль (правозакрученная спираль)

• На один виток -спирали приходится 3, 6 АК-ых остатков, шаг спирали составляет 0, 54 нм, диаметр - 0, 5 нм. Один АК-ый остаток занимает 0, 15 нм длины спирали. Плоскости двух соседних пептидных гр. лежат под углом 108 о, боковые R располагаются на наружной стороне спирали.

• Основное значение в закреплении этой пространственной структуры имеют Н-связи, которые направлены практически параллельно оси спирали

• Второй вид вторичной структуры полипептидов – • -структура (структура складчатого листа). Она представляет собой вытянутую зигзагообразную конформацию, которую образуют вытянутые параллельные полипептидные цепи, закрепленные Н-связями между пептидными гр.
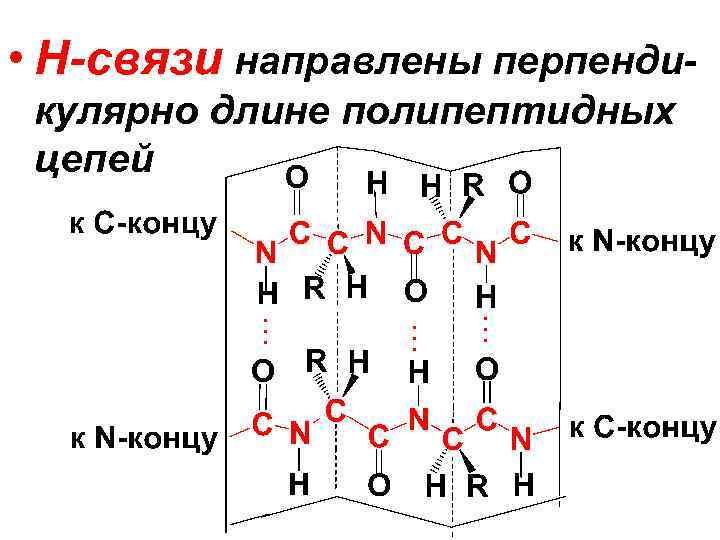
• Н-связи направлены перпендикулярно длине полипептидных цепей

• Третичная структура – формируется в результате укладки в пространстве отдельных или нескольких полипептидных цепей вторичной структуры.

• В стабилизации третичной структуры принимают участие боковые радикалы АК-ых остатков, различные по хим. природе (алифатические, ароматические, гетероциклические), содержащие свободные –СООН, амино-гр. , спиртовые и фенольные ОН, тиольные и амидные группы

• Значительную роль в закреплении третичной структуры играют Н-связи, которые могут образовываться между функциональными группами боковых радикалов и между ними и пептидными связями.
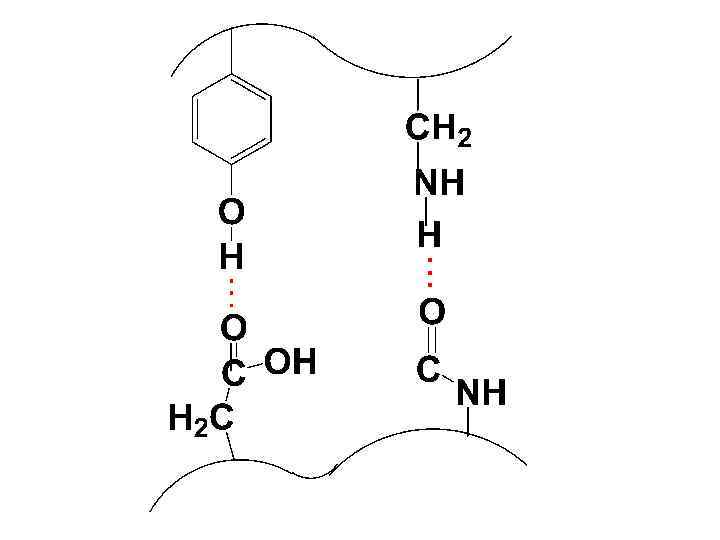
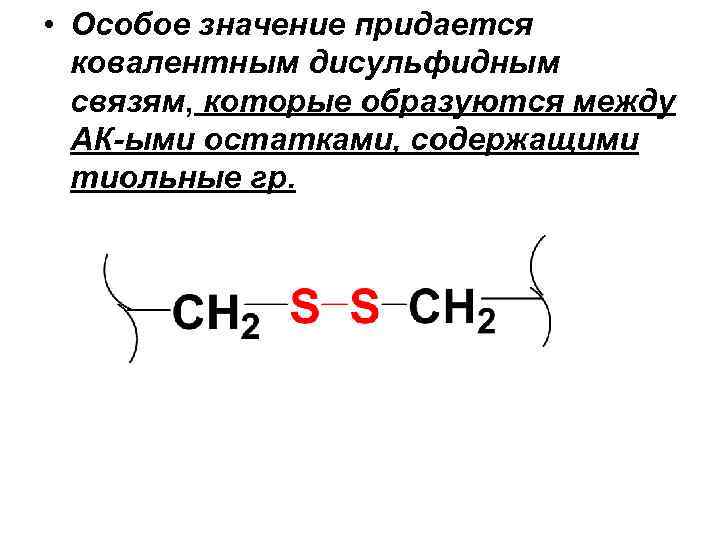
• Особое значение придается ковалентным дисульфидным связям, которые образуются между АК-ыми остатками, содержащими тиольные гр.

• По типу упаковки различают глобулярные и фибриллярные белки. • Глобулярные белки – спиральные полипептидные цепи свернуты причудливым образом – чаще всего образуется сферическая форма (глобула).

• Это рыхлая структура. Такую структуру имеют белки, выполняющие роль катализаторов, регуляторов (напр. миоглобин, гемоглобин).

• Фибриллярные белки – полипептидные цепи упаковываются плотно между собой, располагаясь рядом образуют нитевидные структуры (фибриллы). Такую структуру имеют белки, являющиеся строительным материалом ногтей, кожи, волос (кератин, коллаген).

• Четвертичная структура – формируется при объединении нескольких частиц с третичной структурой в одну более крупную частицу. Образующийся ассоциат существует как единое целое и его распад, как правило, обуславливает изменение биологической активности белка.

• Четвертичной структурой обладает большинство ферментов, имунные белки и др. • Первые три уровня структурной организации обязательны для всех белковых молекул. • Наличие четвертичной структуры не является обязательным для всех белков.

Свойства белков и пептидов • Гидролиз • Поскольку белки являются полипептидами, содержат амидную связь, то они способны гидролизоваться. Гидролиз может быть 3 типов: кислотный, щелочной, ферментативный.
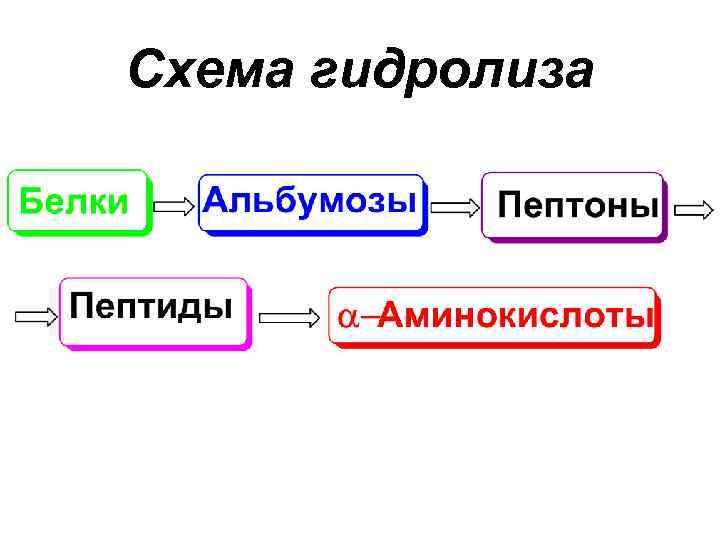
Схема гидролиза

Денатурация • - изменение пространственной конфигурации белковой молекулы (вторичной, третичной , четвертичной структуры белка) под д-ем разл. физических и хим. факторов. Как правило, она сопровождается потерей биологической активности.
аминоК,белки.ppt