Аминокислоты 10 класс.ppt
- Количество слайдов: 41
 Аминокислоты 10 класс метионин
Аминокислоты 10 класс метионин
 Цели урока Ознакомить учащихся с новым классом органических гетерофункциональных веществ – аминокислотами Рассмотреть их свойства, получение и применение Рассмотреть реакции поликонденсации Ввести понятие пептидов, полипептидов, пептидной связи
Цели урока Ознакомить учащихся с новым классом органических гетерофункциональных веществ – аминокислотами Рассмотреть их свойства, получение и применение Рассмотреть реакции поликонденсации Ввести понятие пептидов, полипептидов, пептидной связи
 Ответьте на вопросы Назовите основное химическое свойство аминов. Чем оно обусловлено? В чем проявляется взаимное влияние атомов в молекуле анилина? Сравните основные свойства аммиака, алифатических аминов и анилина Назовите основные области применения анилина и аминов
Ответьте на вопросы Назовите основное химическое свойство аминов. Чем оно обусловлено? В чем проявляется взаимное влияние атомов в молекуле анилина? Сравните основные свойства аммиака, алифатических аминов и анилина Назовите основные области применения анилина и аминов
 Первое знакомство с аминокислотами 1820 г. – Анри Браконно, опыты с веществами животного происхождения, нагревание кожи, хрящей, сухожилий с серной кислотой, получение белых кристаллов сладкого вкуса – гликоколл - глицин Какая реакция могла при этом протекать? Гликоколл считался «родственником» углеводов 1838 г. – Г. Мульдер обнаружил в его составе азот 1844 г. – Э. Хорсфорд установил формулу вещества – С 2 Н 5 О 2 N
Первое знакомство с аминокислотами 1820 г. – Анри Браконно, опыты с веществами животного происхождения, нагревание кожи, хрящей, сухожилий с серной кислотой, получение белых кристаллов сладкого вкуса – гликоколл - глицин Какая реакция могла при этом протекать? Гликоколл считался «родственником» углеводов 1838 г. – Г. Мульдер обнаружил в его составе азот 1844 г. – Э. Хорсфорд установил формулу вещества – С 2 Н 5 О 2 N
 БРАКОННО Анри 29 мая 1780 г. – 13 января 1855 г. Французский химик, член-корреспондент Парижской АН (с 1823). Родился в Коммантри. Учился в Страсбургском и Парижском университетах. Работал аптекарем в Страсбурге, с 1807 г. директор Ботанического сада в Париже, затем профессор университета в Нанси. Основные исследования относятся к области химии природных соединений. Изучал (1808) гуммигут – сгущённый млечный сок, получаемый при надсечке коры некоторых видов семейства зверобойных. Совместно с М. Э. Шеврёлем установил (1817), что большинство жиров состоит из твёрдой (стеарин) и маслообразной жидкой (олеин) частей. • Получил (1819) виноградный сахар (глюкозу) гидролизом целлюлозы. Выделил (1820) аминокислоты лейцин и глицин. При сухой перегонке яблочной кислоты получил (1818) "пирояблочную кислоту" (смесь малеиновой и фумаровой кислот). Синтезировал (1833) тринитроцеллюлозу.
БРАКОННО Анри 29 мая 1780 г. – 13 января 1855 г. Французский химик, член-корреспондент Парижской АН (с 1823). Родился в Коммантри. Учился в Страсбургском и Парижском университетах. Работал аптекарем в Страсбурге, с 1807 г. директор Ботанического сада в Париже, затем профессор университета в Нанси. Основные исследования относятся к области химии природных соединений. Изучал (1808) гуммигут – сгущённый млечный сок, получаемый при надсечке коры некоторых видов семейства зверобойных. Совместно с М. Э. Шеврёлем установил (1817), что большинство жиров состоит из твёрдой (стеарин) и маслообразной жидкой (олеин) частей. • Получил (1819) виноградный сахар (глюкозу) гидролизом целлюлозы. Выделил (1820) аминокислоты лейцин и глицин. При сухой перегонке яблочной кислоты получил (1818) "пирояблочную кислоту" (смесь малеиновой и фумаровой кислот). Синтезировал (1833) тринитроцеллюлозу.
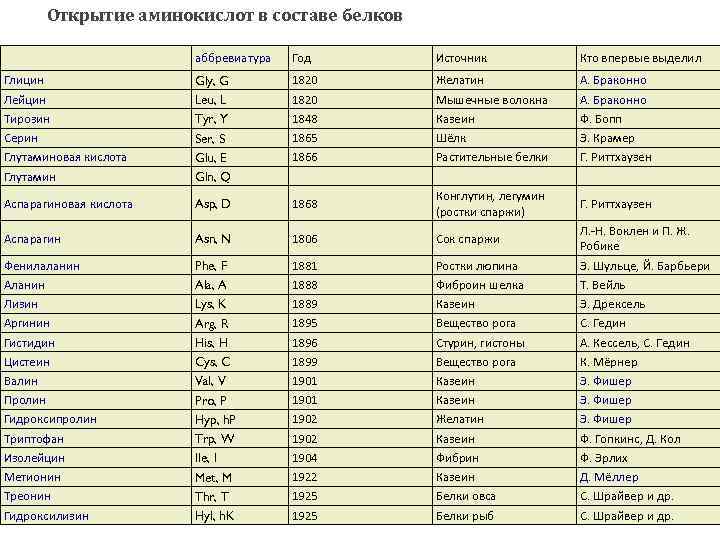 Открытие аминокислот в составе белков аббревиатура Год Источник Кто впервые выделил Глицин Лейцин Тирозин Серин Глутаминовая кислота Глутамин Gly, G Leu, L Tyr, Y Ser, S Glu, E Gln, Q 1820 1848 1865 1866 Желатин Мышечные волокна Казеин Шёлк Растительные белки А. Браконно Ф. Бопп Э. Крамер Г. Риттхаузен Аспарагиновая кислота Asp, D 1868 Конглутин, легумин (ростки спаржи) Г. Риттхаузен Аспарагин Asn, N 1806 Сок спаржи Фенилаланин Аланин Лизин Аргинин Гистидин Цистеин Валин Пролин Гидроксипролин Триптофан Изолейцин Метионин Треонин Гидроксилизин Phe, F Ala, A Lys, K Arg, R His, H Cys, C Val, V Pro, P Hyp, h. P Trp, W Ile, I Met, M Thr, T Hyl, h. K 1881 1888 1889 1895 1896 1899 1901 1902 1904 1922 1925 Ростки люпина Фиброин шелка Казеин Вещество рога Стурин, гистоны Вещество рога Казеин Желатин Казеин Фибрин Казеин Белки овса Белки рыб Л. -Н. Воклен и П. Ж. Робике Э. Шульце, Й. Барбьери Т. Вейль Э. Дрексель С. Гедин А. Кессель, С. Гедин К. Мёрнер Э. Фишер Ф. Гопкинс, Д. Кол Ф. Эрлих Д. Мёллер С. Шрайвер и др.
Открытие аминокислот в составе белков аббревиатура Год Источник Кто впервые выделил Глицин Лейцин Тирозин Серин Глутаминовая кислота Глутамин Gly, G Leu, L Tyr, Y Ser, S Glu, E Gln, Q 1820 1848 1865 1866 Желатин Мышечные волокна Казеин Шёлк Растительные белки А. Браконно Ф. Бопп Э. Крамер Г. Риттхаузен Аспарагиновая кислота Asp, D 1868 Конглутин, легумин (ростки спаржи) Г. Риттхаузен Аспарагин Asn, N 1806 Сок спаржи Фенилаланин Аланин Лизин Аргинин Гистидин Цистеин Валин Пролин Гидроксипролин Триптофан Изолейцин Метионин Треонин Гидроксилизин Phe, F Ala, A Lys, K Arg, R His, H Cys, C Val, V Pro, P Hyp, h. P Trp, W Ile, I Met, M Thr, T Hyl, h. K 1881 1888 1889 1895 1896 1899 1901 1902 1904 1922 1925 Ростки люпина Фиброин шелка Казеин Вещество рога Стурин, гистоны Вещество рога Казеин Желатин Казеин Фибрин Казеин Белки овса Белки рыб Л. -Н. Воклен и П. Ж. Робике Э. Шульце, Й. Барбьери Т. Вейль Э. Дрексель С. Гедин А. Кессель, С. Гедин К. Мёрнер Э. Фишер Ф. Гопкинс, Д. Кол Ф. Эрлих Д. Мёллер С. Шрайвер и др.
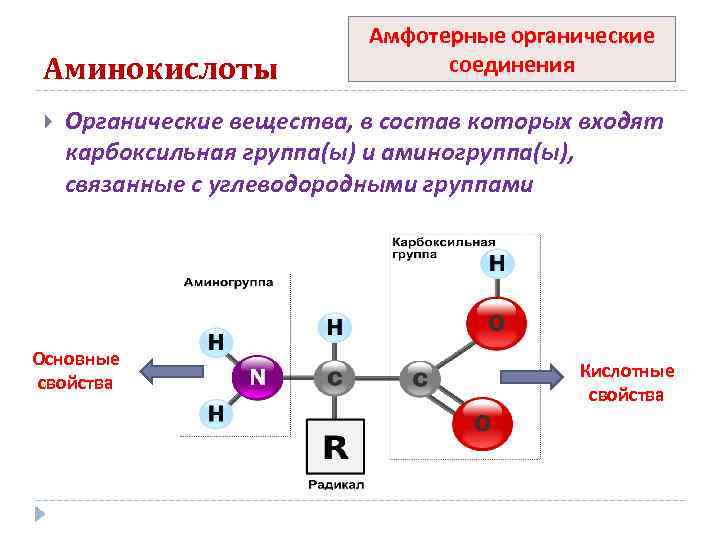 Аминокислоты Амфотерные органические соединения Органические вещества, в состав которых входят карбоксильная группа(ы) и аминогруппа(ы), связанные с углеводородными группами Основные свойства Кислотные свойства
Аминокислоты Амфотерные органические соединения Органические вещества, в состав которых входят карбоксильная группа(ы) и аминогруппа(ы), связанные с углеводородными группами Основные свойства Кислотные свойства
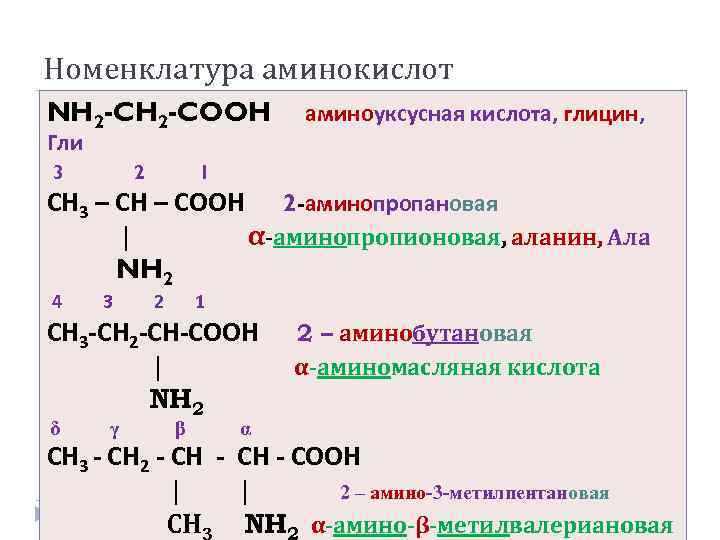 Номенклатура аминокислот NH 2 -COOH аминоуксусная кислота, глицин, Гли 3 2 1 СН 3 – СН – СООН 2 -аминопропановая | α-аминопропионовая, аланин, Ала NH 2 4 3 2 1 СН 3 -СН 2 -СН-СООН 2 – аминобутановая | α-аминомасляная кислота NH 2 δ γ β α СН 3 - СН 2 - СН - СООН | 2 – амино-3 -метилпентановая СН NH α-амино-β-метилвалериановая
Номенклатура аминокислот NH 2 -COOH аминоуксусная кислота, глицин, Гли 3 2 1 СН 3 – СН – СООН 2 -аминопропановая | α-аминопропионовая, аланин, Ала NH 2 4 3 2 1 СН 3 -СН 2 -СН-СООН 2 – аминобутановая | α-аминомасляная кислота NH 2 δ γ β α СН 3 - СН 2 - СН - СООН | 2 – амино-3 -метилпентановая СН NH α-амино-β-метилвалериановая
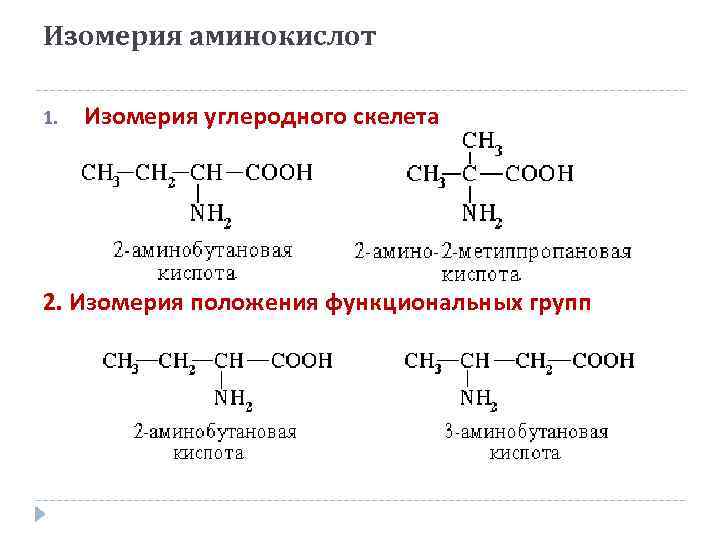 Изомерия аминокислот 1. Изомерия углеродного скелета 2. Изомерия положения функциональных групп
Изомерия аминокислот 1. Изомерия углеродного скелета 2. Изомерия положения функциональных групп
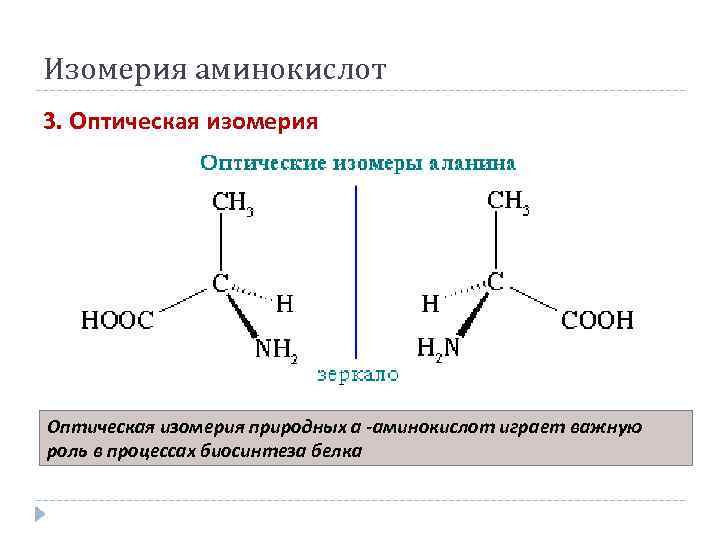 Изомерия аминокислот 3. Оптическая изомерия природных a -аминокислот играет важную роль в процессах биосинтеза белка
Изомерия аминокислот 3. Оптическая изомерия природных a -аминокислот играет важную роль в процессах биосинтеза белка
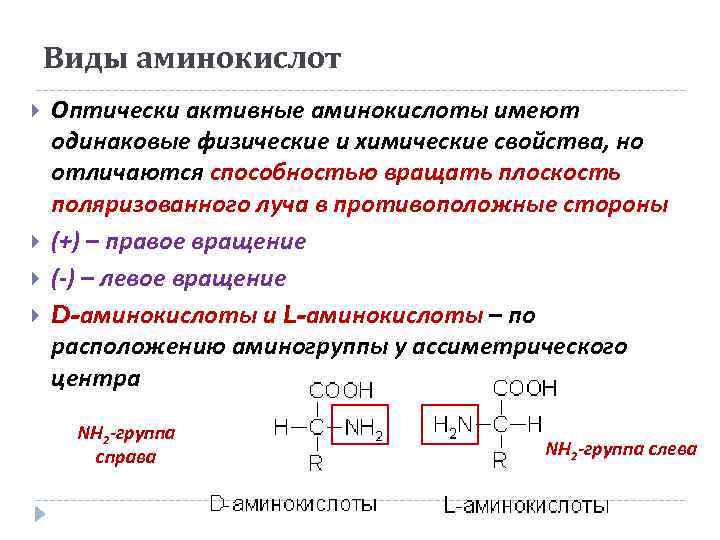 Виды аминокислот Оптически активные аминокислоты имеют одинаковые физические и химические свойства, но отличаются способностью вращать плоскость поляризованного луча в противоположные стороны (+) – правое вращение (-) – левое вращение D-аминокислоты и L-аминокислоты – по расположению аминогруппы у ассиметрического центра NH 2 -группа справа NH 2 -группа слева
Виды аминокислот Оптически активные аминокислоты имеют одинаковые физические и химические свойства, но отличаются способностью вращать плоскость поляризованного луча в противоположные стороны (+) – правое вращение (-) – левое вращение D-аминокислоты и L-аминокислоты – по расположению аминогруппы у ассиметрического центра NH 2 -группа справа NH 2 -группа слева
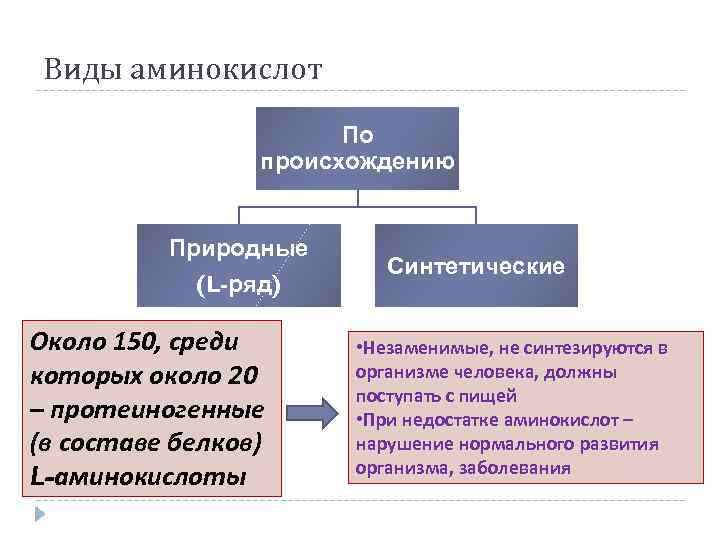 Виды аминокислот По происхождению Природные (L-ряд) Около 150, среди которых около 20 – протеиногенные (в составе белков) L-аминокислоты Синтетические • Незаменимые, не синтезируются в организме человека, должны поступать с пищей • При недостатке аминокислот – нарушение нормального развития организма, заболевания
Виды аминокислот По происхождению Природные (L-ряд) Около 150, среди которых около 20 – протеиногенные (в составе белков) L-аминокислоты Синтетические • Незаменимые, не синтезируются в организме человека, должны поступать с пищей • При недостатке аминокислот – нарушение нормального развития организма, заболевания
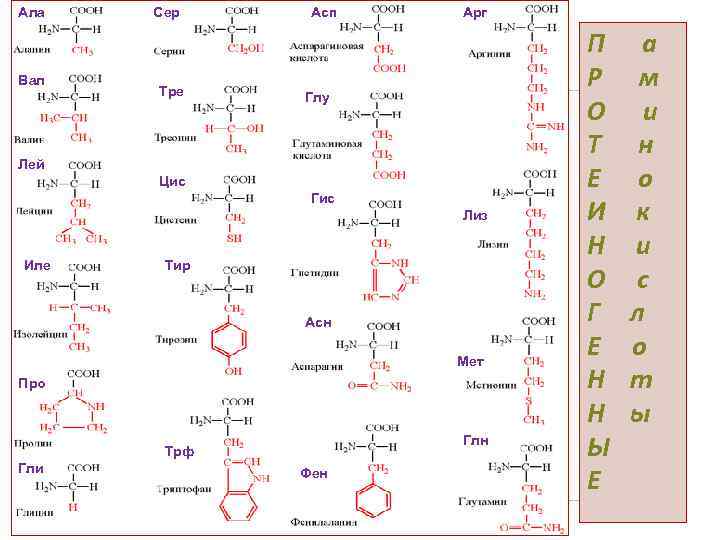 Ала Вал Сер Тре Асп Арг Глу Лей Цис Гис Лиз Иле Тир Асн Мет Про Глн Трф Гли Фен П а Р м О и Т н Е о И к Н и О с Г л Е о Н т Н ы Ы Е
Ала Вал Сер Тре Асп Арг Глу Лей Цис Гис Лиз Иле Тир Асн Мет Про Глн Трф Гли Фен П а Р м О и Т н Е о И к Н и О с Г л Е о Н т Н ы Ы Е
 Получение аминокислот Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах: P (кр. ) 1. R – CH 2 – COOH + Cl 2 → R – CHCl – COOH + HCl 2. Присоединение аммиака к α, β-непредельным кислотам с образованием β-аминокислот: CH 2=CH–COOH + NH 3 H 2 N–CH 2–COOH
Получение аминокислот Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах: P (кр. ) 1. R – CH 2 – COOH + Cl 2 → R – CHCl – COOH + HCl 2. Присоединение аммиака к α, β-непредельным кислотам с образованием β-аминокислот: CH 2=CH–COOH + NH 3 H 2 N–CH 2–COOH
 Получение аминокислот 3. α-Аминокислоты образуются при гидролизе пептидов и белков 4. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот): O 2 N-C 6 H 4 -COOH + 3 H 2 H 2 N-C 6 H 4 -COOH + 2 H 2 O
Получение аминокислот 3. α-Аминокислоты образуются при гидролизе пептидов и белков 4. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот): O 2 N-C 6 H 4 -COOH + 3 H 2 H 2 N-C 6 H 4 -COOH + 2 H 2 O
 Получение аминокислот 5. Биотехнологический способ получения чистых αаминокислот в виде индивидуальных оптических изомеров • Этот способ основан на способности специальных микроорганизмов вырабатывать в питательной среде определенную аминокислоту • Получают чистый продукт, индивидуальный оптический изомер (лизин, метионин – кормовые добавки)
Получение аминокислот 5. Биотехнологический способ получения чистых αаминокислот в виде индивидуальных оптических изомеров • Этот способ основан на способности специальных микроорганизмов вырабатывать в питательной среде определенную аминокислоту • Получают чистый продукт, индивидуальный оптический изомер (лизин, метионин – кормовые добавки)
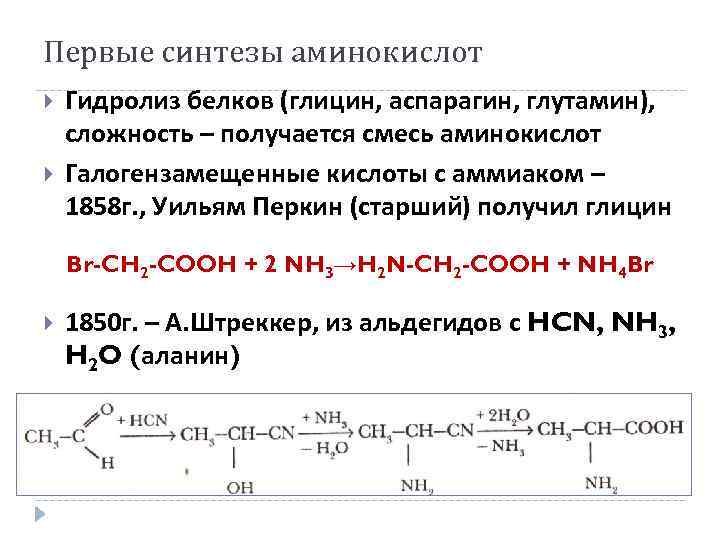 Первые синтезы аминокислот Гидролиз белков (глицин, аспарагин, глутамин), сложность – получается смесь аминокислот Галогензамещенные кислоты с аммиаком – 1858 г. , Уильям Перкин (старший) получил глицин Br-CH 2 -COOH + 2 NH 3→H 2 N-CH 2 -COOH + NH 4 Br 1850 г. – А. Штреккер, из альдегидов с HCN, NH 3, H 2 O (аланин)
Первые синтезы аминокислот Гидролиз белков (глицин, аспарагин, глутамин), сложность – получается смесь аминокислот Галогензамещенные кислоты с аммиаком – 1858 г. , Уильям Перкин (старший) получил глицин Br-CH 2 -COOH + 2 NH 3→H 2 N-CH 2 -COOH + NH 4 Br 1850 г. – А. Штреккер, из альдегидов с HCN, NH 3, H 2 O (аланин)
 Физические свойства • • • Твердые кристаллические вещества с высокой Тпл. При плавлении разлагаются. Имеют сладкий, горький вкус или безвкусны Хорошо растворимы в воде Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Физические свойства • • • Твердые кристаллические вещества с высокой Тпл. При плавлении разлагаются. Имеют сладкий, горький вкус или безвкусны Хорошо растворимы в воде Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
 Химические свойства • • Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т. е. являются амфотерными соединениями. Как основания подобно аминам, они реагируют с кислотами с образованием солей аммония и растворяются в воде: H 2 N–CH 2–COOH + HCl → [H 3 N–CH 2–COOH]+Cl- хлорид аминоуксусной кислоты С азотистой кислотой NH 2–CH 2 – COOH + HNO 2→ HO-CH 2 -COOH + N 2↑ + H 2 O •
Химические свойства • • Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т. е. являются амфотерными соединениями. Как основания подобно аминам, они реагируют с кислотами с образованием солей аммония и растворяются в воде: H 2 N–CH 2–COOH + HCl → [H 3 N–CH 2–COOH]+Cl- хлорид аминоуксусной кислоты С азотистой кислотой NH 2–CH 2 – COOH + HNO 2→ HO-CH 2 -COOH + N 2↑ + H 2 O •
 Как карбоновые кислоты Взаимодействуют с металлами, оксидами металлов, щелочами, солями летучих кислот H 2 N–CH 2–COOH + Na. OH → H 2 N–CH 2–COO- Na+ аминоацетат натрия + H 2 O Взаимодействуют со спиртами (реакция этерификации) этиловый эфир аминоуксусной кислоты, этиламиноацетат
Как карбоновые кислоты Взаимодействуют с металлами, оксидами металлов, щелочами, солями летучих кислот H 2 N–CH 2–COOH + Na. OH → H 2 N–CH 2–COO- Na+ аминоацетат натрия + H 2 O Взаимодействуют со спиртами (реакция этерификации) этиловый эфир аминоуксусной кислоты, этиламиноацетат
 Образование внутренней соли Внутримолекулярное взаимодействие Практическое значение имеет внутримолекулярное взаимодействие функциональных групп e-аминокапроновой кислоты, в результате которого образуется e-капролактам (полупродукт для получения капрона): ε δ γ β α для получения искусственного волокна капрон Амидная связь
Образование внутренней соли Внутримолекулярное взаимодействие Практическое значение имеет внутримолекулярное взаимодействие функциональных групп e-аминокапроновой кислоты, в результате которого образуется e-капролактам (полупродукт для получения капрона): ε δ γ β α для получения искусственного волокна капрон Амидная связь
 Ионизация молекул зависит от характера среды В живых организмах аминокислоты играют роль буферных веществ, поддерживающих постоянную концентрацию ионов водорода (кислотность среды, близкую к нейтральной)
Ионизация молекул зависит от характера среды В живых организмах аминокислоты играют роль буферных веществ, поддерживающих постоянную концентрацию ионов водорода (кислотность среды, близкую к нейтральной)
 Межмолекулярные взаимодействия αаминокислот Приводит к образованию полипептидов (белков). При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярные взаимодействия αаминокислот Приводит к образованию полипептидов (белков). При взаимодействии двух α-аминокислот образуется дипептид.
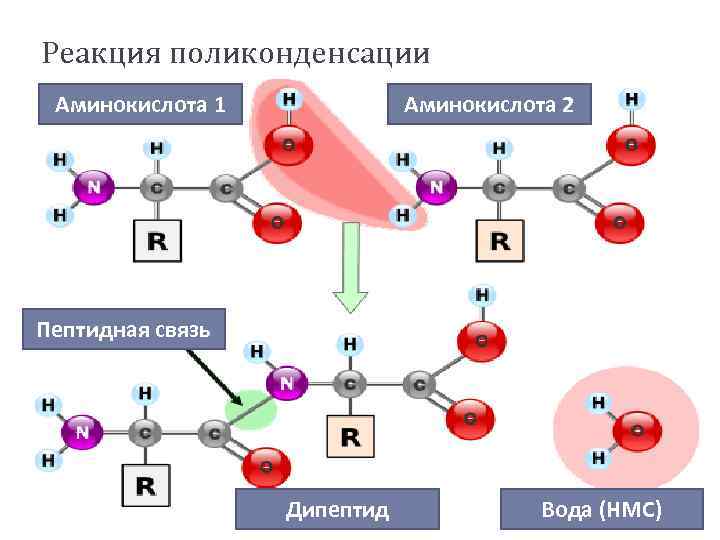 Реакция поликонденсации Аминокислота 1 Аминокислота 2 Пептидная связь Дипептид Вода (НМС)
Реакция поликонденсации Аминокислота 1 Аминокислота 2 Пептидная связь Дипептид Вода (НМС)
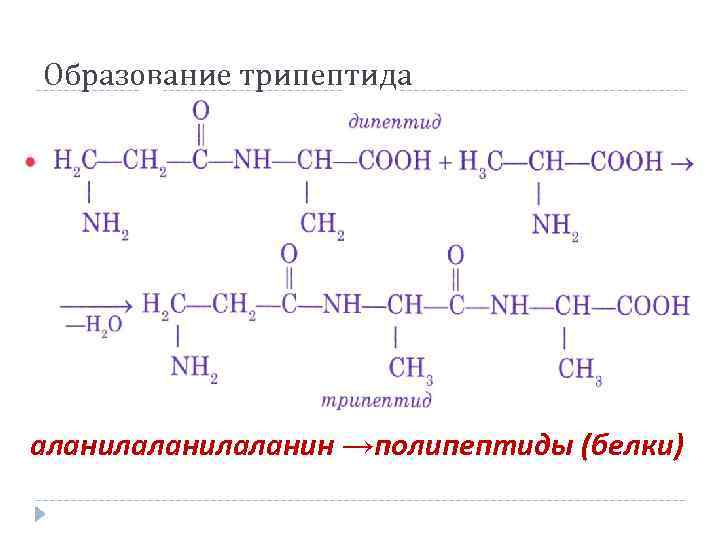 Образование трипептида аланилаланин →полипептиды (белки)
Образование трипептида аланилаланин →полипептиды (белки)
 Специфические свойства аминокислот - нагревание
Специфические свойства аминокислот - нагревание
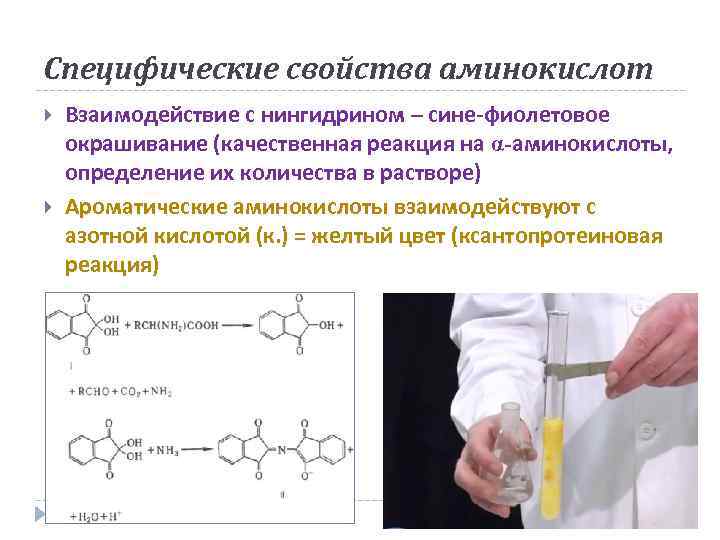 Специфические свойства аминокислот Взаимодействие с нингидрином – сине-фиолетовое окрашивание (качественная реакция на α-аминокислоты, определение их количества в растворе) Ароматические аминокислоты взаимодействуют с азотной кислотой (к. ) = желтый цвет (ксантопротеиновая реакция)
Специфические свойства аминокислот Взаимодействие с нингидрином – сине-фиолетовое окрашивание (качественная реакция на α-аминокислоты, определение их количества в растворе) Ароматические аминокислоты взаимодействуют с азотной кислотой (к. ) = желтый цвет (ксантопротеиновая реакция)
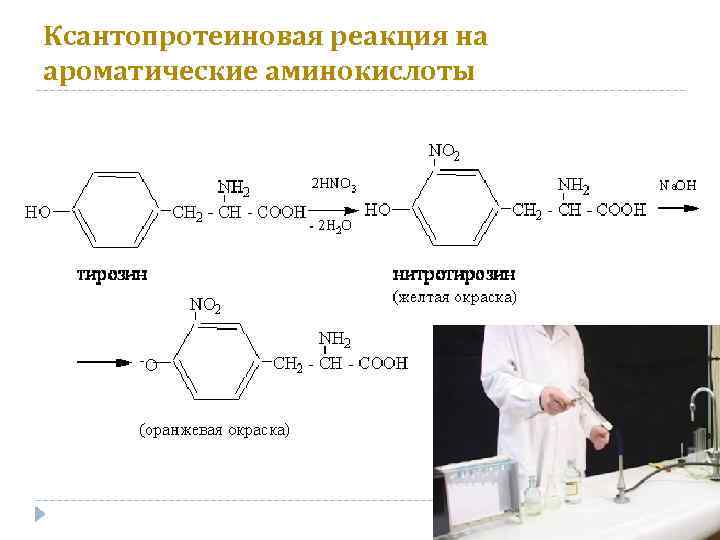 Ксантопротеиновая реакция на ароматические аминокислоты
Ксантопротеиновая реакция на ароматические аминокислоты
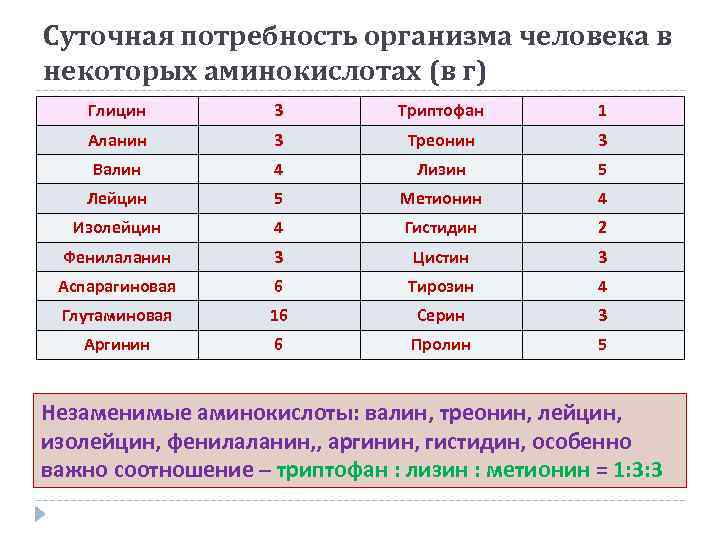 Суточная потребность организма человека в некоторых аминокислотах (в г) Глицин 3 Триптофан 1 Аланин 3 Треонин 3 Валин 4 Лизин 5 Лейцин 5 Метионин 4 Изолейцин 4 Гистидин 2 Фенилаланин 3 Цистин 3 Аспарагиновая 6 Тирозин 4 Глутаминовая 16 Серин 3 Аргинин 6 Пролин 5 Незаменимые аминокислоты: валин, треонин, лейцин, изолейцин, фенилаланин, , аргинин, гистидин, особенно важно соотношение – триптофан : лизин : метионин = 1: 3: 3 триптофан : лизин : метионин
Суточная потребность организма человека в некоторых аминокислотах (в г) Глицин 3 Триптофан 1 Аланин 3 Треонин 3 Валин 4 Лизин 5 Лейцин 5 Метионин 4 Изолейцин 4 Гистидин 2 Фенилаланин 3 Цистин 3 Аспарагиновая 6 Тирозин 4 Глутаминовая 16 Серин 3 Аргинин 6 Пролин 5 Незаменимые аминокислоты: валин, треонин, лейцин, изолейцин, фенилаланин, , аргинин, гистидин, особенно важно соотношение – триптофан : лизин : метионин = 1: 3: 3 триптофан : лизин : метионин
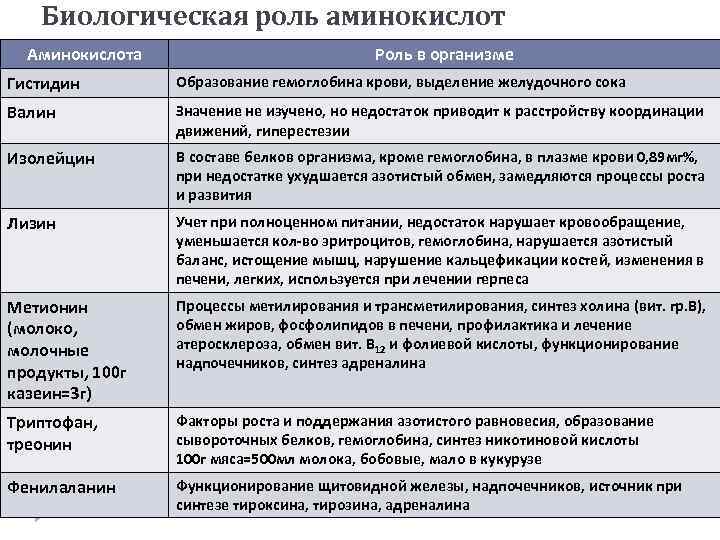 Биологическая роль аминокислот Аминокислота Роль в организме Гистидин Образование гемоглобина крови, выделение желудочного сока Валин Значение не изучено, но недостаток приводит к расстройству координации движений, гиперестезии Изолейцин В составе белков организма, кроме гемоглобина, в плазме крови 0, 89 мг%, при недостатке ухудшается азотистый обмен, замедляются процессы роста и развития Лизин Учет при полноценном питании, недостаток нарушает кровообращение, уменьшается кол-во эритроцитов, гемоглобина, нарушается азотистый баланс, истощение мышц, нарушение кальцефикации костей, изменения в печени, легких, используется при лечении герпеса Метионин (молоко, молочные продукты, 100 г казеин=3 г) Процессы метилирования и трансметилирования, синтез холина (вит. гр. В), обмен жиров, фосфолипидов в печени, профилактика и лечение атеросклероза, обмен вит. В 12 и фолиевой кислоты, функционирование надпочечников, синтез адреналина Триптофан, треонин Факторы роста и поддержания азотистого равновесия, образование сывороточных белков, гемоглобина, синтез никотиновой кислоты 100 г мяса=500 мл молока, бобовые, мало в кукурузе Фенилаланин Функционирование щитовидной железы, надпочечников, источник при синтезе тироксина, тирозина, адреналина
Биологическая роль аминокислот Аминокислота Роль в организме Гистидин Образование гемоглобина крови, выделение желудочного сока Валин Значение не изучено, но недостаток приводит к расстройству координации движений, гиперестезии Изолейцин В составе белков организма, кроме гемоглобина, в плазме крови 0, 89 мг%, при недостатке ухудшается азотистый обмен, замедляются процессы роста и развития Лизин Учет при полноценном питании, недостаток нарушает кровообращение, уменьшается кол-во эритроцитов, гемоглобина, нарушается азотистый баланс, истощение мышц, нарушение кальцефикации костей, изменения в печени, легких, используется при лечении герпеса Метионин (молоко, молочные продукты, 100 г казеин=3 г) Процессы метилирования и трансметилирования, синтез холина (вит. гр. В), обмен жиров, фосфолипидов в печени, профилактика и лечение атеросклероза, обмен вит. В 12 и фолиевой кислоты, функционирование надпочечников, синтез адреналина Триптофан, треонин Факторы роста и поддержания азотистого равновесия, образование сывороточных белков, гемоглобина, синтез никотиновой кислоты 100 г мяса=500 мл молока, бобовые, мало в кукурузе Фенилаланин Функционирование щитовидной железы, надпочечников, источник при синтезе тироксина, тирозина, адреналина
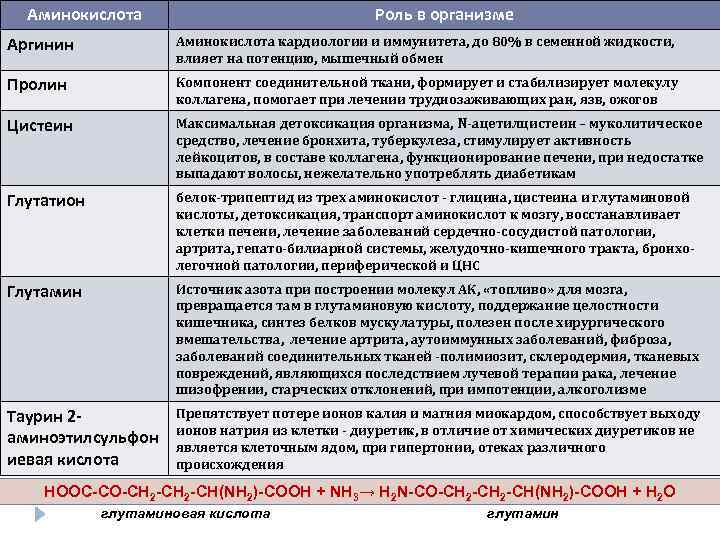 Аминокислота Роль в организме Аргинин Аминокислота кардиологии и иммунитета, до 80% в семенной жидкости, влияет на потенцию, мышечный обмен Пролин Компонент соединительной ткани, формирует и стабилизирует молекулу коллагена, помогает при лечении труднозаживающих ран, язв, ожогов Цистеин Максимальная детоксикация организма, N-ацетилцистеин – муколитическое средство, лечение бронхита, туберкулеза, стимулирует активность лейкоцитов, в составе коллагена, функционирование печени, при недостатке выпадают волосы, нежелательно употреблять диабетикам Глутатион белок-трипептид из трех аминокислот - глицина, цистеина и глутаминовой кислоты, детоксикация, транспорт аминокислот к мозгу, восстанавливает клетки печени, лечение заболеваний сердечно-сосудистой патологии, артрита, гепато-билиарной системы, желудочно-кишечного тракта, бронхолегочной патологии, периферической и ЦНС Глутамин Источник азота при построении молекул АК, «топливо» для мозга, превращается там в глутаминовую кислоту, поддержание целостности кишечника, синтез белков мускулатуры, полезен после хирургического вмешательства, лечение артрита, аутоиммунных заболеваний, фиброза, заболеваний соединительных тканей -полимиозит, склеродермия, тканевых повреждений, являющихся последствием лучевой терапии рака, лечение шизофрении, старческих отклонений, при импотенции, алкоголизме Таурин 2 аминоэтилсульфон иевая кислота Препятствует потере ионов калия и магния миокардом, способствует выходу ионов натрия из клетки - диуретик, в отличие от химических диуретиков не является клеточным ядом, при гипертонии, отеках различного происхождения НООС-СО-СН 2 -СН(NH 2)-СООН + NH 3→ H 2 N-CO-CH 2 -CH(NH 2)-COOH + H 2 O глутаминовая кислота глутамин
Аминокислота Роль в организме Аргинин Аминокислота кардиологии и иммунитета, до 80% в семенной жидкости, влияет на потенцию, мышечный обмен Пролин Компонент соединительной ткани, формирует и стабилизирует молекулу коллагена, помогает при лечении труднозаживающих ран, язв, ожогов Цистеин Максимальная детоксикация организма, N-ацетилцистеин – муколитическое средство, лечение бронхита, туберкулеза, стимулирует активность лейкоцитов, в составе коллагена, функционирование печени, при недостатке выпадают волосы, нежелательно употреблять диабетикам Глутатион белок-трипептид из трех аминокислот - глицина, цистеина и глутаминовой кислоты, детоксикация, транспорт аминокислот к мозгу, восстанавливает клетки печени, лечение заболеваний сердечно-сосудистой патологии, артрита, гепато-билиарной системы, желудочно-кишечного тракта, бронхолегочной патологии, периферической и ЦНС Глутамин Источник азота при построении молекул АК, «топливо» для мозга, превращается там в глутаминовую кислоту, поддержание целостности кишечника, синтез белков мускулатуры, полезен после хирургического вмешательства, лечение артрита, аутоиммунных заболеваний, фиброза, заболеваний соединительных тканей -полимиозит, склеродермия, тканевых повреждений, являющихся последствием лучевой терапии рака, лечение шизофрении, старческих отклонений, при импотенции, алкоголизме Таурин 2 аминоэтилсульфон иевая кислота Препятствует потере ионов калия и магния миокардом, способствует выходу ионов натрия из клетки - диуретик, в отличие от химических диуретиков не является клеточным ядом, при гипертонии, отеках различного происхождения НООС-СО-СН 2 -СН(NH 2)-СООН + NH 3→ H 2 N-CO-CH 2 -CH(NH 2)-COOH + H 2 O глутаминовая кислота глутамин
 ГАМК - нейромедиатор γ-аминомасляная кислота возбуждается при поступлении нервного импульса к нервной клетке, пропускает внутрь ионы натрия и хлора, тормозит нервный импульс подобно действию транквилизаторов Алкоголь также активизирует ГАМК, тормозит нервную систему Особенно опасно при сочетании ГАМК и лекарств = летальный исход
ГАМК - нейромедиатор γ-аминомасляная кислота возбуждается при поступлении нервного импульса к нервной клетке, пропускает внутрь ионы натрия и хлора, тормозит нервный импульс подобно действию транквилизаторов Алкоголь также активизирует ГАМК, тормозит нервную систему Особенно опасно при сочетании ГАМК и лекарств = летальный исход
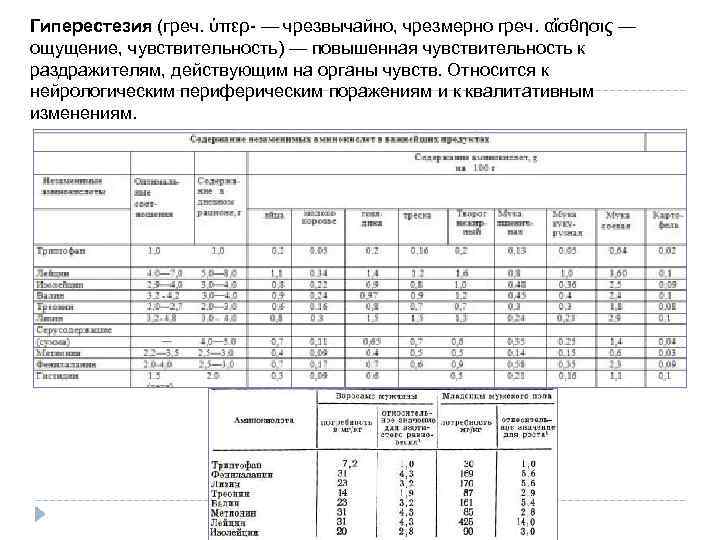 Гиперестезия (греч. ὑπερ- — чрезвычайно, чрезмерно греч. αἴσθησις — ощущение, чувствительность) — повышенная чувствительность к раздражителям, действующим на органы чувств. Относится к нейрологическим периферическим поражениям и к квалитативным изменениям.
Гиперестезия (греч. ὑπερ- — чрезвычайно, чрезмерно греч. αἴσθησις — ощущение, чувствительность) — повышенная чувствительность к раздражителям, действующим на органы чувств. Относится к нейрологическим периферическим поражениям и к квалитативным изменениям.
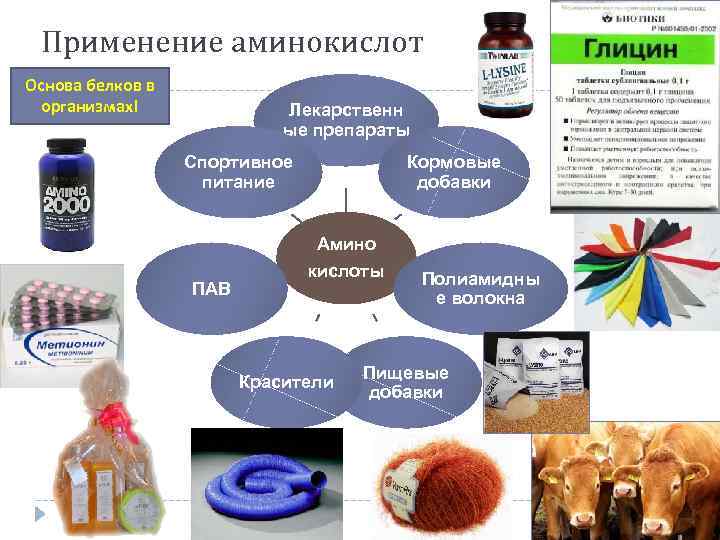 Применение аминокислот Основа белков в организмах! Лекарственн ые препараты Спортивное питание Кормовые добавки Амино ПАВ кислоты Красители Полиамидны е волокна Пищевые добавки
Применение аминокислот Основа белков в организмах! Лекарственн ые препараты Спортивное питание Кормовые добавки Амино ПАВ кислоты Красители Полиамидны е волокна Пищевые добавки
 Пищевые добавки натриевая соль глутаминовой кислоты (Е 621) или глутамат натрия 1909 г. – японец К. Икеда, выяснил действие сушеных водорослей на вкус и аромат пищи от содержания глутаминовой кислоты (Е 620) и ее солей Глутаминаты других металлов – Е 622 -625 Глицин – Е 640 Лейцин – Е 641
Пищевые добавки натриевая соль глутаминовой кислоты (Е 621) или глутамат натрия 1909 г. – японец К. Икеда, выяснил действие сушеных водорослей на вкус и аромат пищи от содержания глутаминовой кислоты (Е 620) и ее солей Глутаминаты других металлов – Е 622 -625 Глицин – Е 640 Лейцин – Е 641

 Задание 1 Определите молекулярную формулу аминокислоты, содержащей 32% углерода, 6, 66% водорода, 42, 67% кислорода и 18, 67% азота. Напишите структурную формулу этой кислоты и назовите ее. Какое количество вещества и сколько молекул содержится в 10, 5 г серина?
Задание 1 Определите молекулярную формулу аминокислоты, содержащей 32% углерода, 6, 66% водорода, 42, 67% кислорода и 18, 67% азота. Напишите структурную формулу этой кислоты и назовите ее. Какое количество вещества и сколько молекул содержится в 10, 5 г серина?
 Задание 2 При взаимодействии 89 г α –аминопропионовой кислоты с гидроксидом натрия образовалась соль массой 100 г. Рассчитайте массовую долю выхода соли. Какой объем аммиака потребуется для превращения 27, 8 г бромуксусной кислоты в глицин, если объемная доля потери аммиака составляет 5%?
Задание 2 При взаимодействии 89 г α –аминопропионовой кислоты с гидроксидом натрия образовалась соль массой 100 г. Рассчитайте массовую долю выхода соли. Какой объем аммиака потребуется для превращения 27, 8 г бромуксусной кислоты в глицин, если объемная доля потери аммиака составляет 5%?
 Домашнее задание Параграф 28 Упражнения 1 , 6, 7
Домашнее задание Параграф 28 Упражнения 1 , 6, 7
 Литература Химия 10 класс, учебник О. С. Габриеляна и др. , М. , «Дрофа» , 2009 О. С. Габриелян, И. Г. Остроумов. Настольная книга учителя химии 10 класс, М. , «Блик и К 0» , 2001 Органическая химия в таблицах. Минск, «Современная школа» , «Кузьма» , 2011 http: //cnit. ssau. ru/organics/chem 5/n 42. htm http: //ru. wikipedia. org http: //www. e-reading-lib. org http: //www. physchem. chimfak. rsu. ru http: //vitaline. at. ua/publ/53 -1 -0 -255
Литература Химия 10 класс, учебник О. С. Габриеляна и др. , М. , «Дрофа» , 2009 О. С. Габриелян, И. Г. Остроумов. Настольная книга учителя химии 10 класс, М. , «Блик и К 0» , 2001 Органическая химия в таблицах. Минск, «Современная школа» , «Кузьма» , 2011 http: //cnit. ssau. ru/organics/chem 5/n 42. htm http: //ru. wikipedia. org http: //www. e-reading-lib. org http: //www. physchem. chimfak. rsu. ru http: //vitaline. at. ua/publ/53 -1 -0 -255


