Aminokisloti-11.ppt
- Количество слайдов: 19

АМІНОКИСЛОТИ – органічні біфункціональні сполуки, до складу яких входять аміно – (–NH 2) та карбоксильна (–СООН) групи. Молекули амінокислот можуть містити і по декілька із зазначених груп. За будовою скелету C їх поділяють на ациклічні (насичені та ненасичені) і циклічні (ароматичні та гетероциклічні), а залежно від взаємного розміщення NH 2 і СООН груп розрізняють α-, β-, γ-, δ- і т. д. амінокислоти, наприклад: Номенклатура амінокислот За систематичною номенклатурою назви амінокислот утворюються від назв відповідних кислот з вказуванням місця розташування аміногрупи стосовно карбоксильної групи та додаванням префіксу аміно, наприклад: За тривіальною номенклатурою до назви карбонової кислоти додається префікс аміно та вказується положення аміногрупи літерою грецького алфавіту, наприклад α-аміномасляна, β-аміномасляна та γ-аміномасляна кислоти. Якщо в молекулі амінокислоти міститься дві аміногрупи, то в її назві використовується префікс діаміно, 3 групи NH 2 – триаміно й т. д.
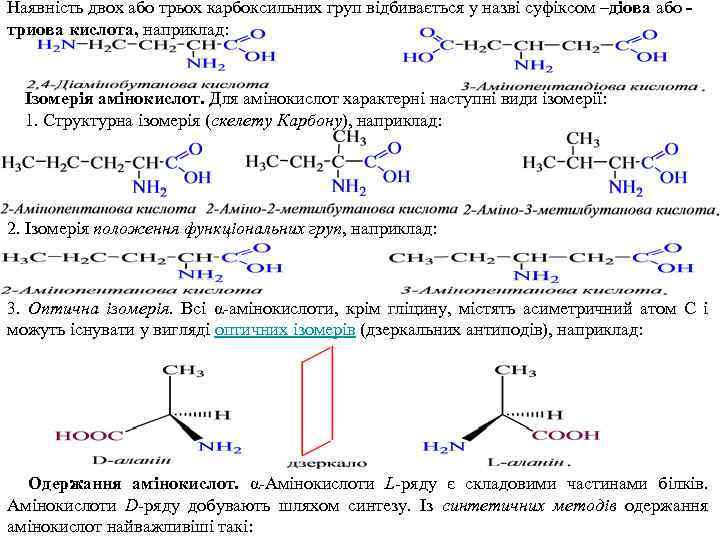
Наявність двох або трьох карбоксильних груп відбивається у назві суфіксом –діова або триова кислота, наприклад: Ізомерія амінокислот. Для амінокислот характерні наступні види ізомерії: 1. Структурна ізомерія (скелету Карбону), наприклад: 2. Ізомерія положення функціональних груп, наприклад: 3. Оптична ізомерія. Всі α-амінокислоти, крім гліцину, містять асиметричний атом С і можуть існувати у вигляді оптичних ізомерів (дзеркальних антиподів), наприклад: Одержання амінокислот. α-Амінокислоти L-ряду є складовими частинами білків. Амінокислоти D-ряду добувають шляхом синтезу. Із синтетичних методів одержання амінокислот найважливіші такі:

1. Мікробіологічний синтез з вуглеводнів нафти, супутнього та природного газу за допомогою мікроорганізмів добувають лізин, глутамінову кислоту тощо. 2. Гідроліз білків. У промислових масштабах гідролізу піддають білкові відходи переважно м’ясної промисловості ( добувають цистеїн, лейцин, ізолейцин). 3. Заміщення галогену на аміногрупу у відповідних галогензаміщених кислотах: 4. Дія амоніаку і гідрогенціаніду на альдегіди або кетони (реакція Штрекера): М. Д. Зелінський вдосконалив цей метод добування α-амінокислот, застосувавши в реакції замість HCN суміш KCN і NH 4 Cl: 5. Приєднання амоніаку до ненасичених кислот: CH 2=CH–COOH + NH 3 → H 2 N–CH 2–COOH 6. Для окремих амінокислот використовують спеціальні методи. Так, ε-амінокапронову кислоту добувають, виходячи з циклогексанолу за такою схемою:

7. Одержання з малонового естеру (для α-амінокислот). За допомогою послідовних перетворень з малонового естеру отримують необхідні α-амінокислоти:

8. Амінування α-кетокислот у присутності паладію. Для одержання α-амінокислот у промисловості набуває все більшого значена амінування кетокислот у присутності Pd або Pt, використовуючи для цього здатність кетокислоти утворювати відповідний кетімін: 9. Одержання з малонової кислоти (метод В. Родіонова, 1926 р. ) За даним методом з альдегіду і малонової кислоти отримують спочатку за Кневенагелем ненасичену кислоту, до якої потік приєднують аміак в одну стадію: Фізичні властивості. Амінокислоти – безбарвні кристалічні речовини з високою температурою плавлення, добре розчинні у воді, водні розчини, гірше – в органічних розчинниках, проводять струм. α-Амінокислоти L-ряду, що входять до складу білків, гіркі на смак або не мають його, а їх D-ізомери – солодкі на смак.

Хімічні властивості амінокислот - ці речовини виявляють властивості як кислот, так і амінів, тобто є амфотерними сполуками. Як карбонові кислоти вони дисоціюють у водному розчині. Відщеплюючи один іон Гідрогену, карбоксильна група утворює аніон: У лужному середовищі підсилюється дисоціація карбоксильної групи: У кислому середовищі відбувається іонізація аміногрупи: При деякому значенні р. Н може відбуватися одночасна дисоціація СООН і протонізація NH 2 з утворенням біполярного йону (цвіттер-іону), сумарний заряд якого дорівнює нулю: Такий змішаний іон не переміщаються в електричному полі. Значення р. Н, при якому молекула амінокислоти не має заряду, називається ізоелектричною точкою амінокислоти. Отже, амінокислоти - амфотерні електроліти. Вони взаємодіють з лугами: При взаємодії з гідроксидами важких металів амінокислоти утворюють комплекси: У цьому металокомплексі атом Купруму сполучений координаційними (донорно-акцепторними) зв’язками. з атомами Нітрогену

Амінокислоти взаємодіють і з мінеральними кислотами з утворенням амонійних сол Крім того, вони взаємодіють зі спиртами з утворенням естерів: Амінокислоти при взаємодії з хлоруючими засобами (PCl 5, SOCl 2, SO 2 Cl 2 тощо) утворюють хлорангідриди (у вигляді гідрогенхлоридів), наприклад: У молекулах амінокислот атом Н аміногрупи може заміщуватися на залишки карбонових кислот завдяки реакції ацилування: При алкілуванні утворюються вторинні, третинні алкіловані амінокислоти, або амонійні основи (бетаїни): Термічне перетворення амінокислот: α-амінокислоти при нагріванні міжмолекулярно відщеплюють воду, утворюючи циклічні аміди –

β-Амінокислоти при нагріванні внутрішньомолекулярно відщеплюють амоніак за рахунок аміногрупи і атома Гідрогену СН 2 -групи, сусідньої з СООН-групою: NH 2–CH 2–COOH → CH 2=CH–COOH + NH 3. γ-, δ- і ε-Амінокислоти при нагріванні внутрішньомолекулярно відщеплюють воду з утворенням циклічних внутрішньомолекулярних амідів – лактамів, які можуть існувати як в лактамній (кетонній), так і в лактимній (енольній) таутомерних формах: Внутрішньомолекулярна взаємодія функціональних груп e-амінокапронової кислоти приводить до утворення ε-капролактаму (напівпродукту для одержання капрону): Декарбоксилування амінокислот: при декарбоксилуванні, наприклад, глутамінової кислоти утворюється γ-аміномасляна:
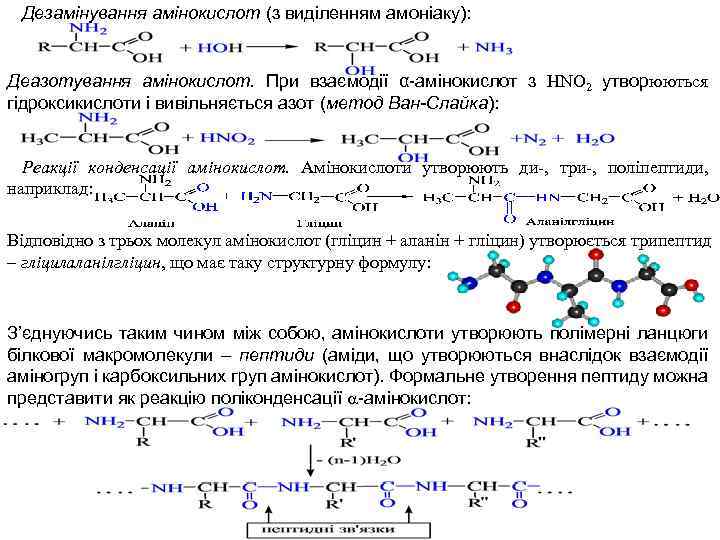
Дезамінування амінокислот (з виділенням амоніаку): Деазотування амінокислот. При взаємодії α-амінокислот з HNO 2 утворюються гідроксикислоти і вивільняється азот (метод Ван-Слайка): Реакції конденсації амінокислот. Амінокислоти утворюють ди-, три-, поліпептиди, наприклад: Відповідно з трьох молекул амінокислот (гліцин + аланін + гліцин) утворюється трипептид – гліцилаланілгліцин, що має таку структурну формулу: З’єднуючись таким чином між собою, амінокислоти утворюють полімерні ланцюги білкової макромолекули – пептиди (аміди, що утворюються внаслідок взаємодії аміногруп і карбоксильних груп амінокислот). Формальне утворення пептиду можна представити як реакцію поліконденсації a-амінокислот:

Поліпептидами вважають зазначені біополімери з молекулярною масою до 10000, а пептиди з більшою молекулярною масою вважають білками. Синтетичні методи добування поліпептидів (E. Фішер) - взаємодія хлорангідридів α-галогенокарбонових кислот з αамінокислотами, наприклад: Поліамідні полімери. Одним із таких поліамідів є найлон. До синтетичних поліамідних полімерів належать також капрон і енант. Капрон добувають шляхом полімеризації капролактаму, яку здійснюють нагріванням його при наявності невеликої кількості води: Капрон використовують для виготовлення хімічного волокна, деталей машин і механізмів (шестерень, гайок, втулок, стійких до дії мастил і проти корозії). При поліконденсації аміноенантової кислоти добувають полімер, з якого виготовляють хімічне волокно енант. Поліконденсація аміноенантової кислоти відбувається за схемою: Волокно енант порівняно з капроновим волокном має значно вищу термо-, світло - і хімічну стійкість, а також приблизно вдвічі стійкіше від капронового волокна до багаторазових деформацій і стирання. Його використовують для виробництва різних трикотажних виробів і корду.

Окрім пептидного зв’язку, в молекулах білків є дисульфідні (ковалентні) зв’язки, що утворюються в результаті окиснення SH-груп залишків цистеїну: Цистеїн Цистин. Дисульфідні зв’язки можуть виникати між окремими поліпептидними ланцюгами в місцях, де два залишки цистеїну розташовані один проти іншого, а також між залишками цих кислот в одному ланцюгу, коли поліпептидний ланцюг утворює вигини і спірали. У молекулі білка існує також іонний (сольовий), зв’язок, який виникає між різнойменно зарядженими групами амінокислотних залишків аспарагінової і глутамінової кислот, аргініну, лізину і гістидину. Кінцеві і вільні СООН- і NН 2 -групи можуть знаходитися в іонізованому стані, що може поєднувати витки як однієї, так і різних поліпептидних ланцюгів: Також в молекулі білка існують водневі зв’язки, що утворюються між частково електровід’ємними атомами Оксигену карбонілу одного пептидного зв’язку і частково електропозитивним атомом Гідрогену іминної групи – іншої.

Водневий зв’язок з’єднує поліпептидні ланцюги чи їх окремі ділянки: Водневий зв’язок набагато слабкіший, ніж пептидний, дисульфідний або іонний. Але в утворенні цього зв’язку приймають участь усі пептидні зв’язки, тому білкова система максимально насичена водневими зв’язками, що має велике значення в стабілізації білкової молекули. У білках існують вуглеводневі радикали таких амінокислот, як аланін, валін, лейцин, ізолейцин тощо, що не несуть електричного заряду і не розчиняються у воді. Радикали цих кислот мають гідрофобні групи (-СН 3, -С 2 Н 5 і т. д. ), між якими можуть виникати сили взаємного притягання завдяки утворенню слабкого гідрофобного зв’язку: Завдяки тому, що молекули води виштовхують гідрофобні радикали зазначених амінокислот з білкової молекули, утворюється система, що нагадує колоїдну частку, усередині якої розміщена гідрофобна, зовні – гідрофільна частини молекули білку. Слабкі хімічні зв’язки (електростатична взаємодія між вільними і кінцевими NH 2 - і СООНгрупами, водневі зв’язки, а також гідрофобна взаємодія) відіграють важливу роль у підтримці і стабілізації строго визначеної конфігурації білкової молекули в просторі.

Найважливіші протеїногенні амінокислоти. Їх фізіологічне значення. На даний час відомо понад 150 амінокислот. Однак у якості структурних елементів білків виявлено лише 22 α-амінокислоти, але до складу більшості білків постійно входить 20 амінокислот. Ці амінокислоти називають протеїногенними. Решта амінокислот входить до складу фізіологічно активних речовин (коферментів, гормонів, антибіотиків) та існують у вільному стані, виконуючи певні біологічні функції. Специфічні функції білків зумовлені їх просторовою конфігурацією, яка обумовлена певною послідовністю амінокислот у білковій молекулі. Отже, структура, фізико-хімічні і біологічні властивості білків залежать від природи амінокислот, що входять до їх складу, тому розглянемо будову цих структурних елементів. Протеїногенні амінокислоти поділяють на ті, що синтезуються в організмі людини та тварин або замінні амінокислоти, а саме:
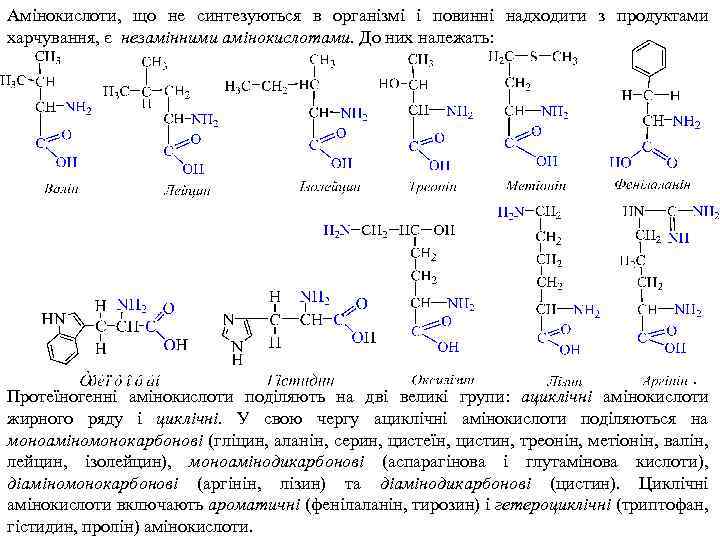
Амінокислоти, що не синтезуються в організмі і повинні надходити з продуктами харчування, є незамінними амінокислотами. До них належать: Протеїногенні амінокислоти поділяють на дві великі групи: ациклічні амінокислоти жирного ряду і циклічні. У свою чергу ациклічні амінокислоти поділяються на моноаміномонокарбонові (гліцин, аланін, серин, цистеїн, цистин, треонін, метіонін, валін, лейцин, ізолейцин), моноамінодикарбонові (аспарагінова і глутамінова кислоти), діаміномонокарбонові (аргінін, лізин) та діамінодикарбонові (цистин). Циклічні амінокислоти включають ароматичні (фенілаланін, тирозин) і гетероциклічні (триптофан, гістидин, пролін) амінокислоти.

Білки - це складні високомолекулярні сполуки біологічного походження (біополімери), побудовані із залишків амінокислот, сполучених між собою пептидними зв'язками. Для кожного білка послідовність сполучення амінокислот різна, і це має важливе життєве значення. Білки містяться в ядрі та протоплазмі всіх тваринних і рослинних клітин. З білків побудовані м'язові, опорні та покривні тканини. За їх допомогою доставляються необхідні організму речовини, наприклад кисень з легенів у тканини; виводяться непотрібні речовини; каталізуються численні біохімічні процеси. Отже, білки в організмах тварин і людей виконують певні біологічні функції. Це функції структурні (45 -50% сухої маси людини припадає на білки), гормональні (більшість гормонів є білками), каталітичні (біологічні каталізатори - ферменти мають білкову природу), захисні (імунні процеси в організмі проходять завдяки антитілам білкової природи), транспортні (поживні речовини переносяться сполуками білкової природи), механічні (робота м'язів, легенів, шлунку тощо здійснюється за участю білкових тіл), енергетичні (білки є джерелом енергії). Класифікація білків. Білки поділяються на прості (апопротеїни) і складні (голопротеїни). Прості білки складаються із залишків амінокислот, а складні містять у своїй структурі крім амінокислот вуглеводи, нуклеїнові кислоти, фосфатну кислоту, барвники так звані простетичні групи). У свою чергу, апопротеїни поділяються на альбуміни, глобуліни, протаміни, гістони, проламіни, глутеліни і протеноїди, а голопротеїни – на нуклеопротеїни, для яких простетичними групами є нуклеїнові кислоти, глікопротеїни (вуглеводи), хромопротеїни (барвники), металопротеїни (метали Fe, Cu, Co, Zn), фосфопротеїни (фосфатна кислота Н 3 РО 4).
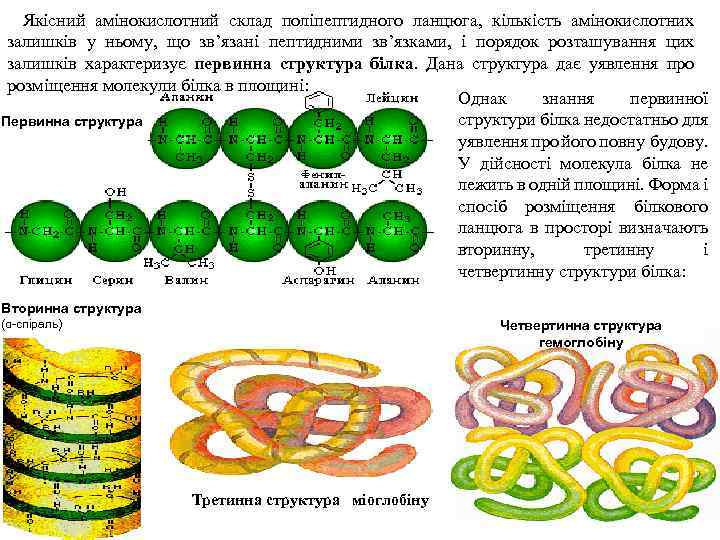
Якісний амінокислотний склад поліпептидного ланцюга, кількість амінокислотних залишків у ньому, що зв’язані пептидними зв’язками, і порядок розташування цих залишків характеризує первинна структура білка. Дана структура дає уявлення про розміщення молекули білка в площині: Однак знання первинної структури білка недостатньо для Первинна структура уявлення про його повну будову. У дійсності молекула білка не лежить в одній площині. Форма і спосіб розміщення білкового ланцюга в просторі визначають вторинну, третинну і четвертинну структури білка: Вторинна структура (α-спіраль) Четвертинна структура гемоглобіну Третинна структура міоглобіну

Головні етапи синтезу білків складаються з: 1) зворотного захисту функціональних груп амінокислоти; 2) утворення пептидних зв'язків і 3) вибіркового (селективного) відщеплення груп захисту. Даний метод багатостадійний, трудомісткий і потребує використання чистих енантіомерів L-ряду (найчастіше S-конфігурації). Тепер уже синтезовано деякі поліпептиди (гормон інсулін, скотофобін, фермент рибонуклеаза, антибіотики актиноміцин, граміцидин, вітаміни тощо), які містять понад 100 амінокислот з точно заданою послідовністю. Наприклад, для синтезу інсуліну (регулює вміст цукру в крові) необхідно було провестп 89 реакцій, в результаті яких одержано два ланцюги з 21 і 30 залишками амінокислот, сполучених двома дисульфідними містками. Для захисту NH 2 групи найчастіше застосовують: 1) бензилоксикарбонілхлорид, або бензилхлороформіат 2)трет-бутоксикарбонілхлорид, або трет-бутилхлороформіат 3) п-толуолсульфонілхлорид 4) трифенілметилхлорид (C 6 H 5)3 C–СІ. Для захисту СООН-групи здебільшого застосовують: 1) спирти для утворення естерів (CH 3)3 C–OH, (CH 3 CH–CH 2–OH; 2) етилоксикарбонілхлорид, або етилхлороформіат, для утворення змішаного ангідриду дициклогексилкарбодіімід С 6 Н 11—N=C=N–C 6 H 11. Часто паралельно з захистом карбоксильної групи проводять її активацію шляхом введення до неї електроноакцепторних груп X з утворенням хлорангідридної, естерної, змішаної ангідридної, азидної груп загального вигляду —СОХ, де

Розглянемо вказані основні етапи на прикладі синтезу дипептиду з гліцину та аланіну. 1. Захист NH -групи: Захист і активація СООН-групи:

Перспективним є твердофазний синтез поліпептидів (Р. Мерріфілд, 1963 р). Утворення пептидних зв'язків при цьому відбувається на поверхні твердого полімерного носія. Як полімер використовують хлороетильований полістирол, що містить активні групи -СН 2 СІ. Захищена NH 2 -групою амінокислота реагує з активними групами носія з утворенням естерового зв'язку. Потім позбавляються захисту NH 2 -гpyп і утворюють на прищеплений до полімерної підкладки (іммобілізований пікладці) гліцин захищеним попередньо αаланіном: При необхідності такий цикл перетворень повторюють до відповідної довжини поліпептиду, який відщеплюють від полістирольного носія дією HF або суміші НВr і CF 3 COOH.
Aminokisloti-11.ppt