2335_1.ppt
- Количество слайдов: 30

Амінокислоти. Білки Підготувала вчитель хімії Монастирищенської загальноосвітньої школи I-III ступенів № 1 Монастирищенської районної ради Мельник О. М. 1

З повною впевненість можна стверджувати, що білки – найважливіші з усіх речовин, що входять до складу организмів тварин і рослин. Л. Полінг 2

Мета: Розширити уявлення про різноманітність органічних сполук. Продовжити вивчення органічних полімерів. Розглянути хімічний склад, будову та властивості білків, спираючись на знання з біології 3

План вивчення нового матеріалу 1. Білки – органічні речовини, біополімери. 2. Амінокислотный склад білків. 3. Хімічний склад і будова амінокислот. 4. Принцип об’єднання амінокислотних ланок у поліпептидну молекулу. 5. Просторові структури білка. 6. Денатурація білка. 4

Молекула білка – макромолекула ( грецьк. «макрос» - великий, гігантський), має велику молекулярну масу Порівняйте: молекулярная маса етилового спирту – 46 оцтової кислоти – 60 альбуміну (одного з білків яйця) – 36000 гемоглобіну – 152000 міозину (білок м’язів) – 500000 5

Вміст білку в деяких тканинах та органах (після зневоднення): М’язи – 80% Нирки – 72% Шкіра – 63% Печінка – 57% Мозок – 45% Жирова тканина, кістки, зуби – 14 – 28% Насіння рослин – 10 – 15 % Стебла, корені, листя – 3% - 5% Плоди – 1 -2% 6

Хімічний склад n n До складу білка входять наступні елементи С, Н, О, N, S, P, Fe. Ферум у гемоглобіні крові , Фосфор у казеїні молока…. Масова частка елементів: С – 50% - 55% О – 19% - 24% Н – 6, 5% - 7, 3% N – 15% – 19% S – 0, 3% - 2, 5% P – 0, 1% - 2% 7

Білки – це нерегулярні полімери, мономерами яких є амінокислоти в природі існує біля 100 α-аминокислот, в организмі людини зустрічається 25, а в кожному білку - близько 20, з них може бути утворено 2 432 902 008 176 640 000 комбінацій (~2 · 1018) n замінні амінокислоти - можуть синтезуватися в організмі; n незамінні - в організмі не утворюються, їх отримуємо з їжею (лізин, валін, лейцин, ізолейцин, треонін, фенілаланін, триптофан, тирозин, метионін) n 8

Склад і класифікація білків За складом: n протеїни (прості) - містять лише залишки амінокислот n протеїди (складні) – містять, крім залишків амінокислот, ще й небілкову частину: вуглеводы (глікопротеїди), жири (ліпопротеїди), нуклеїнові кислоти (нуклеопротеїди) n повноцінні – містять увесь набір незамінних амінокислот n неповноцінні - містять не повний набір незамінних амінокислот 9
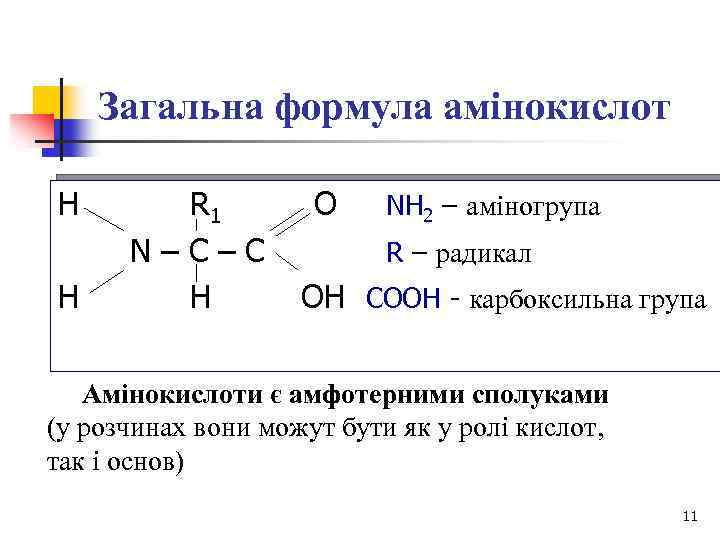
Загальна формула амінокислот H H R 1 O NH 2 – аміногрупа N – C R – радикал H OH COOH - карбоксильна група Амінокислоти є амфотерними сполуками (у розчинах вони можут бути як у ролі кислот, так і основ) 11

Особливості номенклатури амінокислот За тим, до якого атому Карбону приєднана аміно- (або іміно-) група, амінокислоти поділяються на α, β, γ і т. д. При цьому: n α-амінокислотами називаються такі, в яких карбоксильна та аміногрупа приєднані до одного і того ж атому Карбону; n β-амінокислотами – такі, де аміногрупа приєднана до атому Карбону, сусіднього з тим, до якого приєднана карбоксильна група; n γ-амінокислотами - такі, де аміногрупа приєднана через один атом Карбону від карбоксильної, і так далі. 12

Класифікація амінокислот: n n моноамінокарбонові, моноамінодикарбонові, диамінокарбонові, моноамінотрикарбонові. 13
14
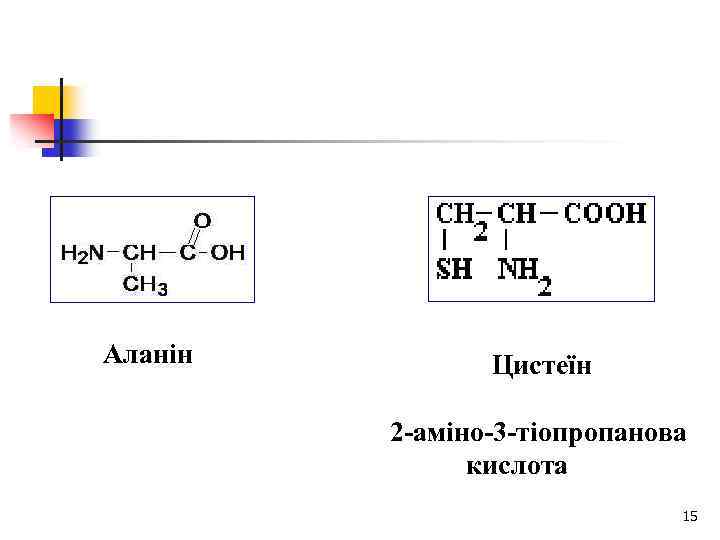
Аланін Цистеїн 2 -аміно-3 -тіопропанова кислота 15
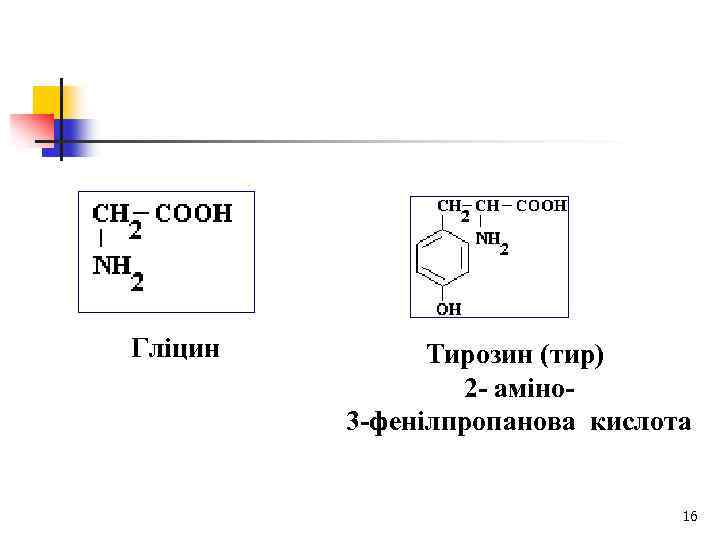
Гліцин Тирозин (тир) 2 - аміно 3 -фенілпропанова кислота 16
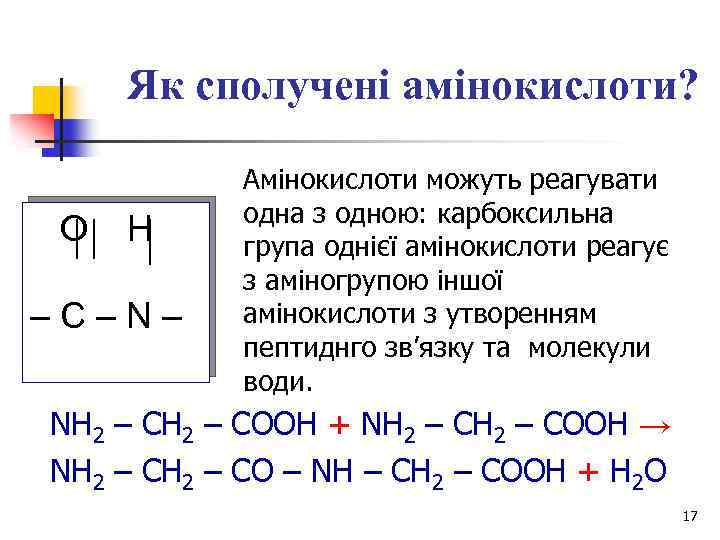
Як сполучені амінокислоти? O H –С–N– Амінокислоти можуть реагувати одна з одною: карбоксильна група однієї амінокислоти реагує з аміногрупою іншої амінокислоти з утворенням пептиднго зв’язку та молекули води. NH 2 – COOH + NH 2 – COOH → NH 2 – CO – NH – CH 2 – COOH + H 2 O 17
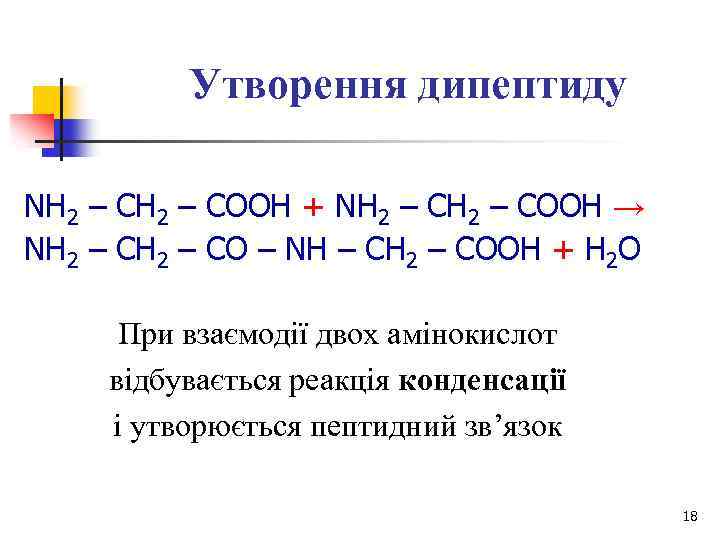
Утворення дипептиду NH 2 – COOH + NH 2 – COOH → NH 2 – CO – NH – CH 2 – COOH + H 2 O При взаємодії двох амінокислот відбувається реакція конденсації і утворюється пептидний зв’язок 18
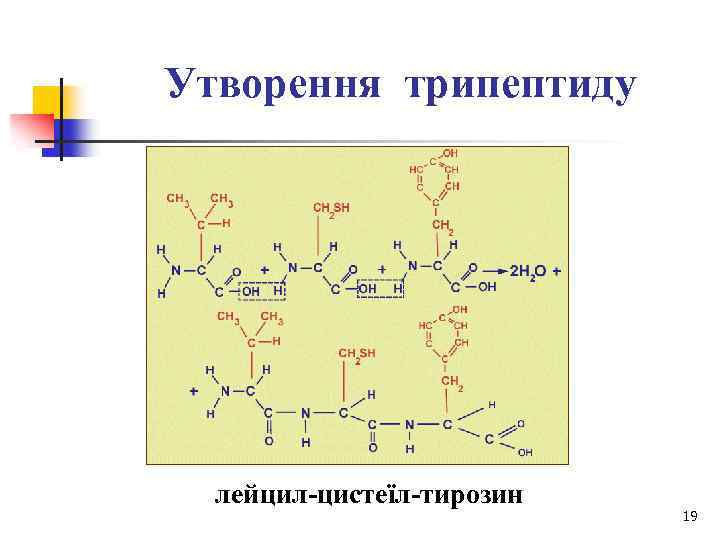
Утворення трипептиду лейцил-цистеїл-тирозин 19
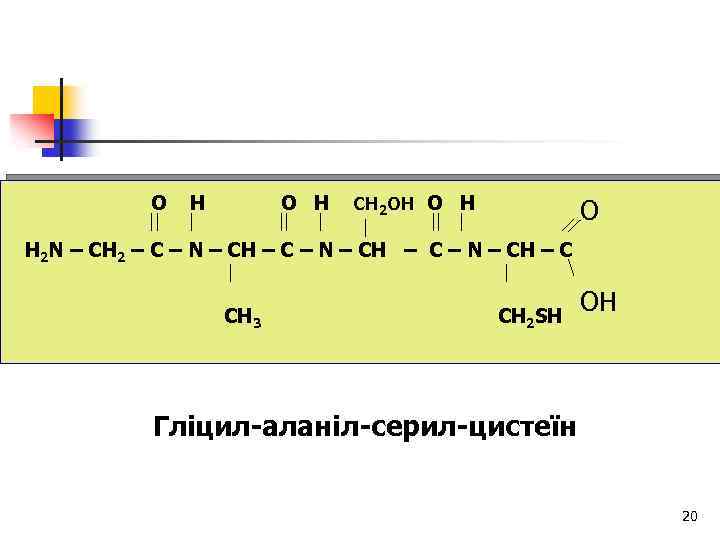
O H О Н CH 2 OH O H О Н 2 N – CH 2 – C – N – CH – C CH 3 СН 2 SH OН Гліцил-аланіл-серил-цистеїн 20

Білки – природні полімери Білки — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. Суміш для нарощування м'язів містить білки молочної сироватки 21

Функції білків n n n Білки-ферменти каталізують протікання біохімічних реакцій і грають важливу роль в обміні речовин. Деякі білки виконують структурну або механічну функцію, утворюючи цитоскелет, що є важливим засобом підтримки форми клітин а також запасаючу функцію Також білки грають важливу роль в сигнальних системах клітин, клітинній адгезії, імунній відповіді і клітинному циклі. 22

З історії дослідження білків Білки були виділені в окремий клас біологічних молекул у XVIII столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати при нагріванні або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці. 23

Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец. πρώτα — «першорядної важливості» . На початку XX-го століття німецький хімік Еміль Фішер експериментально довів, що білки побудовані Герман із залишків амінокислот, сполучених пептидними Фішер зв'язками. Проте, їх центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком. Секвенування першого білка — інсуліну, тобто визначення його амінокислотної послідовності, принесло Фредерику Сенгеру Нобелівську премію з хімії 1958 року. Перші тривимірні структури білків гемоглобіну і міоглобіну були Стрічкова отримані за допомогою рентгеноструктурного модель аналізу, за що автори методу, Макс Перуц і Джон молекули Кендрю, отримали Нобелівську премію з хімії 1962 уреази 24 року.

Рівні організації білку n n n Розмір кожної амінокислоти близько 0, 3 нм, Білок, що складається з багатьох амінокислотних залишків, повинен становити собою довгу нитку Розміри молекул білков значно менші Макромолекули білків мають форму компактних кульок (глобул) або витягнутих структур (фібрил) Поліпептидний ланцюг якимось чином сплетений, утворюючи клубок або пучок «ниток» Він зкручується упорядковано, для кажного білку - певним чином 25
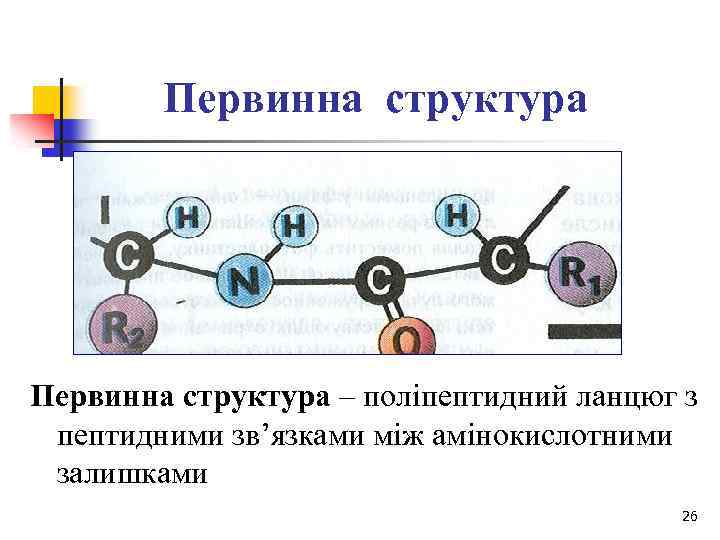
Первинна структура – поліпептидний ланцюг з пептидними зв’язками між амінокислотними залишками 26
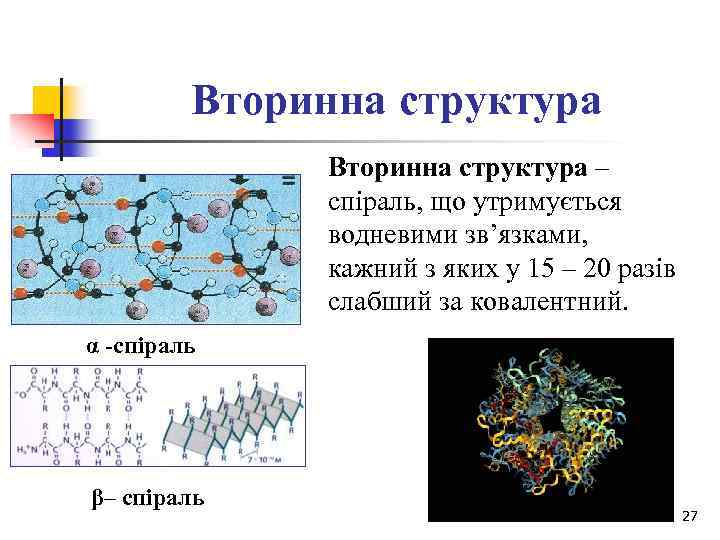
Вторинна структура – спіраль, що утримується водневими зв’язками, кажний з яких у 15 – 20 разів слабший за ковалентний. α -спіраль β– спіраль 27
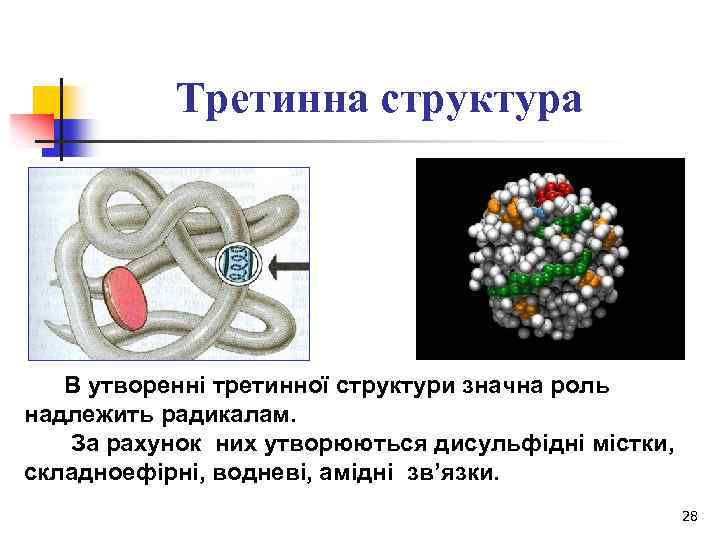
Третинна структура В утворенні третинної структури значна роль надлежить радикалам. За рахунок них утворюються дисульфідні містки, складноефірні, водневі, амідні зв’язки. 28
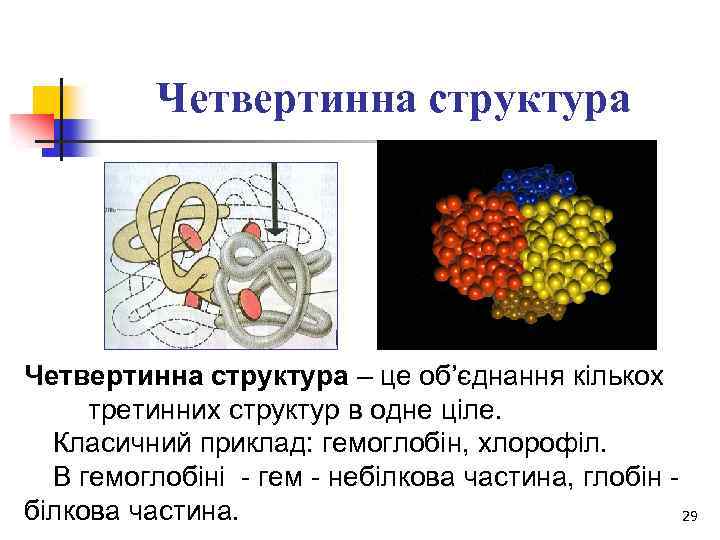
Четвертинна структура – це об’єднання кількох третинних структур в одне ціле. Класичний приклад: гемоглобін, хлорофіл. В гемоглобіні - гем - небілкова частина, глобін білкова частина. 29

Властивості білків n n n Розчинність Висолювання Гідроліз Денатурація Кольорові реакції : біуретова, ксантопртеїнова Амфотерний характер білкових молекул (амфотерність білків) 30

Висновки: «Я завжди говорив і не втомлююся повторювати, що світ не міг би існувати, якби був так просто влаштований» Гете 41
2335_1.ppt