Алюміній, як хімічний елемент


























- Размер: 2.2 Mегабайта
- Количество слайдов: 26
Описание презентации Алюміній, як хімічний елемент по слайдам
 Алюміній, як хімічний елемент Виконала: учениця 8 -Б класу Волкова Вікторія
Алюміній, як хімічний елемент Виконала: учениця 8 -Б класу Волкова Вікторія
 Алюміній Елементголовної підгрупи третьої групи третього періодупериодич ної системи хімічних елементів Д. І. Менделєєва з атомним номером 13. Позначається символом Al
Алюміній Елементголовної підгрупи третьої групи третього періодупериодич ної системи хімічних елементів Д. І. Менделєєва з атомним номером 13. Позначається символом Al
 Алюміній — найпоширеніший у земній корі метал На його частку припадає 8 % маси земної кори. Основна маса його зосереджена в алюмосилікатах — сполуках Алюмінію з Силіцієм. Продуктом руйнування цих гірських порід є глина, склад якої можна виразити у формулі А 120, 2 Si. A 2 2 Н 20 3 інших мінералів, утворених Алюмінієм, найбільше значення мають боксит А 120, Н 20. корунд А 120, і кріоліт A 1 F 3 3 Na. F. Вперше чистий алюміній був отриманий Велером у 1827 році при взаємодії алюміній хлориду з металевим калієм. Однак, незважаючи на широку поширеність у природі, до кінця XIX століття алюміній належав до числа рідкісних металів. Сьогодні у промисловості алюміній одержують електролізом глинозему А 120, у розплавленому кріоліті На аноді електролізера для виплавляння алюмінію відбуваються наступні реакції: А 10, →А 13+ + Аl. O 33, А 13++3ē = А 1°
Алюміній — найпоширеніший у земній корі метал На його частку припадає 8 % маси земної кори. Основна маса його зосереджена в алюмосилікатах — сполуках Алюмінію з Силіцієм. Продуктом руйнування цих гірських порід є глина, склад якої можна виразити у формулі А 120, 2 Si. A 2 2 Н 20 3 інших мінералів, утворених Алюмінієм, найбільше значення мають боксит А 120, Н 20. корунд А 120, і кріоліт A 1 F 3 3 Na. F. Вперше чистий алюміній був отриманий Велером у 1827 році при взаємодії алюміній хлориду з металевим калієм. Однак, незважаючи на широку поширеність у природі, до кінця XIX століття алюміній належав до числа рідкісних металів. Сьогодні у промисловості алюміній одержують електролізом глинозему А 120, у розплавленому кріоліті На аноді електролізера для виплавляння алюмінію відбуваються наступні реакції: А 10, →А 13+ + Аl. O 33, А 13++3ē = А 1°
 На зовнішньому енергетичному рівні три електрони, ступінь окиснення в сполуках +3. Алюміній — найпоширеніший метал у земній корі. Зустрічається тільки у вигляді сполук (алюмосилікати, боксити, корунд, кріоліт). Фізичні властивості. Алюміній — сріблясто-білий метал, легкий, але механічно міцний, . Має високу тепло- та електричну провідність, пластичність. Легко утворює сплави. Добування. Електроліз розчину алюміній оксиду в розплавленому кріоліті. Хімічні властивості. Алюміній — відновник
На зовнішньому енергетичному рівні три електрони, ступінь окиснення в сполуках +3. Алюміній — найпоширеніший метал у земній корі. Зустрічається тільки у вигляді сполук (алюмосилікати, боксити, корунд, кріоліт). Фізичні властивості. Алюміній — сріблясто-білий метал, легкий, але механічно міцний, . Має високу тепло- та електричну провідність, пластичність. Легко утворює сплави. Добування. Електроліз розчину алюміній оксиду в розплавленому кріоліті. Хімічні властивості. Алюміній — відновник
 У вигляді простої речовини алюміній — сріблясто-білий, досить щільний метал із густиною 2, 7 г/см 3 температурою плавлення 660 °С і температурою кипіння 2500 °С. Кристалічний алюміній має гранецентровану кубічну решітку. Характеризується високою тягучістю, високою тепло-і електропровідністю. Зцим пов’язане його використання у виробництві електричних дротів, при однаковій електричній провідності алюмінієвий дріт удвічі легший за мідний. У періодичній системі Менделєєва Алюміній знаходиться в третьому періоді, у головній підгрупі третьої групи Заряд ядра +13 Електронна будова атома 1 s 22 p 63 s 23 p 1.
У вигляді простої речовини алюміній — сріблясто-білий, досить щільний метал із густиною 2, 7 г/см 3 температурою плавлення 660 °С і температурою кипіння 2500 °С. Кристалічний алюміній має гранецентровану кубічну решітку. Характеризується високою тягучістю, високою тепло-і електропровідністю. Зцим пов’язане його використання у виробництві електричних дротів, при однаковій електричній провідності алюмінієвий дріт удвічі легший за мідний. У періодичній системі Менделєєва Алюміній знаходиться в третьому періоді, у головній підгрупі третьої групи Заряд ядра +13 Електронна будова атома 1 s 22 p 63 s 23 p 1.
 На повітрі алюміній вкривається найтоншою (0, 00001 мм), але дуже щільною плівкою оксиду А 1203, що вберігає метал від подальшого окиснення і надає йому матового вигляду. Алюміній легко витягується в дріт і сплощується в тонкі листи. Алюмінієва фольга (завтовшки 0, 005 мм) застосовується для упакування в харчовій і фармацевтичній промисловості.
На повітрі алюміній вкривається найтоншою (0, 00001 мм), але дуже щільною плівкою оксиду А 1203, що вберігає метал від подальшого окиснення і надає йому матового вигляду. Алюміній легко витягується в дріт і сплощується в тонкі листи. Алюмінієва фольга (завтовшки 0, 005 мм) застосовується для упакування в харчовій і фармацевтичній промисловості.
 Основну масу алюмінію використовують для отримання різних сплавів, які крім гарних механічних якостей характеризуються своєю легкістю Найважливіші і цих сплавів — дюралюміній (94 % А 1, 4 % Сu. по 0. 5 % Mg, Mn, Fe, Si) і силумін (сплав Al Si. Na). Алюмінієві сплави застосовуються в ракетній техніці, в авіа авто, корабле і приладобудуванні, виробництві посуду й у багатьох інших галузях промисловості. Заширотою застосування сплави алюмінію займають третє місце після сталі й чавуну Алюміній, крім того, застосовується й у вигляді добавки до багатьох сплавів і і метою надання їм жаростійкості
Основну масу алюмінію використовують для отримання різних сплавів, які крім гарних механічних якостей характеризуються своєю легкістю Найважливіші і цих сплавів — дюралюміній (94 % А 1, 4 % Сu. по 0. 5 % Mg, Mn, Fe, Si) і силумін (сплав Al Si. Na). Алюмінієві сплави застосовуються в ракетній техніці, в авіа авто, корабле і приладобудуванні, виробництві посуду й у багатьох інших галузях промисловості. Заширотою застосування сплави алюмінію займають третє місце після сталі й чавуну Алюміній, крім того, застосовується й у вигляді добавки до багатьох сплавів і і метою надання їм жаростійкості
 По відношенню до води алюміній досить стійкий. Але якщо механічним шляхом чи амальгамуванням зняти запобіжну дію оксидної плівки, то проходить енергічна реакція: 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 Алюміній — типовий амфотерний елемент. Для ньго характерні не тільки аніонні, а й катіонні комплекси. Так, в кислому середовищі існує катіонний аквакомплекс [Al(OH 2)6]3+, а в лужному — аніонний гидрокомплекс та [Al(OH)6]3 -. Найбільш характерна ступінь окислення атома алюмінія +3. Негативна ступінь окислення проявляється рідко. На зовнішньому електронному шарі атома інують вільні d-підрівні. Завдяки цьому його координаційне число в сполуках може бути рівним не тільки 4 (Al. Cl 4 -, Al. H 4 -, алюмосилікати), але й 6 (Al 2 O 3, [Al(OH 2)6]3+).
По відношенню до води алюміній досить стійкий. Але якщо механічним шляхом чи амальгамуванням зняти запобіжну дію оксидної плівки, то проходить енергічна реакція: 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2 Алюміній — типовий амфотерний елемент. Для ньго характерні не тільки аніонні, а й катіонні комплекси. Так, в кислому середовищі існує катіонний аквакомплекс [Al(OH 2)6]3+, а в лужному — аніонний гидрокомплекс та [Al(OH)6]3 -. Найбільш характерна ступінь окислення атома алюмінія +3. Негативна ступінь окислення проявляється рідко. На зовнішньому електронному шарі атома інують вільні d-підрівні. Завдяки цьому його координаційне число в сполуках може бути рівним не тільки 4 (Al. Cl 4 -, Al. H 4 -, алюмосилікати), але й 6 (Al 2 O 3, [Al(OH 2)6]3+).
 Електролізер для виплавки алюмінія являє собою залізний кожух, викладений зсередини вогнестійкою цеглою. Його дно (під), складене з блоків спресованого вугілля, що є катодом. Аноди розташовані зверху: це — алюмінієві каркаси, заповнені вугільними брикетами. При розжарюванні подрібненого алюмінію він енергійно згоряє на повітрі 4 Аl + 3 О, → 2 Аl 203 + Q Аналогічно протікає і взаємодія його із сіркою 2 A 1 + 3 S →Al 2 S 3. З хлором і бромом реакція сполучення відбувається вже при звичайній температурі, із йодом при нагріванні Схема взаємодії алюмінію з галогенами має вигляд 2 А 1 + 6 Н 2 О → 2 Аl. На 1, При дуже високих температурах алюміній взаємодіє також з азотом і вуглецем 2 А 1 + N → 2 Аl 4 A 1 + 3 С → Аl 4 С
Електролізер для виплавки алюмінія являє собою залізний кожух, викладений зсередини вогнестійкою цеглою. Його дно (під), складене з блоків спресованого вугілля, що є катодом. Аноди розташовані зверху: це — алюмінієві каркаси, заповнені вугільними брикетами. При розжарюванні подрібненого алюмінію він енергійно згоряє на повітрі 4 Аl + 3 О, → 2 Аl 203 + Q Аналогічно протікає і взаємодія його із сіркою 2 A 1 + 3 S →Al 2 S 3. З хлором і бромом реакція сполучення відбувається вже при звичайній температурі, із йодом при нагріванні Схема взаємодії алюмінію з галогенами має вигляд 2 А 1 + 6 Н 2 О → 2 Аl. На 1, При дуже високих температурах алюміній взаємодіє також з азотом і вуглецем 2 А 1 + N → 2 Аl 4 A 1 + 3 С → Аl 4 С
 З інших сполук Алюмінію слід згадати його ацетат або оцтовокислу сіль А 1(СН 3 СОО)3, що використовується при фарбуванні тканин і в медицині. Алюміній нітрат легко розчиняється у воді. Алюміній фосфат не розчиняється у воді й оцтовій кислоті, але розчиняється у сильних кислотах і лугах. Як правило, рослини містять мало Алюмінію, хоча великі кількості цього елемента є в бруньках. Ще меншим є його вміст у тваринних організмах. У людини він складає лише десятитисячні частки відсотка за масою. Біологічна роль Алюмінію не з’ясована; відомо лише те, що його сполуки не отруйні ні для людини, ні для тварин.
З інших сполук Алюмінію слід згадати його ацетат або оцтовокислу сіль А 1(СН 3 СОО)3, що використовується при фарбуванні тканин і в медицині. Алюміній нітрат легко розчиняється у воді. Алюміній фосфат не розчиняється у воді й оцтовій кислоті, але розчиняється у сильних кислотах і лугах. Як правило, рослини містять мало Алюмінію, хоча великі кількості цього елемента є в бруньках. Ще меншим є його вміст у тваринних організмах. У людини він складає лише десятитисячні частки відсотка за масою. Біологічна роль Алюмінію не з’ясована; відомо лише те, що його сполуки не отруйні ні для людини, ні для тварин.
 Отримання • Сучасний метод отримання був розроблений незалежно американцем Чарльзом Холом і французом Полем Еру в 1886 році. Він полягає в розчиненні оксиду алюмінію Al 2 O 3 в розплаві кріоліту Na 3 Al. F 6 з подальшим електролізом з використанням витрачаються коксових або графітових електродів. Такий метод отримання вимагає великих витрат електроенергії, і тому виявився затребуваний тільки в XX столітті. • Для виробництва 1 т алюмінію чорнового потрібно 1, 920 т глинозему, 0, 065 т кріоліту, 0, 035 т фториду алюмінію, 0, 600 т анодної маси і 17 тис. к. Вт год електроенергії постійного струму
Отримання • Сучасний метод отримання був розроблений незалежно американцем Чарльзом Холом і французом Полем Еру в 1886 році. Він полягає в розчиненні оксиду алюмінію Al 2 O 3 в розплаві кріоліту Na 3 Al. F 6 з подальшим електролізом з використанням витрачаються коксових або графітових електродів. Такий метод отримання вимагає великих витрат електроенергії, і тому виявився затребуваний тільки в XX столітті. • Для виробництва 1 т алюмінію чорнового потрібно 1, 920 т глинозему, 0, 065 т кріоліту, 0, 035 т фториду алюмінію, 0, 600 т анодної маси і 17 тис. к. Вт год електроенергії постійного струму
 Знаходження в природі • Природний алюміній складається практично повністю з єдиного стабільного ізотопу27 Al зі слідами 26 Al, радіоактивного ізотопу з періодом напіврозпаду 720 тис. років, що утворюється в атмосфері при бомбардуванні ядераргонупротонами космічних променів. • За поширеністю в земній корі Землі займає 1 -е серед металів і 3 -е місце серед елементів, поступаючись тільки кисню і кремнію. Відсоток вмісту алюмінію в земній корі за даними різних дослідників становить від 7, 45 до 8, 14% від маси земної кори.
Знаходження в природі • Природний алюміній складається практично повністю з єдиного стабільного ізотопу27 Al зі слідами 26 Al, радіоактивного ізотопу з періодом напіврозпаду 720 тис. років, що утворюється в атмосфері при бомбардуванні ядераргонупротонами космічних променів. • За поширеністю в земній корі Землі займає 1 -е серед металів і 3 -е місце серед елементів, поступаючись тільки кисню і кремнію. Відсоток вмісту алюмінію в земній корі за даними різних дослідників становить від 7, 45 до 8, 14% від маси земної кори.
 • Боксити — Al 2 O 3 H 2 O (з домішками Si. O 2, Fe 2 O 3, Ca. CO 3) • Нефеліни — KNa 3 [Al. Si. O 4] 4 • Алуніти — (Na, K) 2 SO 4 Al 2 (SO 4) 3 4 Al (OH) 3 • Глиноземи (суміші каолінів з піском Si. O 2, вапняком Ca. CO 3, магнезитом Mg. CO 3) • Корунд ( сапфір, рубін, наждак) — Al 2 O 3 • Польові шпати — (K, Na) 2 O Al 2 O 3 6 Si. O 2, Ca [Al 2 Si 2 O 8] • Каолинит — Al 2 O 3 2 Si. O 2 2 H 2 O • Берил ( смарагд, аквамарин) — 3 Ве. О Al 2 О 3 6 Si. O 2 • Хризоберил ( олександрит) — Be. Al 2 O 4. У природі алюміній у зв’язку з високою хімічною активністю зустрічається майже виключно у вигляді сполук. Деякі з них:
• Боксити — Al 2 O 3 H 2 O (з домішками Si. O 2, Fe 2 O 3, Ca. CO 3) • Нефеліни — KNa 3 [Al. Si. O 4] 4 • Алуніти — (Na, K) 2 SO 4 Al 2 (SO 4) 3 4 Al (OH) 3 • Глиноземи (суміші каолінів з піском Si. O 2, вапняком Ca. CO 3, магнезитом Mg. CO 3) • Корунд ( сапфір, рубін, наждак) — Al 2 O 3 • Польові шпати — (K, Na) 2 O Al 2 O 3 6 Si. O 2, Ca [Al 2 Si 2 O 8] • Каолинит — Al 2 O 3 2 Si. O 2 2 H 2 O • Берил ( смарагд, аквамарин) — 3 Ве. О Al 2 О 3 6 Si. O 2 • Хризоберил ( олександрит) — Be. Al 2 O 4. У природі алюміній у зв’язку з високою хімічною активністю зустрічається майже виключно у вигляді сполук. Деякі з них:
 Тим не менш, в деяких специфічних відновних умовах можливе утворення самородного алюмінію. У природних водах алюміній міститься у вигляді малотоксичних хімічних сполук, наприклад, фториду алюмінію. Вид катіона або аніона залежить, в першу чергу, від кислотності водного середовища. Концентрації алюмінію в поверхневих водних об’єктах Росії коливаються від 0, 001 до 10 мг / л, в морській воді 0, 01 мг / л
Тим не менш, в деяких специфічних відновних умовах можливе утворення самородного алюмінію. У природних водах алюміній міститься у вигляді малотоксичних хімічних сполук, наприклад, фториду алюмінію. Вид катіона або аніона залежить, в першу чергу, від кислотності водного середовища. Концентрації алюмінію в поверхневих водних об’єктах Росії коливаються від 0, 001 до 10 мг / л, в морській воді 0, 01 мг / л
 Деякі алюмосилікати мають пухку структуру і здатні обмінюватися іонами з іншими сполуками. Такі алюмосилікати, природні й особливо штучні, застосовуються для пом’якшення водопровідної води. Крім того, завдяки своїй сильно розвинутій поверхні, вони використовуються як матеріали, що просочуються каталізаторами і застосовуються в хімічній промисловості. Сполуки Алюмінію з галогенами (галогеніди) у звичайних умовах — безбарвні кристалічні речовини. Серед них за властивостями сильно вирізняється алюміній фторид A 1 F 3. Він тугоплавкий, мало розчиняється у воді, хімічно неактивний. Сполуки Алюмінію з Хлором, Бромом і Іодом легкоплавкі, досить реакційноздатні і добре розчиняються не тільки у воді, але й у багатьох хімічних розчинниках. Взаємодія алюміній галогенідів з водою супроводжується значним виділенням теплоти. У водному розчині усі вони сильно гідролізовані. Унаслідок гідролізу алюміній хлорид, бромід і йодид димлять у вологому повітрі. Вони можуть бути отримані прямою взаємодією простих речовин.
Деякі алюмосилікати мають пухку структуру і здатні обмінюватися іонами з іншими сполуками. Такі алюмосилікати, природні й особливо штучні, застосовуються для пом’якшення водопровідної води. Крім того, завдяки своїй сильно розвинутій поверхні, вони використовуються як матеріали, що просочуються каталізаторами і застосовуються в хімічній промисловості. Сполуки Алюмінію з галогенами (галогеніди) у звичайних умовах — безбарвні кристалічні речовини. Серед них за властивостями сильно вирізняється алюміній фторид A 1 F 3. Він тугоплавкий, мало розчиняється у воді, хімічно неактивний. Сполуки Алюмінію з Хлором, Бромом і Іодом легкоплавкі, досить реакційноздатні і добре розчиняються не тільки у воді, але й у багатьох хімічних розчинниках. Взаємодія алюміній галогенідів з водою супроводжується значним виділенням теплоти. У водному розчині усі вони сильно гідролізовані. Унаслідок гідролізу алюміній хлорид, бромід і йодид димлять у вологому повітрі. Вони можуть бути отримані прямою взаємодією простих речовин.
 Хімічні властивості Гідроксид алюмінію При нормальних умовах алюміній покритий тонкою і міцною оксидної плівкою і тому не реагує з класичними окислювачами : з H 2 O (t ); O 2, HNO 3 (без нагрівання). Завдяки цьому алюміній практично не схильний корозії і тому широко затребуваний сучасною індустрією. Однак при руйнуванні оксидної плівки (наприклад, при контакті з розчинами солей амонію NH 4 +, гарячими лугами або внаслідок амальгамирования), алюміній виступає як активний метал-відновник.
Хімічні властивості Гідроксид алюмінію При нормальних умовах алюміній покритий тонкою і міцною оксидної плівкою і тому не реагує з класичними окислювачами : з H 2 O (t ); O 2, HNO 3 (без нагрівання). Завдяки цьому алюміній практично не схильний корозії і тому широко затребуваний сучасною індустрією. Однак при руйнуванні оксидної плівки (наприклад, при контакті з розчинами солей амонію NH 4 +, гарячими лугами або внаслідок амальгамирования), алюміній виступає як активний метал-відновник.
 Легко реагує з простими речовинами: з киснем, утворюючи оксид алюмінію : 4 Al + 3 O 2 = 2 Al 2 O 3 з галогенами (крім фтору) [6], утворюючи хлорид, бромід або йодид алюмінію : 2 Al + 3 Hal 2 = 2 Al. Hal 3 (Hal = Cl, Br, I) з іншими неметалами реагує при нагріванні: з фтором, утворюючи фторид алюмінію : 2 Al + 3 F 2 = 2 Al. F 3 з сірої, утворюючи сульфід алюмінію : 2 Al + 3 S = Al 2 S 3 з азотом, утворюючи нітрид алюмінію : 2 Al + N 2 = 2 Al. N з вуглецем, утворюючи карбід алюмінію : 4 Al + 3 С = Al 4 С 3 Сульфід і карбід алюмінію повністю гідролізуються: Al 2 S 3 + 6 H 2 O = 2 Al (OH) 3 + 3 H 2 Al 4 C 3 + 12 H 2 O = 4 Al (OH) 3 + 3 CH 4 Зі складними речовинами: з водою (після видалення захисної оксидної плівки, наприклад, амальгамуванням або розчинами гарячої лугу): 2 Al + 6 H 2 O = 2 Al (OH) 3 + 3 H 2 з лугами (з утворенням тетрагідроксоалюмінатов та інших алюмінатів): 2 Al + 2 Na. OH + 6 H 2 O = 2 Na [Al (OH) 4] + 3 H 2 2 (Na. OH H 2 O) + 2 Al = 2 Na. Al. O 2 + 3 H 2 Легко розчиняється в соляній і розведеної сірчаної кислотах: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4 (розбій) = Al 2 (SO 4) 3 + 3 H 2 При нагріванні розчиняється в кислотах — окислювачах, що утворюють розчинні солі алюмінію: 2 Al + 6 H 2 SO 4 (конц) = Al 2 (SO 4) 3 + 3 SO 2 + 6 H 2 O Al + 6 HNO 3 (конц) = Al (NO 3) 3 + 3 NO 2 + 3 H 2 O відновлює метали з їх оксидів ( алюминотермия): 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr
Легко реагує з простими речовинами: з киснем, утворюючи оксид алюмінію : 4 Al + 3 O 2 = 2 Al 2 O 3 з галогенами (крім фтору) [6], утворюючи хлорид, бромід або йодид алюмінію : 2 Al + 3 Hal 2 = 2 Al. Hal 3 (Hal = Cl, Br, I) з іншими неметалами реагує при нагріванні: з фтором, утворюючи фторид алюмінію : 2 Al + 3 F 2 = 2 Al. F 3 з сірої, утворюючи сульфід алюмінію : 2 Al + 3 S = Al 2 S 3 з азотом, утворюючи нітрид алюмінію : 2 Al + N 2 = 2 Al. N з вуглецем, утворюючи карбід алюмінію : 4 Al + 3 С = Al 4 С 3 Сульфід і карбід алюмінію повністю гідролізуються: Al 2 S 3 + 6 H 2 O = 2 Al (OH) 3 + 3 H 2 Al 4 C 3 + 12 H 2 O = 4 Al (OH) 3 + 3 CH 4 Зі складними речовинами: з водою (після видалення захисної оксидної плівки, наприклад, амальгамуванням або розчинами гарячої лугу): 2 Al + 6 H 2 O = 2 Al (OH) 3 + 3 H 2 з лугами (з утворенням тетрагідроксоалюмінатов та інших алюмінатів): 2 Al + 2 Na. OH + 6 H 2 O = 2 Na [Al (OH) 4] + 3 H 2 2 (Na. OH H 2 O) + 2 Al = 2 Na. Al. O 2 + 3 H 2 Легко розчиняється в соляній і розведеної сірчаної кислотах: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2 2 Al + 3 H 2 SO 4 (розбій) = Al 2 (SO 4) 3 + 3 H 2 При нагріванні розчиняється в кислотах — окислювачах, що утворюють розчинні солі алюмінію: 2 Al + 6 H 2 SO 4 (конц) = Al 2 (SO 4) 3 + 3 SO 2 + 6 H 2 O Al + 6 HNO 3 (конц) = Al (NO 3) 3 + 3 NO 2 + 3 H 2 O відновлює метали з їх оксидів ( алюминотермия): 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + 9 Fe 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr
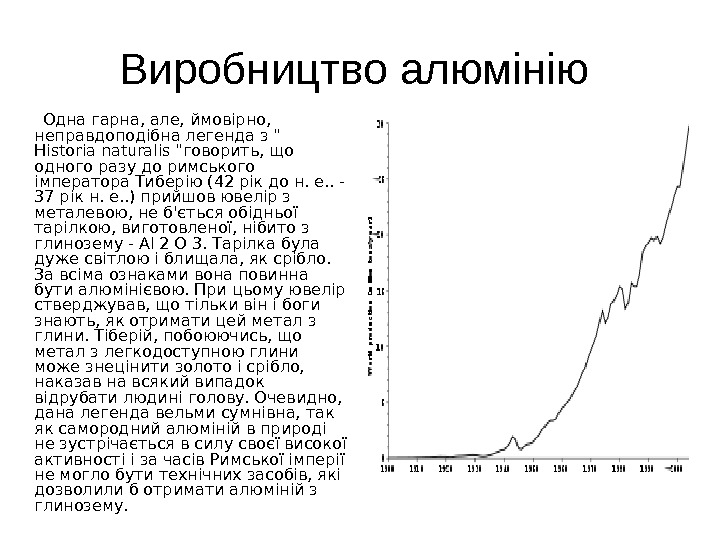
 Виробництво алюмінію Одна гарна, але, ймовірно, неправдоподібна легенда з » Historia naturalis «говорить, що одного разу до римського імператора Тиберію (42 рік до н. е. . — 37 рік н. е. . ) прийшов ювелір з металевою, не б’ється обідньої тарілкою, виготовленої, нібито з глинозему — Al 2 O 3. Тарілка була дуже світлою і блищала, як срібло. За всіма ознаками вона повинна бути алюмінієвою. При цьому ювелір стверджував, що тільки він і боги знають, як отримати цей метал з глини. Тіберій, побоюючись, що метал з легкодоступною глини може знецінити золото і срібло, наказав на всякий випадок відрубати людині голову. Очевидно, дана легенда вельми сумнівна, так як самородний алюміній в природі не зустрічається в силу своєї високої активності і за часів Римської імперії не могло бути технічних засобів, які дозволили б отримати алюміній з глинозему.
Виробництво алюмінію Одна гарна, але, ймовірно, неправдоподібна легенда з » Historia naturalis «говорить, що одного разу до римського імператора Тиберію (42 рік до н. е. . — 37 рік н. е. . ) прийшов ювелір з металевою, не б’ється обідньої тарілкою, виготовленої, нібито з глинозему — Al 2 O 3. Тарілка була дуже світлою і блищала, як срібло. За всіма ознаками вона повинна бути алюмінієвою. При цьому ювелір стверджував, що тільки він і боги знають, як отримати цей метал з глини. Тіберій, побоюючись, що метал з легкодоступною глини може знецінити золото і срібло, наказав на всякий випадок відрубати людині голову. Очевидно, дана легенда вельми сумнівна, так як самородний алюміній в природі не зустрічається в силу своєї високої активності і за часів Римської імперії не могло бути технічних засобів, які дозволили б отримати алюміній з глинозему.
 Лише майже через 2000 років після Тиберія — в 1825, данський фізик Ханс Християн Ерстед отримав кілька міліграмів металевого алюмінію, а в 1827 Фрідріх Велер зміг виділити крупинки алюмінію, які, проте, на повітрі негайно покривалися найтоншою плівкою оксиду алюмінію. До кінця XIX століття алюміній в промислових масштабах не проводився. Тільки в 1854 Анрі Сент-Клер Девіль (його дослідження фінансував Наполеон III, розраховуючи, що алюміній нагоді його армії ) винайшов перший спосіб промислового виробництва алюмінію, заснований на витіснення алюмінію металевим натрієм з подвійного хлориду натрію і алюмінію Na. Cl Al. Cl 3. У 1855 році був отриманий перший зливок металу масою 6 -8 кг. За 36 років застосування, з 1855 по 1890, способом Сент-Клер Девіль було отримано 200 тонн металевого алюмінію. В 1856 він же отримав алюміній електролізом розплаву хлориду натрію-алюмінію. В 1885, грунтуючись на технології, запропонованої російським ученим Миколою Бекетовим, був побудований завод з виробництва алюмінію в німецькому місті Гмелінгеме. Технологія Бекетова мало чим відрізнялася від способу Девіль, але була простіше і полягала у взаємодії між кріоліту (Na 3 Al. F 6) і магнієм. За п’ять років на цьому заводі було отримано близько 58 т алюмінію — понад чверть всього світового виробництва металу хімічним шляхом у період з 1854 по 1890.
Лише майже через 2000 років після Тиберія — в 1825, данський фізик Ханс Християн Ерстед отримав кілька міліграмів металевого алюмінію, а в 1827 Фрідріх Велер зміг виділити крупинки алюмінію, які, проте, на повітрі негайно покривалися найтоншою плівкою оксиду алюмінію. До кінця XIX століття алюміній в промислових масштабах не проводився. Тільки в 1854 Анрі Сент-Клер Девіль (його дослідження фінансував Наполеон III, розраховуючи, що алюміній нагоді його армії ) винайшов перший спосіб промислового виробництва алюмінію, заснований на витіснення алюмінію металевим натрієм з подвійного хлориду натрію і алюмінію Na. Cl Al. Cl 3. У 1855 році був отриманий перший зливок металу масою 6 -8 кг. За 36 років застосування, з 1855 по 1890, способом Сент-Клер Девіль було отримано 200 тонн металевого алюмінію. В 1856 він же отримав алюміній електролізом розплаву хлориду натрію-алюмінію. В 1885, грунтуючись на технології, запропонованої російським ученим Миколою Бекетовим, був побудований завод з виробництва алюмінію в німецькому місті Гмелінгеме. Технологія Бекетова мало чим відрізнялася від способу Девіль, але була простіше і полягала у взаємодії між кріоліту (Na 3 Al. F 6) і магнієм. За п’ять років на цьому заводі було отримано близько 58 т алюмінію — понад чверть всього світового виробництва металу хімічним шляхом у період з 1854 по 1890.
 Метод, винайдений майже одночасно Чарльзом Холом під Франції і Полем Еру в США в 1886 і заснований на отриманні алюмінію електролізом глинозему, розчиненого в розплавленому кріоліті, поклав початок сучасному способу виробництва алюмінію. З тих пір, у зв’язку з удосконаленням електротехніки, виробництво алюмінію удосконалювалося. Помітний внесок у розвиток виробництва глинозему внесли російські вчені К. І. Байєр, Д. А. Пеняк, А. Н. Кузнецов, Є. І. Жуковський, А. А. Яковкін та інші. Перший алюмінієвий завод в Росії був побудований в 1932 в Волхові. Металургійна промисловість СРСР в 1939 році виробляла 47, 7 тис. тонн алюмінію, ще 2, 2 тис. тонн імпортувалося. Друга світова війна значно стимулювала виробництво алюмінію. Так, в 1939 загальносвітове його виробництво, без урахування СРСР, становила 620 тис. т, але вже до 1943 зросла до 1, 9 млн т. До 1956 в світі вироблялося 3, 4 млн т первинного алюмінію, в 1965 — 5, 4 млн т, в 1980 — 16, 1 млн т, в 1990 — 18 млн т.
Метод, винайдений майже одночасно Чарльзом Холом під Франції і Полем Еру в США в 1886 і заснований на отриманні алюмінію електролізом глинозему, розчиненого в розплавленому кріоліті, поклав початок сучасному способу виробництва алюмінію. З тих пір, у зв’язку з удосконаленням електротехніки, виробництво алюмінію удосконалювалося. Помітний внесок у розвиток виробництва глинозему внесли російські вчені К. І. Байєр, Д. А. Пеняк, А. Н. Кузнецов, Є. І. Жуковський, А. А. Яковкін та інші. Перший алюмінієвий завод в Росії був побудований в 1932 в Волхові. Металургійна промисловість СРСР в 1939 році виробляла 47, 7 тис. тонн алюмінію, ще 2, 2 тис. тонн імпортувалося. Друга світова війна значно стимулювала виробництво алюмінію. Так, в 1939 загальносвітове його виробництво, без урахування СРСР, становила 620 тис. т, але вже до 1943 зросла до 1, 9 млн т. До 1956 в світі вироблялося 3, 4 млн т первинного алюмінію, в 1965 — 5, 4 млн т, в 1980 — 16, 1 млн т, в 1990 — 18 млн т.
 В 2007 в світі було вироблено 38 млн т первинного алюмінію, а в 2008 — 39, 7 млн т. Лідерами виробництва були: Китай (у 2007 році виробив 12, 60 млн т, а в 2008 — 13, 50 млн т), Росія(3, 96 / 4, 20), Канада(3, 09 / 3, 10), США(2, 55 / 2, 64), Австралія(1, 96 / 1, 96), Бразилія(1, 66 / 1, 66), Індія(1, 22 / 1, 30), Норвегія(1, 30 / 1, 10), ОАЕ(0, 89 / 0, 92), Бахрейн(0, 87 / 0, 87) ПАР(0, 90 / 0, 85), Ісландія(0, 40 / 0, 79), Німеччина(0, 55 / 0, 59), Венесуела(0, 61 / 0, 55), Мозамбік(0, 56 / 0, 55), Таджикистан(0, 42 / 0, 42)
В 2007 в світі було вироблено 38 млн т первинного алюмінію, а в 2008 — 39, 7 млн т. Лідерами виробництва були: Китай (у 2007 році виробив 12, 60 млн т, а в 2008 — 13, 50 млн т), Росія(3, 96 / 4, 20), Канада(3, 09 / 3, 10), США(2, 55 / 2, 64), Австралія(1, 96 / 1, 96), Бразилія(1, 66 / 1, 66), Індія(1, 22 / 1, 30), Норвегія(1, 30 / 1, 10), ОАЕ(0, 89 / 0, 92), Бахрейн(0, 87 / 0, 87) ПАР(0, 90 / 0, 85), Ісландія(0, 40 / 0, 79), Німеччина(0, 55 / 0, 59), Венесуела(0, 61 / 0, 55), Мозамбік(0, 56 / 0, 55), Таджикистан(0, 42 / 0, 42)
 • У Росії монополістом з виробництва алюмінію є компанія » Російський алюміній «, на яку припадає близько 13% світового ринку алюмінію і 16% глинозему • Світові запаси бокситів практично безмежні, тобто неспівмірні з динамікою попиту. Існуючі потужності можуть виробляти до 44, 3 млн т первинного алюмінію в рік. Слід також враховувати, що в майбутньому деякі з застосувань алюмінію можуть бути переорієнтовані на використання, наприклад, композитних матеріалів.
• У Росії монополістом з виробництва алюмінію є компанія » Російський алюміній «, на яку припадає близько 13% світового ринку алюмінію і 16% глинозему • Світові запаси бокситів практично безмежні, тобто неспівмірні з динамікою попиту. Існуючі потужності можуть виробляти до 44, 3 млн т первинного алюмінію в рік. Слід також враховувати, що в майбутньому деякі з застосувань алюмінію можуть бути переорієнтовані на використання, наприклад, композитних матеріалів.
 Шматок алюмінію Широко застосовується як конструкційний матеріал. Основні переваги алюмінію в цій якості — легкість, податливість штампування, корозійна стійкість (на повітрі алюміній покривається миттєво міцною плівкою Al 2 O 3, яка перешкоджає його подальшому окисленню), висока теплопровідність, неотруйні його сполук. Зокрема, ці властивості зробили алюміній надзвичайно популярним при виробництві кухонного посуду, алюмінієвої фольги в харчовій промисловості та для упаковки.
Шматок алюмінію Широко застосовується як конструкційний матеріал. Основні переваги алюмінію в цій якості — легкість, податливість штампування, корозійна стійкість (на повітрі алюміній покривається миттєво міцною плівкою Al 2 O 3, яка перешкоджає його подальшому окисленню), висока теплопровідність, неотруйні його сполук. Зокрема, ці властивості зробили алюміній надзвичайно популярним при виробництві кухонного посуду, алюмінієвої фольги в харчовій промисловості та для упаковки.
 Алюміній у світовій культурі Поет Андрій Вознесенський написав в 1959 році вірш «Осінь» , в якому використовував алюміній як художнього образу: . . . А за віконцем у юному інеї лежать поля з алюмінію. . . Віктор Цой написав пісню «Алюмінієві огірки» з приспівом: Я саджу алюмінієві огірки На брезентовому поле У ленінградської рок-групи «Народне ополчення» в альбомі «Брежнєв живий» 1989 року є пісня «Алюмінієвий дім». Важливу роль алюміній грає в історико-містичної трилогії Андрія Валентинова та Генрі Олді «Алюмен».
Алюміній у світовій культурі Поет Андрій Вознесенський написав в 1959 році вірш «Осінь» , в якому використовував алюміній як художнього образу: . . . А за віконцем у юному інеї лежать поля з алюмінію. . . Віктор Цой написав пісню «Алюмінієві огірки» з приспівом: Я саджу алюмінієві огірки На брезентовому поле У ленінградської рок-групи «Народне ополчення» в альбомі «Брежнєв живий» 1989 року є пісня «Алюмінієвий дім». Важливу роль алюміній грає в історико-містичної трилогії Андрія Валентинова та Генрі Олді «Алюмен».
 Пенометаллнаосновіалюмінієвогосплав у
Пенометаллнаосновіалюмінієвогосплав у
 Алюмінієвий завод.
Алюмінієвий завод.

